Advances in Clinical Medicine
Vol.
09
No.
04
(
2019
), Article ID:
29876
,
11
pages
10.12677/ACM.2019.94074
Effects of High Estradiol and Progesterone Levels in Controlled Ovarian Hyperstimulation Cycles on ER, PR, HOX10 and Endometrial Receptivity
Lanping Zhong, Xiaomin Kang, Yuansong Jiang, Lei Li, Na Lin, Rui Ma, Ze Wu*
Department of Reproductive Medicine, The First People’s Hospital of Yunnan Province, Kunming University of Science and Technology, Kunming Yunnan

Received: Apr. 5th, 2019; accepted: Apr. 17th, 2019; published: Apr. 24th, 2019

ABSTRACT
Objective: To study the expressions of ER, PR and HOX10 in endometrium during the peri-implatation period after controlled ovarian hyperstimulation (COH); To explore the influence of high estradiol and progesterone levels in COH cycles to endometrial receptivity. Methods: 59 infertile women undergoing COH cancelled embryo transfer because of ovarian hyperstimulation syndrome (OHSS) or excessive high progesterone level were selected as study groups, then they were divided into three groups according to serum estradiol and progesterone concentrations on the day of human chorionic gonadotrophin (hCG) administration: high estradiol group (estradiol ≥ 5210 pg/ml, progesterone < 1.05 ng/ml), high progesterone group (progesterone ≥ 1.05 ng/ml, estradiol < 5210 pg/ml), and high estradiol + high progesterone group (progesterone ≥ 1.05 ng/ml, estradiol ≥ 5210 pg/ml). Endometrial biopsy was performed at 7~8 days after oocytes retrieval by using Pipelle tubes. Ten ovulation-normal FET women were selected as control group; endometrial biopsy was performed using the same method after the seventh day of ovulation. Positioning analysis and semi-quantitative analysis of ER, PR and HOX10 expressions in endometrium during the window of implantation were conducted by immunohistochemical SP method and H-score method; the influences of different estradiol and progesterone levels during implantation period on ER, PR and HOX10 expressions were compared to speculate the effects of high estradiol and progesterone levels on endometrial receptivity in COH. Results: There was no statistically significant difference in the expressions of ER, PR and HOX10 among high estradiol group and control group. However, there were statistically significant differences among high estradiol + high progesterone group, high progesterone group and control group (P < 0.05). Conclusions: There was no connection between the high estradiol levels in COH cycles and endometrial receptivity. However, the high progesterone levels reduced endometrial receptivity significantly.
Keywords:Controlled Ovarian Hyperstimulation (COH), Embryo Implantation, Endometrial Receptivity, Estradiol, Progesterone, HOXA-10
超排卵周期中高雌孕激素对子宫内膜ER、PR、HOX10以及内膜容受性的影响
钟兰萍,康晓敏,蒋圆松,李蕾,林娜,马蕊,武泽*
云南省第一人民医院、昆明理工大学附属医院生殖医学科,云南 昆明

收稿日期:2019年4月5日;录用日期:2019年4月17日;发布日期:2019年4月24日

摘 要
目的:通过检测雌激素受体ER、孕激素受体PR、同源框基因HOXA-10在控制性超排卵(COH)患者的胚胎着床窗口期子宫内膜中的表达,探讨IVF超促排卵过程中超生理剂量的雌激素、孕激素对子宫内膜容受性的影响,及其可能机制。方法:因卵巢过度刺激综合征因卵巢过度刺激综合征或过高孕酮水平而取消鲜胚移植的59例不孕症患者作为研究对象,根据HCG日雌、孕激素水平将研究对象分为三组:高雌激素组(E2 ≥ 5210 pg/ml且P < 1.05 ng/ml)、高孕酮组(P ≥ 1.05 ng/ml且E2 < 5210 pg/ml)、高雌激素合并高孕酮组(E2 ≥ 5210 pg/ml且P ≥ 1.05 ng/ml),于取卵后7~8天用宫腔负压吸管(Pipelle管)取内膜组织;10例排卵正常、拟行冷冻移植的患者作为对照组,于排卵后7~9天同法取内膜,采用免疫组化SP法和组织学积分H-score法对ER、PR、HOXA-10在种植窗口期子宫内膜中的表达进行定位和半定量分析,比较不同雌、孕激素水平在着床期对上述三个指标表达的影响,从而推测超促排卵中高雌、孕激素对子宫内膜容受性的影响。结果:与对照组相比,高雌激素组ER、PR、HOXA-10的表达无明显差异,而高孕酮组、高雌合并高孕酮组的上述指标的表达均明显下降。结论:辅助生殖技术中,COH引起的高雌激素状态可能对子宫内膜容受性无明显影响,而高孕激素则使子宫内膜容受性下降。
关键词 :控制性超排卵,胚胎植入,子宫内膜容受性,雌激素,孕激素,HOXA-10

Copyright © 2019 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
辅助生殖技术(assisted reproductive technology, ART)是治疗不孕症的重要手段。控制性超促排卵(Controlled ovarian hyperstimulation, COH)在募集更多的卵泡以提高助孕成功率的同时,却使子宫内膜和胚胎暴露于超生理剂量的雌、孕激素水平中。Li [1] 等认为IVF周期中HCG日高雌、孕激素水平不影响胚胎质量,但妊娠率降低。提示高雌、孕激素环境可能影响子宫内膜的容受性。内膜容受性的形成,是一系列基因按照一定的时间和空间顺序表达的结果。目前研究的热点是同源框基因HOXA10,它是当前较为公认的子宫内膜容受性标志。本研究通过对不同雌孕激素水平下ER、PR、HOXA-10在种植窗口期子宫内膜中的表达进行研究,分析影响子宫内膜容受性的主要因素,以提高IVF助孕成功率。
2. 资料和方法
2.1. 研究对象
选取2016年10月至2017年10月因输卵管因素,采用黄体期长方案于我院行IVF-ET助孕患者59例作为研究对象,10例排卵正常、拟行冷冻移植的患者作为对照组。纳入标准:1) 年龄 < 38岁;2) 基础内分泌正常;3) 月经周期规律;4) 近3个月无激素使用史以及宫腔操作史,无宫内节育器;5) 阴道超声提示子宫内膜无异常;6) 既往无附件包块的诊断。排除标准如下:合并子宫内膜异位症、输卵管积水,合并多囊卵巢综合征、高泌乳素血症、甲状腺、肾上腺以及其他内分泌疾病,不明原因不孕。分组依据参考Wu [2] 等的研究:高E2组(E2 ≥ 5210 pg/ml且P < 1.05 ng/ml),高P组(P ≥ 1.05 ng/ml且E2 < 5210 pg/ml),高E2并高P组(E2 ≥ 5210 pg/ml且P ≥ 1.05 ng/ml)。本研究中因高P取消鲜胚移植的患者,其高P的诊断参照我中心的标准P ≥ 2.10 ng/ml (即2倍于1.05 ng/ml)。向患者解释本研究的重要性后,取得所有患者的同意并签署知情同意书,同时获云南省第一人民医院医学伦理委员会的批准(2016年6月,编号:2016NS029)。
2.2. 研究方法
1) 外周血获取:内膜获取当天同时抽取静脉血3 ml,以化学发光法检验血清E2、P水平(试剂盒购于美国贝克曼库尔特公司,仪器为UniCel Dxl 800免疫分析系统);2) 内膜获取:研究组对象因卵巢过度刺激综合征或高水平雌孕激素取消移植,于取卵术后7~8天获取种植窗期子宫内膜。对照组为排卵正常,拟行冷冻移植的患者,于月经周期的第10天开始监测卵泡,于排卵后7~8 d,获取种植窗期子宫内膜。子宫内膜的获取方法:生理盐水冲洗阴道,勿需扩张宫颈,用子宫内膜取样管Pipelle (购于美国Coopersurgical公司)吸取子宫内膜组织,内膜如有血,在生理盐水中轻轻漂洗。
实验方法:1) 病理检查:按Noves标准 [3] 区分子宫内膜周期。由两名研究者分别对所有标本进行双盲读片,其中1名为具有多年工作经验的病理科医师。2) 将手术中所刮取的内膜组织分别进行HE染色和SP(免疫组化链霉菌抗生物素蛋白–过氧化物酶连接)染色,检测内膜的ER、PR及HOXA-10表达水平,免疫组化方法按试剂盒说明书操作。鼠抗人ER、HOXA-10、兔抗人PR试剂盒购于DAKO公司。
2.3. 结果判断标准
ER、PR定位于细胞核,HOXA-10定位于细胞浆。细胞核(浆)出现黄色或棕色颗粒为阳性反应。符合下列要求 [4] :1) 镜下组织细胞结构清晰;2) 阳性颗粒定位好;3) 染色部位明显高于背景。在CHK型Olympus显微镜(日本奥林巴斯公司,200×)下观察SP染色切片,每个样本观察5张切片,每张切片随机选取5个高倍视野(400倍)。综合染色强度和染色分布分4级 [4] :阴性(−):阳性细胞 < 25%或不染色;弱阳性(+):阳性细胞25%~50%,阳性染色较清晰;阳性(++):51%~75%,阳性染色清晰;强阳性(+++):阳性细胞 > 75%,深棕色染色颗粒。
采用组织学积分H-score法进行半定量分析 [4] ,计算公式: 。其中Pi代表每一免疫组化染色范围内同一染色强度的阳性细胞数占待测细胞总数的百分比。i为染色强度,分为0~3四个级别,H-score最大值为4,式中1为纠正系数。
2.4. 数据统计
采用SPSS 22.0软件进行数据分析,平均数以均数 ± 标准差表示,采用多因素单变量方差分析、Pearson相关分析进行统计分析,以双侧α = 0.05为显著性检验水准。
3. 结果
3.1. 病例的临床特征
四个组在患者年龄、不孕症类型(原发和继发)、不孕年限、BMI、基础性激素水平方面比较,差异无统计学差异(P > 0.05)。
3.2. 种植窗口期子宫内膜发育同步性比较
三个研究组与对照组比较,子宫内膜取材时间的差异无统计学意义。各组内膜发育同步性的比较,差异无统计学意义(P < 0.05,见表1)。
Table 1. Comparisons of endometrial sampling time and developmental synchrony in four groups [case (%)]
表1. 四组患者子宫内膜取材时间及发育同步性比较[例(%)]
3.3. 子宫内膜种植窗口期血清
E2和P水平高E2组、高E2并高P组HCG日雌激素水平均显著高于高P组(P < 0.05);高P组、高E2并高P组HCG日孕酮水平均显著高于高E2组(P < 0.05);取内膜日三个研究组的雌激素、孕酮水平均无统计学差异(P > 0.05),结果见表2。
Table 2. Comparisons of serum estradiol and progesterone concentrations on the day of hCG administration and the day of endometrial sampling in four groups (pg/ml)
表2. 四组患者HCG日以及子宫内膜取材日血清雌、孕激素的水平(pg/ml)
注:▲:与对照组比较,P < 0.05;△:与对照组比较,P > 0.05;●:与高E2组比较,P < 0.05;○:与高E2组比较,P > 0.05;■:与高P组比较,P < 0.05;□:与高P组比较,P > 0.05。
3.4. 种植窗口期子宫内膜ER、PR、HOXA10蛋白的表达
ER、PR、HOXA10在各组子宫内膜均有表达,ER、PR定位于细胞核,各组均多呈中等强度或强阳性表达,见图1~8;HOXA-10定位于细胞浆,各组均多呈中等强度表达,见图9~12。上述三个指标的表达,高E2组和对照组的表达均无统计学差异(P > 0.05),而高P组、高E2并高P组分别和对照组、高E2组两两比较,三个指标的表达均下降,且均有统计学差异(P < 0.05);高P组和高E2并高P组之间比较,差异无统计学差异(P > 0.05),结果分析见表3。
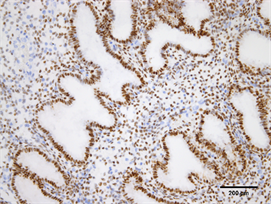
Figure 1. Expression of ER in endometrium of control group (Immunohistochemistry, ×200)
图1. ER在对照组子宫内膜的表达(免疫组化,×200)
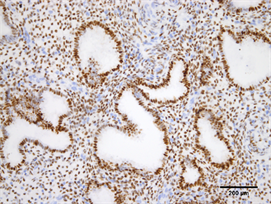
Figure 2. Expression of ER in endometrium of high estradiol group (Immunohistochemistry, ×200)
图2. ER在高E2组子宫内膜的表达(免疫组化,×200)
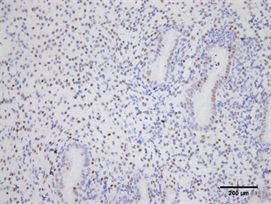
Figure 3. Expression of ER in endometrium of high progesterone group (Immunohistochemistry, ×200)
图3. ER在高P组子宫内膜的表达(免疫组化,×200)
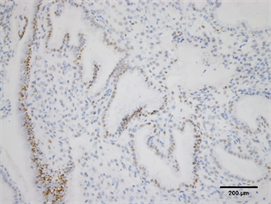
Figure 4. Expression of ER in endometrium of high estradiol + high progesterone group (Immunohistochemistry, ×200)
图4. ER在高E2并P组子宫内膜的表达(免疫组化,×200)
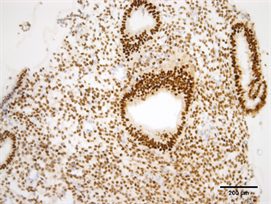
Figure 5. Expression of PR in endometrium of control group (Immunohistochemistry, ×200)
图5. PR在对照组子宫内膜的表达(免疫组化,×200)
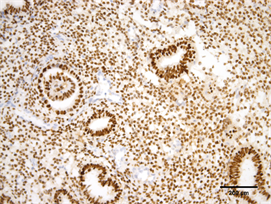
Figure 6. Expression of PR in endometrium of high estradiol group (Immunohistochemistry, ×200)
图6. PR在高E2组子宫内膜的表达(免疫组化,×200)
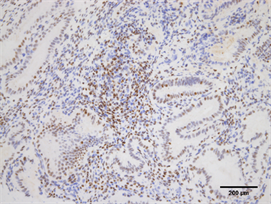
Figure 7. Expression of PR in endometrium of high progesterone group (Immunohistochemistry, ×200)
图7. PR在高P组子宫内膜的表达(免疫组化,×200)
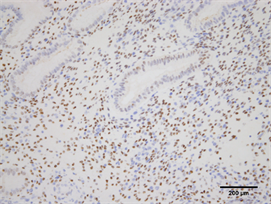
Figure 8. Expression of PR in endometrium of high estradiol + high progesterone group (Immunohistochemistry, ×200)
图8. PR在高E2并P组子宫内膜的表达(免疫组化,×200)
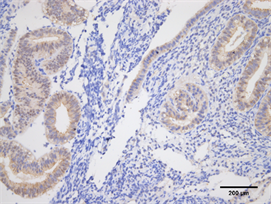
Figure 9. Expression of HOX10 in endometrium of control group (Immunohistochemistry, ×200)
图9. HOXA10在对照组子宫内膜的表达(免疫组化,×200)
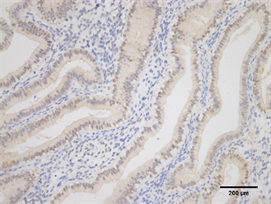
Figure 10. Expression of HOX10 in endometrium of high estradiol group (Immunohistochemistry, ×200)
图10. HOXA10在高E2组子宫内膜的表达(免疫组化,×200)
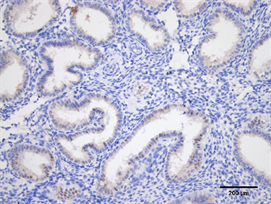
Figure 11. Expression of HOX10 in endometrium of high progesterone group (Immunohistochemistry, ×200)
图11. HOXA10在高P组子宫内膜的表达(免疫组化,×200)
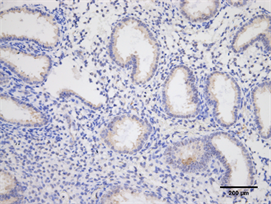
Figure 12. Expression of HOX10 in endometrium of high estradiol + high progesterone group (Immunohistochemistry, ×200)
图12. HOXA10在高E2并P组子宫内膜的表达(免疫组化,×200)
Table 3. Comparisons of immunohistochemical indices in four groups (x ± s)
表3. 四组患者研究指标的比较(x ± s)
注:▲:与对照组比较,P < 0.05;△:与对照组比较,P > 0.05;●:与高E2组比较,P < 0.05;○:与高E2组比较,P > 0.05;■:与高P组比较,P < 0.05;□:与高P组比较,P > 0.05。
3.5. 相关性分析
高P组中,对ER、PR、HOXA10 3个免疫组化指标的表达两两做相关性分析,结果提示上述三个指标的表达,具有显著的正相关关系,见表4。在高E2并高P组中行类似相关性分析,亦得到一致结果,见表5。
Table 4. The correlation analysis of ER, PR and HOXA10 expression in high progesterone group
表4. 高P组ER、PR、HOXA10表达的相关性分析
注:**P< 0.01,有显著相关性。
Table 5. The correlation analysis of ER, PR and HOXA10 expression in high estradiol + high progesterone group
表5. 高E2并高P组ER、PR、HOXA10表达的相关性分析
注:**P < 0.01,有显著相关性。
4. 讨论
4.1. 子宫内膜容受性
人类辅助生殖技术被称为人类生殖技术的一大创举,越来越多的不孕症夫妇选择通过IVF-ET技术获得自己的后代。辅助生殖药物日渐优化,促排卵方案和技术更具个体化,加上实验室技术的改进,IVF助孕过程中获得的胚胎数量、质量已逐步优化,但近年来IVF成功率却陷入瓶颈状态,助孕妊娠成功率徘徊于40%~50% [5] 。决定成功妊娠的因素主要包括以下两方面:胚胎质量、胚胎能否成功种植。胚胎能否成功种植的原因主要在于着床窗口期子宫内膜容受性的变化和胚胎发育是否同步。子宫内膜容受性是指围着床期子宫内膜接受胚胎的能力,是成功受孕的重要环节。故针对子宫内膜容受性的研究日益受到国内外生殖界专家的关注。
子宫内膜容受性的形成和变化需要雌、孕激素的参与,在雌激素的作用下,子宫内膜增生肥大,孕激素使增生期子宫内膜转变为分泌期,形成有利于胚胎着床的宫内环境。影响子宫内膜容受性的因素还包括内膜容积、血供、同源框基因的调节及局部激素水平、细胞因子、生长因子的分泌等 [6] ,其中同源框基因HOXA10是预测子宫内膜容受的重要指标,与胚胎的种植密切相关。目前关于高雌、孕激素是否影响IVF结局以及其影响子宫内膜容受性的确切机制的相关研究很少。
4.2. 雌、孕激素受体和HOXA10与子宫内膜容受性
雌孕激素是调控子宫内膜容受性最基本的因素,它们是通过各自的核受体——雌激素受体ER和孕激素受体PR发挥作用的。ER和PR受雌激素和孕激素的调控,雌激素正调控ER和PR,孕激素负调控ER和PR。ER、PR在子宫内膜腺上皮中的表达呈周期性变化,增生期表达较高,分泌期表达较低,尤其PR,在分泌中期,子宫内膜腺上皮PR表达迅速降低,甚至消失 [7] 。分泌中期是子宫着床窗开放时期,分泌中期PR在子宫内膜腺上皮的表达下降,间质细胞和内膜腺体水肿、血管扩张,是子宫容受性建立的前提之一 [8] 。故ER和PR为子宫内膜容受性重要的分子标记物,其异常表达影响内膜的合成和分泌功能,从而降低子宫内膜容受性,导致胚胎着床失败和早期流产 [9] 。
HOXA10是子宫内膜容受性建立及基质细胞蜕膜化的重要调节因子,对胚胎着床起着关键性的调控作用 [10] 。在人类自然周期中,HOXA10于分泌中期即排卵后5~7天特异性地高表达于内膜上皮细胞和基质细胞,其表达峰值与着床窗口期的开放时间一致,与胚胎植入宫腔的时间一致,表达存在时空的特异性 [11] 。子宫内膜环境中HOXA10基因缺失或表达下降,可使子宫内膜进入接受状态障碍,着床窗口期开放时间与胚胎发育不同步,从而导致胚胎不能正常发育,进而胚胎死亡,植入失败 [12] 。
在胚胎着床窗口期,雌、孕激素与子宫内膜上对应的受体相结合,激活HOXA10基因的转录,使内膜间质细胞蜕膜化,内膜分化呈高峰状态,子宫内膜形成了良好的容受性,为胚胎植入提供条件 [13] 。
4.3. 高雌、高孕激素状态下ER、PR、HOXA10的表达
关于超促排条件下的高雌孕激素水平是否影响子宫内膜容受性从而降低胚胎种植成功率,此方面的研究甚少,且各位研究者的意见尚未达成一致。Zhang [9] 等的研究指出,在控制性超促排卵治疗中,多个卵泡同步发育,促使雌二醇水平升高到生理水平的数倍乃至数十倍,孕酮水平有不同程度的提前升高,雌孕激素水平的异常使得子宫内膜由增生期向分泌期转化,从而ER和PR下调,种植窗的开放等生理过程均提前,导致内膜发育与胚胎发育不同步,子宫内膜容受性下降,最终使得胚胎种植率下降。而Wu [14] 的研究得出,当HCG日E2 > 5000 pg/ml时,着床率、临床妊娠率均有下降,但差异无显著性差异。Li [2] 的研究指出,单纯孕激素升高可能影响试管助孕成功率,但是单纯雌激素浓度升高对妊娠结局无影响。此类研究都是基于临床病例资料,关于子宫内膜容受性基因方面的研究甚少。
本研究通过对不同雌孕激素水平下ER、PR、同源框基因HOXA-10在控制性超排卵(COH)患者的胚胎着床窗口期的子宫内膜中的表达进行检测,以此探讨IVF超促排卵过程中超生理剂量的雌激素、孕激素对子宫内膜容受性的影响及其可能机制。研究得出,与对照组相比,高E2组在ER、PR、同源框基因HOXA-10方面的表达并无统计学差异,提示高雌激素并不影响子宫内膜容受性;而高P组、高E2并高P组分别和对照组、高E2组比较,ER、PR、HOXA-10的表达均下降,且差异有统计学差异(P < 0.05),提示HCG日孕酮提前升高,导致子宫内膜上皮细胞ER、PR的表达提前降低,子宫内膜容受性受到影响,种植窗口期提前关闭,胚胎种植成功率下降,为全胚冷冻提供了理论依据。本研究与上述两位学者的临床研究结果一致 [2] [14] ,从分子层面证实了上述研究的结果。
在高P组中,对ER、PR、HOXA10 3个免疫组化指标的表达分别进行两两相关性分析,结果提示上述三个指标的表达均具有显著的正相关关系。在高E2并高P组中进行类似分析亦得到同样结果。提示ER、PR、HOXA10三个指标的表达呈现高度时空一致性,进一步验证了上述观点,并提示ER、PR、HOXA10作为评价子宫内膜容受性指标的可靠性以及稳定性。
5. 总结
本研究得出,超促排条件下的高雌激素水平可能对子宫内膜容受性无明显影响,而HCG日的高孕激素则对子宫内膜容受性有显著影响,此对临床工作有重要指导意义。本研究结果结合相关文献,可以推测子宫内膜容受性受影响的相关机制:COH过程中超生理水平的雌、孕激素干扰了内源性激素的生理平衡,影响ER、PR的正常表达,从而影响HOXA10基因的转录,使着床窗口期提前关闭,子宫内膜的发育和胚胎自身发育不同步,胚胎种植成功率下降;另一方面,其可直接通过改变与子宫内膜着床相关的细胞因子的时序性表达等方式降低子宫内膜的容受性。掌握上述规律,将对如何改善子宫内膜容受性,提高IVF助孕成功率提供理论依据;提示我们可能通过基因修饰技术,对相关受体进行基因表达的调控,将不失为一种提高内膜容受性的新思路。
超促排卵周期中,高雌孕激素对着床期子宫内膜容受性的影响,国内外的研究大多基于临床病例报道,且各家意见不一。本研究选择ER、PR、HOXA10这三个预测子宫内膜容受性的重要指标进行综合分析,给临床治疗提供了理论依据。但从分子机制方面,各个指标之间是如何进行相互影响的,尚待进一步研究。
基金项目
云南省卫生科技计划项目(2016NS212)、云南省应用基础研究昆医联合专项2017FE467(-114)、云南省人类辅助生殖研究创新团队(2017HC009)、云南省医学学科带头人培养计划(D-201634)以及云南省中青年学术和技术带头人后备人才项目(2017HB041)资助。
文章引用
钟兰萍,康晓敏,蒋圆松,李 蕾,林 娜,马 蕊,武 泽. 超排卵周期中高雌孕激素对子宫内膜ER、PR、HOX10以及内膜容受性的影响
Effects of High Estradiol and Progesterone Levels in Controlled Ovarian Hyperstimulation Cycles on ER, PR, HOX10 and Endometrial Receptivity[J]. 临床医学进展, 2019, 09(04): 477-487. https://doi.org/10.12677/ACM.2019.94074
参考文献
- 1. 李蓉, 乔杰, 武泽, 等. 超促排卵周期中孕酮升高对胚胎植入的影响[J]. 生殖医学杂志, 2013, 4(22): 230-234.
- 2. Wu, Z., Li, R., Ma, Y.P., et al. (2012) Effect of HCG-Day Serum Progesterone and Estradiol Concen-trations on Pregnancy Outcomes in GnRH Agonist Cycles. Reproductive BioMedicine Online, 24, 51-520. https://doi.org/10.1016/j.rbmo.2012.02.003
- 3. Noyes, R.W., Hertig, A.T. and Rock, J. (1975) Dating the En-dometrial Biopsy. American Journal of Obstetrics & Gynecology, 122, 262-263. https://doi.org/10.1016/S0002-9378(16)33500-1
- 4. Budwit-Novotny, D.A., McCarty, K.S., Cox, E.B., et al. (1986) Immunohisto-Chemical Analyses of Estrogen Receptor in Endometrial Adenocarcinoma Using a Monoclonal Antibody. Cancer Research, 46, 5419-5425.
- 5. 曹泽毅. 妇产科学[M]. 北京: 人民卫生出版, 2008: 595.
- 6. Lane, D.B., Rutherford, T.J. and Taylor, H.S. (2004) HOXA10 Expression in Endometrial Adenocarcinoma. Tumor Biology, 25, 264-269. https://doi.org/10.1159/000081390
- 7. Tan, J., Paria, B.C. and Dey, S.K. (1999) Differential Uterine Expression of Estrogen and Progesterone Receptors with Uterine Preparation for Implantation and Decidual in the Mouse. Endocrinology, 140, 5310-5321. https://doi.org/10.1210/endo.140.11.7148
- 8. Sta Vreus, E., Vers, A., Nikas, G., et al. (2001) Formation of Pjnopodes in Human Endometrium Is Associated with the Concentrations of Progesterone and Progesterone Receptors. Fertility and Sterility, 76, 782-791. https://doi.org/10.1016/S0015-0282(01)01993-8
- 9. 张学红. 控制性超排卵与子宫内膜容受性[J]. 生殖医学杂志, 2013, 22(4): 224-228.
- 10. Diedrich, K., Fauser, B.C., Devroey, P., et al. (2007) The Role of the Endometrium and Embryo in Human Implantation. Human Reproduction Update, 13, 365-377. https://doi.org/10.1093/humupd/dmm011
- 11. Taylor, H.S., Arici, A., Olive, D., et al. (1988) HOXA10 Is Ex-pressed in Response to Sex Steroids at the Time of Implantation in the Human Endometrium. Journal of Clinical In-vestigation, 101, 1379-1384. https://doi.org/10.1172/JCI1597
- 12. Eun, K.H. and Taylor, H.S. (2004) The Role of HOX Genes in Human Im-plantation. Annals of the New York Academy of Sciences, 1304, 1-18. https://doi.org/10.1196/annals.1335.001
- 13. Szczepanska, M., Wirstlein, P., Luczak, M., et al. (2011) Expression of HOXA-10 and HOXA-11 in the Endometria of Women with Idiopathic Infertility. Folia Histochemica et Cyto-biologica, 49, 11. https://doi.org/10.5603/FHC.2011.0016
- 14. Wu, R.J. and Zhou, F.Z. (2004) Insulin-Like Growth Factor II and Its Receptor Gene Expression in the Endometrium of Women with Unexplained Infertility. Zhong Hua Fu Chan Ke Za Zhi, 39, 242-245.
NOTES
*通讯作者。
