Open Journal of Nature Science
Vol.
07
No.
03
(
2019
), Article ID:
30335
,
8
pages
10.12677/OJNS.2019.73029
Effects of Glyphosate on Growth, Photosynthetic Pigments and Antioxidant Enzyme Systems of Myriophyllum aquaticum
Huan Cai, Zhonghua Wu
College of Life Sciences, Wuhan University, Wuhan Hubei

Received: May 2nd, 2019; accepted: May 15th, 2019; published: May 22nd, 2019

ABSTRACT
Glyphosate is currently the most widely used and broad-spectrum herbicide in the world. Because it is widely used in agricultural production, it not only has residues in the soil, but also has a high detection rate in the water environment, which poses a certain threat to the aquatic ecosystem. In this study, the growth, photosynthetic pigments and the activity of antioxidase on Myriophyllum aquaticum were determined after 14 days culture under different concentration of glyphosate (0, 0.05, 0.1, 0.3 mmol/L). We observed the ecotoxicological effects of glyphosate on Myriophyllum aquaticum, explored the tolerance of plants under this stress condition, and provided a reference basis for selecting plant species for bioremediation of glyphosate.
Keywords:Glyphosate, Antioxidant Enzyme, Photosynthetic Pigments, Myriophyllum aquaticum
草甘膦对粉绿狐尾藻生长、光合色素和抗氧化酶系统的影响
蔡欢,吴中华
武汉大学生命科学学院,湖北 武汉

收稿日期:2019年5月2日;录用日期:2019年5月15日;发布日期:2019年5月22日

摘 要
草甘膦是目前世界范围内使用范围最广、用量最大的广谱、灭生性除草剂。因其被大量利用于农业生产中,不仅在土壤中存在残留,同时在水环境中检出率也很高,对水生生态系统带来一定威胁。本研究通过模拟实验,选取水生植物粉绿狐尾藻(Myriophyllum aquaticum)于不同浓度(0, 0.05, 0.1, 0.3 mmol/L)的水环境中培养14天后,测定其生长、光和色素含量以及抗氧化酶活性等指标,以观测水体中草甘膦对粉绿狐尾藻的生态毒理作用,探讨植物在草甘膦胁迫下的耐受能力,为将来水体中草甘膦的生物修复选种提供参考依据。
关键词 :草甘膦,抗氧化酶,光合色素,粉绿狐尾藻

Copyright © 2019 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
草甘膦是目前世界上使用范围最广的农药,因其对杂草的毒害具有相对非选择性,对深根多年生草本植物,莎草和阔叶杂草的去除都非常有效,所以常被用于农田和非耕地的除杂用 [1] 。草甘膦主要是通过喷施在植物叶面之后被植物内吸后,积累于植物地上的分生组织,抑制5-烯醇丙酮基莽草酸-3-磷酸合酶,可以防止氨基酸苯丙氨酸,酪氨酸和色氨酸的生物合成,使植物不能合成它生存所必需的某些芳香氨基酸,导致植物次生代谢和蛋白合成反应失衡 [2] [3] [4] ,以及莽草酸合成途径受阻,具有受损的莽草酸代谢的植物易患各种植物病原体,植物最终死亡 [5] 。
草甘膦被大量使用后,其残留物通过雨水、排灌、地表径流以及直接排放(被用于水田杂草的去除)等方式进入水体,在水体中检出率很高,影响水生生态系统 [6] 。草甘膦进入土壤大多被土壤吸附,但在水体环境中较难分解,对水生环境带来严重威胁。本研究通过模拟实验,对粉绿狐尾藻进行不同浓度的草甘膦水溶液培养后,测定其生长指标、光合色素含量及各抗氧化酶活性,以观测草甘膦对水生植物粉绿狐尾藻的生长、生理影响,为后续治理和修复工作提供参考。
2. 材料和方法
2.1. 实验材料
粉绿狐尾藻,双子叶植物纲,桃金娘目,小二仙草科、狐尾藻属的一年生水生浮水草本植物。本实验所用植物采自湖北省武汉市东湖水域。
2.2. 实验方法
① 实验处理
将取得植株用自来水彻底清洗,去除黄叶烂叶后以10%霍格兰营养液进行7天驯化,之后取生长状况良好、大小相近的植物(并记录初始鲜重)按实验浓度设置(0, 0.05, 0.1, 0.3 mmol/L)进行培养,14天后收获,测定各项指标。
实验所使用的草甘膦均为纯度 ≥ 95%的原药粉剂。
② 植物鲜重的测定
实验结束采集样品后,使用蒸馏水对其表面进行冲洗,去除附着物,擦干水分后用万分天平(精确度0.1 mg)称量植株验后鲜重(FW)。
③ 叶绿素含量测定
光合色素测定参考Jampeetong和Brixl [7] 方法加以调整,取0.1 g植物叶片剪碎,放入试管中,加入10 mL 95%乙醇,密封置于黑暗中24 h,用紫外分光度计测定470,649和665 nm的吸光值,根据Lichtenthaler和Wellburn [8] 的方法计算植物叶片中的叶绿素a、b以及类胡萝卜素含量(mg/g FW)。
④ MDA、H2O2、可溶性蛋白和游离脯氨酸含量测定
MDA含量(mmol/g FW)用硫代巴比妥酸(TBA)法测定 [9] 。
H2O2含量的测定,采用紫外分光光度法测定。可溶性蛋白含量测定采用考马斯亮蓝G-250法测定(mg/g FW),以牛血清蛋白(BSA)为标准蛋白。游离脯氨酸含量的测定则是使用快速比色法。
⑤ 抗氧化酶活性测定
取植物叶片0.1 g加入50 mM的PBS,pH7.8 (内含1% PVP)在冰浴下研磨,在冷冻离心机下10,000 g离心10 min [10] ,收集上清液,即为粗酶液,置于4℃环境中保存,用于后续指测定。
过氧化氢酶(CAT)活性采用分光光度法,以1 min内吸光值A240减少0.1的酶量为一个酶活单位(U),酶活性U/(g∙min FW)表示 [11] 。过氧化物歧化酶(SOD)活性采用氮蓝四唑(NBT)光化还原法测定,在560 nm处测定,以抑制NBT光化还原的50%定义为一个SOD酶活性单位。抗坏血酸过氧化物酶(APX)是以抗坏血酸作为电子供体,将H2O2还原为H2O。测定时以加入H2O2为起始点,1 min内反应液在290 nm波长下变化0.01为一个APX酶活力单位。
2.3. 数据处理与分析
所有的实验数值采用“平均值±标准差”的形式表示,分析数据之前,先进行均匀分布和方差齐性检验。对实验数据进行单因素方差分析(one-way ANOVA),再采用Ducan事后检验,以P < 0.05作为显著性评价标准,当P < 0.01是则差异评价为极显著。使用SPSS 22进行数据的统计分析,作图使用软件SigmaPlot 12.5。
3. 实验结果
3.1. 生长
与对照组相比,在草甘膦胁迫条件下,低浓度(0.05 mmol/L)的草甘膦已经显著影响粉绿狐尾藻的生长(P < 0.001)。如图1所示,植物鲜重表现为负增长,其相对生长率从对照组的+4.01下降为−8.71%。随着草甘膦浓度的进一步提高(≥0.1 mmol/L),植物鲜重负增长,相对生长率(−8.72~−11.41)和对照组相比仍表现为显著下降,但与低浓度相比并未见明显差异。
3.2. 光合色素含量
由图2可知,粉绿狐尾藻在经过14天草甘膦处理后,叶绿素a、叶绿素b含量在中低浓度草甘膦(≤0.1 mmol/L)条件下均有一定下降,但与对照组植株体内光合色素含量相比差异不明显,仅在高浓度草甘膦(0.3 mmol/L)条件下含量较对照组显著下降(P < 0.05)。植株体内类胡萝卜素在经各浓度草甘膦处理后含量略微下降,但均未达到显著水平。
3.3. MDA、H2O2、可溶性蛋白和游离脯氨酸含量及抗氧化酶活性
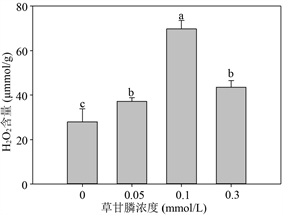
如图3-(1)在草甘膦胁迫条件下培养14天后,收获的粉绿狐尾藻在草甘膦浓度 ≤ 0.1 mmol/L时,MDA含量未见明显差异,当水体中草甘膦浓度达到0.3 mol/L时,MDA显著上升。而与对照组相比,植物体内H2O2含量在三个草甘膦胁迫条件下均显著上升(P < 0.05),在0.1 mmol/L下达到最高(P < 0.001),约为对照组的2.49倍。
 注:图中数值取三次重复的平均值 ± 标准差。同一字母标识法表示植物的同一指标在不同的草甘膦浓度之间差异显著(P ≤ 0.05, Duncan)。下同。
注:图中数值取三次重复的平均值 ± 标准差。同一字母标识法表示植物的同一指标在不同的草甘膦浓度之间差异显著(P ≤ 0.05, Duncan)。下同。
Figure 1. Effects of glyphosate on relative growth rate of M. aquaticum after 14 d treatment
图1. 不同浓度草甘膦处理14天后粉绿狐尾藻的相对生长率
 (1)
(1)
 (2)
(2)
 (3)
(3)
Figure 2. Effects of glyphosate on chlorophyll a (1), chlorophyll b (2) and carotenoid (3) of M. aquaticum after 14 d treatment
图2. 不同浓度草甘膦处理14天后粉绿狐尾藻的叶绿素a、叶绿素b和类胡萝卜素含量
 (1)
(1)
 (2)
(2)
 (3)
(3)
 (4)
(4)
 (5)
(5)
 (6)
(6)
 (7)
(7)
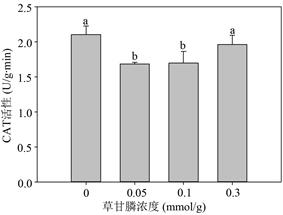
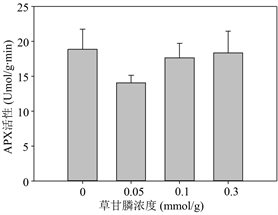
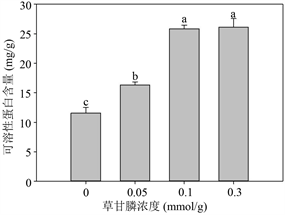
Figure 3. Effects of glyphosate on the content of MDA (1), H2O2 (2), soluble protein (6), proline (7) and the activity of SOD (3), CAT (4) and APX (5) of M. aquaticum after 14 d treatment
图3. 不同浓度草甘膦处理14天后粉绿狐尾藻的MDA (1)和H2O2 (2)含量,CAT (3)、SOD (4)和APX (5)活性及可溶性蛋白(6)和游离脯氨酸(7)含量
图3-(3)~3-(5)反映了植物抗氧化酶活性水平,其中粉绿狐尾藻的APX活性在实验设置的浓度下未见显著差异,维持在一较稳定水平。SOD和CAT活性则在草甘膦浓度 ≤ 0.1 mmol/L下,显著降低,在高浓度草甘膦条件下与对照组相比变化不显著。
粉绿狐尾藻的可溶性蛋白(图3-(6))在实验设定的三个草甘膦浓度条件下均极显著上升(P < 0.001),其中,当草甘膦浓度 ≥ 0.1 mmol/L时,其含量上升至对照组的2.24倍以上。游离脯氨酸(图3-(7))在草甘膦处理后,则与对照组相比并没有显著差异。
4. 讨论
作为被最广泛使用的除草剂,草甘膦已被证实会对植物体内多个代谢过程产生影响。在本实验中草甘膦胁迫条件下,粉绿狐尾藻的相对生长率相比于对照组极显著下降(P < 0.001)。14天培养后,其相对生长率在数值上由对照组的4.01,在草甘膦胁迫下降至−11.41~−8.71,植物表现出负增长。有研究表明,植物在喷施草甘膦后,碳的交换和叶片气孔导度均降低 [12] 。而在此种条件下,植物对二氧化碳的同化能力受到限制,导致二氧化碳大量积累,抑制植物体内将环境中的碳固定为还原糖,从而表现出相对生长率的下降。粉绿狐尾藻在草甘膦胁迫下的生长表现与此研究结果一致。
草甘膦是一种金属螯合剂,可与植物体内的营养成分发生作用,这些营养成分通常是植物生物合成过程中的重要组成成分或是具有酶促辅助因子作用的物质,从而影响植物体内包括光合作用在内的多个反应过程 [13] [14] 。在绿色植物体内,参加光合作用的色素主要包括叶绿素a、叶绿素b和类胡萝卜素,其中类胡萝卜素是辅助色素,而植物光合作用速率和效率与光合色素含量密切相关 [15] 。高浓度草甘膦(0.3 mmol/L)的草甘膦显著降低了粉绿狐尾藻叶绿素a含量由对照组的5.95 mg/g降至4.01 mg/g。而植物叶绿素b和类胡萝卜素未在草甘膦胁迫条件下有较大差异。草甘膦通过抑制光合作用中叶绿素、类胡萝卜素、脂肪酸和氨基酸等必须物质的生物合成间接影响植物的光合作用。作为EPSPS的竞争性抑制剂,草甘膦的喷施阻断了植物体内的莽草酸途径,抑制其体内次生代谢物的合成,如八氢番茄红素酶和胡萝卜素去饱和酶的辅因子——质体醌。在本实验中,草甘膦对粉绿狐尾藻的类胡萝卜素含量的抑制作用并不显著。另有研究表明,草甘膦是通过其代谢产物氨甲基膦酸(AMPA)来干扰叶绿素的生物合成,进而影响植物的光合作用。草甘膦在土壤和水体中C-N键断裂或在草甘膦氧化酶作用下,易被降解为AMPA。AMPA会降低植物中甘氨酸、丝氨酸和谷氨酸的含量,这些氨基酸是植物体合成ALA所需要的原材料,上述氨基酸合成量的减少,直接影响到叶绿素的生物合成。这与本实验中粉绿狐尾藻的叶绿素a、叶绿素b含量在高浓度草甘膦胁迫条件下显著下降的结果一致。
水体环境中的污染物,如农药、重金属、过量或不足的营养等会使水生植物细胞内ROS的大量产生和清除能力失衡,造成植物体内的活性氧(ROS)大量累积,引起膜脂过氧化水平增高,改变膜脂成分,增加细胞膜的相对透性,从而引起一系列生理代谢变化,而植物可以通过合成抗氧化酶以及抗氧剂应对氧化胁迫,清除多余的ROS [16] 。H2O2含量可以衡量植物受胁迫的情况,在本实验中,粉绿狐尾藻在单一草甘膦胁迫下,植物中H2O2含量显著升高,表明此浓度下草甘膦可以引起植物氧化应激反应。H2O2是强氧化剂,可以对光合色素和生物分子如磷脂、蛋白质造成氧化损伤(Gunes等,2009)。在水稻 [17] 、玉米 [18] 和豌豆 [19] 等植物中也观察到在暴露与草甘膦环境中后H2O2的累积和膜脂过氧化程度增加,这与我们在粉绿狐尾藻在草甘膦暴露中观察到的H2O2含量增加的现象相一致。而膜脂过氧化产物MDA含量常被用作为评价植物中氧化应激水平的重要指标 [20] 。在我们的研究中,草甘膦胁迫条件下,粉绿狐尾藻的MDA含量仅在高浓度(0.3 mmol/L)条件下显著提高。在长期的进化历程中,植物体内对外界的刺激产生了酶和非酶的调节系统以应对各种胁迫。其中抗氧化酶系统中主要包括SOD、CAT、POD和APX等酶,本实验中测定了植物在草甘膦胁迫条件下体内SOD、CAT和APX的活性,以了解这两种植物其相对的应激策略。SOD被认为是植物体内面对ROS的第一道防线,是超氧自由基( )的主要清除剂,SOD将植物体内产生的过量的 转化为H2O2,以使植物体内超氧自由基维持在一个正常水平。而在SOD作用下,植物体内积累的H2O2的去除则主要由我们测定的CAT和APX发挥作用。本实验中,草甘膦胁迫下粉绿狐尾藻体内的H2O2含量上升,但其体内SOD活性却表现出显著下降。植物体内的H2O2的积累量上升并非因草甘膦胁迫而刺激SOD歧化胁迫产生的超氧自由基所致,可能是由于环境胁迫抑制了CAT的活性,干扰了机体正常的H2O2代谢,在0.3 mmol/L草甘膦条件下因H2O2含量上升,引起了MDA含量上升,造成细胞膜脂的损伤。当草甘膦浓度不高于0.1 mmol/L时,尽管机体内H2O2含量有所上升,而抗氧化酶系统中的相关反应酶活性并未被显著激活,由此可判断粉绿狐尾藻可能是通过体内非酶系统来抵御外界低中浓度草甘膦带来的损害,以维持机体处于较为稳定的状态。Moldes [21] 在观察大豆在草甘膦胁迫下的生理反应时得出过相似结论,草甘膦胁迫下,敏感型和耐受型大豆体内MDA含量均无显著变化,同时相应的抗氧化酶活性也未观察到被显著激活,但这两种大豆根和叶片中的可溶性氨基酸含量都显著上升。本实验的粉绿狐尾藻在草甘膦胁迫条件下,观察到可溶性蛋白含量显著上升,由空白对照组的11.56 mg/g在低中高三个实验设置的草甘膦浓度条件下分别上升至16.32 mg/g、25.84 mg/g和26.10 mg/g,其中中高浓度下达到了对照组的2.24和2.26倍。蛋白质是植物生长的每个环节都必不可少的生物大分子,其含量对生物维持正常生长以及调节机体代谢都至关重要。在草甘膦刺激下,粉绿狐尾藻MDA含量上升未达到机体ROS阈值,不足以引起相关的抗氧化酶系统内酶活性的显著变化,因此植物需要从环境中获取更多的营养盐以维持正常的生命活动,而这也可能是粉绿狐尾藻在草甘膦刺激下体内可溶性蛋白含量显著上升的原因。
文章引用
蔡欢,吴中华. 草甘膦对粉绿狐尾藻生长、光合色素和抗氧化酶系统的影响
Effects of Glyphosate on Growth, Photosynthetic Pigments and Antioxidant Enzyme Systems of Myriophyllum aquaticum[J]. 自然科学, 2019, 07(03): 197-204. https://doi.org/10.12677/OJNS.2019.73029
参考文献
- 1. Annett, R., Habibi, H.R. and Hontela, A. (2014) Impact of Glyphosate and Glyphosate-Based Herbicides on the Freshwater Environment. Journal of Applied Toxicology, 34, 458-479. https://doi.org/10.1002/jat.2997
- 2. Bai, S.H. and Ogbourne, S.M. (2016) Glyphosate: Environmental Contamination, Toxicity and Potential Risks to Human Health via Food Contamination. Environmental Science and Pollution Research, 23, 18988-19001. https://doi.org/10.1007/s11356-016-7425-3
- 3. Zhong, G., Wu, Z., Liu, N., et al. (2018) Phosphate Alleviation of Glyphosate-Induced Toxicity in Hydrocharis dubia (Bl.) Backer. Aquatic Toxicology, 201, 91-98. https://doi.org/10.1016/j.aquatox.2018.05.025
- 4. 张合彩, 杨玉娟, 石长应, 等. 草甘膦对非靶标生物的毒性研究进展[J]. 生态毒理学报, 2018, 13(5): 69-75.
- 5. 范甜甜, 杨治峰, 张振玲. 除草剂草甘膦毒作用的研究进展[J]. 环境与健康杂志, 2017, 34(1): 91-94.
- 6. Borggaard, O.K. and Gimsing, A.L. (2008) Fate of Glyphosate in Soil and the Possibility of Leaching to Ground and Surface Waters: A Review. Pest Management Science, 64, 441-456. https://doi.org/10.1002/ps.1512
- 7. Jampeetong, A. and Brix, H. (2009) Effects of NaCl Salinity on Growth, Morphology, Photosynthesis and Proline Accumulation of Salvinia natans. Aquatic Botany, 91, 181-186. https://doi.org/10.1016/j.aquabot.2009.05.003
- 8. Lichtenthaler, H.K. and Wellburn, A.R. (1983) Determinations of Total Carotenoids and Chlorophylls a and b of Leaf Extracts in Different Solvent. Biochemical Society Transactions, 11, 591-592.
- 9. 王学奎, 黄见良. 植物生理生化实验原理与技术[M]. 北京: 高等教育出版社, 2015: 267-277.
- 10. 施海涛. 植物逆境生理学实验指导[M]. 北京: 科学出版社, 2016: 58-75.
- 11. 苍晶, 赵会杰. 植物生理学实验教程[M]. 北京: 高等教育出版社, 2013: 85-87.
- 12. Mateos-Naranjo, E., Redondo-Gomez, S., Cox, L., et al. (2009) Effectiveness of Glyphosate and Imazamox on the Control of the Invasive Cordgrass Spartina densiflora. Ecotoxicology and Environmental Safety, 72, 1694-1700. https://doi.org/10.1016/j.ecoenv.2009.06.003
- 13. Wang, C.Y. (2001) Effect of Glyphosate on Aromatic Amino Acid Metabolism in Purple Nutsedge (Cyperus rotundus). Weed Technology, 15, 628-635. https://doi.org/10.1614/0890-037X(2001)015[0628:EOGOAA]2.0.CO;2
- 14. Serra, A., Nuttens, A., Larvor, V., et al. (2013) Low Environmentally Relevant Levels of Bioactive Xenobiotics and Associated Degradation Products Cause Cryptic Perturbations of Metabolism and Molecular Stress Responses in Arabidopsis thaliana. Journal of Experimental Botany, 64, 2753-2766. https://doi.org/10.1093/jxb/ert119
- 15. Zhong, G., Wu, Z., Yin, J., et al. (2018) Responses of Hydrilla verticillata (L.f.) Royle and Vallisneria natans (Lour.) Hara to Glyphosate Exposure. Chemosphere, 193, 385-393. https://doi.org/10.1016/j.chemosphere.2017.10.173
- 16. Wu, Z., Yu, D., Li, J., et al. (2010) Growth and Antioxidant Response in Hydrocharis dubis (Bl.) Backer Exposed to Linear Alkylbenzenesulfonate. Ecotoxicology, 19, 761-769. https://doi.org/10.1007/s10646-009-0453-8
- 17. Ahsan, N., Lee, D., Lee, K., et al. (2008) Glyphosate-Induced Oxidative Stress in Rice Leaves Revealed by Proteomic Approach. Plant Physiology and Biochemistry, 46, 1062-1070. https://doi.org/10.1016/j.plaphy.2008.07.002
- 18. Sergiev, I.G., Alexieva, V.S., Ivanov, S.V., et al. (2006) The Phenylurea Cytokinin 4PU-30 Protects Maize Plants against Glyphosate Action. Pesticide Biochemistry and Physiology, 85, 139-146. https://doi.org/10.1016/j.pestbp.2006.01.001
- 19. Miteva, L.P., Ivanov, S.V. and Alexieva, V.S. (2010) Alterations in Glutathione Pool and Some Related Enzymes in Leaves and Roots of Pea Plants Treated with the Herbicide Glyphosate. Russian Journal of Plant Physiology, 57, 131-136. https://doi.org/10.1134/S1021443710010188
- 20. Gunes, A., Inal, A., Bagci, E.G., et al. (2007) Silicon Mediates Changes to Some Physiological and Enzymatic Parameters Symptomatic for Oxidative Stress in Spinach (Spinacia oleracea L.) Grown under B Toxicity. Scientia Horticulturae, 113, 113-119. https://doi.org/10.1016/j.scienta.2007.03.009
- 21. Moldes, C.A., Medici, L.O., Abrahao, O.S., et al. (2008) Biochemical Responses of Glyphosate Resistant and Susceptible Soybean Plants Exposed to Glyphosate. Acta Physiologiae Plantarum, 30, 469-479. https://doi.org/10.1007/s11738-008-0144-8