Advances in Clinical Medicine
Vol.
12
No.
12
(
2022
), Article ID:
59877
,
8
pages
10.12677/ACM.2022.12121744
非酒精性脂肪性肝炎小鼠模型的构建
戴冠齐1*,林锦涛1*,李永龙1,2,韩留鑫3,赵文淘4,夏加伟3,李迎春1,黄世豪1,何丹华1, 丛金格1,2,贾俊双1,林晓琳1,肖东1,2,申红芬1#
1南方医科大学基础医学院肿瘤研究所,广东 广州
2南方医科大学实验动物管理中心,广东 广州
3昆明市第三人民医院(大理大学第六附属医院),云南 昆明
4昆明医科大学第三附属医院(云南省肿瘤医院,云南省癌症中心)消化肿瘤内科,云南 昆明
收稿日期:2022年11月26日;录用日期:2022年12月23日;发布日期:2022年12月30日

摘要
目的:构建特殊饲料饮食诱导的非酒精性脂肪性肝炎(nonalcoholic steatohepatitis, NASH)小鼠模型。方法:将40只8周龄的C57BL6/J雄性小鼠分成四组,分别予以高脂高果糖高胆固醇饮食(FFC)及对照饮食喂养4个月、6个月,期间每周称量小鼠体重,分别于喂养4个月和6个月取材,取动物血清和肝脏,进行血清学检测与肝组织病理学检测。结果:与对照组相比,FFC组体质量(P < 0.05)、肝湿重(P < 0.01)和肝体比(P < 0.01)均显著升高;FFC组脂肪变性明显比对照组严重(P < 0.001);FFC组肝脏甘油三脂较对照显著升高(P < 0.001),FFC组血清总胆固醇(TC)显著高于对照组(P < 0.001),FFC组血清ALT (P < 0.05)、AST (P < 0.001)较对照显著升高。而且,FFC饮食喂养6个月比喂养4个月的小鼠具有更为严重的NASH疾病特征。结论:建立了不同严重程度的NASH小鼠模型,为研究NASH发病机制以及治疗等研究提供模型参考。
关键词
非酒精性脂肪性肝炎,高脂高果糖高胆固醇饮食,小鼠模型

Establishment of Non-Alcoholic Steatohepatitis Mouse Model
Guanqi Dai1*, Jintao Lin1*, Yonglong Li1,2, Liuxin Han3, Wentao Zhao4, Jiawei Xia3, Yingchun Li1, Shihao Huang1, Danhua He1, Jin’ge Cong1,2, Junshuang Jia1, Xiaolin Lin1, Dong Xiao1,2, Hongfen Shen1#
1Cancer Research Institute, School of Basic Medical Science, Southern Medical University, Guangzhou Guangdong
2Institute of Comparative Medicine and Laboratory Animal Center, Southern Medical University, Guangzhou Guangdong
3The Third People’s Hospital of Kunming (The Sixth Affiliated Hospital of Dali University), Kunming Yunnan
4Department of Gastrointestinal Oncology, The Third Affiliated Hospital of Kunming Medical University (Yunnan Cancer Hospital, Yunnan Cancer Center), Kunming Yunnan
Received: Nov. 26th, 2022; accepted: Dec. 23rd, 2022; published: Dec. 30th, 2022

ABSTRACT
Objective: To construct a mouse model of special diet-induced nonalcoholic steatohepatitis NASH. Methods: A total of 40 male C57BL6/J mice were divided into four groups, fed a high-fat, high-fructose and high-cholesterol diet (FFC) and a control diet for 4 months and 6 months, during which the body weight of mice was weighed weekly, and samples were collected at 4 months and 6 months respectively. Serum and liver of mice were collected for serological and histopathological detection. Results: Compared with the control group, the body mass (P < 0.05), liver wet weight (P < 0.01) and hepatic body ratio (P < 0.01) of the FFC group were significantly increased, the steatosis in the FFC group was significantly more serious than that in the control group (P < 0.001), the serum TC in the FFC group was significantly higher than that in the control group (P < 0.001), and the serum ALT (P < 0.05) and AST (P < 0.001) in the FFC group were significantly higher than those in the control group. Furthermore, mice fed the FFC diet for 6 months showed more severe features of NASH disease than those fed the FFC diet for 4 months. Conclusion: Mouse models of NASH with different severity were established, which can provide a model reference for further study of the pathogenesis of NASH and the treatment.
Keywords:Nonalcoholic Steatohepatitis, High Fat, High-Fructose and High-Cholesterol (FFC) Diet, Mouse Model

Copyright © 2022 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 前言
非酒精性脂肪性肝病(Nonalcoholic fatty liver disease, NAFLD)是目前世界范围内最常见的慢性肝病病因,其进展形式非酒精性脂肪性肝炎(non-alcoholic steatohepatitis, NASH)已成为肝移植的主要适应症之一 [1]。NASH是一类具有炎症细胞浸润和坏死的严重肝病,其特征在于肝细胞以脂肪变性、气球样变、肝小叶炎症为主要特征,并且有发展为纤维化、肝硬化、肝细胞癌和肝衰竭的风险 [2]。然而,针对NASH适应症的药物均尚未获得批准,究其原因除发病机制不清,病因复杂外,理想化实验模型的缺乏也是其中的原因之一 [3]。现有的实验性模型大多都不能够很好地模拟人类NASH疾病的发生、发展以及严重程度,严格来说,大多数模型无法模拟非酒精性脂肪性肝炎肝细胞气球样病变和伴随炎症的大泡性脂肪变性 [4]。因此,寻求出适用于实验室研究,且与人NASH高度相似的NASH动物模型,对NASH机制研究和治疗具有十分重要的意义。本实验构建了FFC饮食诱导的不同严重程度的NASH小鼠模型,并对该模型进行了验证。
2. 材料与方法
2.1. 实验动物
选用SPF级C57BL6/J雄性小鼠40只,7~8周龄,购于广东省实验动物中心,许可证号:SCXK (粤) 2016-0041。动物适应性喂养1周后后再进行实验。小鼠均在SPF级环境中自由采食、饮水,温度控制在22℃,照明/黑暗12 h循环。对照饮食饲料货号:国产仿制的D09100304,高脂高果糖高胆固醇(FFC)饮食饲料货号:research Dies:D09100310。特殊饲料成分见表1。本试验符合实验动物管理规范。
Table 1. Composition of high-fat, high-fructose and high-cholesterol feed and a control feed
表1. 高脂高果糖高胆固醇饲料与对照饲料的组成成分
2.2. 仪器与试剂
2.2.1. 主要仪器
轮转式切片机(德国莱卡公司)、包埋机(德国莱卡公司)、全自动组织脱水机(德国莱卡公司)、正置显微镜(Nikon)、AU680全自动生化分析仪(贝克曼)、高速离心机(艾本德)、样品冷冻研磨仪。
2.2.2. 实验试剂
1%戊巴比妥钠,苏木素试剂,伊红试剂。
2.3. 方法
2.3.1. 动物饲养及分组
将40只小鼠随机分为4组,分别予以FFC及对照饮食喂养4个月、6个月后取材,构建不同程度NASH小鼠模型。小鼠自由采食、饮水,照明/黑暗12 h循环。饲料每2 d更换1次。
2.3.2. 标本采集
所有动物隔夜空腹后称体质量,称后麻醉,摘除眼球采血,测量肝脏湿重,统一对肝左叶取材后用4%的多聚甲醛固定,脱水机脱水,包埋机石蜡包埋,制备肝脏石蜡切片。精确称取0.1 g肝中叶肝组织,加入900 µL的PBS,采用冷冻研磨仪制成匀浆(预冷后进行)。
2.3.3. 肝组织病理学检测
石蜡切片行苏木精-伊红(H & E)染色,根据肝组织脂肪空泡浸润程度,进行NAFLD活动度评分(NAFLD activity score, NAS),评分标准见表2 [5]。
2.3.4. 小鼠血清及肝组织匀浆检测
采用全自动生化分析仪测定肝脏甘油三酯(TC)、血清总胆固醇(TC)、血清谷丙转氨酶(ALT)、谷草转氨酶(AST)。
Table 2. NAFLD activity score
表2. NAFLD活动度评分
注:NAS为半定量评分系统,不属于诊断程序,NAS < 3可排除NASH,NAS >= 5可诊断为NASH,介于二者之间为NASH可能。规定不伴小叶内炎症,肝细胞气球样变和纤维化,但肝脂肪变 > 33%为NAFL,脂肪变但未达此程度为肝细胞脂肪变性。
2.3.5. 统计学处理
实数据采用Image J和GraphPad 8.0进行分析,数据以平均数 ± 标准差表示,采用两独立样品T检验分析计量资料,曼–惠特尼U检验分析计数资料,以P < 0.05为差异具有统计学意义。
3. 结果与分析
3.1. 小鼠的体质量、肝湿重和肝体比变化
各组小鼠体质量均逐渐增加,与对照组比较,FFC组体质量、肝湿重和肝体比均明显升高(P < 0.05),造模6个月的小鼠,FFC组小鼠与对照组相比,体质量、肝湿重和肝体比增长相对于造模4个月的小鼠更明显(图1)。通过对小鼠体型、肝脏的大体图片及肝组织病理学观察,可以佐证这一点(P < 0.01) (图1)。
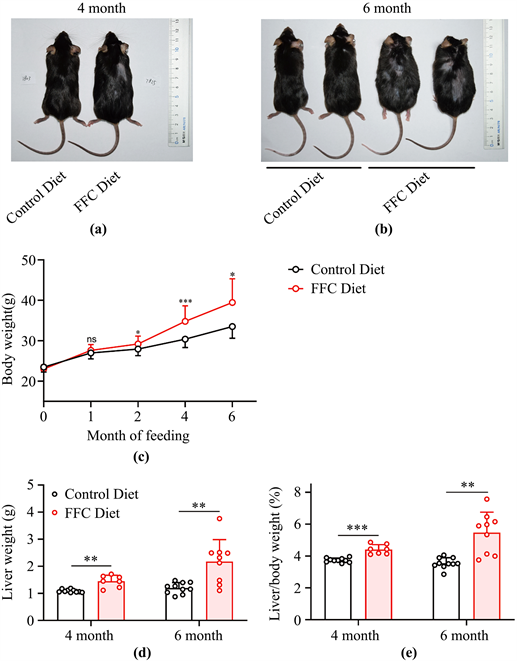
Figure 1. Appearance, body weight, liver weight, and liver index of FFC diet-induced fatty liver mouse model. (a) (b) Appearance of mice after 4 and 6 months of FFC dietary induction; (c) Body weight change of mice after FFC dietary induction; (d) (e) body weight and liver index of mice after 4 and 6 months of FFC dietary induction. All data are shown as mean +/− standard deviation, ***P < 0.001
图1. FFC饮食诱导的脂肪肝小鼠模型大体外观、体重、肝重及肝指数。(a) (b) FFC饮食诱导的4月龄和6月龄小鼠大体外观;(c) FFC饮食诱导的小鼠体重变化;(d) (e) FFC饮食诱导的4 月龄和6 月龄小鼠体重及肝指数。所有数据均展示平均数+/−标准差,***P < 0.001
3.2. 肝组织病理学变化
H-E染色显示,造模4月对照组小鼠肝细胞正常,肝索排列整齐,未见肝细胞脂质空泡NAS评分低于3分;造模4月FFC组肝细胞排列紊乱,发生中度脂肪变性和肝细胞气球样变,NAS评分为4分,很可能为NASH;造模6月对照组小鼠肝细胞正常,肝索排列整齐,不少肝细胞发生脂肪变,NAS为3分;造模6月FFC组小鼠肝细胞排列非常紊乱,肝细胞脂肪变性程度逐渐加重,脂肪变性的肝细胞占2/3以上,见大量脂质空泡,NAS为6分,可诊断为NASH (形态学变化见图2,NAS评分见表2)。

Figure 2. Liver and abdominal fat appearance, histomorphological changes, and NASH related score in FFC diet-induced mouse model (scale 100 µm, magnification picture scale 25 µm). (a) Liver and abdominal fat appearance and HE staining of liver tissue in mice; (b) Liver fatty change score in mice; (c) NASH activity score in mice. All data are shown as mean +/− standard deviation, ***P < 0.001
图2. FFC饮食诱导的小鼠模型肝脏及腹部脂肪外观、组织形态学改变及NASH相关评分(标尺100 µm,放大图片标尺:25 µm)。(a) 小鼠肝脏及腹部脂肪外观及肝组织HE染色;(b) 小鼠肝脏脂肪变程度评分;(c) 小鼠NASH活动度评分。所有数据均展示平均数+/−标准差,***P < 0.001
3.3. 血清学及肝组织匀浆指标
FFC组肝组织TG含量显著高于对照组(P < 0.001),FFC组血清TC显著高于对照组(P < 0.001),FFC组血清ALT、AST显著高于对照组(P < 0.01) (图3)。
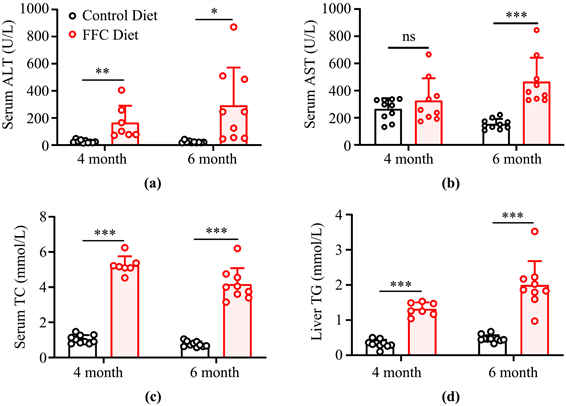
Figure 3. Serum biochemical indexes & liver triglyceride levels in FFC diet-induced mouse model. (a) serum alanine aminotransferase level; (b) serum aspartate aminotransferase level; (c) serum total cholesterol level; (d) liver triglyceride level. All data are shown as mean +/− standard deviation, ns: none significance, *: P < 0.05, ***: P < 0.001
图3. FFC饮食诱导的小鼠模型血清生化指标及肝脏甘油三脂水平。注:(a) 血清谷丙转氨酶水平;(b) 血清谷草转氨酶水平;(c) 血清总胆固醇水平;(d) 肝脏甘油三脂水平。所有数据均展示平均数+/−标准差,ns:无显著性,*:P < 0.05,***:P < 0.001
4. 讨论分析
饮食因素在NASH膳食动物模型中也起着至关重要的作用 [6]。近年来,膳食动物模型主要分为4种,分别是蛋氨酸和胆碱缺乏(methionine-choline deficient, MCD)饮食模型,高胆固醇和高胆酸盐(high-cholesterol and high-cholate, HChCh)模型,果糖及高碳水化合物模型和高脂饮食(high-fat diet, HFD)模型 [7]。
本实验利用多种饮食因素的协同作用,给小鼠饲养高脂高果糖高胆固醇饮食和对照组饮食,建立了程度更为严重的NASH小鼠模型。符合NASH的自然病程经过,提示高脂、高果糖与高胆固醇的协同作用会加快NASH的发生、发展,加重NASH程度 [8] [9] [10]。且造模时间较短,可为进一步研究NASH发病机制以及治疗方面的研究提供模型参考。然而对于NASH进一步发展为肝纤维化甚至肝癌的病理学特征,还有待于进一步充实和完善。
基金项目
广东省基础与应用基础研究基金(2022A1515012477),METTL14通过m6A甲基化修饰脂肪酸转位酶FAT调控脂肪肝形成的研究。
广东省医学科研基金(B2014238),小鼠诱导性多潜能干细胞(mIPScell)对肝损伤修复的研究。
1) 国家自然科学基金(82060425),miR-26a-5p靶向转录因子DCUN1D1调控个旧矿工肺癌进展的研究。
2) 云南省基础研究专项基金(202201AT070044),ZBTB48靶向MTP18促进线粒体分裂抑制肝癌细胞存活和干性的机制研究。
3) 云南省科技厅地方高校联合专项基金(202001BA070001-043),蛋白激酶MST4负向调控PI3K/AKT通路抑制肺癌迁移和侵袭的机制研究。
4) 云南省科技厅地方高校联合专项基金(202001BA070001-063),利用肝脏特异性敲除ZNF173的转基因小鼠解析转录因子ZNF173在肝癌发生中的作用。
文章引用
戴冠齐,林锦涛,李永龙,韩留鑫,赵文淘,夏加伟,李迎春,黄世豪,何丹华,丛金格,贾俊双,林晓琳,肖 东,申红芬. 非酒精性脂肪性肝炎小鼠模型的构建
Establishment of Non-Alcoholic Steatohepatitis Mouse Model[J]. 临床医学进展, 2022, 12(12): 12100-12107. https://doi.org/10.12677/ACM.2022.12121744
参考文献
- 1. Caussy, C., Reeder, S.B., Sirlin, C.B. and Loomba, R. (2018) Noninvasive, Quantitative Assessment of Liver Fat by MRI-PDFF as an Endpoint in NASH Trials. Hepatology, 68, 763-772. https://doi.org/10.1002/hep.29797
- 2. Younossi, Z.M., Koenig, A.B., Abdelatif, D., et al. (2016) Global Epidemi-ology of Nonalcoholic Fatty Liver Disease-Meta-Analytic Assessment of Prevalence, Incidence, and Outcomes. Hepa-tology, 64, 73-84. https://doi.org/10.1002/hep.28431
- 3. 蔡江帆, 陈民利. 非酒精性脂肪肝炎动物模型的研究概况[J]. 中国实验动物学报, 2021, 29(1): 128-136.
- 4. Santhekadur, P.K., Kumar, D.P. and Sanyal, A.J. (2018) Preclinical Models of Non-Alcoholic Fatty Liver Disease. Journal of Hepatology, 68, 230-237. https://doi.org/10.1016/j.jhep.2017.10.031
- 5. Tamaki, N., Munaganuru, N., Jung, J., Yonan, A.Q., Bettencourt, R., Ajmera, V., Valasek, M.A., Behling, C. and Loomba, R. (2021) Clinical Utility of Change in Nonalcoholic Fatty Liv-er Disease Activity Score and Change in Fibrosis in NAFLD. Clinical Gastroenterology and Hepatology, 19, 2673-2674.e3. https://doi.org/10.1016/j.cgh.2020.11.005
- 6. Tsuchida, T., Lee, Y.A., Fujiwara, N., et al. (2018) A Simple Diet- and Chemical-Induced Murine NASH Model with Rapid Progression of Steatohepatitis, Fibrosis and Liver Cancer. Journal of Hepatology, 69, 385-395. https://doi.org/10.1016/j.jhep.2018.03.011
- 7. 范建高. 非酒精性脂肪性肝病诊疗指南(2010年1月修订) [C]//广东省肝脏病学会. 第二届广东省脂肪肝专题研讨会论文汇编. 广东省肝脏病学会: 广东省科学技术协会科技交流部, 2010, 15(11): 6-16+5.
- 8. Ibrahim, S.H., Hirsova, P., Malhi, H., et al. (2016) Animal Models of Nonalcoholic Steatohepatitis: Eat, Delete, and Inflame. Digestive Diseases and Sciences, 61, 1325-1336. https://doi.org/10.1007/s10620-015-3977-1
- 9. Charlton, M., Krishnan, A., Viker, K., et al. (2011) Fast Food Di-et Mouse: Novel Small Animal Model of NASH with Ballooning, Progressive Fibrosis, and High Physiological Fidelity to the Human Condition. American Journal of Physiology-Gastrointestinal and Liver Physiology, 301, G825-G834. https://doi.org/10.1152/ajpgi.00145.2011
- 10. Wu, X., Poulsen, K.L., Sanz-Garcia, C., et al. (2020) MLKL-Dependent Signaling Regulates Autophagic Flux in a Murine Model of Non-Alcohol-Associated Fatty Liver and Steatohepatitis. Journal of Hepatology, 73, 616-627. https://doi.org/10.1016/j.jhep.2020.03.023
NOTES
*共同第一作者。
#通讯作者Email: shenhf12@126.com
