Advances in Clinical Medicine
Vol.
11
No.
06
(
2021
), Article ID:
43053
,
7
pages
10.12677/ACM.2021.116376
Wnt经典通路诱导间充质干细胞向肺上皮细胞分化对自噬的影响
高春雪,辛兆瑞,蔡施霞,李连弟*
青岛大学附属医院,山东 青岛

收稿日期:2021年5月7日;录用日期:2021年5月25日;发布日期:2021年6月10日

摘要
目的:证实细胞自噬参与Wnt经典通路诱导小鼠骨髓来源间充质干细胞(mice bone marrow derived mesenchymal stem cells, mMSCs)向肺泡上皮(type II alveolar epithelial, AT II)细胞的分化。方法:mMSCs与MLE-12结合小气道培养基(SAGM)共培养构建体外诱导MSC向肺上皮细胞分化的模型,通过LiCl或DKK-1分别激活或抑制经典Wnt通路,实验分组如下:a. MSC组:MSC单独培养、b. MSC + MLE组:MSC与MLE-12共培养、c. MSC + MLE + LiCl组:MSC与MLE-12共培养并给予4 mL LiCl激活经典Wnt通路、d. MSC + MLE + DKK-1组:MSC与MLE-12共培养并给予200 ng/mL DKK-1抑制Wnt经典通路。通过Western blot法检测诱导分化的第7天II型肺泡上皮细胞标志表面活性蛋白(surfactant protein, SP) C评估MSC向II型肺泡上皮细胞分化情况,并检测诱导分化第1、3、7天自噬相关蛋白(LC3B及Beclin-l)的表达。结果:与MSC单独培养及与MSC、MLE-12共培养相比较,共培养中加入LiCl时SP-C表达增加(p < 0.05);与MSC单独培养、与MLE-12共培养及与共培养中加入4 mL LiCl相比,加入DKK-1后SP-C表达下降(p < 0.05)。通过Western blot法检测诱导分化第1、3、7天自噬相关蛋白(LC3B及Beclin-l)的表达发现:与MSC单独培养相比较,共培养中加入LiCl时Beclin-l、LC3-II/I表达增加(p < 0.05);而加入DKK-1后与MSC、MLE-12共培养相比较,Beclin-l、LC3-II/I表达下降(p < 0.05)。结论:激活经典Wnt通路促进MSC向肺上皮细胞分化,激活经典Wnt通路增加MSC自噬水平。
关键词
间充质干细胞,自噬,分化
Effects of Wnt Classical Pathway on Autophagy Induced Differentiation of Mesenchymal Stem Cells into Lung Epithelial Cells
Chunxue Gao, Zhaorui Xin, Shixia Cai, Liandi Li*
The Affiliated Hospital of Qingdao University, Qingdao Shandong

Received: May 7th, 2021; accepted: May 25th, 2021; published: Jun. 10th, 2021

ABSTRACT
Objective: It was confirmed that autophagy is involved in the induction of mouse bone marrow-derived mesenchymal stem cells (MMSCs) into the alveolar epithelium (type II alveolar epithelial, AT II). Methods: MMSCs and MLE-12 combined with small airway medium (SAGM) were co-cultured to establish a model of in vitro induction of differentiation of MSCs into lung epithelial cells. The classical Wnt pathway was activated or inhibited by LiCl or DKK-1, respectively. The experimental groups were as follows: a. MSC group: MSC was cultured alone; b. MSC+MLE group: MSC was co-cultured with MLE-12; c. MSC + MLE + LiCl group: MSCs were co-cultured with MLE-12 and given 4 mL LiCl to activate the classical Wnt pathway; d. MSC + MLE + DKK-1 group: MSCs were co-cultured with MLE-12 and given 200 ng/mL DKK-1 to inhibit the Wnt classical pathway. Western blot was used to detect II type alveolar epithelial cell marker surfactant protein (SP) C on day 7 of induced differentiation to evaluate the differentiation of MSC to type II alveolar epithelial cells. The expressions of autophagy-related proteins (LC3B and Beclin-L) on the 1st, 3rd and 7th day of differentiation induction were detected. Results: Compared with MSC alone culture and co-culture with MSC and MLE-12, the expression of SP-C was increased when LICL was added in co-culture (p < 0.05). Compared with MSC alone culture, MLE-12 co-culture and co-culture with the addition of 4 mL LiCl, SP-C expression decreased after the addition of DKK-1 (p < 0.05). The expression of autophagy related proteins (LC3B and Beclin-L) at the 1st, 3rd and 7th day after induction of differentiation was detected by Western blot. Compared with MSC alone culture, the expressions of Beclin-L and LC3-II/I were increased when LiCl was added in co-culture (p < 0.05). The expression of Beclin-L and LC3-II/I decreased after DKK-1 co-culture compared with MSC and MLE-12 (p < 0.05). Conclusion: Activation of classical Wnt pathway promotes differentiation of MSCs into lung epithelial cells, and activation of classical Wnt pathway increases autophagy level of MSCs.
Keywords:Mesenchymal Stem Cells, Autophagy, Differentiation

Copyright © 2021 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
急性呼吸急迫综合征(acute respiratory distress syndrome, ARDS)是由非心源性肺水肿引起的急性呼吸衰竭综合征。与ARDS发展相关的最常见的临床疾病是细菌性和病毒性肺炎。急性呼吸窘迫综合征也常由非肺源性脓毒症、严重创伤和胃内容物误吸引起,较少由胰腺炎和药物反应引起 [1]。急性呼吸窘迫综合征的诊断标准随着时间的推移发生了变化:目前的定义为2012年的柏林定义(Berlin definition) [2],该定义包括三个主要标准,并改变了严重程度的分类。定义急性呼吸窘迫综合征的三个标准是:1) 在已知临床感染后1周内出现或出现新的或恶化的呼吸症状;2) 胸部X线或胸部CT不能完全解释为积液、肺叶/肺萎陷的双侧浑浊;3) 不能完全由心脏衰竭或液体超载解释的呼吸衰竭。尽管进行了几十年的研究,但目前还没有有效的ARDS药物疗法。虽然已经建立了一些支持性护理方法,但ARDS仍然具有破坏性和生命危险 [3] [4]。因此,ARDS的治疗仍然存在重重困难。
随着干细胞的作用被大家所认识,使间质干细胞(MSC)被认为是治疗ARDS的很有意义的干预措施。我们前期实验已经验证治疗性MSC注入ARDS小鼠模型中可以发现在损伤的肺组织聚集大量MSC并向肺上皮细胞分化,促进损伤肺细胞的修复 [5] [6]。新进许多研究发现自噬在MSC分化中发挥作用。MSCs中的自噬调节可能影响其向多种细胞谱系分化的能力,并影响免疫细胞的增殖、激活和功能。而间充质干细胞向肺上皮细胞转化过程中自噬是否起参与,仍不清楚。因此本实验研究外源性MSC向肺泡上皮细胞分化过程中是否对自噬产生影响。运用MSC和肺上皮细胞共培养模型,通过观察调控Wnt经典通路对细胞自噬的影响,明确Wnt经典通路调控MSC向肺泡上皮定向分化过程自噬是否参与。
2. 材料与研究方法
2.1. 实验细胞
小鼠肺上皮细胞(murine lung epithelial, MLE-12细胞),购自拜力细胞库。
小鼠间充质干细胞(mMSCs),来源于C57BL/6小鼠骨髓,购于Cyagen Biosciences, Inc. (Guangzhou, China)。
2.2. 实验分组
a) MSC组:MSC单独培养;
b) MSC + MLE组:MSC + MLE-12;
c) MSC + MLE + LiCl组:MSC + MLE-12 + 浓度4 mmol/L的LiCl激活经典Wnt通路;
d) MSC + MLE + DKK-1组:MSC + MLE-12 + 浓度20 ng/mL的DKK-1抑制经典Wnt通路。
2.3. 研究方法
MSC与肺上皮细胞结合小气道培养基(SAGM)共培养构建体外诱导MSC向肺泡上皮细胞分化的模型,通过LiCl激活或DKK-1阻断Wnt经典通路,观察MSC向肺泡上皮细胞分化过程中调控经典Wnt通路对MSC的自噬活性的影响。
2.3.1. 检测细胞自噬活性
培养后第1、3、7天,运用western blot检测MSC自噬标记蛋白LC3-I、LC3-II及Beclin-l表达。
2.3.2. 评估MSC向肺细胞的分化情况
培养后第7天运用western blot检测共培养体系模型下室中诱导分化后MSC的II型肺泡上皮细胞特征蛋白SP-C的蛋白表达情况。
2.4. 统计学分析
应用SPSS软件进行数据分析,数据以 表示,p < 0.05为差异有统计学意义。
3. 实验结果
3.1. 细胞复苏
按步骤复苏MSC与MLE-12并逐步传代,可分别观察发现镜下为梭形或三角形的MSC细胞,以及镜下形状为铺路石样形态的MLE-12 (见图1(A)、图1(B))。
 A. mMSCs在光镜(×100)下形态;B. MLE-12在光镜(×100)下形态。
A. mMSCs在光镜(×100)下形态;B. MLE-12在光镜(×100)下形态。
Figure 1. Morphology of mMSCs and MLE-12 under light microscope
图1. mMSCs、MLE-12光镜下形态
3.2. MSC向MLE-12分化
在肺上皮细胞结合小气道培养基(SAGM)与MSC共培养细胞模型基础上,通过LiCl激活或DKK1阻断Wnt经典通路,观察实验分组中第1、3、7天中MSC向肺泡上皮细胞的分化。首先随着共培养时间的增加,各个实验组均发现,后期共培养模型中发现梭型或三角形的成纤维细胞样变为铺路石样的类上皮细胞样结构。同时组间比较第7天镜下细胞形状,可发现LiCl激活Wnt经典通路的实验组中,镜下铺路石样细胞形态占比偏多。而使用DKK1阻断Wnt经典通路的实验组中,镜下仍然可见梭形细胞形态,铺路石样上皮细胞少见(见图2(A)~(D))。
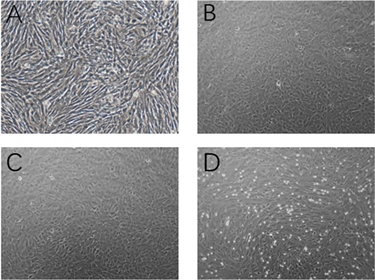 A. 空白组mMSCs在单独培养7天后光镜(×100)下形态;B. MLE-12细胞共培养结合SAGM诱导mMSCs分化7天后光镜(×100)下形态;C. MSC + MLE-12 + 浓度4 mmol/L的LiCl共培养7天后光镜(×100)下形态;D. MSC + MLE-12 + 浓度20 ng/mL的DKK-1共培养7天后光镜(×100)下形态。
A. 空白组mMSCs在单独培养7天后光镜(×100)下形态;B. MLE-12细胞共培养结合SAGM诱导mMSCs分化7天后光镜(×100)下形态;C. MSC + MLE-12 + 浓度4 mmol/L的LiCl共培养7天后光镜(×100)下形态;D. MSC + MLE-12 + 浓度20 ng/mL的DKK-1共培养7天后光镜(×100)下形态。
Figure 2. Morphological changes of MMSCs after differentiation into AT II cells
图2. mMSCs向AT II细胞分化后的形态学变化
3.3. Wnt通路的调节mMSCs向肺上皮细胞分化
本研究分别将4 mmol/L的LiCl,200 ng/mL DKK-1加入肺上皮细胞结合小气道培养基(SAGM)与MSC共培养细胞培养基中培养7天,Western blot法检测SP-C,MSC与MLE共培养较MSC单独培养的SP-C表达增加(p < 0.05);与MSC单独培养及与MSC、MLE-12共培养相比较,共培养中加入LiCl时SP-C表达增加(p < 0.05);与MSC单独培养,与MLE-12共培养及与共培养中加入4 mL LiCl相比,加入DKK-1后SP-C表达下降(p < 0.05)。结果表明,LiCl激活经典Wnt通路促进mMSC向肺上皮细胞分化,抑制Wnt通路减少MSC向肺上皮细胞分化(见图3)。
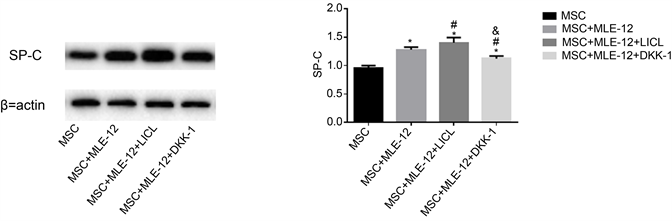 Western blot法检测MLE-12细胞结合SAGM诱导mMSCs向AT II细胞分化不同时间mMSCs中pro-SPC蛋白的表达。(n = 3; *p < 0.05 VS MSC; #p < 0.05 VS MSC + MLE-12; &p < 0.05 VS MSC + MLE-12 + LICL)。
Western blot法检测MLE-12细胞结合SAGM诱导mMSCs向AT II细胞分化不同时间mMSCs中pro-SPC蛋白的表达。(n = 3; *p < 0.05 VS MSC; #p < 0.05 VS MSC + MLE-12; &p < 0.05 VS MSC + MLE-12 + LICL)。
Figure 3. The effect of classical Wnt pathway on the differentiation of MMSCs into AT II cells
图3. 经典Wnt途径对mMSCs向AT II细胞分化的影响
3.4. 自噬的活性改变
在共培养结合SAGM诱导MSC向AT II细胞分化的过程中,加入4 mmol/L的LiCl激活MSC的经典Wnt通路,以及加入200 ng/mL DKK-1抑制Wnt通路。通过Western blot法检测诱导分化第1、3、7天自噬相关蛋白(LC3B及Beclin-l)的表达发现:与MSC单独培养相比较,共培养中加入LiCl时Beclin-l、LC3-II/I表达增加p < 0.05);与MSC、MLE-12共培养相比较,共培养中加入LiCl时Beclin-l、LC3-II/I表达仍然增加p < 0.05),而加入DKK-1后与MSC、MLE-12共培养相比较,加入DKK-1后Beclin-l、LC3-II/I表达下降(p < 0.05);与加入LiCl比较Beclin-l、LC3-II/I表达下降(p < 0.05)。结果表明LiCl活化经典Wnt途径后,细胞自噬相关蛋白表达增加,而DKK-1抑制Wnt途径时自噬相关蛋白表达下降(见图4)。
 Western blot法测定共培养结合SAGM诱导MSC向AT II细胞分化1、3、7 d时MSC的自噬标记蛋白LC3-I、LC3-II及Beclin-1的表达量。(n = 3; *p < 0.05 VS MSC; #p < 0.05 VS MSC + MLE-12; &p < 0.05 VS MSC + MLE-12 + LICL)。
Western blot法测定共培养结合SAGM诱导MSC向AT II细胞分化1、3、7 d时MSC的自噬标记蛋白LC3-I、LC3-II及Beclin-1的表达量。(n = 3; *p < 0.05 VS MSC; #p < 0.05 VS MSC + MLE-12; &p < 0.05 VS MSC + MLE-12 + LICL)。
Figure 4. The effect of Wnt classical pathway on autophagy by regulating MSCs differentiation to AT II cells
图4. Wnt经典通路调节MSC向AT II细胞分化对细胞自噬的影响
4. 结论
1) 激活经典Wnt通路促进MSC向肺上皮细胞分化。
2) 激活经典Wnt通路增加MSC自噬水平。
5. 讨论
急性呼吸窘迫综合征病死率仍然居高不下,研究如何治疗ARDS成为重中之重。肺泡上皮细胞和肺毛细血管内皮细胞弥漫性损伤 [7] 特别是肺泡上皮细胞的损伤,导致肺泡屏障破坏和肺泡结构毁损,是ARDS的主要病理改变。于是研究如何改善损伤的肺泡上皮细胞可以成为治疗ARDS的切入点。间质干细胞(MSC)治疗被认为是治疗ARDS的有希望的干预措施,近年来许多研究证实给予外源性的MSC可以归巢到损伤肺组织,并分化为肺泡上皮细胞,从而促进损伤肺细胞的修复,缓解肺损伤的病理改变,提高ARDS动物的生存率 [8]
而目前Wnt通路是被大家研究最为广泛的信号调节通路,关于Wnt通路是否可以参与调节MSC向AT II细胞,现在众多体内外实验结果均表明该通路可以参加细胞分化,同时激活通路是实验发现细胞分化明显增加 [9] [10]。本实验在共培养结合SAGM诱导MSC分化的基础上,外源性干预经典Wnt通路,观察经典Wnt通路对MSC向AT II细胞分化的调节作用。根据实验结果发现Wnt通路可调节MSC向MLE-12分化,在加入LICL活化经典Wnt通路后AT-II细胞的特征蛋白SP-C表达上调,表明分化在一定程度上增加。加入DKK1后,发现其表达减少。表明激活经典Wnt通路可以促进外源性小鼠骨髓来源间充质干细胞向II型肺泡上皮细胞转化。
然而MSC在ARDS的外源性治疗与大家的理想假设存在差距,具有一定局限型,经研究发现其原因主要是在ARDS动物模型中,发现外源性治疗注射MSC后无法在损伤的肺组织内部长时间停留并分化为相应细胞来改善受损伤的肺,促进恢复。当外源性治疗性干细胞注入目标组织后,将会面临一个充满敌意的环境,包括缺氧、缺乏营养和基质支持,细胞也可能成为免疫系统的目标并被排斥。因此,干细胞的应激反应机制可能在注射细胞的存活中发挥重要作用,并可能有助于其治疗效果 [10]。自噬将多种底物(如细胞质成分、受损细胞器、蛋白聚集物或吞噬在双膜囊泡(自噬体)中的感染性颗粒)传递给溶酶体进行降解。其在细胞内平衡中起着多效性的作用,其中最重要的作用是使细胞在营养缺乏时存活 [11]。多种干细胞如造血干细胞、骨髓间充质干细胞和神经干细胞均存在自噬现象,自噬与细胞的自我更新、定向分化和衰老密切相关 [11] [12]。MSC早期骨质生成和脂肪生成中涉及自噬通量 [13]。因此自噬很大可能参与间充质干细胞向肺上皮细胞的分化。本实验通过测量LC3-I和LC3-II之间的比率来评估自噬。
本实验在MSC、MLE-12结合SAGM共培养构建体外诱导MSC向肺上皮细胞分化的模型基础上,通过实验分组激活或抑制经典Wnt通路,明确经典Wnt通路调节MSC向肺上皮细胞分化过程中对自噬活性的影响。结果验证加入LICL活化经典Wnt通路后,细胞向肺上皮细胞分化增加,同时自噬蛋白的表达同样上调,说明在调控Wnt通路时自噬活性随之发生变化。我们有理由推测MSC向肺上皮细胞转化过程中自噬发挥一定作用。这对于进一步寻找促进MSC的肺泡上皮分化的有效途径,突破目前MSC治疗ARDS的困境,并对ARDS患者预后的改善具有重大意义。
文章引用
高春雪,辛兆瑞,蔡施霞,李连弟. Wnt经典通路诱导间充质干细胞向肺上皮细胞分化对自噬的影响
Effects of Wnt Classical Pathway on Autophagy Induced Differentiation of Mesenchymal Stem Cells into Lung Epithelial Cells[J]. 临床医学进展, 2021, 11(06): 2603-2609. https://doi.org/10.12677/ACM.2021.116376
参考文献
- 1. Ware, L.B. and Matthay, M.A. (2000) The Acute Respiratory Distress Syndrome. New England Journal of Medicine, 342, 1334-1349. https://doi.org/10.1056/NEJM200005043421806
- 2. Ranieri, V.M., Rubenfeld, G.D., Taylor Thompson, B., et al. (2012) Acute Respiratory Distress Syndrome: The Berlin Definition. JAMA, 307, 2526-2533. https://doi.org/10.1001/jama.2012.5669
- 3. Papazian, L., Aubron, C., Brochard, L., et al. (2019) Formal Guidelines: Management of Acute Respiratory Distress Syndrome. Annals of Intensive Care, 9, 69. https://doi.org/10.1186/s13613-019-0540-9
- 4. Bellani, G., et al. (2016) Epidemiology, Patterns of Care, and Mortality for Patients With Acute Respiratory Distress Syndrome in Intensive Care Units in 50 Countries. JAMA, 315, 788-800. https://doi.org/10.1001/jama.2016.0291
- 5. Weiss, D.J., Bertoncello, I., Borok, Z., et al. (2011) Stem Cells and Cell Therapies in Lung Biology and Lung Diseases. Proceedings of the. American Thoracic Society, 8, 223-272. https://doi.org/10.1513/pats.201012-071DW
- 6. Gupta, N., Su, X., Popov, B., et al. (2007) Intrapulmonary Delivery of Bone Marrow-Derived Mesenchymal Stem Cells Improves Survival and Attenuates Endotoxin-Induced Acute Lung Injury in Mice. Journal of Immunology, 179, 1855-1863. https://doi.org/10.4049/jimmunol.179.3.1855
- 7. Wirawan, E., Berghe, T.V., Lippens, S., et al. (2012) Autophagy: For Better or for Worse. Cell Research, 22, 43-61. https://doi.org/10.1038/cr.2011.152
- 8. Peters, A.E., Mihalas, B.P., Bromfield, E.G., et al. (2020) Autophagy in Female Fertility: A Role in Oxidative Stress and Aging. Antioxidants & Redox Signaling, 32, 550-568. https://doi.org/10.1089/ars.2019.7986
- 9. Liu, A.R., Liu, L., Chen, S., et al. (2013) Activation of Canonical Wnt Pathway Promotes Differentiation of Mouse Bone Marrow-Derived MSCs into Type II Alveolar Epithelial Cells, Confers Resistance to Oxidative Stress, and Promotes Their Migration to Injured Lung Tissue In Vitro. Journal of Cellular Physiology, 228, 1270-1283. https://doi.org/10.1002/jcp.24282
- 10. Cai, S.X., Liu, A., Chen, S., et al. (2015) Activation of Wnt/β-Catenin Signalling Promotes Mesenchymal Stem Cells to Repair Injured Alveolar Epithelium Induced by Lipopolysaccharide in Mice. Stem Cell Research & Therapy, 6, 65. https://doi.org/10.1186/s13287-015-0060-y
- 11. Denham, M., Cole, T.J. and Mollard, R. (2006) Embryonic Stem Cells Form Glandular Structures and Express Surfactant Protein C Following Culture with Dissociated Fetal Respiratory Tissue. American Journal of Physiology—Lung Cellular and Molecular Physiology, 290, L1210-L1215. https://doi.org/10.1152/ajplung.00427.2005
- 12. Van Vranken, B.E., Romanska, H.M., Polak, J.M., et al. (2005) Coculture of Embryonic Stem Cells with Pulmonary Mesenchyme: A Microenvironment That Promotes Differentiation of Pulmonary Epithelium. Tissue Engineering, 11, 1177-1187. https://doi.org/10.1089/ten.2005.11.1177
- 13. Beljanski, V., Grinnemo, K.H. and Österholm, C. (2019) Pleiotropic Roles of Autophagy in Stem Cell-Based Therapies. Cytotherapy, 21, 380-392. https://doi.org/10.1016/j.jcyt.2019.02.007
NOTES
*通讯作者。