Advances in Environmental Protection
Vol.07 No.02(2017), Article ID:20359,6
pages
10.12677/AEP.2017.72024
Progress in Magnetic Separation of Microalgae
Chunlei Liu1, Fangchao Zhao1, Xuefei Zhou1, Yalei Zhang1, Yiming Su1,2*
1State Key Laboratory of Pollution Control and Resource Reuse, School of Environmental Science and Engineering, Tongji University, Shanghai
2Postdoctoral Research Station, School of Civil Engineering, Tongji University, Shanghai

Received: Apr. 12th, 2017; accepted: Apr. 27th, 2017; published: Apr. 30th, 2017

ABSTRACT
Microalgae is an ideal renewable energy source that can partially replace fossil fuels. However, the difficulties and high cost of microalgae harvesting which caused by small cell and low concentration are the main constrains of microalgae utilization and further application. Hence, cost-effec- tive separation of microalgae from water body becomes the key issue to microalgae utilization. This paper analyzed the difficulties and research trends of traditional microalgae separation technology, discussed the current problems of microalgae magnetic separation technology, and further provided a theoretical basis for microalgae water treatment, resource recovery and its other application.
Keywords:Microalgae, Magnetic Separation, Magnetic Nano-Iron Oxide, Material Modification
微藻磁分离进展研究
刘春蕾1,赵方超1,周雪飞1,张亚雷1,苏益明1,2*
1同济大学环境科学与工程学院污染控制与资源化国家重点实验室,上海
2同济大学土木工程学院博士后流动站,上海

收稿日期:2017年4月12日;录用日期:2017年4月27日;发布日期:2017年4月30日

摘 要
微藻能源是理想的可再生能源,能部分替代化石能源。然而其开发利用受微藻细胞小、浓度低导致的采收困难、采收成本高的限制。低成本、高效率地将微藻与水体有效分离是保障微藻推广利用的关键。本文分析了传统微藻分离技术存在的难点及研究趋势,讨论了国内外微藻磁分离技术研究现状及存在问题。为微藻水处理、资源回收等领域的进一步应用提供一定的基础理论研究保障。
关键词 :微藻,磁分离,磁性纳米氧化铁,材料改性

Copyright © 2017 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
能源与环境是21世纪人类社会的两大主题。近年来,传统能源的过度消耗引发了一系列的能源危机和环境污染问题,因此可持续洁净能源的开发已成为各国研究的热点。微藻具有含油量高、生长周期短、环境适应能力强、生物产量高等优点,有望成为一种极具潜力的生物柴油生产原料 [1] [2] [3] [4] 。目前国内外藻类资源化的研究热点集中在藻类制生物柴油提取、厌氧发酵产能、燃料电池应用、煤浆制取和水热催化转化等。其中水热技术是一种极具潜力的可将生物质转化为高附加值化学品和能源的环境友好技术,其最显著的优点是反应前无需脱水,节省微藻脱水所需能量,目前研究主要集中于以乙酸作为目标产物的催化转化。
2. 微藻分离技术的难点及研究趋势
微藻能源技术是继纤维素产乙醇后第三代新能源技术,对于缓解目前全球能源危机和气候变暖问题有着重要意义。微藻能源技术仍存在诸多问题,尤其在成本上远不及传统燃料。研究表明,微藻回收成本不仅花费高(占微藻产油总成本的20%~30%),且回收过程还会影响后续的微藻利用 [5] 。因此创新回收技术,建立经济可行的可持续回收系统对微藻推广应用至关重要。
微藻个体微小,一般只有1~30 μm;微藻细胞表面带负电,在培养液中容易形成均匀稳定的分散悬浮体系;微藻培养浓度低,一般只有0.5~3.0 g/L。这些特点造成了传统分离技术难以实现高效分离 [6] 。在这些传统方法中,1) 离心分离法:操作简单,易于机械化控制,但设备投资高,能耗大,机械强度大。对于某些丝状或不具细胞壁的微藻,离心过程中的机械振动作用将使藻细胞断裂或破碎,既影响其生理活性、释放出的细胞内容物又容易污染培养液,降低其循环使用价值 [7] ;2) 絮凝沉淀法:操作简单,但是因为藻细胞与培养液密度差异小,所需絮片体积较大,絮凝、沉淀所需时间都较长。同时因为絮凝剂和藻细胞完全粘附,必须在后续工艺加以去除,这增大了操作难度、加大了生产成本 [5] ;3) 气浮分离法:具设备及工艺流程比较简单、操作条件温和、对细胞损伤小、处理迅速、分离效率较高等诸多优点。但在常规分离回收微藻过程中仍需要投加一定的絮凝剂才可以实现气浮分离,造成后续藻和絮凝剂分离困难 [8] [9] ;4) 膜过滤法:可以回收粒径很微小的藻,出水洁净,能耗较低,但膜成本较高,且易污染,需频繁清洗 [10] [11] 。由于传统技术的种种局限,以及近年来磁性纳米材料合成技术大规模推广应用,部分学者开始关注磁性纳米材料,尤其是纳米铁基材料诱导的藻类磁分离技术 [12] [13] [14] 。据斯托克斯公式计算可知,一定粒径和密度的微藻细胞下沉15 mm理论上至少需要1.5 h。而当磁性颗粒与微藻结合后,在磁场存在条件下,5 min即可完成分离过程 [15] 。且经实验室测算,每立方米的分离成本在1.0~3.5元,比目前最经济的过滤或气浮技术(0.9~15元)更有优势 [16] 。因此,磁分离技术在微藻分离领域具备非常好的应用前景。
3. 微藻磁分离技术国内外研究现状及存在问题
磁分离作为微藻采收的新兴技术,使磁性粒子与微藻细胞聚合,在外部磁场的作用下将其分离。微藻磁分离具备快速、简便、高效节能、价格低廉等优点,已成功的用于湖泊藻类去除。近年来,一些功能化磁性粒子用于鱼塘、淡水及海洋藻类去除,均取得了快速有效的分离成果。
Wang [17] 等用铁氧化物和0.1 mg/mL的聚丙烯酰胺合成磁性絮凝剂,研究了布朗葡萄藻(B. braunii)和小球藻(C. ellipsoidea)的磁分离效率和机理。研究发现,一定剂量磁性絮凝剂条件下,两种藻类均可在10分钟内达到95%的絮凝效率。推测主要絮凝机理为:酸性条件下微藻细胞和磁性粒子在静电相互作用下桥接。
纳米铁基材料具有优异的磁学特性,常温下纳米零价铁、四氧化三铁、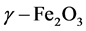 的饱和磁化强度可达到达80 A-m2/kg以上 [18] 。其中零价铁和四氧化三铁由于其易改性修饰、具备氧化还原功能等特性而被广为应用,因此,铁基纳米材料是理想的磁分离诱导材料。目前,纳米铁氧化物的合成方法包括气相沉积法、激光热解法、高压水热法、液相沉淀法、水-油两相合成法、金属醇盐的水解缩聚法等。其中液相沉淀法和水-油两相合成法最受关注,通过改变合成方法可获得不同形态的、不同粒径的、不同表面特性的纳米铁基材料 [19] 。Alexey Shavel等人发现通过改变热解温度能形成不同形态的零价铁核-四氧化三铁壳纳米颗粒,包括四方形、菱形、六边形、球状、棒状等(见图1) [20] ;通过改变稳定剂的浓度能合成粒径不同的四氧化三铁纳米颗粒;将不同改性剂(无机或有机)负载到纳米颗粒上则能获得独特的表面特性。因此,磁性铁基材料在微藻磁分离中的应用空间非常大。
的饱和磁化强度可达到达80 A-m2/kg以上 [18] 。其中零价铁和四氧化三铁由于其易改性修饰、具备氧化还原功能等特性而被广为应用,因此,铁基纳米材料是理想的磁分离诱导材料。目前,纳米铁氧化物的合成方法包括气相沉积法、激光热解法、高压水热法、液相沉淀法、水-油两相合成法、金属醇盐的水解缩聚法等。其中液相沉淀法和水-油两相合成法最受关注,通过改变合成方法可获得不同形态的、不同粒径的、不同表面特性的纳米铁基材料 [19] 。Alexey Shavel等人发现通过改变热解温度能形成不同形态的零价铁核-四氧化三铁壳纳米颗粒,包括四方形、菱形、六边形、球状、棒状等(见图1) [20] ;通过改变稳定剂的浓度能合成粒径不同的四氧化三铁纳米颗粒;将不同改性剂(无机或有机)负载到纳米颗粒上则能获得独特的表面特性。因此,磁性铁基材料在微藻磁分离中的应用空间非常大。
形态各异的纳米颗粒与微藻细胞间作用力不尽相同,其引起的分离效果也不同,两者间作用可由DLVO (Derjaguin-Landau-Verwey-Overbeek)或E-DLVO (Extended-DLVO)理论计算而得 [21] 。以球形颗粒为例,由于纳米颗粒粒径处于纳米级别,而微藻细胞直径位于微米级别,颗粒与微藻细胞间的作用可认为是带电微粒与平板间的相互作用。当两者相互靠近时,范德华力和双电层互相重叠产生电场斥力是主要作用力,其中电势能( )和范德华力引起的吸引势能(
)和范德华力引起的吸引势能(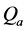 )可分别通过方程式(1) (2)计算获得,两者之和即为总作用势能:
)可分别通过方程式(1) (2)计算获得,两者之和即为总作用势能:
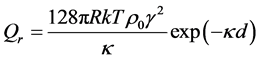 (1)
(1)
 (2)
(2)

Figure 1. Different forms of magnetic nano-iron oxide
图1. 不同形态的磁性纳米铁氧化物
其中,d:两者间距离;R:球形颗粒直径; 为Debye-Hückel理论中的德拜长度,表示胶体表面上离子氛尺寸的特征长度和表面电势衰减的程度;
为Debye-Hückel理论中的德拜长度,表示胶体表面上离子氛尺寸的特征长度和表面电势衰减的程度;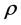 :溶液中远离界面处的离子密度;
:溶液中远离界面处的离子密度; :约化表面势(与离子价数、表面电势等相关);A:Hamaker 常数。当存在磁场时,磁性颗粒受磁力作用而产生定向运动,磁能(
:约化表面势(与离子价数、表面电势等相关);A:Hamaker 常数。当存在磁场时,磁性颗粒受磁力作用而产生定向运动,磁能(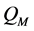 )与磁场强度、颗粒形状及直径大小、颗粒间距大小与直径间比例等因素相关 [22] 。已有研究表明,将纳米颗粒粒径从9 nm增加到53 nm,藻类的分离效率能从60%增加到85% [16] ;采用聚烯丙基氯化铵 [23] 、聚二甲基二烯丙基氯化铵 [24] 、或二氧化硅 [15] 负载的磁性铁氧化物,能有效将Chlorella sp.从溶液中去除(去除率 > 95%)。表面负载有机物后,纳米颗粒与藻细胞之间还将存在空间位能(
)与磁场强度、颗粒形状及直径大小、颗粒间距大小与直径间比例等因素相关 [22] 。已有研究表明,将纳米颗粒粒径从9 nm增加到53 nm,藻类的分离效率能从60%增加到85% [16] ;采用聚烯丙基氯化铵 [23] 、聚二甲基二烯丙基氯化铵 [24] 、或二氧化硅 [15] 负载的磁性铁氧化物,能有效将Chlorella sp.从溶液中去除(去除率 > 95%)。表面负载有机物后,纳米颗粒与藻细胞之间还将存在空间位能(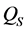 ),其表现形式包含吸附架桥作用和体积排斥作用 [22] 。根据EDLVO理论,吸附能(范德华力引起)、电势能、磁能、空间位能皆可定量表征,当颗粒粒径、颗粒形状、颗粒表面电性(不同有机物表面修饰)等性质发生改变时,纳米颗粒与藻细胞间的结合能也将随之发生改变,进而影响磁分离效率,但目前并未见关于这方面的系统研究。
),其表现形式包含吸附架桥作用和体积排斥作用 [22] 。根据EDLVO理论,吸附能(范德华力引起)、电势能、磁能、空间位能皆可定量表征,当颗粒粒径、颗粒形状、颗粒表面电性(不同有机物表面修饰)等性质发生改变时,纳米颗粒与藻细胞间的结合能也将随之发生改变,进而影响磁分离效率,但目前并未见关于这方面的系统研究。
由于胞外多聚物位于藻细胞最外层,因此胞外多聚物对藻细胞与纳米颗粒间的相互作用存在较大影响,进而对磁分离以及藻细胞和纳米颗粒的再分离产生影响。已有研究表明,藻细胞的胞外聚合物会影响纳米颗粒的团聚、沉降、溶解等过程:Adeleye和Keller的研究表明 [25] ,藻类产生的胞外聚合物能增强碳纳米管在水体中的分散性,使之不易团聚,贴壁率(Attachment efficiencies, α)明显下降;添加0.1 mg-C/L的胞外聚合物,碳纳米管表面荷电数显著增加,其临界凝聚浓度(critical coagulation concentration, CCC)由原来的15 mM上升至54 mM NaCl;但是,对于金属纳米颗粒,藻类产生的胞外聚合物却增强了颗粒在pH 7~9间的溶解性,当离子强度为10 mM NaCl时,5 mg-C/L的胞外多聚物使得纳米氧化铜颗粒的溶解率从0.93%上升至2.01% [26] ;进一步研究表面,多聚物中的蛋白质类有机物对于纳米赤铁矿的团聚行为存在明显影响(α和CCC值发生明显改变),且不同类别的蛋白质在不同pH、温度、离子强度等条件下所起的作用不尽相同 [27] 。胞外聚合物对纳米颗粒的表面电性、团聚沉淀等特性影响显著,进而改变纳米颗粒与藻细胞间吸附能、静电能、空间位能等,势必对磁分离和之后的再分离过程产生不可忽略的影响。虽然胞外聚合物对纳米颗粒的环境行为影响已获得广泛关注,但胞外聚合物对磁分离过程以及藻细胞与纳米颗粒的再分离过程的影响却未受到应有的关注。
对于微藻磁分离技术,磁性材料成本占总成本的33% [16] ,提高材料的重复利用率是降低成本的重要环节,而其中藻细胞和纳米颗粒的再分离是提高利用率的关键。纳米颗粒与微藻细胞间的结合力可分为物理和化学两种,为实现藻细胞与纳米颗粒的再分离,消除两者间的物理作用力可采用超声法,而打断两者间化学作用力(通常存在于经有机物表面修饰的纳米颗粒与藻细胞间)则可采用紫外光照法。由于不同环境(例如混合物pH、温度)条件下,物理及化学作用力都将发生明显变化,因此,探索超声法和紫外光照法的最佳运行条件是解决纳米颗粒与藻细胞再分离的重要步骤。
4. 结论与研究意义
目前,微藻被大量用于水处理、产油、产功能营养物质等方面,如何在低成本条件下实现微藻的高效分离是保障微藻实际利用的关键步骤。磁分离是一种绿色的环境友好技术,不仅分离效率高,且能耗低、经济实用。然而藻类磁分离技术研究仍处于初期阶段,除磁分离过程影响因素尚待系统研究外,磁性材料重复利用的研究工作也亟待跟进。因此可将上述问题作为今后研究的主流方向,推进藻类在水处理、资源能源回收等领域的应用。
致谢
感谢中国博士后科学基金(NO. 2016M591712)的资助。
基金项目
中国博士后科学基金第59批资助。
文章引用
刘春蕾,赵方超,周雪飞,张亚雷,苏益明. 微藻磁分离进展研究
Progress in Magnetic Separation of Microalgae[J]. 环境保护前沿, 2017, 07(02): 164-169. http://dx.doi.org/10.12677/AEP.2017.72024
参考文献 (References)
- 1. Chisti, Y. (2007) Biodiesel from Microalgae. Biotechnology Advances, 25, 294-306.
- 2. Greenwell, H.C., et al. (2010) Placing Microalgae on the Biofuels Priority List: A Review of the Technological Challenges. Journal of the Royal Society Interface, 7, 703-726. https://doi.org/10.1098/rsif.2009.0322
- 3. Christenson, L. and R. Sims (2011) Production and Harvesting of Microalgae for Wastewater Treatment, Biofuels, and Bioproducts. Biotechnology Advances, 29, 686-702.
- 4. Weschler, M.K., et al. (2014) Process Energy Comparison for the Production and Harvesting of Algal Biomass as a Biofuel Feedstock. Bioresource Technology, 153, 108-115.
- 5. Milledge, J.J. and S. Heaven (2012) A Review of the Harvesting of Micro-Algae for Biofuel Production. Reviews in Environmental Science and Bio/Technology, 12, 165-178. https://doi.org/10.1007/s11157-012-9301-z
- 6. Uduman, N., et al. (2010) Dewatering of Microalgal Cultures: A Major Bottleneck to Algae-Based Fuels. Journal of Renewable & Sustainable Energy, 2, 389-392. https://doi.org/10.1063/1.3294480
- 7. Heasman, M.P., et al. (2002) Development of Extended Shelf-Life Microalgae Concentrate Diets Harvested by Centrifugation for Bivalve Molluscs—A Summary. Aquaculture Research, 31, 637-659.
- 8. Coward, T., J.G.M. Lee, and G.S. Caldwell (2014) Harvesting Microalgae by CTAB-Aided Foam Flotation Increases Lipid Recovery and Improves Fatty Acid Methyl Ester Characteristics. Biomass & Bioenergy, 67, 354-362.
- 9. Yap, R.K.L., et al. (2014) Hydrophobically-Associating Cationic Polymers as Micro-Bubble Surface Modifiers in Dissolved Air Flotation for Cyanobacteria Cell Separation. Water Research, 61, 253-262.
- 10. Zhang, X., et al. (2010) Harvesting Algal Biomass for Biofuels Using Ultrafiltration Membranes. Bioresource Technology, 101, 5297-5304.
- 11. Danquah, M.K., et al. (2009) Dewatering of Microalgal Culture for Biodiesel Production: Exploring Polymer Flocculation and Tangential Flow Filtration. Journal of Chemical Technology & Biotechnology, 84, 1078-1083. https://doi.org/10.1002/jctb.2137
- 12. 胡一茹. 微藻细胞的磁性絮凝与规模化采收[D]: [硕士学位论文]. 北京: 中国科学院大学, 2014.
- 13. 陈继伟. 疏水吸附与磁絮凝分离盐藻过程及作用机制[D]: [硕士学位论文]. 广州: 华南理工大学, 2006.
- 14. 邹婧伟. 顺磁性核壳纳米催化剂的制备及微藻油转酯化研究[D]: [硕士学位论文]. 青岛: 中国石油大学, 2013.
- 15. Cerff, M., et al. (2012) Harvesting Fresh Water and Marine Algae by Magnetic Separation: Screening of Separation Parameters and High Gradient Magnetic Filtration. Bioresource Technology, 118, 289-295.
- 16. Wang S K, Wang F, Hu Y R, et al. (2013) Magnetic Flocculant for High Efficiency Harvesting of Microalgal Cells. ACS Applied Materials & Interfaces, 6, 109-115. https://doi.org/10.1021/am404764n
- 17. Ge, S., et al. (2015) Heteroaggregation between PEI-Coated Magnetic Nanoparticles and Algae: Effect of Particle Size on Algal Harvesting Efficiency. ACS Applied Materials & Interfaces, 7, 6102-6108. https://doi.org/10.1021/acsami.5b00572
- 18. de Montferrand, C., et al. (2013) Iron Oxide Nanoparticles with Sizes, Shapes and Compositions Resulting in Different Magnetization Signatures as Potential Labels for Multiparametric Detection. Acta Biomaterialia, 9, 6150-6157.
- 19. Gao, G., et al. (2010) Shape-Controlled Synthesis and Magnetic Properties of Monodisperse Fe3O4 Nanocubes. Crystal Growth & Design, 10, 2888-2894. https://doi.org/10.1021/cg900920q
- 20. Shavel, A., et al. (2007) Synthesis and Characterization of Iron/Iron Oxide Core/Shell Nanocubes. Advanced Functional Materials, 17, 3870-3876. https://doi.org/10.1002/adfm.200700494
- 21. 敖卓. 胶体间相互作用的研究[D]: [博士学位论文]. 合肥: 中国科学技术大学, 2011.
- 22. Ge, S., et al. (2015) Influences of Surface Coating, UV Irradiation and Magnetic Field on the Algae Removal Using Magnetite Nanoparticles. Environmental Science & Technology, 49, 1190-1196. https://doi.org/10.1021/es5049573
- 23. Fakhrullin, R.F., et al. (2010) Interfacing Living Unicellular Algae Cells with Biocompatible Polyelectrolyte-Stabilised Magnetic Nanoparticles. Macromolecular Bioscience, 10, 1257-1264. https://doi.org/10.1002/mabi.201000161
- 24. Lim, J.K., et al. (2012) Rapid Magnetophoretic Separation of Microalgae. Small, 8, 1683-1692. https://doi.org/10.1002/smll.201102400
- 25. Adeleye, A.S. and A.A. Keller (2014) Long-Term Colloidal Stability and Metal Leaching of Single Wall Carbon Nanotubes: Effect of Temperature and Extracellular Polymeric Substances. Water Research, 49, 236-250.
- 26. Adeleye, A.S., et al. (2014) Influence of Extracellular Polymeric Substances on the Long-Term Fate, Dissolution, and Speciation of Copper-Based Nanoparticles. Environmental Science & Technology, 48, 12561-12568. https://doi.org/10.1021/es5033426
- 27. Sheng, A., et al. (2016) Impact of Proteins on Aggregation Kinetics and Adsorption Ability of Hematite Nanoparticles in Aqueous Dispersions. Environmental Science & Technology, 50, 2228-2235. https://doi.org/10.1021/acs.est.5b05298
*通讯作者。