Open Journal of Fisheries Research
Vol.04 No.04(2017), Article ID:23036,15
pages
10.12677/OJFR.2017.44021
The Isolated Microbial Strains of the Hepatopancreas from Laminarin-Fed Prawn, Macrobrachium rosenbergii, Identified as Probiotics
*通讯作者。
Hung-Hung Sung*, Yi-Xuan Pen, Xiao-Yun You
Department of Microbiology, Soochow University, Taipei Taiwan
Received: Nov. 26th, 2017; accepted: Dec. 7th, 2017; published: Dec. 15th, 2017

ABSTRACT
This study tries to isolate special microbes from the hepatopancreas of laminarin-fed prawn, Macrobrachium rosenbergii, and further evaluate whether these microbes can be used as probiotics. On days 5 after continuous feeding with laminarin (30 mg/prawn), two strains MB58 and MB550 belonged to Metschnikowia bicuspidata were isolated from the hepatopancreas, but the same species was not isolated in the domesticated prawn and control prawn. The virulence test found that, after injection with MB58 and MB550, the mortality rate of prawn was 12% and 22%, respectively; both mortalities were lower than 87% caused by what is known as probiotic Lactococcus plantarum. The results from the pathogenic strains cultured in the extracellular fluids of MB58 or MB550 showed that the growth of Aeromonas hydrophila and A. veronii could be inhibited by the both strains and that of Lactococcus garvieae only was inhibited by strain MB550. The survival of prawn challenged with L. garvieae after feeding for 5 days was 70.6%, 73.4% and 100% for prawn fed with only MB58, MB550 and both strains, respectively; however, the control group prawn all died. After feeding for 5 days, the activities of the stimulated phenoloxidase (POS) and the total PO (POT) in hemocytes of the MB550-fed group and the mix-fed group were higher than those of the control group; however, those in plasma were not significantly different from the control. For the MB58-fed group, only plasma POS was higher than the control group. Furthermore, the strains MB58 and MB550 were separately encapsulated into the feed by alginic acid as the adhesive to produce five kinds of particulate feeds. The mortality rates of prawn challenged with L. garvieae after feeding for 5 days were 10.3%, 12.0% and 11.5% for the MB58-fed, MB550-fed and mix-fed groups, respectively; these rates were lower than that of the control group (47.8%). The results of POT detected on days 5 after continuous feeding and day 1 and day 3 after challenge showed that the POT in plasma and hemocytes of the MB550-fed group was significantly higher than that of the control group either before or after infection and that the POT of the MB58-fed group was significantly higher than that in control group only in plasma before infection. For the mix-fed group, the POT in plasma and hemocytes was higher than that of the control group before infection, and that in hemocytes was also higher than that of the control after infection. These results suggest that the two strain MB58 and MB550 by themselves or mixed may enhance the resistance against infection and reduce the mortality of prawn by both the inhibition of the growth of pathogens and the increase of the proPO-activating system. Therefore, the both strains should have the potential as probiotics to be used in prawn aquaculture.
Keywords:Macrobrachium rosenbergii, Laminarin, Gut Microbes, Probiotics
鉴定来自喂食褐藻多醣之淡水长脚大虾肝胰脏的分离株为益生菌
宋宏红*,彭怡瑄,游晓韵
东吴大学微生物学系,台湾 台北
收稿日期:2017年11月26日;录用日期:2017年12月7日;发布日期:2017年12月15日

摘 要
本研究于喂食褐藻多醣后的淡水长脚大虾(Macrobrachium rosenbergii)之肝胰脏分离并评估因喂食出现的特定微生物作为益生菌之可行性。实验以30 mg褐藻多醣喂食每尾虾子连续喂食10天期间,喂食第5天的虾子肝胰脏分离到喂食前和对照组虾子都出现的梅奇酵母菌(Metschnikowia bicuspidata)菌株MB58及MB550。毒性测试发现,菌株MB58及MB550分别注射处理虾子后造成的死亡率分别为12%和22%,均低于已知为益生菌的Lactococcus plantarum的致死率87%。将致病菌分别培养于菌株MB550和MB58之胞外液的结果显示,两菌株都可以抑制致病菌Aeromonas hydrophila和A. veronii的生长;但仅MB550能抑制Lactococcus garvieae。连续口服MB58、MB550及混合菌株(MB58 + MB550)后五天,以L. garvieae感染的虾子存活率分别为70.6%、73.4%和100%,然控制组虾子全数死亡。免疫相关之原酚氧化酵素(prophenoloxidase, proPO)活化系统的表现显示,喂食后5天,MB550喂食组和MB58 + MB550混合喂食组的虾子血浆的活化型酚氧化酵素活性(POS)和总酚氧化酵素活性(POT)与对照组均无差异,然两组虾子的血球内POS及POT则高于对照组;MB58喂食组虾子仅血浆POS高于对照组,血浆POT和血球内POS及POT均与对照组无差异。进一步以褐藻酸(alginic acid)作为黏着剂,将菌株MB58及MB550分别包裹入饲料以制作出5种颗粒饲料,分别连续喂食虾子五天后,易感性实验显示,未包裹菌株的对照组虾子的死亡率为47.8%,仅包裹褐藻酸组23.8%,以褐藻酸包裹MB58、MB550及两株混合的三组虾子的死亡率分别为10.3%、12.0%及11.5%,均明显低于对照组。喂食5天和感染后1天和3天分别测定血浆及血球内POT的结果显示,MB58喂食组仅于感染前的血浆POT高于对照组;MB550组于感染前后的血浆和血球内的POT皆明显高于对照组;混合组则于感染前血浆及血球内POT和感染后血浆POT皆高于对照组。综合上述结果推测,单独喂食菌株MB58和MB550可能抑制致病菌生长和增强proPO活化系统,以提升虾子对感染的抗抵力而降低虾子的死亡率。因此,分离自喂食褐藻多醣之虾子的两株梅奇酵母菌MB58和MB550可能具有作为益生菌的潜力以应用于虾类水产养殖。
关键词 :淡水长脚大虾,褐藻多醣,肠道微生物,益生菌

Copyright © 2017 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
虾类养殖一直饱受病原性与非病原性感染,衍生疾病丛生等问题,造成产量下降。在台湾,淡水长脚大虾(Macrobrachium rosenbergii)为淡水虾中最大型且具有经济价值者。由于养殖快速而盲目的成长及养殖环境恶质化问题上升,虾类一直饱受病原性与非病原性感染,衍生疾病丛生等问题,使的产量下降。淡水长脚大虾的病原体则有好发于夏季的革兰氏阴性菌Aeromonas veronii和A. hydrophila [1] [2] [3] [4] [5] 及革兰氏阳性菌Lactococcus garvieae [6] [7] ,好发于冬天且池底老化有机物堆积过多优养化的酵母菌Debaryomyces hansenii和Metschnikowia bicuspidata等。非病原性方面主要起因于养殖生态的持续恶化,包括:盐度及温度的过度变动、放养密度过高及溶氧不足等问题,使虾类因各种压迫(stresses)造成免疫力降低,进而易受伺机性病原菌的威胁 [8] 。为防止虾病的发生或扩大,专家学人企图利用水质的管理、药物处理、虾苗筛选与提升虾体免疫力及抗病能力等模式以改善之。
在水产养殖上,免疫刺激物曾使用于鱼类及甲壳类动物,藉由提高非专一性免疫反应增加对疾病的抵抗力,有效控制疾病的发生。大多免疫刺激物属于多醣类,例如乙型葡聚糖(β-glucan)、褐藻多醣(laminarin)、基丁质(chitin)、甘露聚醣(mannan oligosaccharide)及脂多醣(lipopolysaccharide)等 [9] [10] [11] [12] 。在虾类的研究发现,乙型葡聚醣除了能促进血球型态的改变与吞噬活性增强外,也能活化原酚氧化酵素活化系统(prophenoloxidase activity system; PAS)提升酚氧化酵素(phenoloxidase; PO)活性 [13] ,适量的使用能增加草虾抵抗Vibrio harveyi、V. vulnificus以及白点病毒(White Spot Syndrome Virus)的能力 [14] [15] 。目前乙型葡聚醣已经是被广泛使用在水产上的免疫刺激物。
益生菌(probiotics)为活的微生物,可藉由改善宿主肠道微生物之平衡,使宿主获益 [16] 。因此,益生菌的使用为目前提升虾体免疫力之策略之一。研究发现,在饲料中添加益生菌可以提高换肉率、幼体存活率以及降低水污染 [17] ,且益生菌可藉由分解宿主体内无法分解的物质,例如乙型葡聚醣,帮助宿主更有效率的吸收养分。研究指出,来自啤酒酵母菌的乙型葡聚醣喂食草虾和萃取自褐藻的乙型葡聚醣注射至鲑鱼(Salmosalar)腹腔后,都会改变肠道菌相 [18] [19] 。由此可见,免疫刺激物具有改变动物肠道微生物组成,以促使益生菌孳长而提升动物抗病力的潜力 [20] 。
由于目前还未有研究观察喂食乙型葡聚醣后菌相改变是否和虾子免疫力上升有关系。因此,本研究利用免疫刺激物褐藻多醣(laminarin)连续喂食淡水长脚大虾后,观察虾子肝胰脏内致病菌及因喂食而特定出现于肠道之微生物的互动;接着,针对特定出现的微生物进行其作为养殖虾益生菌的评估,包括:测定其对虾子的毒力(virulence)和对常见致病菌的抑菌力、以及喂食特定菌株后虾子的易感性、PO活性及抗氧化之谷胱甘肽过氧化酶(Glutathione peroxidase; GPx)活性。
2. 材料与方法
2.1. 实验用虾
实验用虾购买自养殖场外观健康的淡水长脚大虾(M. rosenbergii),平均每尾重25 g,养于 pH = 7.0,水温 23˚C,充分打气的淡水循环养殖虾池中,养殖密度约每平方公尺4~5尾,驯养至少三天后才可以进行实验。养殖期间每日喂食人工饲料2次,饲料来自屏东科技大学郑文腾教授,配方详见Chiu等(2010) [21] 。
2.2. 褐藻多醣的喂食和虾子存活率
本研究室曾以 4 μg的褐藻多醣注射处理淡水长脚大虾,显示其能增强proPO基因的表现 [22] ;以500 μg/L的褐藻多醣浸泡草虾后发现可以改变肝胰脏内细菌的组成 [18] 。所以,本实验选择介于注射与口浸泡之间的不同浓度,以决定适当的喂食浓度。将褐藻多醣溶于已灭菌处理的0.01 M的磷酸盐缓冲液(PBS),并调整浓度为200 mg/mL、300 mg/mL、400 mg/mL。使用1 mL空针筒接上细软管,以软管接触虾口器,每一尾虾注入100 μL褐藻多醣。本实验共有三个实验组,分别是喂食20 mg/prawn、30 mg/prawn及40 mg/prawn,对照组喂食等体积的PBS。连续喂食10天期间,每日观察并纪录虾子死亡数目,换算存活率。
2.3. 虾子肝胰脏中细菌的分离与鉴定
无菌方式取出完整的虾子肝胰脏与肠子,浸泡入20 mL无菌0.85% NaCl。用研钵磨碎组织,以2000 rpm于4˚C离心10 min后,取上清液。以无菌5.0 μm的滤纸抽气过滤上清液后,以8000 rpm离心10 min。以无菌0.85% NaCl悬浮并稀释菌液至适当浓度,取100 mL菌液均匀涂抹至胰蛋白酶大豆琼脂(TSA)平板,于28˚C隔夜培养至少24小时。最后,每个实验组和对照组都随机挑出30个单一菌落(single colony)。所有菌落委请基隆米克斯公司进行菌种鉴定。
2.4. 毒力(virulence)测试
本实验选择来自哺乳动物且被认定是益生菌株的植物乳杆菌(Lactobacillus plantarum ATCC10012)作为对照,针对出现于褐藻多醣处理后虾子肝胰脏内的特定菌株进行对虾子的毒力测试。L. plantarum及分离自虾体肝胰脏内的菌株分别接种至培养基Brain heart infusion broth (BHIB)及TSB后,于28˚C及转速130 rpm,培养至对数晚期(late log phase)。取15 mL菌液,经离心并悬浮于PBS (pH = 7.56, 420 ± 5m Osm/kg),制备成菌液,调整浓度至1 × 109 CFU/mL。取100 μL菌液注射于虾子腹腔第一节后,于72小时内计数虾子的死亡数目,换算出专一性死亡率,12小时内死亡属非专一性死亡。
。
2.5. 菌株胞外液的制备
分离自虾子的菌株以及三株虾子的致病菌Lactococcus garvieae S99、Aeromonas hydrophila及A. veronii ATCC 9071中,除L. garvieae接种至BHIB,其他菌株都接种至TSB,于28˚C及转速130 rpm培养至不同生长时期。取不同生长时期的菌液,4˚C下离心取上清液。以磷酸缓冲液(PB, pH = 7.0)在4˚C下透析18至24小时后,冷冻干燥以浓缩。抑菌测试前,以Poor-nutrient broth (PNB)回溶并调整浓度。
2.6. 抑菌测定
实验分成两部分进行。第一部份实验是制备三株致病菌的菌液,菌株培养至对数晚期后,于4˚C下离心后,以0.85% NaCl清洗两次后,以PNB回溶,并调整菌液至OD600为0.01。第二部分实验则是制备分离自虾子的菌株成对数晚期菌液样本。两部分的实验各自分为三组,空白组加入90 μL PNB及10 μL PNB,对照组加入90 μL菌液及10 μL PNB,实验组加入90 μL菌液及10 μL胞外液样本;各组培养于28˚C后,每一小时以光波600 nm测吸光值。
2.7. 包裹菌株之饲料的制备
褐藻酸(alginic acid)主要为褐藻细胞壁或是细胞间质中的一种阴离子结构多醣,且为不溶性胶体酸,可做为包裹其他物质之用。本实验将虾子的饲料粉末分别与PBS、褐藻酸溶液和含褐藻酸之菌液,以1:1 (W:V)的比例混合后,以去除针头的3 mL空针筒将饲料挤出,风干30分钟,将饲料切成1 mm ´ 3 mm大小,再放置室温7天。取放置不同天数的饲料10颗,溶于10 mL的0.85% NaCl,10倍连续稀释后,取100 mL涂抹至TSA平板,于28˚C隔夜培养后,计数每颗饲料平均含菌落数。
2.8. 虾子的易感性测试
实验分两部分进行,第一部分将培养至对数晚期的菌液调整浓度至1 × 108 CFU/mL后,取菌液100 μL直接喂食虾子;第二部分是将包裹菌株的饲料喂食虾子,每天两次,每次每一尾虾子10颗。两部分实验的虾子连续喂食5天,于停喂第一天将100 μL致病菌L. garvieae (1 × 108 CFU/mL)注射感染虾子。接着于72小时内观察虾子死亡数目,并计算获得各实验组的专一性死亡率。
2.9. 酚氧化酵素活性的测定
以内含抗凝剂的针筒抽取虾血淋巴(hemolymph)后,以3200 rpm于4˚C离心5分钟,取出上清液,即血浆样本;沈淀的血球以PBS悬浮后,于4˚C转速12,000 rpm离心30分钟可使细胞破裂,悬浮于PBS,即获得血球细胞萃取液(hemocyte lysate supernatant; HLS)样本。以Bradford方法测定样本蛋白质浓度。
酚氧化酵素(PO)活性测试以1.6 mg/mL之L-DOPA (L-3,4-dihydroxyphenyl-alanine)为受质。不论血浆或HLS样本都分成两组,一组取50 µL样本,加入50 µL浓度1 mg/mL胰蛋白酶(Trypsin),另一组以PBS取代胰蛋白酶。其后于37˚C作用15分钟后,加入200 µL新鲜制备之DOPA,立即于波长490 nm测吸光值。取前五分钟内且单位时间内最大变化的OD数值,以变化0.001为1 U,获得PO活性,以(ΔU/Δt)/mg表示。根据Chao等实验指出,实验样本不加入胰蛋白酶测得的PO活性,视为样本内已存在由proPO转化成PO的含量,以POS表示;样本加入胰蛋白酶后所测得的PO活性,视为样本内原含有的proPO总量,以POT表示 [23] 。
2.10. 谷胱甘肽过氧化酶活性( Glutathione Peroxidase, GPx)
本实验使用GPx检测试剂套组测定HLS的GPx活性。根据实验手册步骤进行之。活性测定原理为利用GSH为还原当量来源,经GPx作用将过氧化物质氢过氧化枯烯(cumenehydroperoxide)还原成醇类,再以NADPH与谷胱甘肽还原酶(glutathione reductase)将此反应产生的氧化态二硫化谷胱甘肽(glutathione disulfide)迅速转换成还原态,反应伴随NADPH氧化成NADP+。测定每单位时间内NADPH氧化成NADP+的速率得知GPx活性。一单位GPx定义为每分钟 NADPH所氧化的微莫耳数。
2.11. 统计分析
抑菌力及血淋巴之PO和GPx的活性数据以one-way ANOVA进行各不同喂食处理组间的比较,分析后有显着差异者(p < 0.05),再以Duncan比较各组间的差异。
3. 结果
3.1. 喂食不同浓度褐藻多醣后之虾子的自然存活率
连续喂食不同浓度褐藻多醣10天,观察虾子存活以选择适当喂食浓度。结果如表1所示,30-mg喂食组在喂食至第5天的虾子存活率仍为100%;第10天的存活率为63%,高于对照组与20-mg及40-mg喂食组(36%、50%及25%)。观察虾子发现,40-mg喂食组的虾子在第3天开始出现死亡或肌肉白浊症状,对照组及20-mg喂食组则在第5天出现虾子死亡或肌肉白浊症状。因此,后续实验选择喂食褐藻多醣的剂量是每一尾虾30 mg。
Table 1. Survival of freshwater prawn after feeding with laminarin for different days
表1. 褐藻多醣喂食不同天数后之淡水长脚大虾的存活率
注:喂食后0天表示喂食前一天且虾子未经任何处理。喂食剂量0 mg为喂食等体积100 mL PBS以取代褐藻多醣。
3.2. 喂食褐藻多醣前后虾子肝胰脏中微生物的组成
喂食前一天之驯养时之虾子肝胰脏内原本就带有病原菌Lactococcus garvieae,分离率16.7%;然并未分离到常见之革兰氏阴性(G-)致病菌Aeromonas hydrophila或A. veronii等(表2)。相较于对照组虾子肝胰脏可持续分离到L. garvieae且分离率13.3%至16.7%,连续喂食褐藻多醣之虾子肝胰脏于喂食后第5天未分离到L. garvieae,且喂食后3天和10天虽分离到L. garvieae (10%及6.7%),但分离率均低于对照组。另外,A. hydrophila可持续在对照组虾子分离到,但在喂食褐藻多醣的虾子都未分离。实验期间发现,在喂食褐藻多醣的虾子肝胰脏中持续分离到梅奇酵母菌Metschnikowia bicuspidata,且在第5天的分离率最高,达23.3%;然而,此酵母菌不曾在对照组虾子分离到。接着在所有梅奇酵母菌分离株随机选取编号为MB58及MB550两株,进行后续益生菌的评估。
3.3. 梅奇酵母菌MB58及MB550对虾子的毒力(virulence)
选择来自哺乳动物且被认定是益生菌株的植物乳杆菌(Lactobacillus plantarum ATCC10012)与来自褐藻多醣处理之虾子的两株分离株梅奇酵母菌MB58及MB550进行对虾子的毒力测试。结果显示,对照的植物乳杆菌造成87%的虾子死亡,明显高于梅奇酵母菌MB58及MB550的致死率,分别为12%和22% (表3)。
3.4. 梅奇酵母菌MB58及MB550与致病菌的相互抑制力
为了解两株梅奇酵母菌MB58及MB550与常见致病菌A. hydrophila、A. veronii及L. garvieae之间是否会互相影响生长,本实验以两菌株于不同生长时期的胞外液分别与三株致病菌共同培养后,观察的抑菌结果如图1所示,两菌株在对数期(log phase)、对数晚期(late log phase)及稳定期(stationary phase)的胞外液皆能抑菌两株G-致病菌A. hydrophila和A. veronii的生长,其中对数晚期的抑制作用优于其他两个时期的胞外液;另外,只有菌株MB550对数晚期的胞外液能抑制L. garvieae生长。相对地,三株致病菌的胞外液皆无法抑制MB58的生长,且仅L. garvieae三个时期的胞外液会抑制菌株MB550的生长(图2)。
3.5. 喂食梅奇酵母菌MB58及MB550的虾子易感性
为评估两株梅奇酵母菌是否能提高虾子对抗致病菌的感染,本实验对连续喂食5天后的虾子进行注射感染致病菌L. garviae,观测并记录72小时内虾子死亡数。结果如表4所示,对照组虾子在感染后全数死亡(死亡率100%);菌株MB58及MB550之喂食组虾子的死亡率分别为26.6%及29.4%,至于两菌株混合喂食组的虾子则100%存活。
3.6. 虾子喂食梅奇酵母菌MB58及MB550的酚氧化酵素活性
为厘清两菌株提高虾子的抵抗力与虾子酚氧化酵素(PO)的表现是否有关,本实验于喂食菌株期间分
Table 2. Pathogens and special microbes present in prawn hepatopancreas before and after treatment with laminarin
表2. 褐藻多醣处理前后虾子肝胰脏内出现的致病菌与特定微生物
注:喂食后0天表示喂食前一天且虾子未经任何处理。括号内数据为各菌种由不同处理之虾子肝胰脏内分离到的百分率。特定菌株为只出现于口服褐藻多醣的虾子。
Table 3. Mortality of freshwater prawn after injection with Lactobacillus plantarum and Metschnikowia bicuspidata MB58 and MB550
表3. 淡水长脚大虾注射植物乳杆菌和梅奇酵母菌MB58及MB550后的死亡率
注:N表示实验用的数目。
Table 4. Mortality of prawn fed with MB58 and MB550 after infection
表4. 喂食梅奇酵母菌株MB58及MB550后淡水长脚大虾的感染死亡率
注:N表示每组实验用虾子数目。
别测定虾血浆和血球内的PO活性。结果如图3所示,菌株MB58喂食组虾子的血浆POS高于对照组,但POT低于对照组;血球内的POS与POT皆与对照组无显著差异。菌株MB550喂食组虾子的血浆中POS与对照组无差异,POT却低于对照组;然而,血球内POS及POT均高于对照组POS及POT。将两菌株混
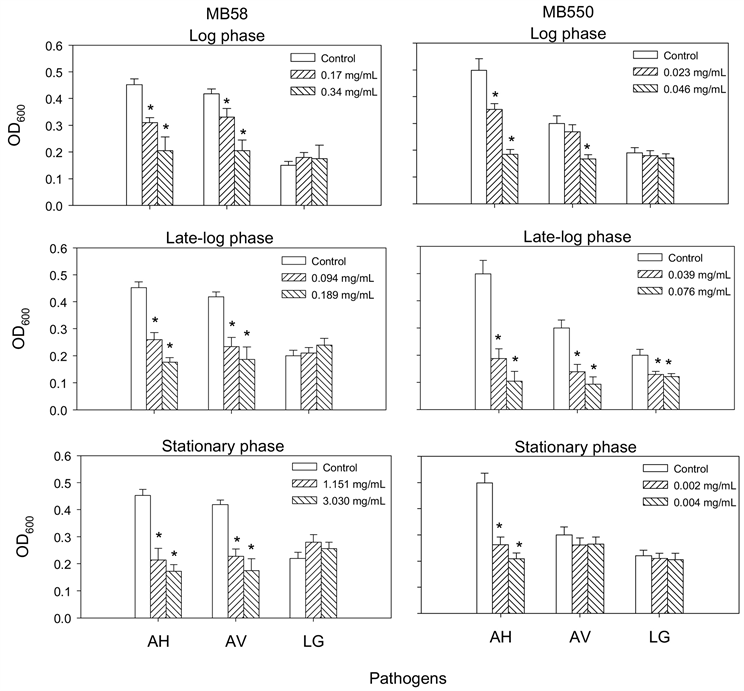 AH,Aeromonas hydrophila;AV,Aeromonase veronii;LG,Lactococcus garvieae。*表示经统计分析后与PBS处理之对照组之间具有显着差异(p < 0.05)。
AH,Aeromonas hydrophila;AV,Aeromonase veronii;LG,Lactococcus garvieae。*表示经统计分析后与PBS处理之对照组之间具有显着差异(p < 0.05)。
Figure 1. Effect of extracellular fluids of Metschnikowia bicuspidata MB58 and MB550 on pathogen growth
图1. 梅奇酵母菌MB58和MB550胞外液对致病菌生长的影响
合喂食虾子后,血浆的POS和POT与对照组无差异,然而血球内的POS及POT则高于对照组。
3.7. 虾子喂食添加奇梅酵母菌株饲料后的易感性
为评估两株奇梅酵母菌株混合入饲料后是否仍具有提升虾子抗病力,本实验以海藻酸(alginic acid)为黏着剂,分别制作成仅含海藻酸及海藻酸分别加MB58、MB550和混合两菌株的四种饲料,对照组饲料则未包裹任何物质。含菌株的饲料保存于4˚C下5天后,测得每颗饲料中的菌数与第一天实无差异,仍能维持在2 ´ 104 CFU/mL。将不同饲料分别喂食虾子5天,并于停喂第一天口服感染L. gariveae后,观察纪录72小时内虾子的死亡数。结果如表5所示,对照组虾子感染后持续死亡,累积死亡率为47.8%,海藻酸组的死亡率为23.8%,至于添加菌株的实验组虾子的死亡率均低于对照组与海藻酸组,分别是MB58组10.3%、MB550组12.0%及混合组11.5%。
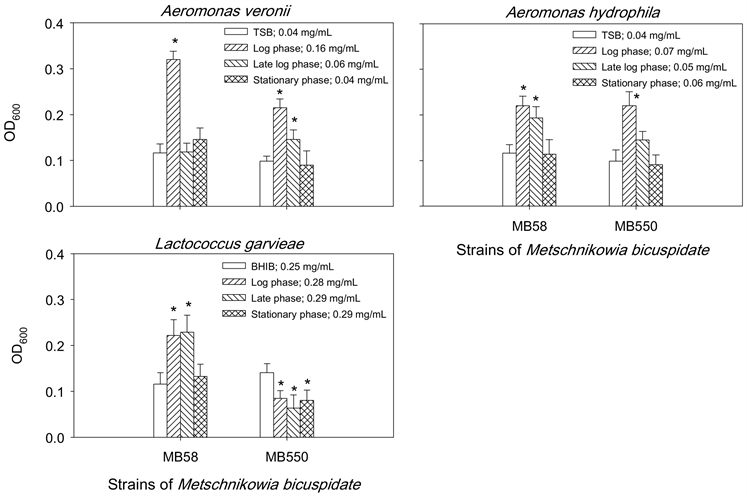 *表示经统计分析后与PBS处理之对照组之间具有显着差异(p < 0.05)。
*表示经统计分析后与PBS处理之对照组之间具有显着差异(p < 0.05)。
Figure 2. Effect of extracellular fluids of pathogens on the growth of Metschnikowia bicuspidata MB58 and MB550
图2. 致病菌胞外液对梅奇酵母菌MB58和MB550生长的影响
 *表示经统计分析后与PBS处理之对照组之间具有显着差异(p < 0.05)。
*表示经统计分析后与PBS处理之对照组之间具有显着差异(p < 0.05)。
Figure 3. Phenoloxidase activity in plasma and hemocyte of prawn fed with stains MB58 and MB550
图3. 喂食菌株MB58和MB550之淡水长脚大虾的血浆及血球内酚氧化酵素活性
3.8. 虾子喂食添加奇梅酵母菌株饲料后的酚氧化酵素和谷胱甘肽过氧化酶的活性
虾子分别喂食含株菌MB58及MB550的饲料5天以及停喂后经L. garvieae感染的1天或3天,抽取血淋巴,分别测定血浆和血球中POT和血球中谷胱甘肽过氧化酶(GPx)活性。结果显示,各组虾子于喂食不同饲料五天后之血浆POT都高于对照组(图4(a));除MB58喂食组与对照组无差异外,其他三组的血球
Table 5. Mortality of prawn fed with strain MB58- and MB550-added feed after infection
表5. 喂食添加菌株MB58及MB550的饲料后淡水长脚大虾的感染死亡率
注:N表示每组实验用虾子的数目。
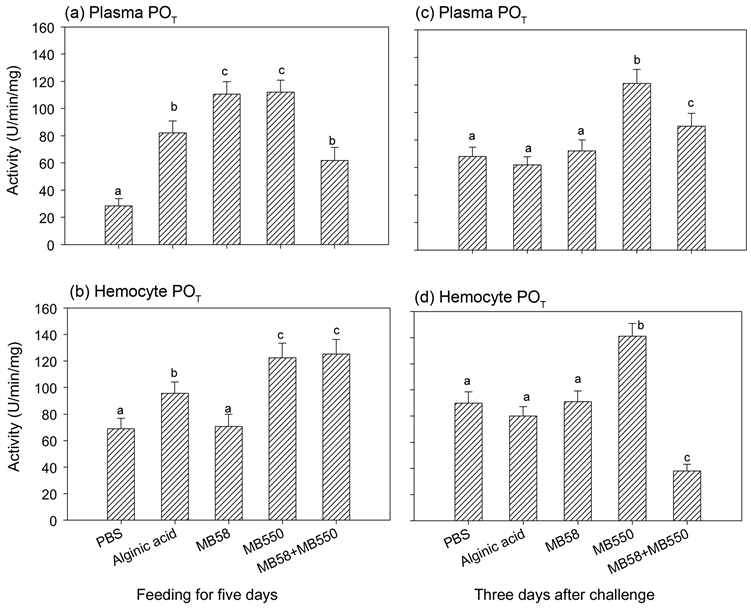 不同字母,表示经统计分析后各组之间具有显着差异(p < 0.05)。
不同字母,表示经统计分析后各组之间具有显着差异(p < 0.05)。
Figure 4. Phenoloxidase activity in plasma and hemocyte of prawn fed with different feeds after infection
图4. 淡水长脚大虾连续喂食不同饲料后再以致病菌感染之血浆及血球内总酚氧化酵素活性
POT亦高于对照组(图4(b))。停喂并经感染后3天的虾子POT显示,MB550和混合喂食组的血浆POT活性皆高于对照组,且MB550组活性高于混合组(图4(c));至于血球内活性,MB550组高于对照组,而混合组的活性明显低于对照组,其他喂食组虾子于感染后的血浆及血球内POT表现均与对照组无差异(图4(c)和图4(d))。喂食不同饲料之虾血球内GPx活性结果显示,混合喂食之虾子于喂食5天和感染后1天及3天的GPx活性均高于对照组;海藻酸和菌株MB58及MB550喂食组于喂食5天和感染后1天的活性均与对照组无差异,但是在感染后3天,前两组的活性明显低于对照组,MB550组则明显高于对照组(图5)。相较于感染后一天,感染后3天测得的每一组活性皆明显大幅降低。
4. 讨论
4.1. 喂食不同剂量褐藻多醣会影响淡水长脚大虾的存活
本研究为厘清喂食葡聚醣是否会影响虾子肝胰脏内微生物组成以提高虾子的抗病力,以不同剂量的褐藻多醣(laminarin)喂食淡水长脚大虾,在连续喂食30 μg剂量至第5天的虾子存活率为100%,喂食至第10天时,存活率仍能维持在62.5%,均高于其他喂食组(表1)。Ai等人 [24] 以不同剂量乙型葡聚醣喂食大黄鱼发现,使用剂量不当无法有效提升免疫力,甚至可能造成免疫力下降。由上述结果推测,每只虾子喂食30 μg的褐藻多醣可适度的提升虾子免疫力,且具有推迟虾子发病或死亡的效应;高喂食剂量对虾子可能造成过度的免疫反应,并未能提供虾子适时的保护力。此外,本实验发现30-μg组于连续喂食5天没有虾子死亡,直至第10天开始死亡。有研究指出,每7天喂食白虾一次添加乙型葡聚醣的饲料与每天喂食方式比较,发现每七天喂食组白虾的抗病毒能力较高 [25] ;也有研究显示,长时间使用乙型葡聚醣会造成免疫力的下降或是产生负向回馈调控(negative feedback regulation) [24] [26] [27] 。所以,免疫刺激
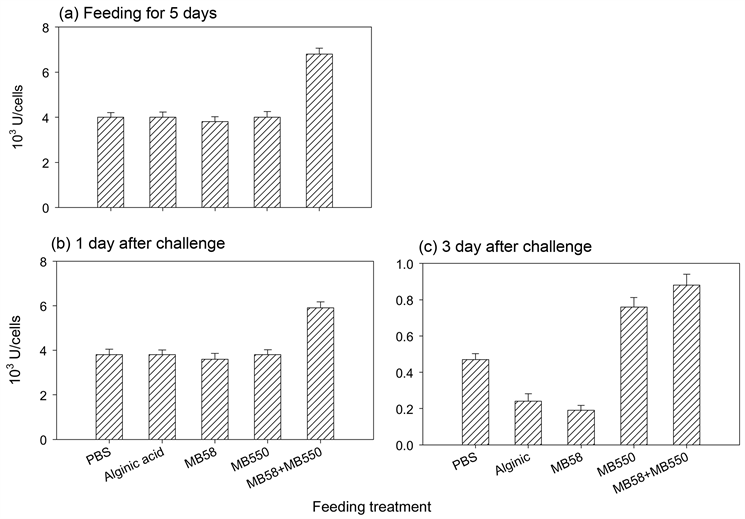
Figure 5. Activity of glutathione peroxidase in plasma and hemocyte of prawn fed with different feeds before and after infection
图5. 淡水长脚大虾连续喂食不同饲料后再以致病菌感染之血球细胞的谷胱甘肽过氧化酶活性
物的施用时间及方式会影响其效果。为避免长时间使用免疫刺激物可能降低对水生生物之保护力,本实验后续实验选择喂食每尾虾子的剂量为30 mg,一次喂食时间为5天。
4.2. 褐藻多醣影响虾子的肝胰脏内致病菌组成与存活
水生生物的肠道微生物菌相常受到食物来源及水体影响 [28] 。本实验以褐藻多醣连续喂食虾子10天后,于喂食后不同时间观察虾子肝胰脏内菌相的变化。研究曾指出,喂食乙型葡聚醣之草虾肝胰脏内的菌相会发生改变 [18] ;针对革兰氏阴性菌(G-)细菌进行分离并鉴定,发现G-细菌主要包含Citrobacter freundii、Enterobacter aerogenes、Aeromonas spp.、Acinetobacter baumannii及Pseudomonas spp.等细菌 [29] 。本实验在对照组及30-μg喂食组虾子肝胰脏内也分离到上述菌种(未显示数据),也发现对照组虾子肝胰脏内主要的致病菌Lactococcus garvieae分离率高于褐藻多醣喂食组,且Aeromonas hydrophila未在喂食组出现;更有趣地发现,梅奇酵母菌(Metschnikowia bicuspidata)出现在喂食组,但未见于对照组。近年研究指出,有些多醣体免疫刺激物具有改变动物肠道菌相的能力,乙型葡聚醣的水解产物能成为Lactobacillus acidophilus生长所需的碳源 [30] 。因此,本实验推测虾子肝胰脏内菌相的改变可能和部分细菌能分解多醣类物质有关系,因而造成能使用此物质为营养来源的细菌出现或成为优势菌。
由肝胰脏内致病菌出现的变化和虾子存活率表现分析发现,喂食前一天已经驯养至少6天的虾子在其肝胰脏就分离致病菌,且在第5天出现虾子死亡(27%)及第10天虾子大量死亡(64%),推测虾子本身即带有致病菌,在本身免疫力无法抵抗致病菌时便会发病死亡。褐藻多醣喂食组出现的致病菌L. garvieae于喂食第3天的分离率低于喂食前,第5天则未分离到,且并未观察到虾子出现死亡,直至第10天致病菌再度出现后,虾子始出现死亡。有研究显示,草虾在发病时,肝胰脏内的弧菌属菌量会增加 [31] 。上述结果显示,致病菌在肝胰脏内出现的变化和虾子的发病与存活状况有密切的关系。
4.3. 梅奇酵母菌MB58和MB550作为益生菌
由于在30-mg喂食组在第3至5天的虾子没有出现死亡,且梅奇酵母菌在喂食期间持续出现,但其未出现在控制组的菌群。因此推测此酵母菌可能可以抑制致病菌而使虾子得以推迟发病而存活。因此,本实验随机挑选MB58和MB550进行是否可以作为益生菌的评估。
本实验选择一株已经被证实可以作为猪等动物益生菌的植物乳杆菌(Lactobacillus plantarum)作为对照,比较三株细菌对虾子的毒力发现,分离自虾子的酵母菌株MB58和MB550对虾子的毒力均低于植物乳杆菌,虽然与对照组比较具有弱毒性,主要原因是两菌株原本存在于虾体肝胰脏内,而非肌肉,故打入肌肉时对虾子仍会造成伤害所致。此外,根据虾子的致病菌L. garvieae及A. veronii之LD50分别为108 CFU/ml及105 CFU/mL [3] ,本实验注射此两种细菌的剂量为108 CFU/ml,致死率均低于25%。因此推测,来自虾体的两酵母菌株MB58和MB550对虾子并没有致病力。
抑菌结果发现,两菌株MB58和MB550都可以抑制两株G-致病菌株A. hydrophila及A. veronii生长以及对数晚期的MB550也可以抑制L. garvieae生长(图1);反之,两株G-致病菌株无法抑制两菌株MB58和MB550,L. garvieae仅能抑制MB550生长(图2)。根据这些结果推测,梅奇酵母菌出现在肝胰脏可能可以抑制两株G-致病菌株,并降低L. garvieae,具有降低虾子感染发病的机率。
本实验以易感性实验分析此两菌株喂食虾子是否提高虾子对抗L. garvieae的感染力。不论直接喂食活菌或喂食包裹活菌的饲料,虾子感染后的死亡率都明显低于对照组(表4和表5)。由于菌株MB58和MB550对L. garvieae的抑制力有限,所以本实验进一步分析抗病力的提高是否与免疫力有关。喂食两菌株前后的虾子血浆与血球PO活性发现,虽然MB58会增进血浆中proPO转化成PO (即POS),但MB58和MB550会降低血浆原酚氧化酵素的含量(POT),即减少释颗粒作用 [23] ;且混合菌株对POS和POT都不具影响(图3)。另外,MB550和混合菌株可以明显提高血球内POS和POT的表现。应感染实验结果(表4),MB550喂食组的虾子之存活率和MB58喂食组相同,然混合菌株组虾子无死亡。这些结果推测,不论喂食单一菌株或混合菌株,在虾子未被感染时,不会引起发炎作用,且MB550和混合菌株均能提高血球内proPO含量,可以在感染时立即提供有效防御。
将活菌以褐藻酸包裹入饲料喂食虾子所测到的PO活性表现与直接喂食活菌不同,推测可能与褐藻酸也有具有免疫刺激效果有关 [32] 。由喂食五日的结果得知,四种实验组饲料能促使血球细胞将原酚氧化酵素分泌至细胞,促进释颗粒外,MB550、褐藻酸和混合菌株三组的虾血球内POT皆比对照组高,表示细胞内会持续生成PO。在感染后二天测得结果发现,褐藻酸组的PO活性不论在血浆或血球皆与对照组无差异。由褐藻酸组虾子死亡率低于对照组,但高于菌株喂食组,推测在喂食含褐藻酸饲料能刺激虾子血球的释颗粒作用和proPO的合成,提升虾子免疫力,但是在感染后其不再具有刺激效果。反观,MB550和混合喂食组于感染后仍持续提高释颗粒作用,提供一定免疫力,虾子的死亡率也低于褐藻酸喂食组。另外,抗氧化之谷胱甘肽过氧化酶活性结果显示,喂食混合两株能有效提高虾抗氧化力(图5),但单一菌株则无此效应。综合酵素活性与易感死亡率的结果推测,混合喂食MB58和MB550可以透过提升免疫力和抗氧化力以提供虾子抵抗力;而单一菌株可能透过提升其他免疫分子的表现或生理活性来提升虾子抵抗力。
5. 结论
褐藻多醣除了能提升虾子的免疫力之外,也能改变虾子肝胰脏内的细菌组成。喂食30 μg的褐藻多醣可能透过改变肝胰脏内微生物组成,并短暂地促使特定菌种的出现(如梅奇酵母菌),以抑制虾子致病菌的生长,达到推迟死亡的效应。经由各种特性的鉴定推测,褐藻多醣喂食后在虾子肝胰脏中出现的梅奇酵母菌MB58及MB550能抑制致病菌的生长、对虾子无(或弱)致病力、以及能提高虾子抗感染力、免疫力和抗氧化力。因此,梅奇酵母菌MB58及MB550可能具有作为虾子益生菌的潜力。本研究建议,找寻更多抑制不同致病菌的菌种,结合本实验分离的梅奇酵母菌MB58及MB550,并于饲料中加入褐藻多醣,共同制作成为合生元(synbiotics)产品以应用于养殖现场,不失为减少虾子疾病的方向。
致谢
本研究感谢科技部补助研究经费(NSC101-2313-B-031-001)得以顺利完成。另外,感谢东吴大学资助经费,顺利申请并获得专利「梅奇酵母菌株、含有该菌株之组合物及该菌株之用途(发明第I 460269号)。
文章引用
宋宏红,彭怡瑄,游晓韵. 鉴定来自喂食褐藻多醣之淡水长脚大虾肝胰脏的分离株为益生菌
The Isolated Microbial Strains of the Hepatopancreas from Laminarin-Fed Prawn, Macrobrachium rosenbergii, Identified as Probiotics[J]. 水产研究, 2017, 04(04): 134-148. http://dx.doi.org/10.12677/OJFR.2017.44021
参考文献 (References)
- 1. Hsu, J.P. and Liu, C.I. (1994) Studies on Yeast Infection in Cultured Giant Freshwater Prawn (Macrobrachium rosenbergii). Fish Disease Research, 15, 55-68.
- 2. Tung, C.W., Wang, C.S. and Chen, S.N. (1999) Histological and Electron Microscopic Study on Macrobrachium Muscle Virus (MMV) Infection in the Giant Freshwater Prawn, Macrobrachium rosenbergii (de Man), Cultured in Taiwan. Journal of Fish Diseases, 22, 319-323. https://doi.org/10.1046/j.1365-2761.1999.00172.x
- 3. Sung, H.H., Hwang, S.F. and Tasi, F.M. (2000) Responses of Giant Freshwater Prawn (Macrobrachium rosenbergii) to Challenge by Two Strains of Aeromonas spp. Journal of Invertebrate Pathology, 76, 278-284. https://doi.org/10.1006/jipa.2000.4981
- 4. Hsu, J.P., Huang, C., Liao, C.M., Hsuan, S.L., Hung, H.H. and Chien M.S. (2005) Engulfed Pathogen-Induced Apoptosis in Haemocytes of Giant Freshwater Prawn. Macrobrachium rosenbergii. Journal of Fish Diseases, 28, 729-735. https://doi.org/10.1111/j.1365-2761.2005.00681.x
- 5. Sahoo, P.K., Biudu, P.R., Mohanty, J., Kumari, J., Mohanty, S. and Mishra, B.K. (2007) In Vivo Humoral and Cellular Reactions, and Fate of Injected Bacteria Aeromonas hydrophila in Freshwater Prawn Macrobrachium rosenbergii. Fish & Shellfish Immunology, 23, 327-340. https://doi.org/10.1016/j.fsi.2006.11.006
- 6. Cheng, W. and Chen, J.C. (1998) Isolation and Characterization of an Enterococcus-Like Becturium Causing Muscle Necrosis and Mortality with Macrobrachium rosenbergii in Taiwan. Diseases of Aquatic Organisms, 34, 93-101. https://doi.org/10.3354/dao034093
- 7. Chen, S.C., Lin, Y.D., Liaw, L.L. and Wang, P.C. (2001) Lactococcus garvieas Infection in the Giant Freshwater Prawn Macrobranchium rosenbergii Confirmed by Polymerase Chain Reaction and 16SrDNA Sequencing. Diseases of Aquatic Organisms, 45, 45-52. https://doi.org/10.3354/dao045045
- 8. Cheng, W. and Chen, J.C. (1999) Effect of Cultivation Broth pH, Temperature and NaCl Concentration on Virulence of an Enterococcus-Like Bacterium to the Giant Freshwater Prawn Macrobrachium rosenbergii. Diseases of Aquatic Organisms, 36, 233-237. https://doi.org/10.3354/dao036233
- 9. Azuma, I. and Jolles, G. (1987) Development of Immunostimulants in Japan. Immunostimulants Now and Tomorrow 41-56.
- 10. Sakata, T. (1990) Microflora in the Digestive Tract of Fish and shell-Fish. In: Microbiology in Poikilotherms (ed R. Lésel). Elsevier Science Publishers, Amsterdam, 171-176.
- 11. Vetvicka, V. and Sima, P. (2004) β-Glucan in Invertebrates. Invertebrate Survival Journal, 1, 60-65.
- 12. Soltanian, S., Stuyven, E., Cox, E., Sorgeloos, P. and Bossier, P. (2009) Beta-Glucans as Immunostimulant in Verte-brates and Invertebrates. Critical Reviews in Microbiology, 35, 109-138. https://doi.org/10.1080/10408410902753746
- 13. Sung, H.H., Chang, H.J., Her, C.H. and Chang J.C. (1998) Phenoloxidase Activity of Hemocytes Derived from Penaeus mondon and Macrobranchium rosenbergii. Journal of Invertebrate Pathology, 71, 26-33. https://doi.org/10.1006/jipa.1997.4703
- 14. Sung, H.H., Kou, G.H. and Song, Y.L. (1994) Vibriosis Resistance Induced by Glucan Treatment in Tiger Shrimp (Penaeus monodon). Fish Pathology, 29, 11-17. https://doi.org/10.3147/jsfp.29.11
- 15. Chang, C.F., Su, M.S., Chen, H.Y., Lo, H.Y., Kou, G.H. and Liao, I.C. (1999) Effect of Dietary β-1.3-Glucan on Resistance to White Spot Syndrome Virus (WSSV) in Postlarvae and Juvenile of Penaeus monodon. Disease of Aquatic Organisms, 36, 163-168. https://doi.org/10.3354/dao036163
- 16. Fuller, R. (1982) Development and Dynamics of the Aerobic Gut Flora in Gnotobiotic and Conventional Animals. Advances in Veterinary Medicine, 33, 7-15.
- 17. Verschuere, L., Rombout, G., Sorgeloos, P. and Verstraete, W. (2000) Probiotic Bacteria as Biological Control Agents in Aquaculture. Microbiology and Molecular Biology Reviews, 64, 655-671. https://doi.org/10.1128/MMBR.64.4.655-671.2000
- 18. Sung, H.H. and Chen, Y.S. (1999) A Change of Bacterial Community in the Hepatopancrease of Tiger Shrimp (Penaeusmonodon) Administered with Beta-Glucan. Journal of the Fisheries Society of Taiwan, 2, 43-50.
- 19. Liu, Y.C., Zhou, Z.G., Yao, B., Shi, I., He, S., Holvold, L.B. and Ringo, E. (2008) Effect of Intraperitoneal Injection of Immunostimulatory Substances on Allochthonous Gut Microbiota of Atlantic salmon (Salmosalar) Determined using Denaturing Gradient Gel Electrophoresis. Aquaculture Research, 39, 635-646. https://doi.org/10.1111/j.1365-2109.2008.01934.x
- 20. Collins, M.D. and Gibson, G.R. (1999) Probiotics, Prebiotics, and Synbiotics: Approaches for Modulating the Microbial Ecology of the Gut. American Journal of Clinical Nutrition, 69, 1052S-1057S.
- 21. Chiu, S.T., Hsieh, S.L., Yeh, S.P., Jian, S.J., Cheng, W. and Liu, C.H. (2010) The Increase of Immunity and Disease Resistance of the Giant Freshwater Prawn, Macrobrachium rosenbergii by Feeding with Selenium Enriched-Diet. Fish & Shellfish Immunology, 29, 623-629. https://doi.org/10.1016/j.fsi.2010.06.012
- 22. 郑婉璇. β型葡萄聚醣激活虾类血球细胞生理相关基因之讯号传导路径的研究[D]: [学士论文]. 苏州: 私立东吴大学, 2008.
- 23. Chuo, C.P., Liang, S.M. and Sung, H.H. (2005) Signal Transduction of Prophenoloxidase Activating System of Prawn Haemocytes Triggered by Cp Goligodeoxynucleotides. Fish & Shellfish Immunology, 18, 149-162. https://doi.org/10.1016/j.fsi.2004.06.009
- 24. Ai, Q., Mai, K., Zhang, L., Tan, B., Zhang, W., Xu, W. and Li, H. (2007) Effects of Dietary -1, 3 Glucan on Innate Immune Response of Large Yellow Croaker, Pseudosciaenacrocea. Fish & Shellfish Immunology, 22, 394-402. https://doi.org/10.1016/j.fsi.2006.06.011
- 25. Sajeevan, T.P., Philip, R. and Singh, B.I.S. (2009) Dose/Frequency: A Critical Factor in the Administration of Glucan as Immunostimulant to Indian White Shrimp Fenneropenaeusindicus. Aquaculture, 287, 248-252. https://doi.org/10.1016/j.aquaculture.2008.10.045
- 26. Castro, R., Couso, N., Obach, A. and Lamas, J. (1999) Effect of Different β-Glucans on the Respiratory Burst of Tuebot (Psetta maxima) and Gilthead Seabream (Sparusaurata) Phagocytes. Fish & Shellfish Immunology, 9, 529-541. https://doi.org/10.1006/fsim.1999.0210
- 27. Robertsen, B., Engstad, R.E. and Jorgensen, J.B. (1994) Beta-Glucans as Immunostimulants. In: Stolen, J. and Fletcher, T.C., Eds., Modulators of Fish Immune Response, SOS Publications, Fair Haven, 83-99.
- 28. Gatesoupe, F.J. (1994) Lactic Acid Bacteria Increase the Resistance of Turbot Larvae, Scophthalmusmaximus, against Pathogenic Vibrio. Aquatic Living Resources, 7, 277-282. https://doi.org/10.1051/alr:1994030
- 29. Sung, H.H. and Hong, T.Y. (1997) The Gram-Negative Bacterial Flora in Hepatopancreas of Giant Freshwater Prawn (Macrobrachium rosenbergii): Antibiotic Sensitivities and Production of Extracellular Products. Journal of the Fisheries Society of Taiwan, 24, 211-223.
- 30. Snart, J., Bibiloni, R., Grayson, T., et al. (2006) Supplementation of the Diet with High-Viscosity Beta-Glucan Results in Enrichment for Lactobacilli in the Rat Cecum. Applied and Environmental Microbiology, 72, 1925-1931. https://doi.org/10.1128/AEM.72.3.1925-1931.2006
- 31. Song, Y.L., Cheng, W. and Wang, C.H. (1993) Isolation and Characterization of Vibrio damsel Infections for Cultured Shrimp in Taiwan. Journal of Invertebrate Pathology, 61, 24-31. https://doi.org/10.1006/jipa.1993.1005
- 32. Cheng, W., Liu, C.H., Yeh, S.T. and Chen, J.C. (2004) The Immune Stimulatory Effect of Sodium Alginate on the White Shrimp Litopenaeusvannamei and Its Resistance against Vibrio alginolyticus. Fish & Shellfish Immunology, 17, 41-51. https://doi.org/10.1016/j.fsi.2003.11.004
