Hans Journal of Nanotechnology
Vol.04 No.02(2014), Article ID:13453,7
pages
10.12677/NAT.2014.42005
Preparation of Zn-Doped Fe2O3 Nanowires on Carbon Steels and Their Photoelectrochemical Performance under Visible Light
Rongwei Ma, Jingjing Luo, Nan Zhang, Chen Shao, Xuliang Fan, Xiaoshun Zhou, Zhenjiang Niu*
Key Laboratory of the Ministry of Education for Advanced Catalysis Materials, Zhejiang Key Laboratory for Chemistry on Solid Surfaces, Institute of Physical Chemistry, Zhejiang Normal University, Jinhua
Email: *nzjiang@zjnu.cn
Received: Mar. 3rd, 2014; revised: Mar. 30th, 2014; accepted: Apr. 8th, 2014
Copyright © 2014 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
Films of Zn-doped Fe2O3 Nanowires were prepared on the surface of carbon steel using a method of thermal decomposition of oxalate conversion coatings at 350˚C in air. The coating precursors were obtained by immersing the steels in ethanol solutions of 1.5 mol/L oxalic acid with 5.0 × 10−4 mol/L zinc oxalate for 90 min. The oxide films were characterized with X-ray diffraction (XRD), scanning electron microscopy (SEM), transmission electron microscope (TEM) and photocurrent measurement. The results indicate the Fe2O3 nanowires with diameter of ~100 nm. In 2.5 mol/L NaOH solution, the oxide films generated anodic photocurrents of n-type semiconductor behavior under visible light irradiation and zero bias. The Zn doped film generated larger photocurrent than the undoped film did.
Keywords:Carbon Steel, Conversion Coating, Zinc-Doped Fe2O3, Nanowires, Photoelectrochemistry

碳钢表面Zn掺杂Fe2O3纳米线的制备及其 可见光光电化学性能
马荣伟,罗晶晶,张南,邵辰,范旭良,周小顺,牛振江*
先进催化材料教育部重点实验室,固体表面反应化学浙江省重点实验室,浙江师范大学物理化学研究所,金华
Email: *nzjiang@zjnu.cn
收稿日期:2014年3月3日;修回日期:2014年3月30日;录用日期:2014年4月8日

摘 要
以碳钢在1.5 mol/L草酸 + 5.0 × 10−4 mol/L草酸锌溶液中浸泡90 min后形成的草酸盐转化膜为前驱体,经空气中350℃热处理2 h,在碳钢表面制备出Zn掺杂的Fe2O3纳米线氧化膜。采用X射线衍射(XRD)、扫描电子显微镜(SEM)、透射电子显微镜(TEM)和光电流测试对氧化膜进行了表征。结果表明:Fe2O3纳米线的直径约100 nm左右。在2.5 mol/L NaOH溶液中,氧化膜在可见光照射和零偏置电压下,显示n型半导体特征的阳极光电流。Zn掺杂的Fe2O3纳米线氧化膜具有良好的光电化学性能。
关键词 :碳钢,转化膜,Zn掺杂Fe2O3,纳米线,光电化学

1. 引言
铁及其氧化物在自然界中广泛存在,并在环境和工业生产的许多环节中有着广泛、重要的作用。近年来,由于其毒性低、资源丰富、制备成本低和优良的物理化学性能,在光催化、光电化学方面也广受关注。其中Fe2O3是自然环境下最稳定的铁氧化物,属n型半导体,禁带宽度大约为2.2 eV,已经证明Fe2O3作为光阳极可在NaOH溶液中分解水 [1] [2] 。太阳能转化效率可达12%左右 [3] 。通过构建Fe2O3纳米结构能够克服Fe2O3中载流子迁移率低、空穴扩散距离短等一些固有缺陷 [1] ,可进一步提高光催化性能[4] 。通过在Fe2O3中掺杂Pt [5] 、Al [6] 、Zn [7] - [11] 等元素,也能增强Fe2O3的光电化学性能。
在制备纳米Fe2O3薄膜的众多方法中,最简单的方法是将钢铁基底在各种条件下进行加热氧化。如铁片在氧气流下经过10 h的高温热处理,400℃下形成Fe2O3纳米片、700℃下得到Fe2O3纳米带和800℃ Fe2O3纳米线 [12] 。铁片经过短时间的高温处理也可形成纳米结构的Fe2O3和Fe3O4[13] 。Yu等 [14] 在空气中300℃下氧化铁箔或有Fe涂层的基底,在5 h内得到Fe3O4纳米线,12 h后得到Fe2O3纳米线。Vincent等 [15] 用250 μm的铁箔为基底,通过控制气氛、气流、升温速率等方式,在400~800℃范围内制备了多种形貌的Fe3O4和Fe2O3薄膜。
但高温下直接氧化钢铁形成的氧化膜,与基底的结合力一般都较差,而且基底材料的金相结构、表面粗造度等因素对氧化膜的结构和形貌的都有严重的影响 [16] 。另一方面,在许多电解质溶液中,钢铁材料容易与溶液中的氧化性物种反应,在表面形成各种铁化合物的转化膜 [17] 。钢铁经草酸溶液处理后能形成有附着力较好的草酸盐转化膜 [18] [19] 。而铁的草酸盐在一定温度下热分解可得到各种氧化物 [20] - [25] 。焦华等 [26] 通过将草酸溶液滴在铁片上,于空气中加热1 h,在200~500℃和600℃温度下,分别制备出了直径为0.5~0.8 μm的Fe3O4纳米棒和Fe2O3纳米线。为了尽可能消除基底的影响,并在较低的温度下制备与基底结合良好的纳米结构氧化膜,本文采用350℃热分解碳钢表面草酸盐转化膜的方法,制备出与基底结合良好的纯Fe2O3和Zn掺杂Fe2O3纳米线薄膜。分析了氧化膜的组成、形貌和结构,测试了氧化膜的可见光光电化学性能。
2. 实验部分
2.1. 氧化膜的制备
草酸–草酸锌乙醇溶液的配制:称取9.45 g草酸溶于50 mL的无水乙醇,加入2.0 mg氧化锌固体搅拌至完全溶解,草酸和草酸锌的浓度分别为1.5 mol/L和5.0 × 10−4 mol/L。将市售的碳钢裁成2 cm × 4 cm的片状,用金相砂纸磨光、二次水冲洗后,放入无水乙醇中超声清15min,然后置于草酸乙醇溶液中浸泡90 min。浸泡处理后的碳钢片经50℃热风干燥后放入马弗炉中,以10℃/min的升温速率加热至350℃,恒温2 h后自然冷却至室温。所得样品标示为ZFF。在相同条件下,用不含草酸锌的草酸乙醇溶液制备了无Zn掺杂的样品(标示为FF)作为对比。实验中所用试剂均为分析纯试剂。
2.2. 氧化膜的结构、形貌和光电性能表征
样品的结构和形貌分别用XRD (PW 3040/60型X-射线衍射仪,光源为Cu Kα射线,荷兰Phillips公司)、TEM(JEM-2100F型透射电子显微镜,日本电子公司)和SEM (S-4800型高分辨场发射扫描电镜,日本日立公司)进行表征。
通过可见光下的光电流表征样品的光电化学性能。光电流测试采用双电极体系,装置示意见图1。待测样品(照光面积1 cm × 1 cm,其他部分进行避光处理)为工作电极,铂片为对电极。2.5 mol/L NaOH溶液为电解液。用CHI440A电化学工作站(上海辰华仪器公司)在零偏置电压时测试样品的I-t曲线。光源为150 W氙灯(北京纽比特科技有限公司),使用紫外截止滤光片ZJB380滤去氙灯光谱中的紫外光部分。光照前溶液经过通氮气10 min以除去溶解氧。
3. 结果与讨论
3.1. 氧化膜的形貌和结构
图2给出了经350℃热处理后,不同预处理的碳钢的表面SEM形貌。可见未经草酸前处理的碳钢表面呈现较为稀疏且大小不一的纳米片形貌(图1(a))。而经草酸乙醇溶液浸泡的碳钢,表面均呈现出较均匀的直径为100~200 nm纳米线形貌(图2(b)和图2(c))。
由图3的XRD分析结果可见,热氧化后的所有样品都在2θ为44.6、65.0、82.3˚出现对应于Fe基底的(110)、(200)、(211)晶面的衍射峰(JCPDS no. 870721)。说明碳钢表面的氧化膜都较薄。但未经浸泡前处理的碳钢样品(图2(a)),只在2θ为18.2、30.0、35.4、43.0、53.4、56.9、62.5˚出现对应于Fe3O4(111)、(220)、(311)、(400)、(422)、(511)和(440)晶面的衍射峰(JCPDS no. 893854)。表明未经溶液浸泡的碳钢,

Figure 1. Schematic diagram of photoelectric performance testing device
图1. 光电性能测试装置示意图

Figure 2. SEM morphologies of the samples heated in air at 350℃ for 2h (a) unimmersed, (b) immersed in ethanol solution of oxalic acid (FF) and (c) immersed in the solution with ZnO (ZFF)
图2. 样品的SEM表面形貌
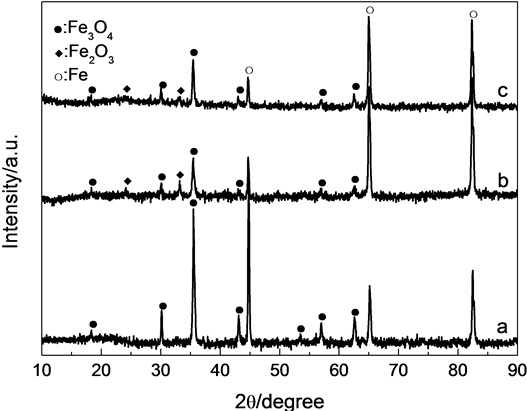
Figure 3. XRD patterns of samples heated in air at 350℃ for 2h unimmersed in ethanol solution of oxalic acid (a), immersed in ethanol solution of oxalic acid (FF, b) and in the solution with ZnO (ZFF, c).
图3. 样品的XRD衍射特征
经350℃加热2 h后表面氧化膜主要是Fe3O4。这与文献报道的结果相一致 [13] 。经过草酸和草酸–草酸锌乙醇溶液浸泡处理的碳钢样品(图3(b)和图3(c)),表面氧化膜的XRD衍射特征基本相同。除了对应基底和Fe3O4的衍射峰外,在2θ为24.1、33.1˚处出现对应于Fe2O3 (012)、(104)晶面的衍射峰(JCPDS no. 892810)。在ZFF中没有检测出ZnO的衍射峰。说明经过浸泡后的碳钢,热处理后表面生成了由Fe2O3和Fe3O4两相构成的复合氧化膜。
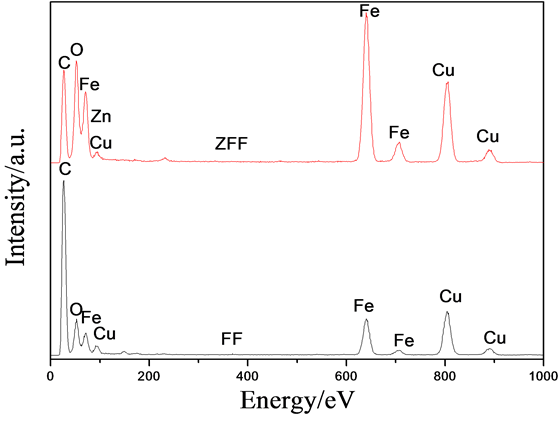
通过TEM分析(图4),可进一步确定碳钢表面形成的纳米线是Fe2O3。FF和ZFF两种样品表面的Fe2O3纳米线,晶体结构基本相同,但对应的傅里叶转换图表明,ZFF中Fe2O3的结构发生了轻微的形变,并不是完好的六方结构,这可能与Zn的掺杂有关。通过EDX分析(图4(c))表明,在ZFF样品的纳米线中除了含Fe和O元素外,还含有Zn元素的存在。由于XRD分析未检测出ZFF中存在 ZnO,可推断ZFF样品的纳米线为Zn掺杂的Fe2O3。FF和ZFF样品中XRD检测出的Fe3O4,应是碳钢基底氧化的产物。根据Grigorescu等 [13] 的研究,铁片在空气中经600℃以上的高温氧化1 h,表面会形成由外层Fe2O3、中间层Fe3O4和底层FeO组成的多层氧化膜。在本文的实验条件下,可以推测经草酸乙醇液处理后,碳钢表面先生成了一层草酸盐转化膜,在后续热处理中转化为Fe2O3纳米线,而草酸盐转化膜底层的部分单
 (a)
(a)
 (b)
(b)
 (c)
(c)
Figure 4. TEM imagines of the samples heated in air at 350 ℃ for 2h (a) immersed in ethanol solution of oxalic acid (FF) and (b) immersed in the solution with ZnO (ZFF); (c) the EDX spectra of (a) and (b)
图4. 样品的TEM图像和EDX图谱
质Fe则氧化生成了Fe3O4。
从XRD、SEM和TEM分析结果可以确定,碳钢经过草酸乙醇溶液浸泡再加热处理,在表面生成了Fe2O3纳米线和底层Fe3O4构成的复合氧化膜。未经浸泡处理的碳钢表面则生成纳米片状的Fe3O4膜。与文献 [12] - [15] [26] 报道的各种方法相比,本文的制备条件更为温和及可控。
碳钢表面草酸盐转化膜热分解后形成Fe2O3纳米线的原因,可能与草酸盐的结晶特性有关。Ashrafi等 [19] 报道,在草酸溶液中对碳钢进行阳极氧化,一定电位范围内,可在表面形成纳米棒状结构的草酸盐转化膜。在本文实验条件下,碳钢浸泡在草酸乙醇溶液的过程中,Fe将与草酸作用生成FeC2O4∙xH2O。而草酸乙醇溶液中加入的微量ZnO,将与草酸反应生成ZnC2O4,在Fe与草酸反应的同时,可能还生成少量的ZnFe2(C2O4)3∙xH2O [20] [21] 。由于FeC2O4∙xH2O和ZnFe2(C2O4)3∙xH2O的溶解度都很小,容易在碳钢表面成核结晶并按其晶体生长习性形成纳米线结构的草酸盐转化膜。转化膜受热分解后形成了纳米线Fe2O3[23] [25] 和Zn掺杂的Fe2O3。
3.2. 薄膜的光电化学性能
图5是在2.5 mol/L NaOH溶液中,三种热氧化制备的样品在零偏压和可见光照射下的光电流测试结

Figure 5. Photocurrent measured at zero-bias in 2.5 mol/L NaOH solution under visible light for various samples heated in air at 350 ℃ for 2h (a) unimmersed, (b) immersed in ethanol solution of oxalic acid(FF) and (c) immersed in the solution with ZnO (ZFF)
图5. 样品的光电流—时间曲线
果。可见在相同热处理条件下,所得样品均产生阳极光电流,显示出n型半导体的特性 [27] 。但未经草酸乙醇溶液前处理的碳钢,表面氧化膜产生的光电流仅为0.03 μA/cm2(图5(a))。这可能是由于其表面的氧化膜主要组成是光电响应性能低的Fe3O4[28] 。经草酸乙醇溶液浸泡的样品FF,光电流增加到0.1 μA/cm2(图5(b))。经草酸–草酸锌乙醇溶液浸泡的样品ZFF,光电流进一步提高到0.3 μA/cm2。比前两个样品的光电流分别增加了10倍和3倍。另外,在光照起止的瞬间,FF和ZFF样品的光电流–时间曲线上都会相应出现阳极脉冲电流和阴极脉冲电流。这种现象在文献中已有报道 [29] [30] 。Cummings等 [30] 认为,当光照射的瞬间由于有大量的空穴进入到电极表面,因而出现很大的阳极光电流脉冲,随后空穴被俘获或者复合达到平衡,光电流趋于稳定;在停止光照射的瞬间由于有空穴在表面态重组,同时有大量电子进入电极表面,因而出现很大的阴极光电流脉冲。
光电流测试结果表明,热分解草酸转化膜制备的纳米线氧化膜,具有更好的可见光光电化学性能。这是因为,草酸盐转化膜前驱体制备的氧化膜具有纳米线的形貌,而且氧化膜由Fe2O3和Fe3O4两相构成。Fe2O3具有较高的光电活性,Fe3O4与Fe2O3复合后,Fe3O4可充当一个良好的背接触 [16] ,有利于将光生电子传递到背电极,减少光生电子与空穴间的复合几率,提高了材料光电化学性能。当Fe2O3纳米线中掺杂少量的Zn,可以减少Fe2O3薄膜的电阻率,还可能形成少量的ZnFe2O4[7] ,可进一步提高Fe2O3薄膜的光电化学性能 [31] 。对于草酸–草酸锌乙醇溶液的浓度等因素对碳钢表面氧化膜的结构、形貌和性能的影响,正在进行系统的实验分析中。
4. 结论
经过草酸乙醇溶液浸泡,使碳钢表面生成草酸盐转化膜前驱体,再经空气中350℃热处理,制备出Fe2O3纳米线薄膜。草酸乙醇溶液中加入微量的ZnO,可制备出Zn掺杂的Fe2O3纳米线氧化膜。氧化膜与基底结合良好,纳米线直径为100 nm左右。氧化膜在零偏置电压、可见光照射时显示n型半导体特征的阳极光电流。Zn掺杂的Fe2O3纳米线氧化膜具有更优良的光电化学性能。
致谢
感谢国家自然科学基金(21173196)对本文研究工作的资助。
文章引用
马荣伟,罗晶晶,张 南,邵 辰,范旭良,周小顺,牛振江, (2014) 碳钢表面Zn掺杂Fe2O3纳米线的制备及其可见光光电化学性能
Preparation of Zn-Doped Fe2O3
Nanowires on Carbon Steels and Their
Photoelectrochemical Performance under Visible Light. 纳米技术,02,23-30. doi: 10.12677/NAT.2014.42005
参考文献 (References)
- 1. Sivula, K., Le Formal, F. and Gratzel, M. (2011) Solar water splitting: Progress using hematite α-Fe2O3 photoelectrodes. ChemSusChem, 4, 432-449.
- 2. Kay, A., Cesar, I. and Grätzel, M. (2006) New benchmark for water photooxidation by nanostructured α-Fe2O3 films. Journal of the American Chemical Society, 128, 15714-15721.
- 3. Murphy, A., Barnes, P., Randeniya, L., Plumb, I., Grey, I., Horne, M. and Glasscock, J. (2006) Efficiency of solar water splitting using semiconductor electrodes. International Journal of Hydrogen Energy, 31, 1999-2017.
- 4. Rahman, G. and Joo, O.S. (2013) Facile preparation of nanostructured α-Fe2O3 thin films with enhanced photoelectrochemical water splitting activity. Journal of Materials Chemistry A, 1, 5554-5561.
- 5. Cha, H. G., Song, J., Kim, H.S., Shin, W., Yoon, K.B. and Kang, Y.S. (2011) Facile preparation of Fe2O3 thin film with photoelectrochemical properties. Chem Commun (Camb), 47, 2441-2443
- 6. Kleiman-Shwarsctein, A., Huda, M.N., Walsh, A., Yan, Y., Stucky, G.D., Hu, Y.-S., Al-Jassim, M.M., McFarland, E.W. (2009) Electrodeposited aluminum-doped α-Fe2O3 photoelectrodes: Experiment and theory. Chemistry of Materials, 22, 510-517.
- 7. Ingler Jr., W.B., Baltrus, J.P. and Khan, S.U. (2004) Photoresponse of p-type zinc-doped iron(III) oxide thin films. Journal of the American Chemical Society, 126, 10238-10239
- 8. Kumari, S., Tripathi, C., Singh, A.P., Chauhan, D., Shrivastav, R., Dass, S. and Satsangi, V.R. (2006) Characterization of Zn-doped hematite thin films for photoelectrochemical splitting of water. Current Science, 91, 1062-1064.
- 9. Kumari, S., Singh, A. P., Tripathi, C., Chauhan, D., Dass, S., Shrivastav, R., Gupta, V., Sreenivas, K. and Satsangi, V.R. (2007) Enhanced photoelectrochemical response of Zn-dotted hematite. International Journal of Photoenergy, 2007, Article ID: 87467.
- 10. Nikolic, M., Slankamenac, M., Nikolic, N., Sekulic, D., Aleksic, O., Mitric, M., Ivetic, T., Pavlovic, V. and Nikolic, P. (2012) Study of dielectric behavior and electrical properties of hematite α-Fe2O3 doped with Zn. Science of Sintering, 44, 307-321.
- 11. Qi, X., She, G., Wang, M., Mu, L. and Shi, W. (2013) Electrochemical synthesis of p-type Zn-doped alpha-Fe2O3 nanotube arrays for photoelectrochemical water splitting. Chemical Communications (Cambridge, England), 49, 57425744
- 12. Wen, X., Wang, S., Ding, Y., Wang, Z.L. and Yang, S. (2004) Controlled growth of large-area, uniform, vertically aligned arrays of α-Fe2O3 nanobelts and nanowires. The Journal of Physical Chemistry B, 109, 215-220.
- 13. Grigorescu, S., Lee, C.Y., Lee, K., Albu, S., Paramasivam, I., Demetrescu, I. and Schmuki, P. (2012) Thermal air oxidation of Fe: Rapid hematite nanowire growth and photoelectrochemical water splitting performance. Electrochemistry Communications, 23, 59-62.
- 14. Yu, T., Sow, C., Xu, X., Zhu, Y., Lim, C. T. and Thong, J. (2007) Formation of α-Fe2O3 nanoflakes by heating Fe in air. Solid State Phenomena, 121, 45-48.
- 15. Vincent, T., Gross, M., Dotan, H. and Rothschild, A. (2012) Thermally oxidized iron oxide nanoarchitectures for hydrogen production by solar-induced water splitting. International Journal of Hydrogen Energy, 37, 8102-8109.
- 16. Yuan, L., Cai, R., Jang, J.I., Zhu, W., Wang, C., Wang, Y. and Zhou, G. (2013) Morphological transformation of hematite nanostructures during oxidation of iron. Nanoscale, 5, 7581-7588.
- 17. 蔡丽丽, 郭瑞光, 牛林清, 马建青, 唐长斌, 张建锋 (2011) 氧化剂对钢铁表面氟铁酸盐转化膜的影响. 电镀与涂饰, 30, 31-34.
- 18. Sekine, I. and Okano, C. (1989) Corrosion behavior of mild steel and ferritic stainless steels in oxalic acid solution. Corrosion, 45, 924-932.
- 19. Ashrafi, A., Golozar, M. A. and Mallakpour, S. (2007) EIS investigation of passive film formation on mild steel in oxalic acid solution. Journal of Applied Electrochemistry, 38, 225-229.
- 20. Jia, Z., Ren, D., Liang, Y. and Zhu, R. (2011) A new strategy for the preparation of porous zinc ferrite nanorods with subsequently light-driven photocatalytic activity. Materials Letters, 65, 3116-3119.
- 21. Zhu, H., Gu, X., Zuo, D., Wang, Z., Wang, N. and Yao, K. (2008) Microemulsion-based synthesis of porous zinc ferrite nanorods and its application in a room-temperature ethanol sensor. Nanotechnology, 19, 405503.
- 22. Wang, M., Ai, Z. and Zhang, L. (2008) Generalized preparation of porous nanocrystalline ZnFe2O4 superstructures from zinc ferrioxalate precursor and its superparamagnetic property. The Journal of Physical Chemistry C, 112, 1316313170.
- 23. Rao, V., Shashimohan, A.L. and Biswas, A.B. (1974) Studies on the formation of γ-Fe2O3 (maghemite) by thermal decomposition of ferrous oxalate dihydrate. Journal of Materials Science, 9, 430-433.
- 24. Boyanov, B., Khadzhiev, D. and Vasilev, V. (1985) Study of thermal decomposition of FeC204•2H20. Thermochimica Acta, 93, 89-92.
- 25. 唐万军, 陈栋华 (2007) 二水草酸亚铁热分解反应动力学. 物理化学学报, 4, 605-608.
- 26. 焦华, 杨合情 (2009) Fe3O4纳米棒和 Fe2O3纳米线的热氧化制备与表征. 中国科学: B , 1, 39-45.
- 27. McShane, C.M. and Choi, K.S. (2009) Photocurrent enhancement of n-type Cu2O electrodes achieved by controlling dendritic branching growth. Journal of the American Chemical Society, 131, 2561-2569.
- 28. Hu, X.D., Zhang, H.Q. and Cao, D.M. (2011). Synthesis of Fe3O4 nanocrystals and application in photocatalytic degradation of levofloxacin lactate. Materials Science Forum, 688, 376-382.
- 29. Wilhelm, S.M., Yun, K.S., Ballenger, L.W. and Hackerman, N. (1979) Semiconductor properties of iron oxide electrodes. Journal of the Electrochemical Society, 126, 419-424.
- 30. Cummings, C.Y., Marken, F., Peter, L.M., hir, A.A. and Wijayantha, K.G. (2012) Kinetics and mechanism of light-driven oxygen evolution at thin film alpha-Fe2O3 electrodes. Chemical Communications (Cambridge, England), 48, 2027-2029.
- 31. Satsangi, V.R. (2007) Metal oxide semiconductors in PEC splitting of water. Society of Photo-Optical Instrumentation Engineers (SPIE) Conference Series, 6650, 9.