Hans Journal of Nanotechnology
Vol.
13
No.
04
(
2023
), Article ID:
76240
,
13
pages
10.12677/NAT.2023.134010
纳米递送系统在肿瘤免疫治疗中的应用
袁豪华1,李林照1*,聂瑛洁2,桂欢1
1贵州大学医学院,贵州 贵阳
2贵州省人民医院肺部免疫疾病重点实验室,贵州 贵阳
收稿日期:2023年10月20日;录用日期:2023年11月17日;发布日期:2023年11月29日

摘要
免疫疗法已成为治疗癌症的有力临床策略。免疫治疗药物批准的数量一直在增加,在临床和临床前开发中出现了许多治疗方法。然而,广泛实施癌症免疫疗法的一个关键挑战仍然是免疫系统的受控调节,因为这些疗法具有严重的副作用,包括自身免疫和非特异性炎症。先进的生物材料和药物输送系统,例如纳米颗粒和使用T细胞进行治疗,可以有效地利用免疫疗法并提高其效力,同时减少毒副作用。在这里,我们讨论了这些研究进展,以及将纳米递送技术运用于肿瘤免疫治疗中机遇与挑战以及应用,以改善肿瘤免疫治疗的不足。
关键词
肿瘤,纳米递送,免疫治疗,理化性质

Application of Nano-Delivery System in Tumor Immunotherapy
Haohua Yuan1, Linzhao Li1*, Yingjie Nie2, Huan Gui1
1Medical College of Guizhou University, Guiyang Guizhou
2NHC Key Laboratory of Pulmonary Immunological Diseases, Guizhou Provincial People’s Hospital, Guiyang Guizhou
Received: Oct. 20th, 2023; accepted: Nov. 17th, 2023; published: Nov. 29th, 2023

ABSTRACT
Immunotherapy has become a powerful clinical strategy for the treatment of cancer. The number of approved immunotherapy drugs has been increasing, and many treatments have emerged in clinical and preclinical development. However, a key challenge to the widespread implementation of cancer immunotherapy remains the controlled regulation of the immune system, as these treatments have serious side effects, including autoimmunity and non-specific inflammation. Advanced biomaterials and drug delivery systems, such as nanoparticles and treatment with T cells, can effectively use immunotherapy and improve its effectiveness while reducing side effects. Here, we discuss the research progress, as well as the opportunities, challenges and applications of nano- delivery technology in tumor immunotherapy in order to improve the shortcomings of tumor immunotherapy.
Keywords:Tumour, Nano-Delivery, Immunotherapy, Physicochemical Properties

Copyright © 2023 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
肿瘤免疫疗法目前已经被认为是治疗癌症的有力的策略 [1] 。检查点抑制剂是迄今为止研究最彻底的一类免疫治疗,经典的抗PD-1和抗CTLA4疗法已经被人们所熟知。目前为止,5种PD-1或PD-L1抑制剂和1种CTLA4抑制剂已被批准用于治疗各种癌症,与传统化疗相比,总生存率有所提高,许多涉及检查点抑制剂联合化疗或其他靶向药物的试验正在进行中 [2] [3] [4] 。但是其存在一些缺点,例如:① 可能对许多器官产生严重的副作用;② 许多患者对检查点抑制剂的治疗没有反 [5] [6] 。
因此,为了解决以上问题,可以开发这些疗法的递送技术,目的为实现靶向和可控释放,从而使免疫治疗在所需的细胞类型中活跃,尽量减少脱靶效应。通过有效地激活肿瘤组织中的固有免疫应答,将“冷”肿瘤转变为“热”肿瘤,有望实现肿瘤从免疫不响应到免疫响应的转 [7] 。
2. 研究背景
根据Cancer杂志发布的最新的癌症数据显示:国际癌症研究机构(IARC)对2020年全球癌症发病率和死亡率统计,在世界范围内,估计有1930万新的癌症病例和近1000万例癌症死亡。到2040年,全球癌症病例预计增加到2840万 [8] [9] 。因此,越来越多的人开始重视癌症。
传统的肿瘤治疗方法分为:化疗,放射,手术。传统的化学疗法和放射疗法对癌症的治疗效果有限,并且这些方法与严重的副作用和高复发风险有关。近年来,免疫治疗药物在临床癌症治疗中取得了可喜的成果,因此引起了全世界临床医生和癌症患者的密切关注 [10] 。肿瘤免疫治疗是继传统治疗方法后快速发展的新一代肿瘤治疗方法,具有巨大的临床应用前景。尽管临床上的免疫肿瘤治疗取得了巨大的成功,但存在于淋巴细胞不足和耗尽的“冷”肿瘤中的免疫抑制肿瘤微环境(TME)可能导致治疗效率低于预期 [11] 。同时这些免疫治疗都存在不同程度的免疫逃避现象,也就是激活的免疫细胞识别不了肿瘤细胞,降低了免疫治疗的效果 [12] 。癌细胞使用的免疫逃逸策略被认为是所有癌症免疫疗法的主要障碍,并为肿瘤进展和免疫耐受提供了有利的背景。肿瘤细胞的内在免疫逃逸机制,包括MHC分子的下调、热休克蛋白的高表达以及抗原性和免疫原性的变化,可以显着抑制肿瘤细胞凋亡和T细胞活化 [13] [14] 。因此,应考虑设计合理的协同策略,有效地将“冷”肿瘤转变为“热”,以提高免疫肿瘤治疗的疗效。此外,肿瘤免疫抑制微环境还抑制各种效应淋巴细胞的功能,并允许肿瘤细胞逃避免疫系统的监视,最终导致免疫逃逸的发生。同时,在治疗过程中肿瘤免疫治疗也会有其副作用以及不良反应,并且响应率低,具体情况视个人体质而定 [15] 。然而,不良副作用和免疫抑制肿瘤微环境阻碍了这些策略的有效性。
因此,为了解决以上问题,可以开发这些疗法的递送技术,目的为实现靶向和可控释放,从而使免疫治疗在所需的细胞类型中活跃,尽量减少脱靶效应。通过有效地激活肿瘤组织中的固有免疫应答,将“冷”肿瘤转变为“热”肿瘤,有望实现肿瘤从免疫不响应到免疫响应的转变 [16] 。
本文将从肿瘤免疫治疗入手,讲述纳米递送系统的作用机制、影响因素以及在肿瘤免疫治疗中的应用与挑战。
3. 肿瘤免疫治疗
肿瘤免疫治疗是利用免疫学原理和方法,激活和增强机体免疫系统识别、攻击和清除肿瘤细胞的能力,抑制肿瘤生长 [17] 。根据不同的作用方式,癌症免疫治疗有不同的分类。可以根据其作用机制将其分为“被动”免疫疗法和“主动”免疫疗法 [18] 。
3.1. “被动”免疫疗法
“被动”疫疗法针对的是肿瘤细胞本身,指给机体输注外源的免疫效应物质,由这些外源性效应物质在机体内发挥治疗肿瘤作用,也可以发挥直接的抗肿瘤作用 [19] 。主要分为抗体靶向疗法及其衍生物(如抗体–药物偶联物),过继性免疫细胞疗法、最新的基因工程T细胞(嵌合抗原受体[CAR]-T,T细胞受体[TCR]-T等) [20] 。其中过继性细胞疗法,单克隆抗体在肿瘤治疗中发展的较为成熟,该疗法的特点为不十分依赖于宿主本身的免疫功能状态,弥补了“主动”免疫疗法的缺陷,即使在宿主免疫功能低下状态,仍能以较快的速度的发挥治疗作用 [21] 。
3.1.1. 单克隆抗体
单克隆抗体治疗在临床肿瘤学中变得越来越重要。FDA已经批准了十几种mAb用于治疗实体瘤和血液系统恶性肿瘤,目前正在研究更多新的mAb临床试验 [21] [22] 。这些抗体特异性抑制肿瘤生长中的信号通路和/或诱导针对肿瘤细胞的免疫反应。通过结合单克隆抗体,可以同时靶向多种途径,多种单克隆抗体联合使用与单一单克隆抗体使用时相比可以产生协同作用,可能产生抗肿瘤的效果,同时有可能产生相反的作用 [23] 。总之,已发表的研究结果各不相同,具体取决于抗体、适应症和患者群体的组合。需要更多的临床前和临床研究来揭示联合单克隆抗体的协同或拮抗作用背后的机制 [24] 。大多数联合疗法的研究仍处于早期阶段,但预计对于几种肿瘤类型,抗体联合疗法的使用将在不久的将来成为标准治疗 [25] 。
3.1.2. 过继性细胞疗法
过继性免疫治疗(Adoptive Cell Transfer Therapy, ACT),是指从肿瘤患者体内分离免疫活性细胞,在体外进行扩增和功能鉴定,然后向患者回输,从而达到直接杀伤肿瘤或激发机体的免疫应答杀伤肿瘤细胞的目的 [26] 。
3.2. “主动”免疫疗法
“主动”免疫疗法针对的是机体的免疫系统,指给机体输入具有抗原性的瘤苗,刺激机体免疫系统产生抗肿瘤免疫以治疗肿瘤的方法。该法应用的前提是肿瘤抗原能刺激机体产生免疫反应。此种方法对地手术后清除微小的转移瘤灶和隐匿瘤、预防肿瘤转移和复发有较好的应用效 [27] 。主要涉及到一些肿瘤疫苗,例如抗原疫苗、以树突状细胞(Dendritic cells, DC)为基础的疫苗等,但目前大多数仍然在实验验证中,其安全性还未得到完全的验证,还需进一步完成临床试验。
在大部分患者中,这些增强策略确实为免疫激活过程提供了必要的措施。因此,这些患者可以从这种治疗中获益。然而,“主动”免疫疗法并非对每个患者都适用,例如一些免疫缺陷的患者。但这些策略可能只是免疫系统的一般激活剂,增加了针对肿瘤的免疫反应,但也将免疫系统推至超生理水平,随后增加了免疫相关不良事件(irAEs)的风险。这可能解释了增强免疫治疗期间免疫不应答的原因。“主动”免疫疗法可以通过以下几种策略增加免疫反应:
1) 增强抗原呈递细胞(APC)对抗原的摄取,加工和呈递给T细胞。如I型干扰素(IFNs),Toll样受体(TLR)激动剂和干扰素基因(STINGs)激动剂;
2) 增强未分化T细胞(naive T cells)的活化和扩增:例如树突细胞疫苗和抗细胞毒性T淋巴细胞抗原-4 (CTLA-4)单克隆抗体(CTLA-4和PD-1共享2018诺贝尔奖)
3) 强化免疫应答的效应阶段:使用离体刺激和扩增的肿瘤浸润T细胞(TILs,能渗透肿瘤内的T细胞)输注回癌症患者的过继细胞疗法。
4. 纳米递送
尽管癌症免疫治疗取得了重大的进展,但免疫疗法的临床应用仍面临着与疗效和安全性相关的若干挑战。在疗效方面,由于半衰期短、肿瘤穿透性有限、个体差异、靶标行为低、稳定性等原因,因此很难预测患者的反应 [28] 。最近,几种免疫疗法,包括用于检查点阻断的激活细胞因子和单克隆抗体,已被FDA批准用于实体瘤治疗 [29] 。值得注意的是,CAR T细胞疗法尚未被FDA批准用于实体瘤,但研究人员正在开发对实体瘤细胞具有高度特异性的CAR T细胞 [30] [31] 。在安全性方面,免疫疗法会在一些患者中诱发自身免疫性副作用,从而导致对健康组织的攻击。正如IL-2治疗所观察到的,许多免疫疗法会导致细胞因子释放综合征和血管渗漏综合征,从而导致严重的低血压、发烧、肾功能不全和其他可能致命的不良反应 [32] [33] [34] 。
尽管已经确定了一些免疫调节剂在将“冷”肿瘤转变为具有更强免疫原性的“热”肿瘤方面的关键作用,但临床应用的效果和安全性仍然是一个问题。在安全性方面,大剂量时,一些患者会出现细胞因子释放综合征、自身免疫性疾病、免疫抑制细胞聚集,甚至其他致命的副作用 [15] 。因此,需要探索替代和有效的递送策略,以减少全身给药免疫调节剂的副作用并最大限度地提高治疗效果,从而提高反应率并尽快转化为临床应用 [35] [36] 。
近年来,多种纳米材料辅助免疫调节疗法已被证明可以实现免疫调节剂的靶向递送,以较低剂量放大免疫反应,并有效降低全身毒性 [37] [38] 。各种纳米载体,包括聚合物纳米颗粒(聚合物纳米颗粒)、脂质体、介孔二氧化硅纳米粒子(MSNs)和膜伪装纳米粒子(MCNPs)已成为旨在持续局部给药的智能给药平台的重点。纳米材料显著延长免疫调节剂的循环时间并提高其体内稳定性和生物利用度。此外,递送系统可以增加治疗药物在肿瘤组织中的积累,并最大限度地减少非靶位点的脱靶毒性。改善体内药代动力学行为,从而增强治疗效果并减少副作用。由于其特殊的物理化学性质可以对肿瘤微环境(TME)进行重新编程,从而增强免疫系统 [39] 。此外,表面修饰的纳米材料可用于更精确地靶向特定细胞(树突状细胞、肿瘤相关细胞,例如巨噬细胞等),传递免疫调节有效载荷,从而不断调节T细胞介导的适应性免疫反应的强度。因此,基于纳米材料的免疫调节剂传递正成为一种有前途的策略,并且与光动力疗法(PDT)、光热疗法(PTT)、放射疗法(RT)、化学疗法或ICB等联合治疗,可以获得更好的疗效 [40] 。NDDS为癌症化学免疫治疗提供了有前景的策略,因为它们很容易被免疫细胞内化,并且由于特殊的物理和化学性质可以重新教育TME,从而增强免疫系统 [35] 。此外,NDDS可以增加药物的溶解度和生物利用度,通过被动或主动靶向延长药物的循环时间 [41] [42] [43] [44] 。
4.1. 递送策略
纳米材料在肿瘤组织的特异性富集是肿瘤活体无损诊断和靶向治疗的前提 [45] 。其主要通过两种机制实现,一种是被动靶向,即利用增强渗透和滞留(EPR)效应;另一种是主动靶向,即在纳米材料上装载肿瘤标志分子的识别配体 [46] 。
4.1.1. 被动靶向
被动蓄积系统包括静脉内或皮下给药的注射剂,其保留在体循环中并逐渐积聚在肿瘤部位 [47] 。EPR效应,即实体瘤的高通透性和滞留效应(Enhanced permeability and retention effect)指的是,相对于正常组织,某些尺寸的分子或颗粒更趋向于聚集在肿瘤组织的性质。
将EPR效应与血流动力学和扩散机制相结合,有助于延长血液循环和NPs在肿瘤中的积累。然而,被动靶向有许多缺点。由于内皮网状系统的清除功能,颗粒在不同器官的次优分布是有效递送的主要障碍。此外,由于个体肿瘤内的异质性和血管通透性差异,EPR效应的程度因肿瘤而异,甚至在肿瘤内也不同 [48] 。此外,肿瘤内较高的压力差导致纳米从内部区域流向外部区域,进一步加剧了这一问题 [49] 。在靶向递送中必须解决两个主要挑战:进一步延长血液循环时间并使纳米具有特定的靶向位点以进行细胞内递送。因此,需要努力将被动靶向与更动态的方法进行协同作用,进一步改善被动靶向的不足之处。
4.1.2. 主动靶向
即使EPR效应改善了生物分布,由于单核吞噬细胞的清除,大部分治疗剂(超过90%)将不可避免地集中在肝和脾等网状内皮器官中 [50] 。正在探索主动靶向作为一种实现空间定位的方法,该方法有目地的将NPs引导到活跃的病变部位,同时消除正常组织中的脱靶副作用。用配体对NP表面进行修饰可以促进与靶细胞中特异性过度表达的生物标志物相结合,并触发受体介导的内吞作用(图1),这一过程对靶向递送具有重要意义 [51] 。用于修饰纳米的配体包括抗体、工程抗体片段、蛋白质、肽、小分子和适体 [52] 。特定的配体–受体相互作用可用于在体内将治疗性纳米药物集中在患病组织中,从而产生优选的分布曲线 [3] [53] 。配体密度可以在配方过程中进行微调,以优化亲合力 [10] [54] 。
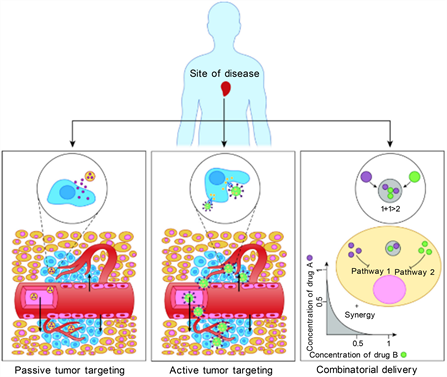
Figure 1. The relationship between nanometer and ligand binding
图1. 纳米与配体结合作用的关系
4.2. 纳米载体
用于肿瘤免疫治疗递送的纳米载体根据其物理化学性质不同可以分为:脂质体、聚合物胶束、树状聚合物、金属和无机纳米粒子、纳米凝胶、仿生纳米粒子。
4.2.1. 脂质体
脂质体是由磷脂和胆固醇组成的双层囊泡,具有包封率高、靶向性强、毒性低等优点,在工业化生产中具有广阔的前景。免疫治疗剂,如抗原和佐剂,可以封装在疏水核心中或通过试剂与脂质之间的电荷相互作用或与脂质双层的化学接头吸附在脂质表面上 [55] 。同时,亲水性小分子化学治疗剂可以封装在内部水核中,其中疏水剂可以封装在脂质双层中 [50] 。
脂质体在癌症治疗中得到了很好的应用,多种脂质体产品获批。同时,脂质体也被广泛研究作为发挥化学免疫疗法最大功效的载体。陈等人开发了pH和基质金属蛋白酶(MMPs)双响应脂质体(LPDp)与PD-L1抑制剂偶联物与低剂量化疗多柔比星(DOX)相结合,以实现增强的抗肿瘤功效 [56] 。
4.2.2. 聚合物胶束
聚合物胶束是由两亲嵌段共聚物自组装形成的热力学稳定的胶体溶液 [57] 。疏水性小分子药物可以被包裹在胶束的疏水核心中,亲水性药物可以通过物理相互作用或化学共轭负载 [58] 。载有Genexol®的PTX和载有Nanoxel®的多西紫杉醇(DTX)已被批准用于癌症治疗。聚合物胶束已在癌症化学免疫疗法中得到广泛评估。此外,通过对聚合物材料表面进行修饰,可以得到多功能聚合物胶束,可以有效地包装亲水或疏水药物,并保护其在体外和体内不被降解。聚乳酸–羟基乙酸共聚物(PLGA)和聚乳酸(PLA)是FDA批准的具有可生物降解和生物相容性特征的聚合物材料 [59] [60] [61] 。由PLGA/PLA制备的聚合物胶束已被评估为化学免疫疗法中的药物载体 [62] [63] 。例如,周等人 [64] 开发了一种PLGA-PEG胶束共递送全反式维甲酸(ATRA)和PD-L1mAb,用于治疗口腔发育不良和口腔鳞状细胞癌。体内抗肿瘤试验表明,ATRA-PLGA-PEG-PD-L1比游离ATRA具有更好的治疗效果,并且治疗后TME中激活了CD8+T细胞。还探索了其他多功能聚合物胶束以提高化学免疫疗法的功效。
4.2.3. 树状聚合物
树枝状聚合物是由疏水中心核、支化单体和功能性外围基团形成的超支化球形聚合物 [65] 。凭借树枝状大分子独特的结构特征,例如结构清晰、接近单分散、易于多功能和多价,已经设计了许多基于树枝状大分子的新型纳米粒子并引起了科学界的关注 [66] [67] 。疏水中心核心可以装载小分子药物,功能性外围基团可以化学连接免疫治疗剂,如治疗性抗体。目前,应用最广泛的树枝状大分子是聚酰胺胺(PAMAM)、聚丙烯亚胺(PEI)和肽树枝状大分子。目前,一些树枝状大分子已经进入癌症免疫治疗的临床试验,它们在化学免疫治疗中也具有很高的应用前景 [54] 。有研究 [68] 通过共同加载DOX和CpG设计了一种基于PAMAM的化学免疫疗法NPs (LMWH/PPD/CpG)用于治疗转移性黑色素瘤。DOX通过pH敏感的腙键(PPD)与氨基封端的PAMAM树枝状大分子结合。LMWH/PPD/CpG是由带负电的低分子量肝素(LMWH)涂层在PAMAM表面形成的。LMWH/PPD/CpG显示出增强的体内免疫反应和增强的抗黑色素瘤抗肿瘤功效。
4.2.4. 金属和无机纳米粒子
金属和无机纳米粒子作为药物载体具有良好的载药能力、功能化可行性和无免疫原性等优点。已经研究了大量用于化学免疫疗法的金属和无机纳米粒子,包括基于氧化石墨烯的纳米粒子(GO NPs)、介孔二氧化硅纳米粒子(MSN NPs)、黑磷(BP)纳米粒子、金纳米粒子(Au NPs)、铜衍生纳米粒子(Cu NPs)等。以BP为例,BP是二维材料的新成员,具有波纹结晶和织构特性的非金属层状半导体。独特的结构使BP具有比表面积大、机械柔韧性好、光热转化效率高、生物相容性好、可生物降解等特殊性能。
BP在光声成像、光热疗法、光动力疗法和化学免疫疗法的载药方面显示出良好的前景 [51] 。
4.2.5. 纳米凝胶
纳米凝胶具有纳米级水凝胶支架、良好的生物相容性、高含水量以及与各种治疗剂(如小分子药物和生物大分子)的良好相容性,被认为是有效化学免疫治疗的有前途的NDDS。多功能纳米凝胶可通过靶向配体修饰、合成响应功能键等合理设计用于化学免疫疗法 [69] 。
4.2.6. 仿生性纳米粒子
仿生NPs旨在通过涂覆或混合生物相容性材料来模仿自然生物体/结构,这可以将NPs伪装成自体成分以逃避免疫系统的清除。仿生纳米粒子具有天然结构(如红细胞、外泌体)的形态、表面性质和大小,具有增强的靶向能力,可将药物递送至靶细胞或组织,具有良好的生物相容性,提高治疗效率并减少副作用。目前,仿生NPs的细胞膜主要包括红细胞、白细胞、血小板、中性粒细胞、巨噬细胞、T淋巴细胞、干细胞和肿瘤细胞 [70] 。不同的细胞膜使仿生NPs在癌症治疗中具有不同的功能。红细胞膜仿生纳米粒子可以提高生物相容性和生物降解性,延长血液循环 [71] 。
4.3. 纳米药物的理化性质
纳米药物的粒径、形态、电荷、溶解度、亲和力和其他特性决定了药物的递送。因此,需要将其理化性质与药物动力学相结合,实现药物的有效地送。
4.3.1. 粒度
纳米药物的粒径、形态、电荷、溶解度、亲和力和其他特性决定了药物的递送。小尺寸纳米药物通常比大尺寸药物具有更深的肿瘤穿透 [72] ,但在许多报道中,不同尺寸的亚100 nm颗粒的积累趋势不同 [73] 。研究表明,与较大的纳米药物相比,30 nm的大分子胶束在胰腺肿瘤中具有更高的组织穿透性和抗肿瘤活性 [74] 。与20 nm或更大的纳米颗粒相比,50 nm的二氧化硅纳米颗粒在乳腺肿瘤中表现出更深的组织穿透和更高的聚集 [75] ,这表明更小的尺寸并不总是有利的。
此外,纳米药物的大小可能会影响细胞摄取、药物分布、细胞毒性和免疫反应。例如,约1000 nm的石墨烯倾向于通过吞噬作用进入细胞,而尺寸为200 nm的石墨烯倾向于通过网格蛋白介导的内吞作用(CME)进入细胞 [76] 。尺寸小于2 nm的金纳米粒子可穿透核膜并诱导强烈的细胞毒性。当金纳米粒子的粒径大于10 nm时,其细胞毒性降低 [77] [78] [79] 。与较大尺寸的纳米药物相比,尺寸在20 nm到200 nm之间的纳米药物会引起更强的免疫反应 [80] 。但需要注意的是,在纳米药物的制备过程中,一些研究人员使用220 nm或450 nm过滤注射器去除杂质和直径较大的纳米颗粒,从而降低了平均直径。过滤后,纳米药物可能会丢失,从而导致有效载荷和截留效率发生变化。在细胞实验中,纳米药物溶解在介质中,与蒸馏水不同,其粒径可能会发生变化,都会导致与初始测量结果不同。在细胞毒性实验中,化疗药物的浓度往往很低。假设一种药物的分子量为1000 (抗肿瘤药物的分子量通常小于此),制剂载药量为20%,药物浓度为1 uM,那么纳米药物的浓度为5 ug/ml。一些胶束中的临界胶束浓度高于此浓度,类似于一些共聚物 [81] 。因此,对于柔性纳米药物,浓度变化时尺寸分布会发生变化。对于刚性纳米药物,如二氧化硅纳米粒子,它们会在高浓度下聚集,稀释后会分散。它们的粒径也会受到影响。在动物实验中,剂量增加。即使配方得到优化,给药时也应考虑溶液的体积。因此,当浓度发生变化时,粒径也可能发生变化,尤其是对于柔性纳米药物。换言之,对于CMC值较高的纳米胶束或聚合物–药物偶联物,颗粒大小和形状的影响只在注射后几分钟就存在,在血液循环过程中可能不会影响大小和形态。柔性纳米药物的治疗益处可能不依赖于它们的纳米颗粒。由于药物代谢迅速,纳米材料的生物相容性和生物降解性的影响可能会在数周后出现 [82] 。这就是为什么一些市场上的胶束制剂 [83] ,例如紫杉醇-Paclical®、Nanoxel®和Genexol-PM®,通过静脉滴注连续给药。
小鼠肿瘤模型中的单次给药与静脉滴注完全不同。这是因为当纳米药物的直径远大于分子的直径时,它们不能快速扩散,从而减慢了它们的代谢速度,增加了它进入肿瘤的概率。然而,EPR效应或进入肿瘤的扩散能力由于其较大的粒径而受到限制。因此,合理降低纳米药物的粒径,维持其在血液循环中的粒径具有重要意义。此外,粒径与浓度的相关性应通过从高浓度到多次稀释测量粒径进行体外测试,而不是只关注粒径作为唯一参数的最佳处方,因为处方可能不稳定。过滤器的孔径大小应根据纳米颗粒的实际情况选择,避免药物的有效损失。因此,对于柔性纳米药物,需要考虑CMC值。
4.3.2. 形态学
纳米药物的形状会影响治疗的几个方面,包括血管转运、细胞摄取、组织渗透、生物分布和药代动力学 [84] 。丝状胶束也称为蠕虫状胶束,其血液循环时间是球形胶束的10倍 [85] 。这种长循环特性主要是由于它们的形态变化,与球形胶束相比,这提高了它们到达目标部位的机会。这些发现表明,丝状胶束具有将静脉滴注转变为一次性注射的潜在方法。纳米球通过网格蛋白介导的内吞作用和大胞饮作用依赖性内吞作用被吸收,而纳米片通过网格蛋白介导的内吞作用被吸收。这些结果表明,不同形状的纳米药物不仅可能在载药机制上存在差异,而且在细胞摄取机制上也可能存在差异。在血液中运输的纳米药物的动力学、血管壁粘附和内皮细胞摄取受颗粒几何形状的影响。如前所述,纳米药物的扩散是异质的。与其他分子不同,它们的传输主要取决于施加的对流力和弱布朗运动。为了使纳米药物被内皮细胞内化或进入肿瘤组织,它们必须靠近血管壁。对于球形纳米药物 [86] ,特别是浮力型和漂浮型纳米药物,除非施加外力,否则它们很难横向漂移。对于非球形纳米药物,各种形状在运输容器中产生不同的力,包括静电力、范德华力和摩擦力。横向漂移的速度取决于纵横比。例如,盘状纳米药物受到扭矩的影响,导致翻滚和旋转,使其更容易漂移到血管壁 [87] 。即使是同一种经ICAMI修饰的纳米药物,虽然它们的形状发生了变化,但它们的性能可能会有所不同 [88] 。与球形纳米药物相比,圆柱形纳米药物可以很容易地粘附在血管内皮细胞上,但会被肝脏迅速清除。与球形氧化铁纳米药物相比,砖状氧化铁纳米药物具有较高的细胞摄取率 [89] 。在外加磁场作用下,球形氧化铁纳米药物的细胞摄取变化不显着,而砖状纳米药物则明显增加。
经过靶配体修饰后,非球形纳米药物,如扁平、棒状或丝状纳米药物,与球形纳米药物相比,可能有更多的机会与血管内皮接触,从而促进内皮内化。总的来说,这些结果表明纳米颗粒的形状可以影响细胞摄取和细胞内药物积累。然而,并非所有几何形状的变化都会极大地影响细胞毒性。例如,金纳米棒、纳米球和纳米星的大小和形状的变化对人胶质母细胞瘤和人真皮成纤维细胞系的细胞活力几乎没有影响,但表面修饰的配体(CTAB、PEG、HSA)会引起一些影响 [90] 。需要注意的是,在形态变化的过程中,研究人员更愿意将它们从原来的球形纳米颗粒转变为不同的形状。例如,可以通过压缩球形纳米颗粒来制备纳米棒,然后引起纵横比的变化。因此,有必要考虑生物学变化是否属于横向直径。应检查与纳米棒具有相同横向直径的纳米球。在不同的研究中,只能考虑将相同的材料和相同的细胞系放在一起比较 [91] 。一般来说,几何形状在纳米医学靶向中起着重要作用,不同的形状可能针对不同的器官。与纳米球相比,纳米棒具有更好的粘附性和更深的穿透性能,而丝状纳米药物具有更长的循环持续时间,纳米立方体具有更高的细胞摄取。
4.3.3. 表面电荷
纳米药物的表面工程具有多种特性。例如,肿瘤细胞表面的负电荷使带正电荷的纳米药物更容易被肿瘤细胞摄取。然而,带正电的纳米药物在血液循环中不稳定,很容易被RES清洗,而电中性或带负电的纳米药物具有更高的肿瘤积累和更长的血液循环持续时间。因此,控制电荷反转或制备混合电荷纳米药物是一种有效的策略 [92] 。在活性药物靶向设计中,特定的配体可以附着在纳米药物表面,例如小分子肽或叶酸。然而,与纳米药物相比,配体的体积往往要小得多 [93] 。配体驱动功率的效率尚不清楚。此外,研究人员发现肿瘤部位的主动靶向剂和被动靶向剂的药物含量是相等的。这可能是因为当它们在血液中流动时,主动靶向剂和被动靶向剂之间没有选择性差异。活性靶向剂在进入肿瘤前应在血液中运输,与血管壁的接触是随机的。只有当它们进入肿瘤时,修饰的配体才能生效。与主动靶向制剂相比,分子靶向药物的开发更为成功。此外,纳米药物最基本的表面特性,如疏水性、材料末端基团的设计和排列等,在研究中往往被忽视。对于具有相似尺寸和潜力的聚苯乙烯–聚丙烯纳米药物,不同的分子拓扑结构会引起表面粗糙度和润湿性的变化,从而影响肿瘤细胞内化、内吞作用,甚至是肿瘤穿透 [94] 。
5. 结论与展望
基于纳米颗粒的药物递送系统为开发高效的靶向治疗提供了革命性的机会,并改善了循环半衰期、生物利用度、生物分布、药代动力学和安全性。此外,纳米颗粒在维持联合治疗中的协同药物比例方面是必不可少的,并提供了第一种提供治疗剂(如核酸和不稳定蛋白质)的可能性。将具有抗原的佐剂与肿瘤共同递送可促进针对癌症的抗原特异性免疫反应,并且是正在开发的众多纳米颗粒抗癌疗法的另一个方面。然而,在新兴的纳米医学领域还有很多东西需要学习。我们还没有开发出一种载体,可以有效地在肿瘤内提供有效载荷,并获得临床验证的结果。还有更重大的挑战例如将颗粒保留在疾病部位而不是网状内皮器官。纳米医学的进步是通过开发新的纳米载体和药物递送技术来实现的。理想的纳米载体应符合以下条件:i) 可生物降解和生物相容性;ii) 能够有效归位,大多数治疗剂位于目标部位;iii) 具有最佳的生物物理化学特性,可在不频繁的给药时间内实现卓越的载药量、循环半衰期和持续药物释放;iv) 能够以具有成本效益的规模扩大商业化。在一个纳米载体中改进和整合这些品质是纳米医学的“圣杯”,它综合了医学、化学、工程和物理学学科的前沿知识和技术。
除了纳米粒子实验设计的复杂性外,在临床使用的纳米粒子的制造、监管和批准方面也存在多重挑战。纳米医学时代将在未来几十年走向成熟;结合个性化医疗的元素,它将以一种强大而持久的方式影响治疗世界。
文章引用
袁豪华,李林照,聂瑛洁,桂 欢. 纳米递送系统在肿瘤免疫治疗中的应用
Application of Nano-Delivery System in Tumor Immunotherapy[J]. 纳米技术, 2023, 13(04): 97-109. https://doi.org/10.12677/NAT.2023.134010
参考文献
- 1. Riley, R.S., June, C.H., Langer, R. and Mitchell, M.J. (2019) Delivery Technologies for Cancer Immunotherapy. Nature Reviews Drug Discovery, 18, 175-196. https://doi.org/10.1038/s41573-018-0006-z
- 2. Pardoll, D.M. (2012) The Blockade of Immune Checkpoints in Cancer Immunotherapy. Nature Reviews Cancer, 12, 252-264. https://doi.org/10.1038/nrc3239
- 3. Webb, E.S., et al. (2017) Immune Checkpoint Inhibitors in Cancer Therapy. The Journal of Biomedical Research, 32, 317-326. https://doi.org/10.7555/JBR.31.20160168
- 4. Granier, C., et al. (2017) Mechanisms of Action and Rationale for the Use of Checkpoint Inhibitors in Cancer. ESMO Open, 2, e000213. https://doi.org/10.1136/esmoopen-2017-000213
- 5. Chakraborty, S. and Rahman, T. (2012) The Difficulties in Cancer Treatment. Cancer Medical Science, 6, ed16.
- 6. Wheler, J., Lee, J.J. and Kurzrock, R. (2014) Unique Molecular Landscapes in Cancer: Implications for Individualized, Curated Drug Combinations. Cancer Research, 74, 7181-7184. https://doi.org/10.1158/0008-5472.CAN-14-2329
- 7. Song, Q., Zhang, G.F., et al. (2021) Rein-forcing the Combinational Immuno-Oncotherapy of Switching “Cold” Tumor to “Hot” by Responsive Penetrating Nano-gels. ACS Applied Materials & Interfaces, 13, 36824-36838. https://doi.org/10.1021/acsami.1c08201
- 8. Sung, H., Ferlay, J., Siegel, R.L., Laversanne, M., Soerjomataram, I., Jemal, A. and Bray, F. (2021) Global Cancer Statistics 2020: GLOBOCA Nestimates Of incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA: A Cancer Journal for Clinicians, 71, 209-249. https://doi.org/10.3322/caac.21660
- 9. Arbyn, M., Weiderpass, E., Bruni, L., de Sanjosé, S., Saraiya, M., Ferlay, J., et al. (2020) Estimates of Incidence and Mortality of Cervical Cancer in 2018: A Worldwide Analysis. The Lancet Global Health, 8, E191-E203. https://doi.org/10.1016/S2214-109X(19)30482-6
- 10. Esfahani, K., Roudaia, L., Buhlaiga, N., Del Rincon, S.V., Papneja, N. and Miller Jr., W.H. (2020) A Review of Cancer Immunotherapy: From the Past, to the Present, to the Fu-ture. Current Oncology, 27, 87-97. https://doi.org/10.3747/co.27.5223
- 11. Binnewies, M., Roberts, E.W., Kersten, K., Chan, V., Fearon, D.F., Me-rad, M. and Coussens, L.M. (2018) Understanding the Tumor Immune Microenvironment (TIME) for Effective Therapy. Nature Medicine, 24, 541-550. https://doi.org/10.1038/s41591-018-0014-x
- 12. Veillette, A. and Davidson, D. (2018) Developing Combination Immunotherapies against Cancer That Make Sense. Science Immunology, 3, eaav1872. https://doi.org/10.1126/sciimmunol.aav1872
- 13. Schreiber, R.D., Old, L.J. and Smyth, M.J. (2011) Cancer Im-munoediting: Integrating Immunity’s Roles in Cancer Suppression and Promotion. Science, 331, 1565-1570. https://doi.org/10.1126/science.1203486
- 14. Croft, M. (2003) Co-Stimulatory Members of the TNFR Family: Keys to Effective T-Cell Immunity? Nature Reviews Immunology, 3, 609-620. https://doi.org/10.1038/nri1148
- 15. Yuan, C.S., Liu, Y., Wang, T., Sun, M.J. and Chen, X.G. (2020) Nanomateri-als as Smart Immunomodulator Delivery System for Enhanced Cancer Therapy. ACS Biomaterials Science & Engineer-ing, 6, 4774-4798. https://doi.org/10.1021/acsbiomaterials.0c00804
- 16. Capretto, L., et al. (2013) Microfluidic and Lab-on-a-Chip Preparation Routes for Organic Nanoparticles and Vesicular Systems for Nanomedicine Applications. Advanced Drug Delivery Reviews, 65, 1496-1532. https://doi.org/10.1016/j.addr.2013.08.002
- 17. Whitesides, G.M. (2006) The Origins and the Future of Microflu-idics. Nature, 442, 368-373. https://doi.org/10.1038/nature05058
- 18. Valencia, P.M., Farokhzad, O.C., Karnik, R. and Langer, R. (2012) Mi-crofluidic Technologies for Accelerating the Clinical Translation of Nanoparticles. Nature Nanotechnology, 7, 623-629. https://doi.org/10.1038/nnano.2012.168
- 19. Coelho, T., et al. (2013) Safety and Efficacy of RNAi Therapy for Transthyretin Amyloidosis. The New England Journal of Medicine, 369, 819-829. https://doi.org/10.1056/NEJMoa1208760
- 20. 曹雪涛. 医学免疫学[M]. 北京: 人民卫生出版社, 2013.
- 21. Fuchs, C.S., Fakih, M., Schwartzberg, L., Cohn, A.L., Yee, L., Dreisbach, L., et al. (2013) TRAIL Receptor Agonist Conatumumab with Modified FOLFOX6 plus Bevacizumab for first-Line Treatment of Metastatic Colorectal Cancer: A Randomized Phase 1b/2 Trial. Cancer, 119, 4290-4298. https://doi.org/10.1002/cncr.28353
- 22. Salgia, R., Patel, P., Bothos, J., Yu, W., Eppler, S., Hegde, P., et al. (2014) Phase I Dose-Escalation Study of Onartuzumab as a Single Agent and in Combination with Bevacizumab in Patients with Advanced Solid Malignancies. Clinical Cancer Re-search, 20, 1666-1675. https://doi.org/10.1158/1078-0432.CCR-13-2070
- 23. Windbergs, M., Zhao, Y.J., Hey-man, J. and Weitz, D.A. (2013) Biodegradable Core-Shell Carriers for Simultaneous Encapsulation of Synergistic Ac-tives. Journal of the American Chemical Society, 135, 7933-7937. https://doi.org/10.1021/ja401422r
- 24. Jokerst, J.V., Lobovkina, T., Zare, R.N. and Gambhir, S.S. (2011) Nano-particle PEGylation for Imaging and Therapy. Nanomedicine, 6, 715-728. https://doi.org/10.2217/nnm.11.19
- 25. Peracchia, M.T., et al. (1999) Visualization of in vitro Protein-Rejecting Properties of PEGylated Stealth® Polycyanoacrylate Nanoparticles. Biomaterials, 20, 1269-1275. https://doi.org/10.1016/S0142-9612(99)00021-6
- 26. Radovic-Moreno, A.F., et al. (2012) Surface Charge-Switching Polymeric Nanoparticles for Bacterial Cell Wall-Targeted Delivery of Antibiotics. ACS Nano, 6, 4279-4287. https://doi.org/10.1021/nn3008383
- 27. Maleki Vareki, S., Garrigós, C. and Duran, I. (2017) Bi-omarkers of Response to PD-1/PD-L1 Inhibition. Critical Reviews in Oncology/Hematology, 116, 116-124. https://doi.org/10.1016/j.critrevonc.2017.06.001
- 28. Hay, K.A., et al. (2017) Kinetics and Biomarkers of Severe Cytokine Release Syndrome after CD19 Chimericantigen Receptor—Modified T-Cell Therapy. Blood, 130, 2295-2306. https://doi.org/10.1182/blood-2017-06-793141
- 29. Schmidt, C. (2017) The Benefits of Immunotherapy Combina-tions. Nature, 552, S67-S69. https://doi.org/10.1038/d41586-017-08702-7
- 30. Riley, R.S. and Day, E.S. (2017) Gold Nanoparticle-Mediated Photothermal Therapy: Applications and Opportunities for Multimodal Cancer Treatment. WIREs Nanomedicine and Nanobiotechnology, 9, e1449. https://doi.org/10.1002/wnan.1449
- 31. Lee, S. and Margolin, K. (2011) Cytokines in Cancer Immunotherapy. Cancers, 3, 3856-3893. https://doi.org/10.3390/cancers3043856
- 32. Milling, L., Zhang, Y. and Irvine, D.J. (2017) Delivering Safer Im-munotherapies for Cancer. Advanced Drug Delivery Reviews, 114, 79-101. https://doi.org/10.1016/j.addr.2017.05.011
- 33. June, C.H., Warshauer, J.T. and Bluestone, J.A. (2017) Is Auto-immunity the Achilles’ Heel of Cancer Immunotherapy? Nature Medicine, 23, 540-547. https://doi.org/10.1038/nm.4321
- 34. Zhang, Y., Li, N., Suh, H. and Irvine, D.J. (2018) Nanoparticle Anchoring Targets Immune Agonists to Tumors Enabling Anti-Cancer Immunity without Systemic Toxicity. Nature Communica-tions, 9, Article No. 6. https://doi.org/10.1038/s41467-017-02251-3
- 35. Wilson, J.T., Keller, S., Manganiello, M.J., Cheng, C., Lee, C.C., Opara, C., Convertine, A. and Stayton, P.S. (2013) pH-Responsive Nanoparticle Vaccines for Dual-Delivery of Antigens and Immunostimulatory Oligonucleotides. ACS Nano, 7, 3912-3925. https://doi.org/10.1021/nn305466z
- 36. Maeda, H., Nakamura, H. and Fang, J. (2013) The EPR Effect for Mac-romolecular Drug Delivery to Solid Tumors: Improvement of Tumor uptake, Lowering of Systemic Toxicity, and Distinct Tumor Imaging in vivo. Advanced Drug Delivery Reviews, 65, 71-79. https://doi.org/10.1016/j.addr.2012.10.002
- 37. Shukla, S. and Steinmetz, N.F. (2016) Emerging Nanotechnologies for Cancer Immunotherapy. Experimental Biology and Medicine, 241, 1116-1126. https://doi.org/10.1177/1535370216647123
- 38. Zang, X., Zhao, X., Hu, H., Qiao, M., Deng, Y. and Chen, D. (2017) Nanoparticles for Tumor Immunotherapy. European Journal of Pharmaceutics and Biopharmaceutics, 115, 243-256. https://doi.org/10.1016/j.ejpb.2017.03.013
- 39. Hu, Q., Sun, W., Wang, C. and Gu, Z. (2016) Recent Advances of Cocktail Chemotherapy by Combination Drug Delivery Systems. Advanced Drug Delivery Reviews, 98, 19-34. https://doi.org/10.1016/j.addr.2015.10.022
- 40. Pacardo, D.B., Ligler, F.S. and Gu, Z. (2015) Programma-ble Nanomedicine: Synergistic and Sequential Drug Delivery Systems. Nanoscale, 7, 3381-3391. https://doi.org/10.1039/C4NR07677J
- 41. Langer, R. and Peppas, N.A. (2003) Advances in Biomaterials, Drug Delivery, and Bionanotechnology. AIChE Journal, 49, 2990-3006. https://doi.org/10.1002/aic.690491202
- 42. Xie, Z., Su, Y., Kim, G.B., Selvi, E., Ma, C., Aragon-San-abria, V., Hsieh, J.T., Dong, C. and Yang, J. (2017) Immune Cell-Mediated Biodegradable Theranostic Nanoparticles for Melanoma Targeting and Drug Delivery. Small, 13, Article ID: 1603121. https://doi.org/10.1002/smll.201603121
- 43. Kamaly, N., et al. (2012) Targeted Polymeric Therapeu-tic Nanoparticles: Design, Development and Clinical Translation. Chemical Society Reviews, 41, 2971-3010. https://doi.org/10.1039/c2cs15344k
- 44. Acharya, S. and Sahoo, S.K. (2011) PLGA Nanoparticles Containing Various Anticancer Agents and Tumour Delivery by EPR Effect. Advanced Drug Delivery Reviews, 63, 170-183. https://doi.org/10.1016/j.addr.2010.10.008
- 45. Bertrand, N., et al. (2014) Cancer Nanotechnology: The Impact of Passive and Active Targeting in the Era of Modern Cancer Biology. Advanced Drug Delivery Reviews, 66, 2-25. https://doi.org/10.1016/j.addr.2013.11.009
- 46. Chauhan, V.P., et al. (2012) Normalization of Tumour Blood Ves-sels Improves the Delivery of Nanomedicines in a Size-Dependent Manner. Nature Nanotechnology, 7, 383-388. https://doi.org/10.1038/nnano.2012.45
- 47. Monsky, W.L., et al. (1999) Augmentation of Transvascular Transport of Macromolecules and Nanoparticlesin Tumors Using Vascular Endothelial Growth Factor. Cancer Research, 59, 4129-4135.
- 48. Danquah, M.K., Zhang, X.A. and Mahato, R.I. (2011) Extravasation of Polymeric Nanomedicines across Tumor Vasculature. Advanced Drug Delivery Reviews, 63, 623-639. https://doi.org/10.1016/j.addr.2010.11.005
- 49. Zhang, X.Q., et al. (2012) Interactions of Nanomaterials and Bio-logical Systems: Implications to Personalized Nanomedicine. Advanced Drug Delivery Reviews, 64, 1363-1384. https://doi.org/10.1016/j.addr.2012.08.005
- 50. Peer, D., et al. (2007) Nanocarriers as an Emerging Platform for Cancer Therapy. Nature Nanotechnology, 2, 751-760. https://doi.org/10.1038/nnano.2007.387
- 51. Ge, Z. and Liu, S. (2013) Functional Block Copolymer Assemblies Responsive to Tumor and Intracellular Microenvironments for Site-Specific Drug Delivery and Enhanced Imaging Per-formance. Chemical Society Reviews, 42, 7289- 7325. https://doi.org/10.1039/c3cs60048c
- 52. Valencia, P.M., et al. (2011) Effects of Ligands with Different Water Solubilities on Self-Assembly and Properties of Targeted Nanoparti-cles. Biomaterials, 32, 6226-6233. https://doi.org/10.1016/j.biomaterials.2011.04.078
- 53. Decuzzi, P., Lee, S., Bhushan, B. and Ferrari, M. (2005) A Theoretical Model for the Margination of Particles within Blood Vessels. Annals of Biomedical Engineering, 33, 179-190. https://doi.org/10.1007/s10439-005-8976-5
- 54. Guo, Y.F., Zhao, S., Qiu, H.H., Wang, T., Zhao, Y.N., Han, M.H., Dong, Z.Q. and Wang, X.T. (2018) Shape of Nanoparticles as a Design Parameter to Improve Docetaxel Antitumor Efficacy. Bioconjugate Chemistry, 29, 1302-1311. https://doi.org/10.1021/acs.bioconjchem.8b00059
- 55. He, C.B., Hu, Y.P., Yin, L.C., Tang, C. and Yin, C.H. (2010) Effects of Particle Size and Surface Charge on Cellular uptake and Biodistribution of Polymeric Nanoparticles. Biomaterials, 31, 3657-3666. https://doi.org/10.1016/j.biomaterials.2010.01.065
- 56. Chen, X.J., Zhang, X.Q., Tang, M.X., Liu, Q. and Zhou, G. (2020) Anti-PD-L1-Modified and ATRA-Loaded Nanoparticles for Immuno-Treatment of Oral Dysplasia and Oral Squamous Cell Carcinoma. Nanomedicine, 15, 951-968. https://doi.org/10.2217/nnm-2019-0397
- 57. Liu, Y., Chen, X.G., Yang, P.P., Qiao, Z.Y. and Wang, H. (2019) Tumor Microenvironmental pH and Enzyme Dual Responsive Polymer-Liposomes for Synergistic Treatment of Cancer Immuno-Chemotherapy. Biomacromolecules, 20, 882-892. https://doi.org/10.1021/acs.biomac.8b01510
- 58. Leamon, C.P., Cooper, S.R. and Hardee, G.E. (2003) Fo-late-Liposome-Mediated Antisense Oligodeoxynucleotide Targeting to Cancer Cells: Evaluation in Vitro and in Vivo. Bi-oconjugate Chemistry, 14, 738-747. https://doi.org/10.1021/bc020089t
- 59. Lu, W., Xiong, C.Y., Zhang, R., Shi, L.F., Huang, M., Zhang, G.D., Song, S.L., Huang, Q., Liu, G.Y. and Li, C. (2012) Receptor-Mediated Transcytosis: A Mechanism for Active Extravascular Transport of Nanoparticles in Solid Tumors. Journal of Controlled Release, 161, 959-966. https://doi.org/10.1016/j.jconrel.2012.05.014
- 60. Zhang, L., Hao, P.Y., Yang, D.J., Feng, S., Peng, B., et al. (2019) Designing Nanoparticles with Improved Tumor Penetration: Surface Properties from the Molecular Architecture Viewpoint. Journal of Materials Chemistry B, 7, 953- 964. https://doi.org/10.1039/C8TB03034K
- 61. Saha, K., Rahimi, M., Yazdani, M., Kim, S.T., Moyano, D.F., Hou, S., Das, R., Mout, R., Rezaee, F., Mahmoudi, M. and Rotello, V.M. (2016) Regulation of Macrophage Recognition through the Interplay of Nanoparticle Surface Functionality and Protein Corona. ACS Nano, 10, 4421-4430. https://doi.org/10.1021/acsnano.6b00053
- 62. Yan, Y., Gause, K.T., Kamphuis, M.M.J., Ang, C.S., O’brien-Simpson, N.M., Lenzo, J.C., Reynolds, E.C., Nice, E.C. and Caruso, F. (2013) Differential Roles of the Proteincorona in the Cellular Uptake of Nanoporous Polymerparticles by Monocyte and Macro-phage Cell Lines. ACS Nano, 7, 10960-10970. https://doi.org/10.1021/nn404481f
- 63. Yang, M.Y., Yu, L.X., Guo, R.W., Dong, A.J., Lin, C.G. and Zhang, J.H. (2018) A Modular Coassembly Approach to All-In-One Multifunc-tional Nanoplatform for Synergistic Codelivery of Doxorubicin and Curcumin. Nanomaterials, 8, Article 167. https://doi.org/10.3390/nano8030167
- 64. Zhang, M.K., Wang, X.G., Zhu, J.Y., Liu, M.D., Li, C.X., Feng, J. and Zhang, X.Z. (2018) Double-Targeting Explosible Nanofirework for Tumor Ignition to Guide Tumor-Depth Photothermal Therapy. Small, 14, Article ID: 1800292. https://doi.org/10.1002/smll.201800292
- 65. Wang, J. (2017) Spatial Targeting of Tumor-Associated Macrophage and Tumor Cells with a Designer Nanocarrier for Cancer Chemo-Immunotherapy. 2017 39th Annual International Con-ference of the IEEE Engineering in Medicine and Biology Society (EMBC), Jeju, 11-15 July 2017, 291. https://doi.org/10.1109/EMBC.2017.8036819
- 66. Christina, V., Gabriel, H., Bruce, G. and Francesco, P. (2015) A Mechanistic Tumor Penetration Model to Guide Antibody Drug Conjugate Design. PLOS ONE, 10, e0118977. https://doi.org/10.1371/journal.pone.0118977
- 67. Ozcelikkale, A., Moon, H.R., Linnes, M. and Han, B. (2017) In Vitro Microfluidic Models of Tumor Microenvironment to Screen Transport of Drugs and Nanoparticles. WIREs Nano-medicine and Nanobiotechnology, 9, e1460. https://doi.org/10.1002/wnan.1460
- 68. Li, H.J., Du, J.Z., Liu, J., Du, X.J., Shen, S., et al. (2016) Smart Su-per-Structures with Ultrahigh pH-Sensitivity for Targeting Acidic Tumor Microenvironment: Instantaneous Size Switch-ing and Improved Tumor Penetration. ACS Nano, 10, 6753-6761. https://doi.org/10.1021/acsnano.6b02326
- 69. Jiang, T., Sun, W., Zhu, Q., Burns, N.A., Khan, S.A., Mo, R. and Gu, Z. (2015) Furin-Mediated Sequential Delivery of Anticancer Cytokine and Small-Molecule Drug Shuttled by Gra-phene. Advanced Materials, 27, 1021-1028. https://doi.org/10.1002/adma.201404498
- 70. Hu, X.X., Wang, Y. and Peng, B. (2014) Chitosan-Capped Meso-porous Silica Nanoparticles as pH-Responsive Nanocarriers for Controlled Drug Release. Chemistry—An Asian Journal, 9, 319-327. https://doi.org/10.1002/asia.201301105
- 71. Slowing, I.I., Vivero-Escoto, J.L., Wu, C.W. and Lin, V.S.Y. (2008) Mesoporous Silica Nanoparticles as Controlled Release Drug Delivery and Gene Transfection Carriers. Advanced Drug Delivery Reviews, 60, 1278-1288. https://doi.org/10.1016/j.addr.2008.03.012
- 72. Ou, W., Byeon, J.H., Thapa, R.K., Ku, S.K., Yong, C.S. and Kim, J.O. (2018) Plug-and-Play Nanorization of Coarse Black Phosphorus for Targeted Chemo-Photoimmunotherapy of Col-orectal Cancer. ACS Nano, 12, 10061-10074. https://doi.org/10.1021/acsnano.8b04658
- 73. Bobo, D., Robinson, K.J., Islam, J., Thurecht, K.J. and Corrie, S.R. (2016) Nanoparticle-Based Medicines: A Review of FDA-Approved Materials and Clinical Trials to Date. Pharmaceu-tical Research, 33, 2373-2387. https://doi.org/10.1007/s11095-016-1958-5
- 74. Shao, J., Xie, H., Huang, H., Li, Z., Sun, Z., et al. (2016) Biode-gradable Black Phosphorus-Based Nanospheres for in vivo Photothermal Cancer Therapy. Nature Communications, 7, Article No. 12967. https://doi.org/10.1038/ncomms12967
- 75. Chen, W., Ouyang, J., Liu, H., Chen, M., et al. (2017) Black Phos-phorus Nanosheet-Based Drug Delivery System for Synergistic Photodynamic/Photothermal/Chemotherapy of Cancer. Advanced Materials, 29, Article ID: 1603864. https://doi.org/10.1002/adma.201603864
- 76. Wu, X., Wu, Y., Ye, H., Yu, S., He, C. and Chen, X. (2017) Inter-leukin-15 and Cisplatin Co-Encapsulated Thermosensitive Polypeptide Hydrogels for Combined Immuno-Chemotherapy. Journal of Controlled Release, 255, 81-93. https://doi.org/10.1016/j.jconrel.2017.04.011
- 77. Lee, S. and Margolin, K. (2011) Cytokines in Cancer Immuno-therapy. Cancers, 3, 3856-3893. https://doi.org/10.3390/cancers3043856
- 78. Dudley, M.E. and Rosenberg, S.A. (2007) Adoptive Cell Transfer Therapy. Seminars in Oncology, 34, 524-531. https://doi.org/10.1053/j.seminoncol.2007.09.002
- 79. Dehaini, D., Fang, R.H. and Zhang, L. (2016) Biomimetic Strategies for Targeted Nanoparticle Delivery. Bioengineering & Translational Medicine, 1, 30-46. https://doi.org/10.1002/btm2.10004
- 80. Eralp, Y., Wang, X., Wang, J.P., Maughan, M.F. and Polo, J.M. (2004) Doxorubicin and Paclitaxel Enhance the Antitumor Efficacy of Vaccines Directed against HER2/Neu in a Murine Mam-mary Carcinoma Model. Breast Cancer Research, 6, Article No. R275. https://doi.org/10.1186/bcr787
- 81. Song, Q., Yin, Y., Shang, L., Wu, T., Zhang, D., et al. (2017) Tumor Microenvironment Responsive Nanogel for the Combi-natorial Antitumor Effect of Chemotherapy and Immunotherapy. Nano Letters, 17, 6366-6375. https://doi.org/10.1021/acs.nanolett.7b03186
- 82. Kuai, R., Yuan, W.M., Son, S., Nam, J., Xu, J., Fan, Y.C., Schwendeman, A. and Moon, J.J. (2018) Elimination of Established Tumors with Nanodisc-Based Combination Chemoimmunotherapy. Science Advances, 4, eaao1736. https://doi.org/10.1126/sciadv.aao1736
- 83. Kemp, J.A., Shim, M.S., Heo, C.Y. and Kwon, Y.J. (2016) “Combo” Nanomedicine: Co-Delivery of Multi-Modal Therapeutics for Efficient, Targeted, and Safe Cancer Therapy. Advanced Drug Delivery Reviews, 98, 3-18. https://doi.org/10.1016/j.addr.2015.10.019
- 84. Guo, C.L., Chen, Y.A., Gao, W.J., Chang, A.T., Ye, Y.J., et al. (2017) Liposomal Nanoparticles Carrying Anti-IL6R Antibody to the Tumour Microenvironment Inhibit Metastasis in Two Molecular Subtypes of Breast Cancer Mouse Models. Theranostics, 7, 775-788. https://doi.org/10.7150/thno.17237
- 85. Zhang, B., Wang, T., Yang, S., Xiao, Y., Song, Y., Zhang, N. and Garg, S. (2016) Development and Evaluation of Oxaliplatin Andirinotecan Co-Loaded Liposomes for Enhanced Colorectal Cancer Therapy. Journal of Controlled Release, 238, 10-21. https://doi.org/10.1016/j.jconrel.2016.07.022
- 86. Wei, J., Long, Y., Guo, R., Liu, X.L., Tang, X., et al. (2019) Multifunctional Polymeric Micelle-Based Chemo-Immu- no-therapy with Immune Checkpoint Blockade for Efficient Treatment of Orthotopic and Metastatic Breast Cancer. Acta Pharmaceutica Sinica B, 9, 819-831. https://doi.org/10.1016/j.apsb.2019.01.018
- 87. Gu, Z., Wang, Q., Shi, Y., Huang, Y., Zhang, J., Zhang, X. and Lin, G. (2018) Nanotechnology-Mediated Immunochemotherapy Combined with Docetaxel and PD-L1 Antibody Increase Therapeutic Effects and Decrease Systemic Toxicity. Journal of Controlled Re-lease, 286, 369-380. https://doi.org/10.1016/j.jconrel.2018.08.011
- 88. Hernandez-Gil, J., Cobaleda-Siles, M., Za-baleta, A., Salassa, L., Calvo, J. and Mareque-Rivas, J.C. (2015) An Iron Oxide Nanocarrier Loaded with a Pt (IV) Pro-drug and Immunostimulatory dsRNA for Combining Complementary Cancer Killing Effects. Advanced Healthcare Ma-terials, 4, 1034-1042. https://doi.org/10.1002/adhm.201500080
- 89. Lee, I.H., An, S., Yu, M.K., Kwon, H.K., Im, S.H. and Jon, S. (2011) Targeted Chemoimmunotherapy Using Drug- Loaded Aptamer-Dendrimer Bioconjugates. Journal of Controlled Release, 155, 435-441. https://doi.org/10.1016/j.jconrel.2011.05.025
- 90. Chen, L., Zhou, L.L., Wang, C.H., Han, Y., Lu, Y.L., et al. (2019) Tumor-Targeted Drug and CpG Delivery System for Phototherapy and Docetaxel-Enhanced Immunotherapy with Polarization toward M1-Type Macrophages on Triple Negative Breast Cancers. Advanced Materials, 31, Article ID: 1904997. https://doi.org/10.1002/adma.201904997
- 91. Kadiyala, P., Li, D., Nunez, F.M., Altshuler, D., Doherty, R., et al. (2019) High-Density Lipoprotein-Mimicking Nanodiscs for Chemo-Immunotherapy against Glioblastoma Mul-tiforme. ACS Nano, 13, 1365-1384. https://doi.org/10.1021/acsnano.8b06842
- 92. Kataoka, K., Harada, A. and Nagasaki, Y. (2001) Block Copolymer Micelles for Drug Delivery: Design, Characterization and Biological Significance. Advanced Drug Delivery Reviews, 47, 113-131. https://doi.org/10.1016/S0169-409X(00)00124-1
- 93. Makadia, H.K. and Siegel, S.J. (2011) Poly Lac-tic-Co-Glycolic Acid (PLGA) as Biodegradable Controlled Drug Delivery Carrier. Polymers, 3, 1377-1397. https://doi.org/10.3390/polym3031377
- 94. Gref, R., Minamitake, Y., Peracchia, M.T., Trubetskoy, V., Torchilin, V. and Langer, R. (1994) Biodegradable Long- Circulating Polymeric Nanospheres. Science, 263, 1600-1603. https://doi.org/10.1126/science.8128245
NOTES
*通讯作者。