Hans Journal of Biomedicine
Vol.
10
No.
02
(
2020
), Article ID:
35117
,
6
pages
10.12677/HJBM.2020.102003
ABO Genotypes Were Identified by PCR-RFLP Method
Chenhang Wang, Yujia Kang, Jinlei Shi*
School of Life Science and Technology, Shanghai Tech University, Shanghai

Received: Mar. 29th, 2020; accepted: Apr. 13th, 2020; published: Apr. 20th, 2020

ABSTRACT
The substitution of several bases in ABO gene and the deletion of single base lead to the production of A, B and O alleles, which can make the erythrocyte membrane surface with different antigens, and thus form four blood type phenotypes. According to the differences of the key loci of the three alleles, the PCR-RFLP method was used to amplify the DNA fragments and perform specific enzyme digestion. The genotype could be preliminarily determined based on the enzyme digestion results, and then the enzyme digestion results are verified by sequencing method. In this study, ABO genotypes were identified for the first author and another student, and the results showed that the PCR-RFLP results were consistent with the sequencing results.
Keywords:PCR-RFLP, ABO Genetypes

PCR-RFLP方法鉴定ABO血型基因型
王晨航,康宇佳,石金磊*
上海科技大学,生命科学与技术学院,上海

收稿日期:2020年3月29日;录用日期:2020年4月13日;发布日期:2020年4月20日

摘 要
ABO基因中几个碱基的替换、单碱基缺失导致A、B、O三种等位基因的产生,可使红细胞膜表面带有不同抗原,进而形成四种血型表型。根据三种等位基因关键位点的不同,采用PCR-RFLP方法扩增DNA片段并进行特异性酶切,根据酶切结果可以初步判断基因型,再通过测序的方法验证酶切结果。本实验对笔者和另一名同学进行了ABO基因型鉴定,结果显示,PCR-RFLP结果与测序结果相一致。
关键词 :PCR-RFLP,ABO基因型

Copyright © 2020 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 背景介绍
ABO血型系统是人类最早发现的一种血型分类系统 [1],在临床上具有重要意义。根据ABO基因参比序列(Genebank:NM_020469),ABO血型基因位于人类染色体9q34.2,长度约25 kbp,包含7个外显子和6个内含子,基因编码糖基转移酶。A基因编码N-乙酰半乳糖转移酶,可使红细胞膜表面的H抗原的寡糖链末端携带N-乙酰半乳糖胺,成为A抗原。B基因表达半乳糖转移酶,可使H抗原的寡糖链末端携带半乳糖,成为B抗原。O基因由于碱基缺失形成移码变异,表达产物无酶活性,因此红细胞表面的H抗原无变化 [2]。O基因为隐形基因,A、B基因为共显性,二者对O基因完全显性。
根据Yamamato等人的研究 [3],B基因的cDNA与A基因的cDNA相比有7个单碱基替换,分别是A294G,C523G,C654T,G700A,C793A,G800C,G927A。其中,C523G、G700A、C793A、G800C导致编码的氨基酸改变,使表达产物酶活性发生改变。G700A位点位于外显子7内,可被限制性内切酶Alu I、Msp I等特异性识别。O基因的cDNA发生258G缺失,导致第352位的TTA形成终止密码子TAA,提前终止翻译,使产物失去活性。这一位点位于外显子6内,可被Kpn I识别。
聚合酶链反应–限制性片段长度多态性(polymerase chain reaction-restriction fragment length polymorphism, PCR-RFLP)先PCR扩增目的片段,再用限制性内切酶特异性识别并切割待测DNA片段,然后对酶切产物进行电泳,最终,观察比较限制性图谱分析序列差异。PCR-RFLP技术可用于各种基因分型鉴定、细菌或真菌的菌种鉴定、基因突变的快速检测等。
本实验利用PCR-RFLP方法,利用两对引物分别扩增ABO基因的第6、7外显子片段,再根据A、B、O基因的序列不同,利用限制性内切酶特异性识别序列,通过酶切产物条带的不同来判断基因型。同时,通过对PCR产物直接测序并比对,再次验证基因型。
2. 实验材料与方法
2.1. 实验用品
2.1.1. 试剂
一管式口腔拭子DNA抽提试剂盒购自上海生工;引物由金唯智合成;高保真聚合酶试剂盒购自诺唯赞公司;DNA marker购自全式金公司;限制性内切酶购自NEB公司,测序由上海铂尚生物公司完成。
2.1.2. 仪器与耗材
灭菌棉签,EP管(1.5 mL、0.2 mL),金属浴,PCR扩增仪,移液器,琼脂糖凝胶电泳装置,凝胶成像系统,离心机,250 mL锥形瓶,电子天平,药匙,微波炉,Nanodrop超微量分光光度计。
2.2. 实验方法
2.2.1. DNA提取
根据DNA抽提试剂盒的方法,用灭菌棉签刮取口腔上皮细胞,放入1.5 mLEP管,加入200 μL Qlysis-S Reagent和20 μL蛋白酶K,室温放置2 min,震荡混匀5 min。将灭菌棉签上的液体全部挤压在离心管内,弃掉棉签。室温放置5 min,95℃金属浴3 min。向离心管中加入200 μL buffer NST,震荡混匀,12,000 rpm室温离心5 min。取上清作为PCR扩增的DNA模板。分别提取笔者自己和班内另一名同学的DNA。
2.2.2. PCR扩增
根据参考文献 [4] [5],设计2对引物如下。
引物 1: 5’-CGGAATTCACTCGCCACTGCCTGGGTCTC-3’;
引物 2: 5’-CGGGATCCATGTGGGTGGCACCCTGCCA-3’;
引物 3: 5’-GTGGAGATCCTGACTCCGCTG-3’;
引物 4: 5’-CACCGACCCCCCGAAGAA-3’。
引物1、2用于扩增包含6号外显子的片段,片段长度252 bp;引物3、4用于扩增7号外显子的片段,片段长度159 bp。PCR反应条件:95℃预变性5 min,94℃变性15 s,60℃退火15 s,72℃延伸15 s,30个循环,72℃延伸5 min,最后4℃保温。PCR结束后使用Nanodrop测量产物浓度和纯度。
2.2.3. PCR产物鉴定及测序
用2%琼脂糖凝胶进行电泳,设定电压130 V,时间25 min。取9 μL PCR产物混合1 μL 10× loading buffer上样。如果得到目的条带,取20 μL PCR产物送测序。
2.2.4. 酶切消化
使用Kpn I消化引物1、2扩增的PCR产物,使用Alu I消化引物3、4扩增的PCR产物。酶切反应体系为20 μL,37℃金属浴3 h。
2.2.5. 酶切片段检测
配制3%琼脂糖凝胶进行电泳,设定电压130 V,时间30 min。取9 μL PCR产物混合1 μL 10×上样缓冲液上样,根据条带判断基因型。
2.2.6. 测序结果比对分析
使用MEGA-X,将测序结果与ABO基因参比序列(GeneBank: NM_020469)进行序列比对,判断基因型。
3. 实验结果
3.1. PCR-RFLP鉴定结果
引物1、2用于扩增一段包含第6外显子的252 bp的序列,用于区分O基因。O基因在该序列上有Kpn I酶的特异性识别位点,可被水解成169 bp和83 bp长度的两段DNA。但A、B基因上无法被识别,因此不会被酶消化。引物3、4用于扩增第7外显子上的159 bp长的序列,B基因在该区域上有Alu I的识别位点,可形成118 bp的条带,而A、O基因缺少识别位点。表1为酶切结果与对应的基因型。
本次实验提取了笔者和另一位同学的DNA进行鉴定,分别记为#1、#2。每人的DNA都用2对引物分别扩增,记为#1-12、#1-34、#2-12、#2-34。PCR产物浓度及纯度如表2所示,PCR电泳结果如图1(a)所示,酶切结果如图1(b)所示。PCR产物浓度较高,A260/A280在1.7~1.9范围内,表明DNA纯度较好,电泳条带清晰,无非特异性扩增,引物1、2扩增的片段均在252 bp处有条带,引物3、4扩增的片段均在159 bp处有条带,结果符合预期。#1-12、#2-12的酶切结果均只有252 bp一个条带,#1-34酶切结果只有159 bp条带,#2-34酶切结果有159 bp和118 bp两个条带,118 bp条带颜色略浅。根据酶切结果,对应表1,可知#1基因型为AA,#2基因型为AB。
Table 1. Digestion results and corresponding genotypes
表1. 酶切结果与对应基因型
Table 2. The concentration and purity of PCR products
表2. PCR产物浓度及纯度
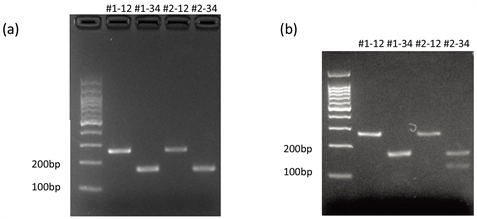 (a) PCR产物电泳结果。#1-12是#1的DNA提取物用引物1、2进行PCR扩增的产物,长度为252 bp;#1-34是#1的DNA提取物用引物3、4扩增的产物,长度为159 bp。同理,#2-12、#2-34是#2的DNA提取物分别用引物对1、2和引物对3、4扩增的产物,分别长252 bp、159 bp。(b) 酶切反应结果。#1-12是#1的DNA提取物用引物1、2扩增,再用Kpn I酶切得到的产物,由图中可知仅有252 bp一个条带。#1-34是#1的DNA提取物用引物3、4扩增,再用Alu I酶切产物,仅得到159 bp条带。#2-12是#2的DNA提取物用引物1、2扩增,Kpn I酶切,得到一个252 bp条带。#2-34是#2的DNA提取物用引物3、4扩增,Alu I酶切,得到159 bp和118 bp两个条带
(a) PCR产物电泳结果。#1-12是#1的DNA提取物用引物1、2进行PCR扩增的产物,长度为252 bp;#1-34是#1的DNA提取物用引物3、4扩增的产物,长度为159 bp。同理,#2-12、#2-34是#2的DNA提取物分别用引物对1、2和引物对3、4扩增的产物,分别长252 bp、159 bp。(b) 酶切反应结果。#1-12是#1的DNA提取物用引物1、2扩增,再用Kpn I酶切得到的产物,由图中可知仅有252 bp一个条带。#1-34是#1的DNA提取物用引物3、4扩增,再用Alu I酶切产物,仅得到159 bp条带。#2-12是#2的DNA提取物用引物1、2扩增,Kpn I酶切,得到一个252 bp条带。#2-34是#2的DNA提取物用引物3、4扩增,Alu I酶切,得到159 bp和118 bp两个条带
Figure 1. Electrophoresis results
图1. 电泳结果
3.2. 测序结果
#1-12、#2-12测序峰图清晰,无杂峰(如图2(a)和图2(b)),测序结果与参比序列比对后显示无碱基缺失(图2(e)),表明均不携带O基因。#1-34测序结果如图2(c)所示,信号清晰,结果表明不携带B基因。#2-34测序结果出现双峰位点,表明是携带B基因的杂合子。与参比序列比对的结果(图2(f))表明#1不携带B基因,#2携带B基因。综合所有测序结果,可得结论,#1基因型为AA,#2基因型为AB,与之前的PCR-RELP结果相一致。
 (a) #1-12测序结果。O基因在箭头所指处碱基缺失。此结果表明该个体不携带O基因。(b) #2-12测序结果,该个体不携带O基因。(c) #1-34测序峰图。B基因在箭头所指处发生G→A替换。此结果表明该个体不携带B基因。(d) #2-34测序峰图,箭头所指处出现A、G双峰,表明该个体是携带B基因的杂合子。(e)和(f) 测序结果与参比序列比对结果。
(a) #1-12测序结果。O基因在箭头所指处碱基缺失。此结果表明该个体不携带O基因。(b) #2-12测序结果,该个体不携带O基因。(c) #1-34测序峰图。B基因在箭头所指处发生G→A替换。此结果表明该个体不携带B基因。(d) #2-34测序峰图,箭头所指处出现A、G双峰,表明该个体是携带B基因的杂合子。(e)和(f) 测序结果与参比序列比对结果。
Figure 2. Sequencing results
图2. 测序结果
4. 讨论
ABO血型系统是一套应用最广泛的血型分类系统,在临床输血、器官移植、法医检验鉴定等领域都有重要意义。血型的鉴定可通过抗原–抗体反应鉴定红细胞膜表面抗原种类,但这种方法只能区分不同表型,对A型血和B型血的个体不能确定是纯合子还是杂合子。A、B、O等位基因的关键差异在于几个位点的单碱基缺失或替换,因此,如果想鉴定个体基因型,可以对包含相关位点的片段进行测序;可以采用PCR-RFLP方法,选择能够识别相关位点的限制性内切酶,通过是否被酶切判断相关位点的序列情况;也可采用AS-PCR方法,根据相关位点的序列变化设计引物,通过扩增结果条带的有无、长度、数量来判断基因型。
本实验选择了PCR-RFLP方法。实验中根据参考文献、试剂使用说明等设计实验步骤,进行实验,根据实验结果修改步骤,以得到更好的实验数据。比如在PCR时,第一次PCR每种引物都加入2 μL,结果有引物二聚体生成,第二次PCR就将每种引物用量改为1 μL,得到的结果就没有引物二聚体(如图2(a)所示)。酶切反应时第一次使用50 μL反应体系,37℃反应30 min,电泳结果条带非常浅,不确定是否发生了酶切,推测可能是DNA含量太少的原因;第二次仍使用50 μL反应体系,增加反应体系中的DNA含量,延长反应时间为1 h,电泳结果条带依然很浅,有很模糊的酶切后的短条带形成,推测体系中DNA浓度仍然太低导致条带很浅,DNA含量太低或酶切不充分导致酶切后的短条带非常模糊;第三次为留出足够的PCR产物用于测序,改用20 μL反应体系,加入6 μL PCR产物,使体系中DNA浓度比之前更高,同时延长酶切反应时间至3 h,得到清晰结果(图2(b))。
通过本次实验,学生们对ABO血型系统有更深入的了解,同时,锻炼了查阅文献、设计修改实验方案的能力。本次实验是在遗传学实验《人的ABO血型测定》之后提出的自主性实验,希望学生们能够设计实验并检测自己血型所对应的基因型,是遗传学实验教学的有益尝试,达到了提高学生自主设计实验的目的,为以后的毕业设计打下坚实的基础。
基金项目
上海科技大学生命科学与技术学院本科生实验室运行经费——2019A0202-405-18。
文章引用
王晨航,康宇佳,石金磊. PCR-RFLP方法鉴定ABO血型基因型
ABO Genotypes Were Identified by PCR-RFLP Method[J]. 生物医学, 2020, 10(02): 13-18. https://doi.org/10.12677/HJBM.2020.102003
参考文献
- 1. Landsteiner, K. (1900) Zur Kenntnis der antifermativen, lytischen und agglutinierenden Wirkungendes Blutserums und der Lymphe. Zentbl Bakt Parasitkde (Abt), 27, 357-363.
- 2. 王静, 游国岭, 叶星晨, 等. B等位基因新突变导致AB弱表型[J]. 中国输血杂志, 2017(30): 676-678.
- 3. Yamamoto, F., Clausen, H., White, T., et al. (1990) Molecular Genetic Basis of the Histo-Blood Group ABO System. Nature, 345, 229-233. https://doi.org/10.1038/345229a0
- 4. 刘长利, 龚晓燕, 王卓研, 等. ABO血型基因分型诊断方法的建立[J]. 北京医学, 2007(29): 745-747.
- 5. 杨庆恩, 朱传红. 复合PCR-RFLP技术检测ABO基因型[J]. 中华医学遗传学杂质, 1999(16): 110-112.
NOTES
*通讯作者。
