Hans Journal of Biomedicine
Vol.
10
No.
03
(
2020
), Article ID:
36411
,
8
pages
10.12677/HJBM.2020.103006
Regulation of NF-Kappa B Signaling Pathway by Hepatitis Viruses
Wenjing Wang1*, Shilin Gong1*, Wenhai Yu2, Fen Huang1#
1Medical School, Kunming University of Science and Technology, Kunming Yunnan
2Institute of Medical Biology, Chinese Academy of Medical Sciences and Peking Union Medical College, Kunming Yunnan

Received: May 14th, 2020; accepted: Jun. 30th, 2020; published: Jul. 7th, 2020

ABSTRACT
The innate immune response is the first line of host against viral infection. As an important part of the innate immune response, NF-kappa B (NF-κB) signaling pathway can protect host against pathogen invasion by activating the production of cytokines. Viruses can inhibit the expression of NF-κB by escaping the host immune response, while some viruses can use the activation of NF-κB to promote replication. Hepatitis viruses are the major pathogens of viral hepatitis. Up to now, there is no comprehensive report about the relationship between hepatitis viruses and NF-κB signaling pathway. The regulation of NF-κB signaling pathway during hepatitis viruses (B, C, D and E) infection was summered to clarify the interaction between NF-κB signaling pathway and hepatitis viruses.
Keywords:Hepatitis Virus, NF-κB Signaling Pathway, Innate Immunity, Immune Escaping

肝炎病毒对NF-κB信号通路的调控作用
王文静1*,龚石林1*,禹文海2,黄芬1#
1昆明理工大学医学院,云南 昆明
2中国医学科学院医学生物学研究所,云南 昆明

收稿日期:2020年5月14日;录用日期:2020年6月30日;发布日期:2020年7月7日

摘 要
先天免疫应答是机体抵抗病毒感染的第一道防线。NF-κB信号通路作为先天免疫应答的重要部分,能够通过促进多种细胞因子产生而抵抗病原体的入侵。病毒可通过抑制NF-κB表达,逃逸宿主免疫反应,而有些病毒则可利用NF-κB的活化,促进自身的复制。肝炎病毒是引起病毒性肝炎的一大类病原体。目前,有关肝炎病毒对NF-κB信号通路的调控还没有系统的文献报道,本文将就乙型、丙型、丁型、戊型四种肝炎病毒对NF-κB信号通路的调控进行综述。
关键词 :肝炎病毒,NF-κB信号通路,先天免疫,免疫逃逸

Copyright © 2020 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
肝炎病毒是引起病毒性肝炎的一类病原体,在临床上较为常见。据估计,全球每年约有130万人死于病毒性肝炎,严重危害人类健康 [1]。肝炎病毒侵入人体后主要引起肝脏炎性病变,有的病毒感染(如急性戊肝)可以不治自愈 [2],有的病毒感染(如乙肝或丙肝)则易诱发严重的病毒性肝炎,大部分感染肝炎病毒的患者会发展为慢性感染,进而发展为肝硬化,甚至肝癌 [3]。
先天免疫系统作为宿主免疫的第一道防线,在机体抵御病原体入侵过程中发挥重要作用 [4]。模式识别受体(Pattern recognition receptor, PRR)是一类能够直接识别病原体某些共有的特定分子结构的受体。当病毒入侵时,PRR能特异识别病原体中保守的抗原分子–病原相关分子模式(Pathogen-associated molecular patterns, PAMPs),从而激活先天免疫信号通路。通过触发核因子κb (Nuclear factor kappa-B, NF-κB)、干扰素调节因子(Interferon regulatory factor, IRF)等转录因子的活化,调控一系列干扰素(Interferon, IFN)、白细胞介素(Interleukin, IL)、肿瘤坏死因子(Tumor necrosis factor, TNF)和趋化因子(Chemokines)等细胞因子的表达 [5] [6]。
NF-κB是一个普遍存在的核转录因子,在免疫反应、炎症反应、细胞凋亡和肿瘤发生等多种生物过程中发挥重要作用 [7]。NF-κB的激活主要有两种途径:1) 经典途径。正常生理状态下,NF-κB以p50~p65形成的二聚体与抑制蛋白IκBα结合成复合物的方式存在于细胞质中。当炎症因子如肿瘤坏死因子TNF触发后,会募集TNF-receptor-associated death domain (TRADD)、Receptor Interacting Protein (RIP)和TNF-receptor associated factor 2 (TRAF2)与细胞膜相互作用,进而激活IKK (Inhibitor of nuclear factor kappa-B kinase, IκB-kinase)复合物,IKK复合物激活后磷酸化IκBα蛋白。IκBα蛋白在IκB泛素连接酶作用下,进一步发生泛素化并通过蛋白酶体途径降解,游离的NF-κB二聚体迅速转位入核,与基因启动子区域的κB位点结合,启动下游一系列IFNs (IFN-α、IFN-β和IFN-γ)、ILs (IL-1、IL-2、IL-6、IL-8、IL-10和IL-1β等)、TNFs (TNF-α和TNF-β)和趋化因子(CCL20和RANTES)等细胞因子的表达。2) 替代途径。NF-κB的激活可由CD40配体(如CD154)等触发,这一信号通路依赖于TRAF蛋白在细胞膜上的募集以及NF-κB诱导激酶(NF-κB inducing kinase, NIK)的激活。NIK激活IKKα二聚体并使其发生磷酸化,IKKα二聚体的底物p100进而被泛素化并裂解为NF-κB蛋白p52,随RelB进入细胞核。此外,NF-κB信号通路还可通过Toll样受体(TLR)识别病毒的方式,对其进行调控 [7] [8]。作为宿主防御机制的一部分,NF-κB信号通路的激活,能抑制病毒的复制,如机体可通过激活NF-κB的表达抵抗病毒入侵。而人类免疫缺陷病毒1型(Human immunodeficiency virus 1, HIV-1)却能够利用NF-κB的激活分泌细胞因子IL-2,促进病毒复制,导致机体发生感染 [9]。非洲猪瘟病毒(African Swine fever virus, ASFV)和牛痘病毒(Cowpox virus)可通过抑制NF-κB的表达促进病毒持续复制 [10]。
本文就NF-κB信号通路在乙肝、丙肝、丁肝、戊肝四种肝炎病毒感染中的作用进行综述,阐明宿主如何抵抗肝炎病毒感染以及肝炎病毒如何逃逸宿主先天免疫,为病毒性肝炎致病机制的研究及抗肝炎病毒治疗提供策略。
2. 乙型肝炎病毒(Hepatitis B Virus, HBV)对NF-κB信号通路的调控
HBV是一种严重危害人类健康的病毒性肝炎病原体,迄今为止全球约20亿人感染HBV,其中超过3.5亿人为慢性感染。作为乙型肝炎高发区之一,我国每年约有30万人死于HBV相关性肝硬化和肝癌,对人类健康造成极大威胁 [11] [12]。HBV的基因组可编码七种病毒蛋白:乙型肝炎病毒E抗原(HBeAg)、核心蛋白(Core)、X蛋白(HBx)、HBV多聚酶(HBV Pol)、和大、中、小包膜蛋白(统称HBsAg) [13]。关于HBV与宿主相互作用的研究表明,NF-κB信号通路参与HBV与宿主相互作用 [14] [15]。
2.1. HBV感染激活NF-κB信号通路
Marianna Hosel等人研究发现,HBV感染3小时内,NF-κB可在人肝原代细胞(PHHs)和非实质细胞(NPCs)中被激活。随后释放白细胞介素-6 (IL-6)和其他细胞因子(IL-8、IL-1和TNF-α),抑制HBV在肝细胞中的早期转录和复制,但这种激活是非常短暂的。此外,他们还发现HBsAg在感染后早期很大程度上促进了NF-κB相关细胞因子的分泌 [16]。俞振军等人的研究同样发现了HBsAg上调NF-κB的表达,促进了细胞因子IL-6、IL-10和IFN-γ的分泌 [11]。
乙肝核心抗原(HBcAg)是一种介导肝损伤的病毒抗原,具有很强的免疫原性。研究表明,在肝癌细胞SMM-C7721细胞、Huh7细胞和人正常肝细胞L-02细胞中,HBcAg均能显著降解IκB (P < 0.05),激活NF-κB信号通路,促进细胞因子IL-6的分泌,这为解释HBcAg与严重肝损伤和炎症的关系提供了分子机制 [17]。
HBx蛋白是一种可溶性小蛋白,在HBV相关性肝癌中发挥重要作用。在SMM-C7721细胞和L-02细胞中HBx均通过MyD-88 (TLR信号通路中重要的转导蛋白)信号通路显著降低IκB的表达水平,激活NF-κB表达,促进IL-6的合成与分泌。尽管在HBx表达细胞中MyD-88的mRNA表达水平显著上升,但免疫共沉淀实验结果并未显示它们有直接或间接的相互作用,HBx如何调控NF-κB信号通路仍有待研究 [15]。刘从等人在HepG2细胞中同样发现HBx可诱导p65从细胞质向细胞核的转移,使核内p65蛋白表达量增加到了2.5倍,激活了NF-κB的表达,抑制肝癌细胞凋亡,这在肝癌发病过程中有重要作用 [18]。尽管肝细胞与肝癌细胞以同样的信号通路产生IL-6,但它们对IL-6的反应不相同,肝癌细胞中IL-6促进HBV复制,而肝细胞中IL-6抑制HBV复制 [15]。
2.2. HBV抑制NF-κB信号通路
研究发现,在HEK 293T和HepG2中,HBV Pol可以通过抑制IKK复合物与热休克蛋白Hsp90β相互作用,抑制IκBα蛋白降解,从而抑制NF-κB的活性,显著降低细胞因子IL-6和IL-8的分泌。HBV Pol也可通过抑制NIK的表达,从而抑制NF-κB二聚体向细胞核的转移,抵消局部先天免疫抗病毒反应,建立病毒的持续性感染 [14]。
3. 丙型肝炎病毒(Hepatitis C Virus, HCV)对NF-κB信号通路的调控
丙型肝炎病毒感染是一种以慢性感染为主的传染病。据估计,全世界有超过1.85亿人感染了丙型肝炎病毒,其中每年约有35万人死于感染。中国的丙肝感染者约有4000万例,是世界上HCV感染率最高的国家之一。丙型肝炎感染患者中80%~85%不能清除病毒,从而发展为慢性肝炎、肝硬化甚至肝癌 [19] [20]。HCV是一种单股正链RNA病毒,主要有7种基因型(HCV 1-7)和90多种亚型,其中基因1型(HCV-1a和HCV-1b)最为常见 [21]。HCV的基因组包括一个大的开放阅读框,可以编码三个结构蛋白(核心蛋白Core、E1、E2)、编码一种膜内在蛋白的p7蛋白和六个非结构蛋白(NS2、NS3、NS4A、NS4B、NS5A和NS5B) [22]。
HCV对宿主抗病毒反应信号通路的调节可通过病毒编码相关蛋白来实现。HCV Core对NF-κB的调控具有基因型特异性。HCV-1b Core会激活NF-κB的活性,抑制HCV感染肝细胞,而HCV-1a Core抑制NF-κB的活性,抑制细胞因子IL-2和IFN-γ的分泌 [23]。这一结论在Myungsoo Joo等人的实验中进一步得到验证,他们在人宫颈癌细胞HeLa细胞和人胚肾细胞HEK 293细胞中发现,HCV-1a Core与IKK相互作用,干扰相关的IKK核易位,从而抑制NF-κB活性,导致病毒持续性感染 [24]。
MAVS是一种先天免疫中必不可少的线粒体抗病毒信号蛋白,NS3/4A蛋白可裂解MAVS而抑制NF-κB信号通路的激活,减少I型干扰素的分泌来逃避先天免疫。因此阻断NS3/4A蛋白对MAVS的裂解可能有助于HCV的治疗 [25]。
Mainak Majumder在HEK 293T细胞中通过Pull-down实验和荧光素酶检测实验发现,NS5A能与TRADD相互作用并抑制TRADD介导的NF-κB-Luc荧光素酶的活性,这表明NS5A可通过干扰TRADD与TRAF2/RIP相互作用,抑制TNF-α介导的NF-κB的活化,从而促进HCV持续感染 [22] [26]。
在转染JFH-1 (基因型2a)RNA的Huh 7.5细胞中发现,Core、NS4B和NS5B能抑制TNF-α介导的NF-κB的活化,抑制了抗凋亡蛋白Bcl-xL、XIAP和c-FLIP的表达,这将有助于HCV逃避NF-κB引发的促炎反应,促进病毒复制,引起肝脏损伤 [27]。
4. 丁型肝炎病毒(Hepatitis D Virus, HDV)对NF-κB信号通路的调控
HDV是最小的人类环状负链RNA病毒,需要HBV提供包膜蛋白才能进行组装。在复制中可以编码大亚型(LHDAg)和小亚型(SHDAg)两种抗原亚型 [28]。HDV只能在伴随HBV感染的情况下通过合并感染进行传播 [29]。据估计,在HBV感染患者中有5%的患者同时感染了HDV [1]。在人胚肾细胞HEK293细胞和肝癌细胞Huh7细胞中,LHDAg与TRAF2蛋白相互作用,刺激IκBα泛素化并通过蛋白酶体途径降解,促进TNF-α介导的NF-κB激活。研究发现过度激活NF-κB可能参与了HDV相关疾病的发病过程 [30] [31]。
5. 戊型肝炎病毒(Hepatitis E Virus, HEV)对NF-κB信号通路的调控
HEV是急性肝炎的主要病原体之一。世界卫生组织(WHO)数据显示全球每年约有2000万人感染HEV,其中约7万人死于HEV感染引起的病毒性肝炎 [32]。戊型肝炎早期被认为是一种急性自限性疾病,健康人群4~6周内会自行恢复 [2]。随着戊型肝炎研究的深入,关于HEV持续性感染的临床报道日渐增多 [33]。HEV是一种准包膜正链RNA病毒,包含三个开放阅读框:ORF1、ORF2和ORF3,有八种基因型(HEV 1-8)和一个血清型 [34] [35]。宿主先天免疫在识别HEV病原体后会抑制病毒的复制。相应的,HEV已经进化出复杂的策略来逃避宿主细胞的先天免疫反应,从而成功建立感染 [36]。
Pradip B. Devhare等人发现A549细胞在感染HEV 12 h后观察到NF-κB启动子激活(17~20倍),24-72小时内p65的核累积明显增多,证实了NF-κB信号通路的激活参与HEV感染宿主的过程。同时,他们在感染HEV的细胞中发现,CCL5/RANTES在24 h的表达水平明显高于空白组(2.5~10倍),IL-6 (108~400 pg/ml)、IL-8 (1.7~11 ng/ml)和RANTES (258~420 pg/ml)在12~96小时内显著升高,激活宿主细胞先天免疫抗病毒反应。然而,HEV编码的一些蛋白参与了抑制宿主抗病毒反应 [4] [37]。基因1型HEV ORF3可在早期通过未折叠蛋白质应答(Unfolded protein response, UPR)瞬时激活NF-κB,促进IL-6、IL-12和TNF-α分泌,从而抑制HEV复制。随后通过ATF6通路上调TNF-α诱导的蛋白3 (TNFAIP3,又称A20),导致RIP1降解或失活,阻断NF-κB信号通路,抑制TNF-α、IL-8和IL-1β的表达,为HEV的复制提供一个良好环境 [38]。它还可通过降解TRADD,减少RIPI K63泛素化,从而抑制TLR3介导的NF-κB的表达 [39]。在Huh7细胞中,ORF2可以直接与F-box蛋白β-TrCP相互作用,减少IκBα蛋白的泛素化和降解,抑制NF-κB的表达,为病原体建立持续感染提供一个可能依据 [40]。
HEV可在早期激活NF-κB,激活宿主抗病毒免疫反应,但其编码的相关蛋白ORF2、ORF3可与许多细胞蛋白相互作用,逃逸宿主免疫清除机制,为病毒自身在宿主细胞中的复制提供有利条件。
6. 结语
近年来,肝炎病毒感染所引发的慢性肝炎、肝硬化和肝癌发病率逐年上升,对人们的生命安全造成极大威胁 [3]。在这四种肝炎病毒中,乙型肝炎与丙型肝炎对人类危害最大,全球有超过5亿人口的乙型肝炎和/或丙型肝炎患者为慢性化感染,有更大的机率发展为肝癌 [3]。研究证明,NF-κB信号通路与肝炎和肝癌有着密切联系 [41]。因此,迫切需要了解肝炎病毒与NF-κB之间的关系,发现新型抗病毒治疗策略,降低病毒感染导致的损伤。
激活NF-κB是机体免疫防御的一部分,肝炎病毒感染宿主细胞后首先会被PRR识别,激活NF-κB信号通路,产生多种细胞因子,进而诱导适应性免疫应答。大多数急性肝炎患者在机体无任何临床症状时,病毒就已经被机体清除。但许多病毒会通过调控NF-κB信号通路来逃逸宿主先天免疫,从而成功建立持续性感染,对机体造成慢性损伤。本文对HBV、HCV、HDV和HEV在感染过程中对NF-κB信号通路的调控进行了总结,如图1所示。
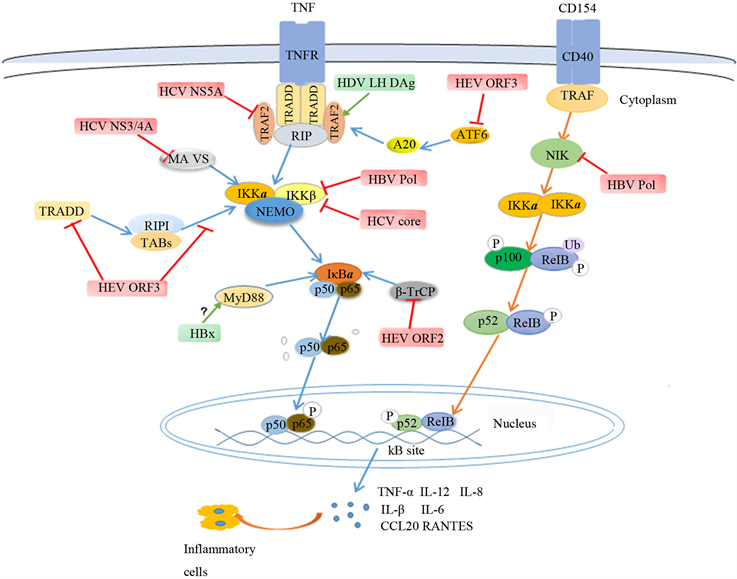
Figure 1. Regulation of NF-κB signaling pathway by hepatitis virus infection
图1. 肝炎病毒感染对NF-κB信号通路的调控
由于甲型肝炎病毒感染早期可激活先天免疫应答,有效地预防了疾病的发生,因此甲型肝炎发病率较低。自甲型肝炎疫苗上市后,从1990年至2017年,甲肝发病率明显下降,其中天津市做为全国甲肝发病率最低的城市,2011年发病率仅为0.12/10万 [42] [43]。因此,甲型肝炎病毒与NF-κB信号通路是否有相互作用尚无报道。
本文就NF-κB信号通路在肝炎病毒感染过程中发挥的作用进行了综述,对病毒感染过程中与NF-κB信号通路相互作用产生的细胞因子进行了总结,如表1所示。这为进一步了解宿主如何抵抗肝炎病毒感染以及肝炎病毒如何逃逸宿主抗病毒先天免疫提供了策略,并为今后研发病毒性肝炎药物提供了基础。
Table 1. Relationship between hepatitis virus and NF-κB
表1. 肝炎病毒与NF-κB的关系
致谢
感谢昆明理工大学病毒与免疫课题组提供实验环境。
基金项目
国家自然科学基金项目(81660338);国家自然科学基金项目(31360619)。
利益冲突
无。
文章引用
王文静,龚石林,禹文海,黄 芬. 肝炎病毒对NF-κB信号通路的调控作用
Regulation of NF-Kappa B Signaling Pathway by Hepatitis Viruses[J]. 生物医学, 2020, 10(03): 35-42. https://doi.org/10.12677/HJBM.2020.103006
参考文献
- 1. Eller, C., et al. (2018) The Functional Role of Sodium Taurocholate Cotransporting Polypeptide NTCP in the Life Cycle of Hepatitis B, C and D Viruses. Cellular and Molecular Life Sciences, 75, 3895-3905. https://doi.org/10.1007/s00018-018-2892-y
- 2. Kamar, N., et al. (2012) Hepatitis E. The Lancet, 379, 2477-2488. https://doi.org/10.1016/S0140-6736(11)61849-7
- 3. El-Serag, H.B. (2012) Epidemiology of Viral Hepatitis and Hepatocellular Carcinoma. Gastroenterology, 142, 1264-1273e1. https://doi.org/10.1053/j.gastro.2011.12.061
- 4. Kang, S. and Myoung, J. (2017) Host Innate Immunity against Hepatitis E Virus and Viral Evasion Mechanisms. Journal of Microbiology and Biotechnology, 27, 1727-1735. https://doi.org/10.4014/jmb.1708.08045
- 5. Chan, S.T. and Ou, J.J. (2017) Hepatitis C Virus-Induced Autophagy and Host Innate Immune Response. Viruses, 9, 224. https://doi.org/10.3390/v9080224
- 6. Jensen, S. and Thomsen, A.R. (2012) Sensing of RNA Viruses: A Review of Innate Immune Receptors Involved in Recognizing RNA Virus Invasion. Journal of Virology, 86, 2900-2910. https://doi.org/10.1128/JVI.05738-11
- 7. Scott, O. and Roifman, C.M. (2019) NF-κB Pathway and the Goldilocks Principle: Lessons from Human Disorders of Immunity and Inflammation. Journal of Allergy and Clinical Immunology, 143, 1688-1701. https://doi.org/10.1016/j.jaci.2019.03.016
- 8. Viatour, P., Merville, M.-P., Bours, V. and Chariot, A. (2005) Phosphorylation of NF-κB and IκB Proteins: Implications in Cancer and Inflammation. Trends in Biochemical Sciences, 30, 43-52. https://doi.org/10.1016/j.tibs.2004.11.009
- 9. Fortin, J.-F., Barat, C., Beausejour, Y., Barbeau, B. and Tremblay, M.J. (2004) Hyper-Responsiveness to Stimulation of Human Immunodeficiency Virus-Infected CD4+ T Cells Requires Nef and Tat Virus Gene Products and Results from Higher NFAT, NF-κB, and AP-1 Induction. Journal of Biological Chemistry, 279, 39520-39531. https://doi.org/10.1074/jbc.M407477200
- 10. Oie, K.L. and Pickup, D.J. (2001) Cowpox Virus and Other Mem-bers of the Orthopoxvirus Genus Interfere with the Regulation of NF-κB Activation. Virology, 288, 175-187. https://doi.org/10.1006/viro.2001.1090
- 11. Yu, Z., et al. (2016) Effects of T Cell Immunoglobulin and Mucin Domain-Containing Molecule-3 Signaling Molecule on Human Monocyte-Derived Dendritic Cells with Hepatitis B Virus Surface Antigen Stimulation in Vitro. Molecular Medicine Reports, 13, 2785-2790. https://doi.org/10.3892/mmr.2016.4815
- 12. Zhang, S., Wang, F. and Zhang, Z. (2017) Current Advances in the Elimination of Hepatitis B in China by 2030. Frontiers in Medicine, 11, 490-501. https://doi.org/10.1007/s11684-017-0598-4
- 13. Tong, S., Li, J., Wands, J.R. and Wen, Y.-M. (2013) Hepatitis B Virus Genetic Variants: Biological Properties and Clinical Implications. Emerging Microbes & Infections, 2, e10. https://doi.org/10.1038/emi.2013.10
- 14. Liu, D., et al. (2014) Hepatitis B Virus Polymerase Suppresses NF-κB Signaling by Inhibiting the Activity of IKKs via Interaction with Hsp90beta. PLoS ONE, 9, e91658. https://doi.org/10.1371/journal.pone.0091658
- 15. Xiang, W.Q., Feng, W.-F., Zhen, W.K., Zhi, S. and Liu, C.W. (2011) Hepatitis B Virus X Protein Stimulates IL-6 Expression in Hepatocytes via a MyD88-Dependent Pathway. Journal of Hepatology, 54, 26-33. https://doi.org/10.1016/j.jhep.2010.08.006
- 16. Hosel, M., et al. (2009) Not Interferon, But Interleukin-6 Controls Early Gene Expression in Hepatitis B Virus Infection. Hepatology, 50, 1773-1782. https://doi.org/10.1002/hep.23226
- 17. Chen, Z., et al. (2017) Hepatitis B Virus Core Antigen Stimulates IL-6 Expression via p38, ERK and NF-κB Pathways in Hepatocytes. Cellular Physiology and Biochemistry, 41, 91-100. https://doi.org/10.1159/000455954
- 18. Liu, C., et al. (2017) HBV X Protein Induces Overexpression of HERV-W env through NF-κB in HepG2 Cells. Virus Genes, 53, 797-806. https://doi.org/10.1007/s11262-017-1479-2
- 19. Shi, J., et al. (2017) Current Progress in Host Innate and Adaptive Immunity against Hepatitis C Virus Infection. Hepatology International, 11, 374-383. https://doi.org/10.1007/s12072-017-9805-2
- 20. 唐立红, 等. 丙型肝炎流行病学及临床检验技术研究进展[J]. 实验与检验医学, 2019, 37(4): 553-556.
- 21. Warkad, S.D., et al. (2018) Performance of 6 HCV Genotyping 9G Test for HCV Genotyping in Clinical Samples. Virology Journal, 15, 107. https://doi.org/10.1186/s12985-018-1017-4
- 22. Xie, Z., Xiao, Z. and Wang, F. (2017) Hepatitis C Virus Non-structural 5A Protein (HCV-NS5A) Inhibits Hepatocyte Apoptosis through the NF-κb/miR-503/bcl-2 Pathway. Mole-cules and Cells, 40, 202-210.
- 23. Ray, R.B., et al. (2002) Distinct Functional Role of Hepatitis C Virus Core Protein on NF-κB Regulation Is Linked to Genomic Variation. Virus Research, 87, 21-29. https://doi.org/10.1016/S0168-1702(02)00046-1
- 24. Joo, M., et al. (2005) Hepatitis C Virus Core Protein Sup-presses NF-κB Activation and Cyclooxygenase-2 Expression by Direct Interaction with IκB Kinase Beta. Journal of Virology, 79, 7648-7657. https://doi.org/10.1128/JVI.79.12.7648-7657.2005
- 25. Li, X.D., et al. (2005) Hepatitis C Virus Protease NS3/4A Cleaves Mitochondrial Antiviral Signaling Protein off the Mitochondria to Evade Innate Immunity. Proceedings of the National Academy of Sciences of the United States of America, 102, 17717-17722. https://doi.org/10.1073/pnas.0508531102
- 26. Majumder, M., et al. (2002) Hepatitis C Virus NS5A Protein Im-pairs TNF-Mediated Hepatic Apoptosis, But Not by an Anti-FAS Antibody, in Transgenic Mice. Virology, 294, 94-105. https://doi.org/10.1006/viro.2001.1309
- 27. Park, J., et al. (2012) Hepatitis C Virus Infection Enhances TNFalpha-Induced Cell Death via Suppression of NF-κB. Hepatology, 56, 831-840. https://doi.org/10.1002/hep.25726
- 28. Huang, I.C., Chien, C.-Y., Huang, C.-R. and Lo, S.J. (2006) Induction of Hepatitis D Virus Large Antigen Translocation to the Cytoplasm by Hepatitis B Virus Surface Antigens Correlates with Endoplasmic Reticulum Stress and NF-κB Activation. Journal of General Virology, 87, 1715-1723. https://doi.org/10.1099/vir.0.81718-0
- 29. Botelho-Souza, L.F., et al. (2017) Hepatitis Delta: Virological and Clinical Aspects. Virology Journal, 14, 177. https://doi.org/10.1186/s12985-017-0845-y
- 30. Williams, V., et al. (2012) Large Hepatitis Delta Antigen Activates STAT-3 and NF-κB via Oxidative Stress. Journal of Viral Hepatitis, 19, 744-753. https://doi.org/10.1111/j.1365-2893.2012.01597.x
- 31. CY, P., et al. (2009) Hepatitis Delta Virus Large Antigen Sensitizes to TNF-Alpha-Induced NF-κB Signaling. Molecules and Cells, 28, 49-55. https://doi.org/10.1007/s10059-009-0100-5
- 32. Rein, D.B., et al. (2012) The Global Burden of Hepatitis E Virus Genotypes 1 and 2 in 2005. Hepatology, 55, 988-997. https://doi.org/10.1002/hep.25505
- 33. Nassim, K., et al. (2011) Factors Associated with Chronic Hepatitis in Pa-tients with Hepatitis E Virus Infection Who Have Received Solid Organ Transplants. Gastroenterology, 140, 1481-1489. https://doi.org/10.1053/j.gastro.2011.02.050
- 34. Lu, L., Li, C. and Hagedorn, C.H. (2006) Phylogenetic Analysis of Global Hepatitis E Virus Sequences: Genetic Diversity, Subtypes and Zoonosis. Reviews in Medical Virology, 16, 5-36. https://doi.org/10.1002/rmv.482
- 35. Todt, D., et al. (2016) In Vivo Evidence for Ribavirin-Induced Muta-genesis of the Hepatitis E Virus Genome. Gut, 65, 1733-1743. https://doi.org/10.1136/gutjnl-2015-311000
- 36. Xu, L., et al. (2017) Noncanonical Antiviral Mechanisms of ISGs: Dispensability of Inducible Interferons. Trends in Immunology, 38, 1-2. https://doi.org/10.1016/j.it.2016.11.002
- 37. Devhare, P.B., et al. (2013) Analysis of Antiviral Response in Human Epithelial Cells Infected with Hepatitis E Virus. PLoS ONE, 8, e63793. https://doi.org/10.1371/journal.pone.0063793
- 38. Xu, J., et al. (2014) Open Reading Frame 3 of Genotype 1 Hepatitis E Virus Inhibits Nuclear Factor-Kappaappa B Signaling Induced by Tumor Necrosis Factor-Alpha in Human A549 Lung Epithelial Cells. PLoS ONE, 9, e100787. https://doi.org/10.1371/journal.pone.0100787
- 39. He, M., et al. (2016) The ORF3 Protein of Genotype 1 Hepatitis E Virus Suppresses TLR3-Induced NF-κB Signaling via TRADD and RIP1. Scientific Reports, 6, Article No. 27597. https://doi.org/10.1038/srep27597
- 40. Surjit, M., Varshney, B. and Lal, S.K. (2012) The ORF2 Glycoprotein of Hepatitis E Virus Inhibits Cellular NF-κB Activity by Blocking Ubiquitination Mediated Proteasomal Degradation of IκBα in Human Hepatoma Cells. BMC Biochemistry, 13, 7. https://doi.org/10.1186/1471-2091-13-7
- 41. Michael, K. (2006) Nuclear Factor-κB in Cancer Development and Progression. Nature, 441, 431-436. https://doi.org/10.1038/nature04870
- 42. 毛群颖, 等. 甲型肝炎疫苗的研发和应用[J]. 中国生物制品学杂志, 2017, 30(9): 999-1002.
- 43. Sun, X.J., et al. (2019) Changes in the Epidemiology of Hepatitis A in Three So-cio-Economic Regions of China, 1990-2017. Infectious Diseases of Poverty, 8, 80. https://doi.org/10.1186/s40249-019-0591-z
