Hans Journal of Biomedicine
Vol.
11
No.
04
(
2021
), Article ID:
44945
,
6
pages
10.12677/HJBM.2021.114025
人ABO血型PCR与限制性片段长度多态性的遗传分析
白东升,康宇佳,石金磊
上海科技大学生命科学与技术学院,上海

收稿日期:2021年7月23日;录用日期:2021年8月13日;发布日期:2021年9月1日

摘要
由于三个等位基因IA、IB、i的不同组合,红细胞表面带有不同的抗原,因而ABO血型分为A型、B型、AB型、O型。其中A型血个体的基因型可能是IAIA或IAi,B型血个体的基因型可能是IBIB或IBi,因此,利用血清学方法无法直接判断A或B型血个体的基因型。根据IA、IB与i基因在序列上的区别,应用PCR与限制性内切酶片段长度多态性相结合的技术,可以进行人ABO血型的基因型鉴定。本实验用PCR-RFPL法对一名A型血个体进行基因型鉴定,并用测序进行验证。结果显示,PCR-RFLP法与测序得到的结论一致,说明该方法可行性较高。
关键词
PCR-RFLP,ABO血型,自主设计,开放式实验教学

Genetic Analysis of Human ABO Blood Type by PCR and Restriction Fragment Length Polymorphism
Dongsheng Bai, Yujia Kang , Jinlei Shi
School of Life Science and Technology, Shanghai Tech University, Shanghai

Received: Jul. 23rd, 2021; accepted: Aug. 13th, 2021; published: Sep. 1st, 2021

ABSTRACT
Due to different combinations of alleles IA, IB and i, red blood cells carry different kinds of antigens, for which there are four blood types: A, B, AB and O in the ABO blood type system. Genotype of individuals with A blood type can be IAi or IAIA, and genotype of people with B type can be IBi or IBIB. As a result, we cannot know the genotype of people with A or B blood type directly by serological methods. According to the difference of sequences between IA, IB and i, we can use PCR combined restriction fragment length polymorphism method to identify genotype of human ABO blood type. In this experiment, we analyzed genotype of one individual with A blood type by PCR-RFLP and verified the result by sequencing. The result showed that the conclusion of PCR-RFLP and sequencing method is coincided, which means that PCR-RFLP is feasible.
Keywords:PCR-RFPL, ABO Blood Type, Self-Design, Open Experimental Teaching

Copyright © 2021 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
ABO血型系统是第一个被描述的红细胞血型系统,也是最具有临床意义的一个系统 [1]。ABO血型由IA、IB、i等位基因的组合决定,其中IA、IB基因分别编码N-乙酰半乳糖胺转移酶和D-半乳糖糖基转移酶,可以对抗原前体H进行不同的修饰,从而得到A、B抗原;i基因由于碱基缺失导致密码子移位,终止密码子提前出现,不能合成相关的酶,因此,抗原前体H保持不变 [2]。基因型为IAIB的个体为AB血型,ii的个体为O血型,IAIA或IAi的个体为A血型,IBIB或IBi的个体为B血型。
人的ABO血型在分析家谱、亲缘关系鉴定等方面有重要的作用,因此鉴定个体的ABO血型和基因型有重要的意义。利用带有A抗原的红细胞遇到A抗体会凝集,带有B抗原的红细胞遇到B抗体也会凝集的特性,可以将抗体加入到血液样品中,如果发生凝集,则待测个体有对应的抗原。根据个体的抗原的种类,可以确定其血型。AB或O型血的个体的基因型可以直接确定,但A或B血型的个体由于可能是杂合子或纯合子,基因型无法通过抗体凝集法确定。
ABO血型决定基因定位于9q34.1-9q34.2,包含了7个外显子和6个内含子。其中第6、7号外显子负责编码ABO糖基转移酶的催化结构域 [3]。本文采用Polymerase Chain Reaction-Restriction Fragment Length Polymorphism (PCR-RFLP)方法鉴定A或B血型个体的基因型。由于6号外显子上G258的存在,IA或IB基因与i基因相比,在这个位点多出了一个BstEII酶的酶切位点,而少了一个KpnI酶切位点 [3]。首先PCR扩增一段在IA基因和IB基因中完全相同且包含G258的DNA片段(i基因中对应的片段没有G258),然后用限制性内切酶处理PCR产物,最后进行琼脂糖凝胶电泳检测,根据条带来判断PCR产物的成分,进而确定待测个体的基因型。
2. 实验材料
2.1. 实验用品
2.1.1. 试剂
人唾液DNA提取试剂盒购自上海生工;高保真PCR试剂购自擎科公司;引物由上海铂尚公司合成;PCR产物纯化试剂盒购自MACHEREY-NAGEL公司;DNA 10× loading buffer购自诺唯赞公司;BstEII和KpnI限制性内切酶购自NEB公司;DNA marker购自全式金公司。
2.1.2. 仪器与耗材
移液器,1.5 mL EP管,金属浴,PCR仪,琼脂糖凝胶电泳装置,凝胶成像仪,台式离心机,锥形瓶,药匙,电子天平,微波炉,NanoDrop2000超微量分光光度计。
3. 实验方法
3.1. DNA提取
分别收集一名AB血型个体、一名O型血个体和一名A型血个体的唾液,按照人唾液DNA提取试剂盒的使用说明书提取DNA。取250 uL唾液至1.5 mL EP管中,加入350 μL Buffer CL和20 μL Proteinase K,震荡混匀,65℃水浴20 min,间或混匀。向离心管中加入300 μL无水乙醇,充分混匀,然后将全部溶液和沉淀物转移至硅胶膜吸附柱内(吸附柱放入收集管中),10000 rpm离心1 min,倒掉收集管中溶液,将吸附柱放回收集管中。向吸附柱中加入500 μL Wash Solution (已经加过乙醇),10,000 rpm离心1 min,倒掉收集管中溶液,将吸附柱放回收集管中,并重复一次。将吸附柱放回收集管中,12,000 rpm离心2 min。取出吸附柱,放入一个新的1.5 mL离心管中,在吸附膜中央加入50 μL TE Buffer,静置3 min,12,000 rpm离心2 min,得到人唾液基因组DNA,并用NanoDrop2000测浓度。
3.2. PCR扩增
根据ABO血型基因6号外显子序列设计引物如下:
引物1:5’-GCTGCTTCGTTCTCTCCTCT-3’
引物2:5’-TGAACACAAGGAGAGACCTC-3’
这两个引物可以用于扩增一段包含G258的区域,序列长度为674 bp。设置4组PCR反应:#1组:用A血型个体的DNA样品作为模板;#2组:用AB血型个体的DNA样品作为模板;#3组:用O血型个体的DNA样品作为模板;#4组:用等量O血型个体的DNA样品和AB血型个体的DNA样品作为模板。每组配置两管50 uL反应体系。PCR反应条件:98℃预变性2 min,98℃变性10 s,57℃退火10 s,72℃延伸10 s,35个循环,72℃延伸1 min。
3.3. PCR产物鉴定、测序和纯化
用1%琼脂糖凝胶进行电泳,设定电压130 V,时间25 min。每管取1 μL PCR产物混合0.1 μL 10× loading buffer上样。如果出现目的条带,则每组各取一管送测序,另一管进行PCR产物纯化,用于后续实验。如果杂带较少,则直接纯化;如果杂带较多,则将剩余PCR产物电泳并进行凝胶回收。
用PCR产物纯化试剂盒进行凝胶回收。将剩下的4管PCR产物用1%琼脂糖凝胶进行电泳,设定电压130 V,时间25 min。切下只含有目的条带的凝胶,放入1.5 mL EP管中,每100 mg凝胶加入200 uL Buffer NT1,50℃加热10 min,间或震荡。收集柱放入收集管中,将液体倒入收集柱中,11,000 g离心30 s。倒去废液,将收集柱重新放回收集管中。向收集柱中加入700 uL Buffer NT3,11,000 g离心30 s,倒去废液,将收集柱重新放回收集管中,并重复一次。11,000 g离心1 min,将收集柱放入干净的1.5 mL EP管中,EP管用70℃金属浴加热2 min。向收集柱中加入30 uL Buffer NE,室温静置1min,11,000 g离心1 min。得到纯化的DNA片段。
3.4. 酶切消化
分别使用BstEII和Kpn I消化4种纯化后的PCR产物。构建10 uL酶切反应体系和10 uL对照体系(后者除了将限制性内切酶换为等量的双蒸水之外,与前者完全相同),37℃反应1 h。
3.5. 酶切结果检测
配制1%琼脂糖凝胶进行电泳,设定电压130 V,时间30 min。取9 μL PCR产物混合1 μL 10×上样缓冲液上样,根据条带判断基因型。
4. 实验结果
4.1. PCR-RFLP 鉴定结果
引物1和2用于扩增一段含有G258的片段,用于区分A或B基因与O基因。图1为PCR的电泳检测结果,可以看到每一管反应体系都出现了目的条带。A或B基因的PCR产物(以下简称pA)长度为674 bp,在G258的位置有一个BstEII酶切位点;O基因的PCR产物(以下简称pO)长度为673 bp,在缺失G258的位置有一个KpnI酶切位点。因此,pA被BstEII酶切为478 bp和196 bp的片段,被KpnI切为530 bp和144 bp的片段;pO无法被BstEII酶切,被KpnI切为334 bp、195 bp和144 bp的片段。不同基因型的个体的PCR产物由于含有不同的片段,在经过酶切后会有不同的电泳结果。表1为基因型对应的电泳结果,+表示会出现这个条带。注意表中标注的DNA片段的长度均为估计值,实际长度可能与这些值相差几个碱基,但这种微小的差异对琼脂糖凝胶电泳的结果基本没有影响。
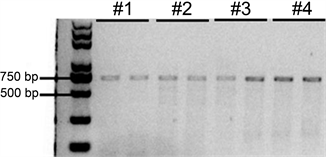 PCR产物纯化前电泳检测,可以看到在700 bp附近都可以看到一条单一条带。
PCR产物纯化前电泳检测,可以看到在700 bp附近都可以看到一条单一条带。
Figure 1. Results of PCR electrophoresis
图1. PCR电泳结果
Table 1. Genotype and enzyme digestion results
表1. 基因型与对应的酶切结果
本实验用O血型个体和AB血型个体的基因组样本作为对照,检测了一名A血型个体的基因型。AB血型个体的PCR产物(#2)中只有pA;O型血个体的PCR产物(#3中只有pO);等量AB血型个体基因组和O血型个体基因组的混合物的PCR产物(#4)中有pA和pO,因而可以被看做A或B型血的杂合子的基因组PCR产物。图2为各组的PCR产物酶切后的电泳结果,其中#1为待测A型血个体的实验结果。从电泳结果可知,#1的结果总是与#2相同,所以待测A血型个体为纯合子,基因型为AA。
 酶切电泳结果,+表示体系中加入酶,−表示将酶换为水。(a) BstEII酶切电泳结果;(b) KpnI酶切电泳结果。
酶切电泳结果,+表示体系中加入酶,−表示将酶换为水。(a) BstEII酶切电泳结果;(b) KpnI酶切电泳结果。
Figure 2. Results of enzyme digestion electrophoresis
图2. 酶切电泳结果
4.2. 测序结果
#1、#2和#3的测序峰图清晰,无杂峰(如图3(a)、图3(b)和图3(c))。#1和#2中存在G258,说明二者中只含有pA;而#3中没有G258,说明#3中只含有pO。#4的G258的位置有G对应的黑色峰,但从G258的位置开始全都是杂峰,且多数位置是两个不同颜色的峰(如图3(d))。这说明#4中有两种DNA片段,且其中一种片段(即pA)有G258,另一种(即pO)没有,所以从G258的位置开始出现错位。#2、#3和#4的测序结果与之前预测的各组的PCR产物的成分对应。#1的测序结果与#2完全相同,说明待测的A血型个体为纯合子,基因型为AA,这个结果与PCR-RFLP实验的结果相同。
 (a) #1的测序结果,红圈标出了G258;(b) #2的测序结果,红圈标出了G258;(c) #3的测序结果,没有G258;(d) #4的测序结果,虽然有G258,但从此开始出现杂峰。
(a) #1的测序结果,红圈标出了G258;(b) #2的测序结果,红圈标出了G258;(c) #3的测序结果,没有G258;(d) #4的测序结果,虽然有G258,但从此开始出现杂峰。
Figure 3. Sequencing results
图3. 测序结果
5. 结语
ABO血型是一种重要的血型分类系统,在输血、刑侦、鉴定亲缘关系等领域有重要的作用。利用红细胞在相应的抗体的作用下可以凝集的特点,可以快速判断待测个体的血型。如果确定该个体为AB型血或O型血,则基因型可以直接确定;但如果该个体为A型血或B型血,则抗体凝集的方法无法判断基因型。对于A或B型血的个体,判断其基因型最好用判断等位基因种类的方法。随着分子生物学技术的迅猛发展,血型的基因检测研究也取得了突破性进展。有通过双链探针,采用实时PCR方法对个体进行ABO血型基因的分型,也有应用单管PCR,通过基因扫描(Gene Scan)的方法进行ABO血型基因的分型,还有采用分子信标的方法对ABO血型进行基因分型 [2] [4] [5] [6]。
国内许多高校在遗传学实验教学过程中也经常采用PCR-RFLP技术对ABO血型进行基因分型,并取得不错的教学效果 [7] [8]。在实际的教学过程中,我们发现由于PCR片段设计得过短,DNA酶切并电泳之后,小片段经常看得不是很清楚。因此,我们重新设计了引物,使PCR产物长度达到了674 bp,同时,选用了BstEII和KpnI对一份PCR产物进行酶切分型,简化了实验步骤,大大提高了成功率,所有的酶切分型结果同时用测序继续进行了验证,证实本实验方法切实有效。为了更方便地确定结果,在对AB血型DNA进行处理的同时也将等量AB型血的DNA与O型血DNA混合并处理。如果待测样本的酶切结果与AB型血DNA的酶切结果相同,则待测个体为纯合子;如果待测样本与混合DNA的酶切结果相同,则个体为杂合子。这样不仅方便确定结果,还可以证明AB型血的DNA的酶切结果与混合DNA不同的原因是二者的DNA成分不同,而不是某个反应体系中酶切不彻底。
无论是BstEII酶切,KpnI酶切,还是测序,结果都显示待测个体为纯合子。所以,任何一种方法都可以鉴定A或B血型个体的基因型。考虑到测序所需要的时间较长,所以推荐酶切法,且只需要一种限制酶进行反应就可以得出结论。
本实验在加深学生对ABO血型系统的了解的同时,锻炼了学生的动手能力和设计、优化实验方案的能力,比如PCR的过程可以让学生根据电泳鉴定结果判断反应体系和程序是否合适,进而掌握优化PCR反应的方法;学生考虑设计几组实验、每组实验如何设计的过程可以增强学生的逻辑思考能力。通过最终的实验结果,可以加深学生对复等位基因的理解,同时领会表现型与基因型的关系。本实验是上海科技大学遗传学实验课程的自主设计实验,旨在让学生通过自己设计实验,感受到科研的趣味性和实际用途,在实验成功后获得成就感,为之后的科研生活打下基础。
文章引用
白东升,康宇佳,石金磊. 人ABO血型PCR与限制性片段长度多态性的遗传分析
Genetic Analysis of Human ABO Blood Type by PCR and Restriction Fragment Length Polymorphism[J]. 生物医学, 2021, 11(04): 195-200. https://doi.org/10.12677/HJBM.2021.114025
参考文献
- 1. Landsteiner, K. (1900) Zur Kenntnis der antifermativen, lytischen und agglutinierenden Wirkungendes Blutserums und der Lymphe. Zentbl Bakt Parasitkde (Abt), 27, 357-363.
- 2. 胡健, 等. ABO血型综合实验基因分型技术简化及其群体遗传分析拓展[J]. 遗传, 2017, 39(5): 423-429.
- 3. Yamamoto, F., et al. (1990) Molecular Genetic Basis of the Histo-Blood Group ABO System. Nature, 345, 229-233. https://doi.org/10.1038/345229a0
- 4. 赵会安, 等. 单管实时PCR快速检验ABO基因型[J]. 中国法医学杂志, 2007, 22(6): 363-365.
- 5. 刘长利, 等. 复合PCR技术在ABO血型基因分型中的应用[J]. 北京医学, 2007, 29(2): 109-111.
- 6. 皮妍, 等. 遗传学实验的教学改革——经典实验与新技术相融合(一) [J]. 高校生物学教学研究(电子版), 2017. 7(3): 53-57.
- 7. 赵健, 等. 人类血型性状综合遗传大实验的设计与教学实践[J]. 遗传, 2016. 38(5): 461-466.
- 8. 王晨航, 康宇佳, 石金磊. PCR-RFLP方法鉴定ABO血型基因型[J]. 生物医学, 2020. 10(2): 13-18. https://doi.org/10.12677/HJBM.2020.102003
