Hans Journal of Chemical Engineering and Technology
Vol.06 No.03(2016), Article ID:17624,12
pages
10.12677/HJCET.2016.63006
Determination of Allura Red by Tx-100 Sensitization CdTe QDs Fluorescence Quenching Method
Liu Ye, Xiashi Zhu
College of Chemistry & Chemical Engineering, Yangzhou University, Yangzhou Jiangsu

Received: Apr. 29th, 2016; accepted: May 21st, 2016; published: May 24th, 2016
Copyright © 2016 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
The fluorescence quenching effect of Allura red on the water-soluble CdTe quantum dots (CdTe QDs) in surfactant Tx-100 medium was investigated. Based on the Tx-100 sensitization CdTe QDs fluorescence quenching, a novel method for the determination of Allura red was proposed. Under the optimal conditions, the relationship of Allura red concentration in the 0.6 - 60.0 µg/mL range and CdTe QDs fluorescence quenching value was linear. The linear regression equation and the linear correlation were ΔF = 12.86c-77.36 (c:µg/mL) and 0.9939, respectively. The limit of detection was found to be 0.35 µg/mL (the definition of limit of detection was LOD = 3σ/k, where σ was the standard deviation and k was the slope of the standard curve). The sensitized mechanism and fluorescence quantum yield in different media were discussed preliminarily. The method has been applied to the determination of Allura red in samples with satisfactory results.
Keywords:Allura Red, Cadmium Telluride Quantum Dots, Tx-100, Sensitization, Fluorescence Quenching

Tx-100增敏碲化镉量子点荧光猝灭法 分析诱惑红
叶柳,朱霞石
扬州大学化学化工学院,江苏 扬州

收稿日期:2016年4月29日;录用日期:2016年5月21日;发布日期:2016年5月24日

摘 要
本文研究表面活性剂Tx-100介质中诱惑红对水溶性碲化镉量子点(CdTe QDs)荧光猝灭效应。建立Tx-100增敏CdTe QDs荧光猝灭法测定诱惑红(Allura red)新方法。结果表明:Tx-100介质中,Allura red对CdTe QDs荧光猝灭值增大,Allura red浓度在0.6~60.0 µg/mL范围内与CdTe QDs荧光猝灭值呈良好线性关系,其线性回归方程为ΔF=12.86c + 77.36 (c:µg/mL),线性相关系数为0.9939,检出限为0.35µg/mL(检出限定义为LOD = 3 σ/k,其中,σ是标准偏差,k是标准曲线的斜率)。本文初步探讨了增敏机制和在不同介质中的荧光量子产率。该法测定实际样品中Allura red,结果令人满意。
关键词 :诱惑红,碲化镉量子点,Tx-100,增敏,荧光猝灭

1. 引言
诱惑红(Allura red)是一种食用色素 [1] ,它是由4-氨基-5-甲氧基-2-甲基苯磺酸经重氮化后与6-羟基-2-萘磺酸钠偶合而成的合成染料(图1),化学名称为6-羟基-5-(2-甲氧基-4-磺酸-5-甲苯基)偶氮萘-2-磺酸二钠盐 [2] 。国际染料索引称为食用红色17(Food Red 17),美国、日本等国又称为食用红色40(Red 40),溶于水、甘油与丙二醇,微溶于乙醇,不溶于油脂,可以添加到饮料,果酒,火腿、灌肠、果冻、油炸、膨化食品等中增加其色彩吸引力。诱惑红是一种含有偶氮官能团和芳环结构的合成染料,具有潜在的基因毒性 [3] ,可引起过敏反应 [4] 和儿童多动症 [5] 。它在丹麦、比利时、法国、德国、瑞士、瑞典、奥地利、挪威等国家是禁止使用的 [6] 。
目前,测定Allura red方法为分光光度法 [7] ,电化学传感器法 [8] ,毛细管电泳法 [9] ,微分脉冲极谱法 [10] ,超高效液相色谱–质谱联用法 [11] ,高效液相色谱法 [12] 。但这些方法操作复杂,为此要寻找简单高效的方法至关重要。
在荧光法中荧光探针技术起到重要作用。荧光探针种类主要包括金属离子、染料、金属–络合物、纳米材料等 [13] 。纳米荧光探针主要包括无机发光量子点、荧光聚合物纳米微球和复合荧光二氧化硅纳米粒子等。无机发光量子点荧光探针具有激发光谱宽、发射光谱窄、荧光强度大、稳定性好等优点,按其材料组成可分为元素半导体量子点(如Se量子点)、异质结量子点(如ZnO量子点)和化合物半导体量子点(ZnSe、CdSe、ZnS、CdS、CdTe量子点) [14] - [16] 。已有报道利用CdTe量子点荧光探针测定甲磺酸培氟沙星、山奈酚和栀子甙等 [17] - [19] 。
合适的介质可以提高光谱分析灵敏度。本课题组研究表明:分子有序组合体(表面活性剂、离子液体、β-环糊精)对紫外吸收光谱法和荧光法具有增敏作用,并已用于金属离子、药物、染料等方面,同时对增敏机理进行了初步探讨 [20] - [22] 。已报道利用钇纳米光谱探针荧光増敏法分析橙皮苷 [13] ,利用Tx-100增敏CdTe QDs荧光探针法测定Allura red的文献未见报道。
本文建立Tx-100增敏CdTe QDs荧光法测定Allura red新方法。该方法操作简单,快速方便且具有较高的灵敏度,在用于测定糖、果冻和膨化食品等食品中添加剂Allura red测定,结果令人满意。
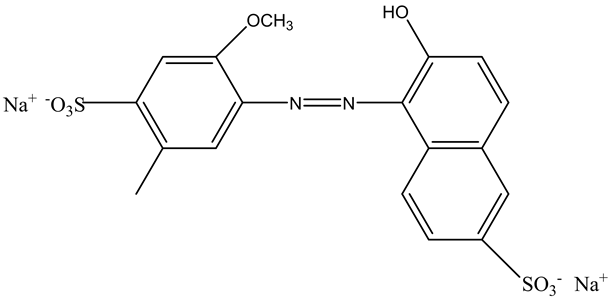
Figure 1. Chemical structure of Allura red
图1. Allura red的结构示意图
2. 实验部分
2.1. 仪器与试剂
数显恒温水浴锅,电动搅拌器(国华电器有限公司);荧光分光光度计(日本日立公司,F-4500),紫外–可见分光光度计(SHIMADZU, UV-2550);DZF-6020真空干燥箱(精宏实验设备有限公司,上海),TG16-WS台式高速离心机。
所有试剂均为分析纯,除非另外说明。实验中使用到的试剂有硼氢化钠(国药集团化学试剂有限公司)、碲粉(国药集团化学试剂有限公司)、四水硝酸镉(国药集团化学试剂有限公司)、硫代乙醇酸(国药集团化学试剂有限公司)、氢氧化钠(国药集团化学试剂有限公司)、曲拉通X-100(国药集团化学试剂有限公司)、乙醇、丙酮、Allura red储备液(0.1g/L)。
2.2. 实验方法
参照文献 [23] 合成如下水溶性碲化镉量子点的合成如下,准确称取0.0686 g碲粉和0.0864 g硼氢化钠于离心管中,加入2 mL蒸馏水置于室温(19℃)反应7小时至黑色碲粉完全消失得到紫色透明的NaHTe水溶液。在氮气保护下,于50 mL浓度为0.02 mol/L硝酸镉水溶液中加入0.2 mL硫代乙醇酸,反应10分钟后用1 mol/L的氢氧化钠溶液调pH为10,继续通氮气除氧30分钟后,加入已合成好的NaHTe前驱体溶液,使n(Cd2+):n(Te):n(TGA) = 1:0.5:2.4,在100℃下继续加热搅拌回流3小时,得到具有显著荧光的水溶性碲化镉量子点溶液。
向碲化镉量子点溶液中加入丙酮,量子点和丙酮的比例为1:3,量子点会在丙酮中沉淀出来,用离心机在7000 rpm条件下离心10 min,让后再用真空干燥箱烘干然后避光保存。纯化过程不影响量子点的稳定性和光学特性。
2.3. 荧光试验
测定Allura red,在一个10.0毫升的标准离心管中加入优化好的碲化镉量子点溶液、Tx-100溶液、1毫升的醋酸–醋酸钠缓冲溶液(pH值为6.5)和Allura red标准溶液。然后用蒸馏水稀释至刻度线,轻轻摇晃充分混合,静置10分钟。在最佳实验条件下,于λex = 330 nm,在300~650 nm波长范围内分别测定空白溶液(FQDs-Tx-100体系)与待测溶液(FQDs-Tx-100-Allura red体系)荧光强度(F),并计算荧光猝灭值ΔF(ΔF = FQDs-Tx-100 − FQDs-Tx-100-Allura red)。其中,F-4500荧光分光光度计仪器条件如下,扫描模式:发射,数据模式:荧光强度,入射狭缝宽度:5.0 nm,出射狭缝宽度:5.0 nm,扫描速度:1200 nm/min。
2.4. 样品制备
本实验样品都来源于超市中并进行以下的预处理:
1) 糖
先把糖碾碎然后准确称取10.0658 g的糖于100 mL烧杯中,加入40 mL去离子水,在加热板上加热至糖溶解。移取10.0 mL糖浆液于100 mL容量瓶中定容。
2) 果冻
将样品粉碎混合均匀,水浴加热70℃~80℃使样品融化至液态。准确称取10.2006 g加入100 mL烧杯中,再加入20 mL去离子水在加热板上加热至果冻溶解抽滤。移取10.0 mL果冻溶液于100 mL容量瓶中定容。
3) 膨化食品
准确称取1.3433 g膨化食品加热充分浸泡后离心。取上层清液,反复提取色素至试样无色为止,含有色素溶液为试样溶液。移取10.0 mL膨化食品溶液于100 mL容量瓶中定容。
2.5. 荧光量子产率测定
在本试验中,通过测量待测物质和参比物质稀溶液在同一激发波长下的积分荧光强度和对该波长激发光的吸光度,按下式计算待测物质荧光量子产率:
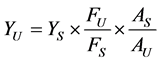
式中,Yu和Ys分别表示待测物质和参比物质荧光量子产率, 和
和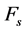 分别表示待测物质和参比物质的积分荧光强度,Au和As分别表示待测物质和参比物质对该波长激发光的吸光度。实验中,要求参比物质与待测物质光谱性质相似,溶液吸光度不大于0.05,且本实验以硫酸喹啉在发射波长330 nm的荧光量子产率0.55为标准 [24] 。
分别表示待测物质和参比物质的积分荧光强度,Au和As分别表示待测物质和参比物质对该波长激发光的吸光度。实验中,要求参比物质与待测物质光谱性质相似,溶液吸光度不大于0.05,且本实验以硫酸喹啉在发射波长330 nm的荧光量子产率0.55为标准 [24] 。
2.6. 机理实验
本实验根据判断猝灭类型进行探讨实验的机理。猝灭类型可分为动态猝灭和静态猝灭。猝灭类型的判定可以根据Stern-Volmer动态猝灭常数随温度的变化规律进行判断 [25] 。对于动态猝灭,猝灭常数随温度增大而增大,相反则是静态猝灭。通过Stern-Volmer方程进行判断实验猝灭机理,方程如:
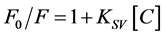
式中,F0和F分别为不存在和存在猝灭剂情况下的荧光强度,[C]是猝灭剂浓度,KSV是Stern-Volmer动态猝灭常数,表示猝灭剂猝灭效率。在本实验,利用荧光分光光度计仪器测定10℃、20℃和30℃温度下不同猝灭剂浓度荧光强度,拟合Stern-Volmer方程线性,判断荧光猝灭类型。
3. 结果与讨论
3.1. 介质选择
图2为不同介质中相关体系荧光光谱。由图2可知:1) Allura red加入能猝灭CdTe QDs荧光强度(ΔF1 = FQDs-H2O − FQDs--Allura red-H2O) (曲线1,曲线2);2) Tx-100介质中BPA对QDs猝灭值增加(ΔF2 = FQDs-Tx-100 − FQDs-Tx-100-Allura red) (曲线3,曲线4);3) 猝灭值ΔF2大约是ΔF1的5倍。Tx-100对Allura red的测定具有增敏作用。
3.2. 条件优化
3.2.1. pH影响
按照试验方法,改变溶液的pH值,考察了pH对CdTe QDs-Tx-100-Allura red体系的荧光猝灭值(ΔF = FQDs-Tx-100 − FQDs-Tx-100-Allura red)的影响(图3),由图3可知这是因为pH对ΔF = FQDs-Tx-100 − FQDs-Tx-100-Allura red中FQDs-Tx-100影响较大,对FQDs-Tx-100-Allura red影响微弱,致使ΔF主要由FCdTe QDs-CTAB的趋势决定(图3内插图)。随着pH增大,FQDs-Tx-100逐渐增大,在pH = 6.5时ΔF达到最大值,但当pH继续增大,FQDs-Tx-100逐渐减小。因此本实验选用pH = 6.5的NH4Cl-NH3.H2O缓冲溶液控制体系,pH用量为1.00 mL。
3.2.2. CdTe QDs浓度影响
按照试验方法,改变体系中CdTe QDs的用量,测定并记录荧光猝灭值ΔF变化。由图4可知,随着CdTe QDs浓度增大,体系ΔF不断增大,当CdTe QDs浓度为45.0 µg/mL时达到最大的猝灭值,继续增大CdTe QDs浓度体系荧光猝灭程度减小。由图4内插图可知:1) CdTe QDs用量在10.0~45.0 mg/mL内,当Tx-100浓度为45.0 mg/mL时体系的荧光强度均达到最大值,CdTe QDs-Tx-100体系荧光强度和CdTe QDs-Tx-100-Allura red体系荧光强度均增加,但CdTe QDs-Tx-100体系荧光强度增加比CdTe QDs-Tx-100-Allura red体系荧光强度均增加的大,导致ΔF增大(ΔF = FQDs-Tx-100↑↑ − FQDs-Tx-100-Allura red↑);2) CdTe QDs用量在45.0~55.0 mg/mL内,体系荧光强度都在减小,从而导致体系ΔF减小(ΔF = FQDs-Tx-100↓↓ − FQDs-Tx-100-Allura red↓)。因此,本实验CdTe QDs最优浓度为45.0mg/mL。
3.2.3. Tx-100浓度影响
由图5可知,随着Tx-100浓度升高,体系ΔF不断增大,当Tx-100浓度在1.25 mg/mL时猝灭值最大,继续增大浓度时,ΔF开始减小。这是因为Tx-100浓度在0.25~2.0 mg/mL范围内,CdTe QDs-Tx-100体系荧光强度先增大后减小在1.25 mg/mL达到最大值,而CdTe QDs-Tx-100-Allura red体系荧光强度在1.25 mg/mL浓度达到最小值(图5内插图)。因此,本实验采取最佳Tx-100浓度为1.25 mg/mL。
3.2.4. 温度影响
由图6可知,温度对体系ΔF影响不大,在15℃~40℃范围内ΔF先增大后减小且在常温25℃时ΔF最大。因此,本实验采用最佳温度为25℃。
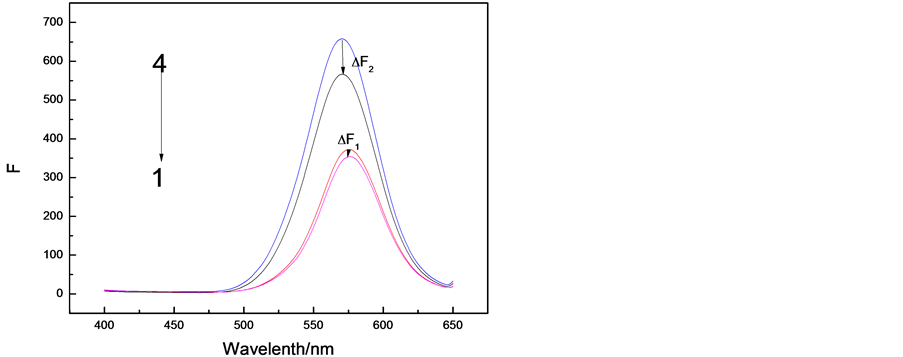
Figure 2. Fluorescence emission
图2. 荧光光谱图
 (CdTe QDs: 45.0 mg/mL, Tx-100: 1.25 mg/mL, Allura red: 20.0 µg/mL)
(CdTe QDs: 45.0 mg/mL, Tx-100: 1.25 mg/mL, Allura red: 20.0 µg/mL)
Figure 3. Effect of pH on fluorescence intensity
图3. pH值对荧光强度影响
 (pH = 6.5,Tx-100: 1.25 mg/mL, Allura red: 20.0 µg/mL)
(pH = 6.5,Tx-100: 1.25 mg/mL, Allura red: 20.0 µg/mL)
Figure 4. Effect of the amount of CdTe QDs on fluorescence intensity
图4. CdTe QDs浓度对荧光强度影响
3.2.5. 时间影响
按照试验方法,测定CdTe QDs-Tx-100-Allura red体系在不同时间点荧光猝灭值ΔF。由图7可知,
 (pH = 6.5, CdTe QDs: 45.0 mg/mL, Allura red: 20.0 µg/mL)
(pH = 6.5, CdTe QDs: 45.0 mg/mL, Allura red: 20.0 µg/mL)
Figure 5. Effect of the amount of Tx-100 on fluorescence intensity
图5. Tx-100浓度对荧光强度影响
 (pH = 6.5, CdTe QDs: 45.0 mg/mL, Tx-100: 1.25 mg/mL, Allura red: 20.0 µg/mL)
(pH = 6.5, CdTe QDs: 45.0 mg/mL, Tx-100: 1.25 mg/mL, Allura red: 20.0 µg/mL)
Figure 6. Effect of temperature on fluorescence intensity
图6. 温度对荧光强度影响
随着静置时间增加,荧光猝灭值ΔF增大,20 min后猝灭值出现稳定平台后降低。因此本实验选择在20 min为最佳测量荧光猝灭时间。
3.3. 干扰实验
研究了不同干扰物质对检测20.0 µg/mL Allura red 的影响,允许相对误差范围(对荧光猝灭程度≤±5%
视为无干扰)。不同干扰物质误差范围如表1。结果表明他们没有对荧光猝灭造成干扰。
3.4. 分析性能
在最佳实验条件下,Allura red浓度在5.0-1000.0µg/mL浓度范围内与(CdTe QDs-Tx-100)荧光猝灭值 ΔF(ΔF = FCdTe QDs-Tx-100 − FCdTe QDs-Tx-100-Allura red)呈良好的线性关系(图8),其线性回归方程为ΔF = 12.86C + 77.36(µg/mL),线性相关系数为0.9939,检出限为0.35µg/mL(检出限定义为LOD = 3σ/k ,其中,σ是空白的标准偏差,k是校准曲线的斜率)。相对标准偏差为1.5%(c = 20.0µg/mL, n = 11)。
与其他文献比较,尤其是纸层色谱光度法对比 [30] ,该方法简单、检测限好,见表2。
3.5. 实际样品测定
在最佳实验条件下进行检测了软糖、硬糖、口香糖、果冻和夹心饼干。测定结果见表3,发现软糖
 (pH = 6.5, CdTe QDs: 45.0 g/mL, Tx-100: 1.25 mg/mL, Allura red: 20.0 µg/mL)
(pH = 6.5, CdTe QDs: 45.0 g/mL, Tx-100: 1.25 mg/mL, Allura red: 20.0 µg/mL)
Figure 7. Effect of time on fluorescence intensity
图7. 时间对荧光强度的影响

Figure 8. Calibration curve
图8. 校准曲线
Table 1. Effect of foreign substances on determination of BPA
表1. 干扰物质对Allura red检测的影响
Table 2. Comparison with the results in other literatures
表2. 与其它文献比较
Table 3. Determination results of the samples
表3. 样品检测
*未检测到。
中诱惑红0.25 μg/kg,硬糖中诱惑红1.71 μg/kg,口香糖中诱惑红0.32 μg/kg,果冻中诱惑红0.10 μg/kg,夹心饼干中没有测到,加标回收率为96.24%~104.60%。国家诱惑红限量标准为≤0.085 g/kg [30] 。因此本方法由于操作简单具有良好的应用性。
3.6. 机理探讨
3.6.1. 猝灭类型
荧光猝灭类型分为动态猝灭或静态猝灭两种。动态猝灭过程是碰撞过程,与扩散有关,温度升高时分子运动加速,分子扩散系数增大,从而增大猝灭常数。静态猝灭是猝灭剂与荧光物质分子发生配合反应,形成配合物。温度升高,配合物稳定性下降,猝灭常数降低 [31] 。可以用Stern-Volmer方程观察反应温度对猝灭常数影响进行判断荧光猝灭类型。
由图9及表4可知,在不同温度下F0/F对c呈良好的线性关系且在本实验浓度范围内呈单一猝灭类型。由图9可得Tx-100对CdTe QDs猝灭值随温度的增大而减小,这表明Tx-100对CdTe QDs的荧光猝灭为静态猝灭过程。
3.6.2. Tx-100增敏作用
荧光猝灭值ΔF = FQDs − FAllura red-QDs,若QDs的荧光量子产率增加,必定会使荧光猝灭值ΔF增加。因此,本实验中考察了QDs分别在Tx-100和H2O介质中的荧光量子产率Yu。结果见表5。
由表5可知,QDs在Tx-100介质中的荧光量子产率是水介质中的3倍。这是因为表面活性剂的存在改变了“溶剂”的微观性质,提供了对务之激发单重态的一种保护性环境。这种保护性环境降低了QDs荧光质点自身的溶度猝灭以及外部猝灭剂的猝灭作用,大大降低了激发单重态非辐射去活化的速率常数,从而提高了QDs的Yu,即发生Tx-100对QDs的增敏作用,进而增加Allura red对QDs的荧光猝灭值。
4. 结论
本实验与其他方法相比,该方法操作简单、成本较低且有较好的检测限和线性范围。本文中介质
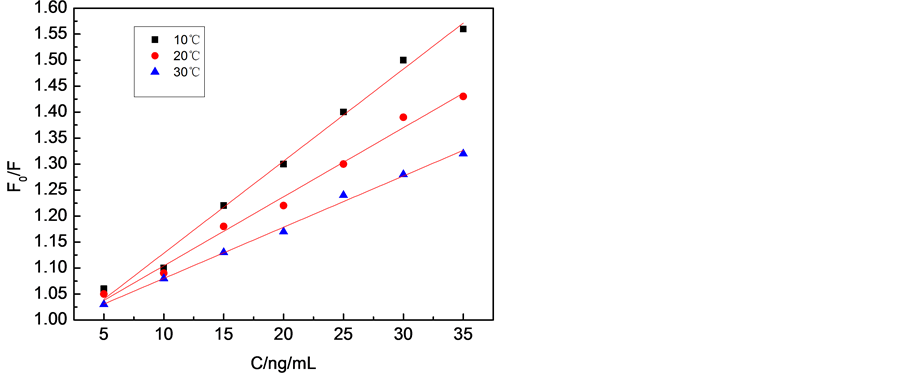 (pH = 6.5, Tx-100: 1.25 mg/mL, QDs: 45.0 µg/mL)
(pH = 6.5, Tx-100: 1.25 mg/mL, QDs: 45.0 µg/mL)
Figure 9. Stern-Volmer curves for different system at different temperatures
图9. 不同体系不同温度下的Stern-Volmer曲线
Table 4. Stern-Volmer equation parameters at different temperatures
表4. 不同温度下Stern-Volmer方程的参数
Table 5. Fluorescent quantum yield
表5. 荧光量子产率
Tx-100的增敏作用促使Allura red对CdTe QDs的荧光猝灭值增大。基于这一点,本文建立了一种新的荧光猝灭法测定Allura red。
文章引用
叶 柳,朱霞石. Tx-100增敏碲化镉量子点荧光猝灭法分析诱惑红
Determination of Allura Red by Tx-100 Sensitization CdTe QDs Fluorescence Quenching Method[J]. 化学工程与技术, 2016, 06(03): 43-54. http://dx.doi.org/10.12677/HJCET.2016.63006
参考文献 (References)
- 1. Lilianne, A.-Z. and Ilbäck, N.-G. (2013) The Synthetic Food Colouring Agent Allura Red Ac (E129) Is Not Genotoxic in a Flow Cytometry-Based Micronucleus Assay in Vivo. Food and Chemical Toxicology, 59, 86-89. http://dx.doi.org/10.1016/j.fct.2013.05.047
- 2. Abdullah, S.U., Badaruddin, M., Sayeed, S.A., Ali, R. and Riaz, M.N. (2008) Binding Ability of Allura Red with Food Proteins and Its Impact on Protein Digestibility. Food Chemistry, 110, 605-610. http://dx.doi.org/10.1016/j.foodchem.2008.02.049
- 3. Fabio, G., Ugo, C., Eleonora, M. and Giorgio, C. (2013) Non-Target Screening of Allura Red AC Photodegradation Products in a Beverage through Ultra High Performance Liquid Chromatography Coupled with Hybrid Triple Quadrupole/Linear Ion Trap Mass Spectrometry. Food Chemistry, 136, 617-623. http://dx.doi.org/10.1016/j.foodchem.2012.08.019
- 4. Mikkelsen, H., Larsen, J. and Tarding, F. (1978) Hyper-sensitivity Reactions to Food Colours with Special Reference to the Natural Colour Annatto Extract (Butter Colour). Archives of Toxicology Supplement, 1, 141-143. http://dx.doi.org/10.1007/978-3-642-66896-8_16
- 5. McCann, D., Barret, A., Cooper, C., Crumpler, D., Dalen, L., Grimshaw, K., Kitchin, E., Lok, K., Porteous, L., Prince, E., Sonuga-Barke, E., O’Warner, J. and Stevenson, J. (2007) Food Additives and Hyperactive Behaviour in 3-Year-Old and 8/9-Year-Old Children in the Community: A Randomised, Double-Blinded, Placebo-Controlled Trial. Lancet, 370, 1560-1567. http://dx.doi.org/10.1016/S0140-6736(07)61306-3
- 6. Pourreza, N., Rastegarzadeh, S. and Larki, A. (2011) De-termination of Allura Red in Food Samples after Cloud Point Extraction Using Mixed Micelles. Food Chemistry, 126, 1465-1469. http://dx.doi.org/10.1016/j.foodchem.2010.11.158
- 7. Mustafa, S., Yunus, E.U. and Mustafa, T. (2011) Spectrophotometric Determination of Trace Levels of Allura Red in Water Samples after Separation and Pre-concentration. Food and Chemical Toxicology, 49, 1183-1187. http://dx.doi.org/10.1016/j.fct.2011.02.013
- 8. Xu, Y.L., Zhong, D.J. and Jia, J.P. (2008) Electrochemi-cal-Assisted Photodegradation of Allura Red and Textile Effluent Using a Half-Exposed Rotating TiO2/Ti Disc Electrode. Journal of Environmental Science & Health, Part A: Toxic/Hazardous Substances & Environmental Engineering, 43, 503-510. http://dx.doi.org/10.1080/10934520701796408
- 9. Berzas Nevado, J.J., Guiberteau-Cabanillas, C., Conten-to-Salcedo, A.M. and Martin-Villamuelas, R. (1999) Spectrophotometric Simultaneous Determination of Amaranth, Ponceau 4R, Allura Red and Red 2G by Partial Least Squares and Principal Component Regression Multivariate Cali-bration. Analytical Letters, 32, 1879-1898. http://dx.doi.org/10.1080/00032719908542940
- 10. Chanlon, S., Joly-Pottuz, L., Chatelut, M., Vittori, O. and Cretier, J.L. (2005) Determination of Carmoisine, Allura red and Ponceau 4R in Sweets and Soft Drinks by Differential Pulse Polarography. Journal of Food Composition and Analysis, 18, 503-515. http://dx.doi.org/10.1016/j.jfca.2004.05.005
- 11. Chen, X.H., Zhao, Y.G., Shen, H.Y., Zhou, L.X., Pan, S.D. and Jin, M.C. (2014) Fast Determination of Seven Synthetic Pigments from Wine and Soft Drinks Using Magnetic Disper-sive Solid-Phase Extraction Followed by Liquid Chromatography-Tandem Mass Spectrometry. Journal of Chromato-graphy A, 1346, 123-128. http://dx.doi.org/10.1016/j.chroma.2014.04.060
- 12. Zou, T.T., He, P.L. and Zhen, L. (2013) Determination of Seven Synthetic Dyes in Animal Feeds and Meat by High Performance Liquid Chromatography with Diode Array and Tandem Mass Detectors. Food Chemistry, 138, 1742-1748. http://dx.doi.org/10.1016/j.foodchem.2012.11.084
- 13. 沈薇, 朱霞石. 钇纳米光谱探针合成及荧光增敏法分析橙皮苷[J]. 分析化学, 2012, 40(1): 150-154.
- 14. 朱霞石, 孙静, 包莉, 郭荣. β-环糊精与CTAB微乳液协同增敏荧光法测定微量铋研究[J]. 应用化学, 2006, 23(3): 323-327.
- 15. 冯刚, 柏苗, 朱霞石. 表面活性剂增敏分光光度法测定微量锡研究[J]. 光谱实验室, 2007, 24(6): 1059-1062.
- 16. Zhu, X.S., Bao, L., Guo, R. and Wu, J. (2004) Determination of Aluminium(III) in Water Samples in a Microemulsion System by Spectrofluorimetry. Analytica Chi-mica Acta, 523, 43-48.
- 17. 赵燕, 高楼军, 孙雪花, 柴红梅. 水溶性碲化镉量子点测定甲磺酸培氟沙星[J]. 光谱实验室, 2012, 29(3): 1749- 1752.
- 18. Tan, X.P., Liu, S.P., He, Y.Q. and Yang, J.D. (2014) Quantum Dots (QDs) Based Fluorescence Probe for the Sensitive Determination of Kaempferol. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 133, 66-72. http://dx.doi.org/10.1016/j.saa.2014.05.032
- 19. 张浩, 王芳, 马静, 卞伟. 栀子甙对碲化镉量子点的荧光淬灭作用[J]. 化学研究, 2015, 26(1): 64-69.
- 20. Zhu, X.S. and He, Y. (2007) Spectroscopic Probe-Aluminum(III)-Chrome Azure S Enhanced Determination of Serum Albumin in Microemulsion Medium. Ana-lytical Letters, 40, 103-112. http://dx.doi.org/10.1080/00032710600952465
- 21. 龚爱琴, 朱霞石, 郭荣, 马晓芹. Triton X-100微乳液中铈与L-色氨酸荧光反应的研究与应用[J]. 光谱学与光谱分析, 2008, 28(4): 900-903.
- 22. 朱霞石, 郭荣, 张晓红. 非离子型微乳液对荧光猝灭法测定微量镍的增敏作用[J]. 光谱学与光谱分析, 2001, 21(4): 515-517.
- 23. Zhang, L.J., Xu, C.L. and Li, B.X. (2009) Simple and Sensitive Detection Method for Chro-mium(VI) in Water Using Glutathione—Capped CdTe Quantum Dots as Fluorescent Probes. Microchimica Acta, 166, 61-68.
- 24. Zhu, X.S., Gong, A.Q. and Yu, S.H. (2008) Fluorescence Probe Enhanced Spectrofluorimetric Method for the Determination of Gatifloxacin in Pharmaceutical Formulations and Biological Fluids. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 69, 478-482. http://dx.doi.org/10.1016/j.saa.2007.04.026
- 25. 赵晶, 魏永巨. 曲通X-100的荧光光谱与荧光量子产率[J]. 光谱学与光谱分析, 2004, 26(8): 1523-1525.
- 26. Minioti, K.S., Sakellariou, C.F. and Thomaidis, N.S. (2007) Determination of 13 Synthetic Food Colorants in Water- Soluble Foods by Reversed-Phase High-Performance Liquid Chromatography Coupled with Diode-Array Detector. Analytica Chimica Acta, 583, 103-110. http://dx.doi.org/10.1016/j.aca.2006.10.002
- 27. Erdal, D., Emine, B., Murat, K. and Feyyaz, O. (2002) Spectrophotometric Multicomponent Determination of Sunset Yellow, Tartrazine and Allura Red in Soft Drink Powder by Double Divisor-Ratio Spectra Derivative, Inverse Least- Squares and Principal Component Regression Methods. Talanta, 58, 579-594. http://dx.doi.org/10.1016/S0039-9140(02)00320-X
- 28. Zhang, Y., Zhang, X. and Lu, X. (2010) Multi-Wall Carbon Nanotube Film-Based Electrochemical Sensor for Rapid Detection of Ponceau 4R and Allura Red. Food Che-mistry, 122, 909-913. http://dx.doi.org/10.1016/j.foodchem.2010.03.035
- 29. Li, W.J., Zhou, X., Tong, S.S. and Jia, Q. (2013) Poly Monolithic Column Embedded with γ-Alumina Nanoparticles Microextraction Coupled with High-Performance Liquid Chromatography for the Determination of Synthetic Food Dyes in Soft Drink Samples. Talanta, 105, 386-392. http://dx.doi.org/10.1016/j.talanta.2012.10.065
- 30. 中国国家标准化管理委员会. GB/T 5009.141-2003食品中合成着色剂的测定[S]. 北京: 中华人民共和国卫生部, 2004.
- 31. Liu, Z.Q., Yin, P.F. and Gong, H.P. (2012) De-termination of Rifampicin Based on Fluorescence Quenching of GSH Capped CdTe/ZnS QDs. Journal of Luminescence, 132, 2484-2488. http://dx.doi.org/10.1016/j.jlumin.2012.03.072.
