Hans Journal of Chemical Engineering and Technology
Vol.
10
No.
03
(
2020
), Article ID:
35355
,
8
pages
10.12677/HJCET.2020.103019
Kinetics of NOx Reduction by CH4 on Fe-Mn/H-Beta Catalyst
Shuning Tan, Hua Pan*, Zilong Zhao, Li Wang
College of Biology and Environmental Engineering, Zhejiang Shuren University, Hangzhou Zhejiang
Received: Apr. 6th, 2020; accepted: Apr. 21st, 2020; published: Apr. 28th, 2020

ABSTRACT
Kinetic of catalytic reduction of NOx with methane over Fe-Mn/H-BEA catalyst reveals that the catalytic reaction is first order and 0.21 - 0.31 order with respect to NOx and oxygen, respectively. At 350˚C and 400˚C, the NO reaction order of de-NOx rate is 0.91 and 0.95, respectively. The catalytic reaction is almost independent to the presence of methane and CO2 at temperatures ranging from 300˚C to 450˚C. It means that catalytic decomposition of NOx is the dominant reaction. NO oxidation is the rate-limiting step. DeNOx catalysis by methane over Fe-Mn/H-beta comprises two reactions: one is catalytic decomposition of NOx (the dominant reaction), and the other is NOx reduction by methane (CH4-SCR).
Keywords:DeNOx Catalysis, Kinetic Parameters, Reaction Mechanism, Fe-Mn/H-Beta

Fe-Mn/H-BEA催化剂上甲烷催化还原NOx的动力学研究
谭淑宁,潘华*,赵子龙,王莉
浙江树人大学,生物与环境工程学院,浙江 杭州
收稿日期:2020年4月6日;录用日期:2020年4月21日;发布日期:2020年4月28日

摘 要
Fe-Mn/H-BEA催化剂上甲烷催化还原NOx的动力学研究表明,脱硝催化反应为NOx的拟一级反应,在350℃和400℃时,脱硝反应速率的NO反应级数分别为0.91和0.95。O2的反应级数为0.21~0.31,当温度范围在300℃至450℃时,脱硝催化反应与甲烷和二氧化碳的浓度无关,即主要以NOx催化分解为主。NO氧化是催化反应的限速步骤。Fe-Mn/H-BEA催化剂上甲烷催化还原NOx反应包括2个途径:一个是NOx的催化分解(主反应),另一个是甲烷催化还原NOx(CH4-SCR)。
关键词 :催化脱硝,动力学参数,反应机理,Fe-Mn/H-BEA

Copyright © 2020 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
甲烷是天然气的主要成分,且存在于大多数燃烧废气中,因此,利用甲烷作为还原剂催化还原NOx一直是近年来环境催化领域的研究热点 [1] [2] [3]。自Li和Armor [4] 率先报道Co-ZSM-5是高效的甲烷催化还原NOx(CH4-SCR)催化剂,分子筛基催化剂收到了学者们的广泛关注,如ZSM-5 [5] [6]、镁碱沸石(ferrierite) [7] [8],BEA [9] [10] 和丝光沸石(mordenite) [11] [12] 等。
虽然学者们对于最具发展前景的分子筛基催化剂,已经做了很多工作来阐明催化剂的活性位点的特性和催化反应机理。但另一方面,已发表的关于分子筛基催化剂上甲烷催化还原反应的动力学研究主要集中在ZSM-5和丝光沸石分子筛基催化剂上 [13] [14] [15]。Sowade等人 [13] 发现在CeO2/In-ZSM-5催化剂上,干进料和湿进料反应条件之间动力学参数的差异反映了CH4-SCR过程中反应物和水之间在催化剂上的吸附竞争。Shimizu等 [14] 观察到CH4-SCR在Pd-H-MOR催化剂上的反应速率与 数量密切相关,这表明 是NO催化还原过程中的活性位点。Ribotta等人 [16] 研究了H-丝光沸石上CH4-SCR反应动力学和酸性位点,他们认为在450℃~550℃温度范围内,NO、甲烷和氧浓度的反应级数不同,酸性位点不是决定CH4-SCR选择性(NO转化/CH4转化)的主要因素。
在本文中,我们考察了Fe-Mn/H-BEA催化剂上甲烷催化还原NOx反应动力学,与其他研究相比,我们在较宽的温度范围(300℃~450℃)内计算了NO、甲烷和氧浓度的反应级数等动力学参数和反应活化能,并考察了CO2对反应动力学的影响,并通过动力学结果中推断了脱硝反应机理。
2. 实验
2.1. 催化剂的制备
H-BEA分子筛(SiO2/Al2O3 = 25)购自南开大学催化剂厂。Fe-Mn/H-BEA催化剂是将H-BEA分子筛浸渍在Fe(NO3)3和Mn(NO3)2的混合溶液中,在室温下浸渍24小时后,在120℃下干燥8小时,最后在马弗炉中500℃的空气中煅烧2小时。煅烧的升温速率为10℃/min。催化剂中Fe:Mn:H-BEA = 1:1:20 (重量比)。将制得的催化剂压片、粉碎并筛分成40~60目的颗粒用于催化活性测试。
2.2. 催化活性测试
将0.61 g (1 mL)的催化剂颗粒置于石英管固定床反应器(内径为10 mm、长为300 mm)中进行常压动力学实验。从反应器顶部嵌入催化剂床内的k型热电偶与PID温控仪相连接,从而控制催化剂床内反应温度。将5 vol.% NO/N2、5 vol.% CH4/N2、CO2、O2和高纯N2等5种气源通过各自质量流量计独立控制,混合得到实验所需的反应气体组成。
在动力学实验中,温度范围为300℃~450℃,NO体积分数为2 × 10−4~1.5 × 10−3、NO2体积分数为5 × 10−5~4.1 × 10−4、CH4体积分数为0~1.57 × 10−3、O2体积分数为0~8 vol.%、CO2体积分数为0~12.8 vol.%。反应进气总流量为500ml/min,空速为30000 h−1。NOx体积分数用美国Thermo Scientific的42i-HL型化学发光NO-NO2-NOx分析仪进行在线分析,通过气相色谱仪测量CH4体积分数。催化反应中NOx浓度变化速率的动力学方程为式(1):
(1)
式(1)中:[NOx]、[CH4]、[O2]和[CO2]分别NOx、CH4、O2和CO2的体积分数;t为催化反应的停留时间;k,a,b,c,d是根据在不同条件下获得的经验动力学参数。
3. 结果和讨论
3.1. NOx体积分数的影响
图1为在进气O2和CH4的体积分数分别固定在4 vol.%和1 × 10−3时,进气NOx体积分数变化在300℃~450℃时对NOx转化速率的影响。在300℃~450℃时,脱硝反应速率均随着进气NOx体积分数的增大而增加。脱硝反应速率随NOx体积分数变化的拟合曲线的相关系数R2分别为0.934 (300℃)、0.998 (350℃)、0.990 (400℃)和0.964 (450℃)。根据式(1)得到脱硝反应速率的NOx反应级数,见表1。从表1中可见,在350℃和400℃下,脱硝反应速率为NOx的拟一级反应,在350℃和400℃时,脱硝反应速率的NO反应级数分别为0.91和0.95。然而在300℃和450℃时,NOx的反应级数分别为0.52和0.74。350℃和400℃时Fe-Mn/H-BEA催化剂上NOx的拟一级反应级数与一些ZSM-5基 [15] [18] 和H-mordenite基 [16] 催化剂的CH4-SCR动力学研究结果相一致。而300℃和450℃时较低的NOx反应级数则可能是由于限制反应速率的步骤是由被吸附的NO2形成的一个物种激活甲烷,而被吸附的NO2的浓度与进气NOx体积分数无关。
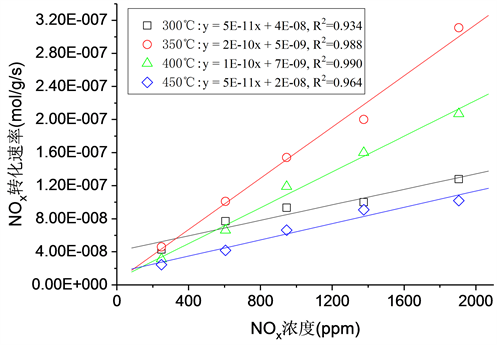
Figure 1. Effect of NOx concentration on the conversion rate of NOx at various temperatures. Reaction conditions: O2 = 4 vol.%, CH4 = 10−3 and T = 300˚C - 450˚C
图1. 不同温度下进口NOx浓度对NOx转化速率的影响。反应条件:O2 = 4 vol.%, CH4 = 10−3, T = 300˚C ~450˚C
Table 1. Dynamic parameters obtained by fitting equation (1) with experimental data
表1. 将式(1)与实验数据进行拟合得到动力学参数
3.2. CH4体积分数的影响
图2为在进气O2和NOx的体积分数分别固定在4 vol.%和9.8 × 10−4时,进气CH4体积分数变化在300℃~450℃时对NOx转化速率的影响。从图2可见,脱硝反应速率随着CH4体积分数的增大而缓慢增加,尤其在中温条件下(350℃和400℃),CH4体积分数对脱硝反应速率的影响不大。脱硝反应速率随CH4体积分数变化的拟合曲线的相关系数R2分别为0.992 (300℃)、0.798 (350℃)、0.980(400℃)和0.908 (450℃)。同样根据式(1)得到脱硝反应速率的CH4反应级数,见表1。由表1可以看出,在300℃~450℃范围内,CH4反应级数仅为0.01~0.10。因此,脱硝催化反应与CH4浓度无关,即推断Fe-Mn/H-BEA催化剂上脱硝催化反应主要以NOx催化分解为主。此外,当反应温度从300℃增加到450℃,CH4反应级数的0.06降低到0.01,在增加到0.10。这与NOx反应级数的变化趋势大致相反,即CH4反应级数接近为0时,而NOx反应级数接近为1。这与Sowade等人 [13] 报道的In-ZSM-5上脱硝催化反应结果基本一致,却不同于其他ZSM-5基催化剂上的脱硝催化反应 [15] [17]。

Figure 2. Effect of CH4 concentration on the conversion rate of NOx at various temperatures. Reaction conditions: O2 = 4 vol.%, NOx = 9.8 × 10−4, T = 300˚C - 450˚C
图2. 不同温度下进口CH4浓度对NOx转化速率的影响。反应条件:O2 = 4 vol.%, NOx = 9.8 × 10−4, T = 300˚C ~450˚C
有学者报道Co-MFI、Co-ferrierite和Cu-MFI催化剂吸附的CH4与NO2之间的反应是CH4-SCR反应的速率决定步骤 [18]。但本研究中的Fe-Mn/H-BEA催化剂上CH4-SCR反应的CH4反应级数很低,说明吸附的CH4与NO2之间的氧化还原反应不是脱硝反应的速率决定步骤。我们推断Fe-Mn/H-BEA上的脱硝催化包括两个反应:一个是CH4催化还原NOx反应,另一个是NOx本身的催化分解反应。与CH4催化还原NOx反应相比,NOx本身的催化分解反应在脱硝催化反应中起主导作用,尤其在中温条件下(350℃和400℃)。
3.3. O2体积分数的影响
图3显示了在300℃~450℃下NOx转化速率与O2体积分数的关系曲线。在所有温度下,有氧条件下的NOx转化速率都远大于比无氧条件下的NOx转化速率。但当O2体积分数继续增加到8.0 vol.%时,NOx转化率速率呈现先快速增加而后略有下降,最终逐渐继续增加的趋势。从表1中可见,当温度从300℃增加到450℃时,O2反应级数从0.31降低到0.21。这与部分学者制备的ZSM-5基催化剂上CH4-SCR的动力学研究相似 [13] [17],但是与Stevenson等人 [19] 对HZSM-5上NH3-SCR的研究有所不同,NH3-SCR的反应在氧浓度上是一级反应,即使在不同的NO进口浓度下,氧浓度与N2生成速率之间的线性关系也保持不变。
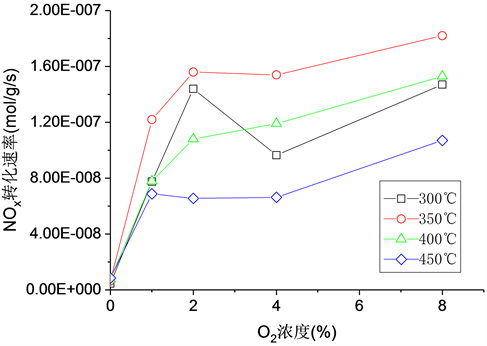
Figure 3. Effect of O2 concentration on the conversion rate of NOx at various temperature. Reaction conditions: NOx = 9.8 × 10−4, CH4 = 10−3, T=3 00˚C - 450˚C
图3. 不同温度下进口O2浓度对NOx转化速率的影响。反应条件:NOx = 9.8 × 10−4, CH4 = 10−3, T=3 00˚C ~450˚C
3.4. CO2体积分数的影响
在300℃和350℃下,CO2体积分数变化对NOx转化速率的影响如图4所示。很显然,NOx转化速率与CO2体积分数变化完全无关。Toops等人 [20] 研究了La2O3催化剂上CO2对CH4-SCR动力学,研究表明CO2通过与反应物在催化剂表面活性位的竞争吸附并导致形成碳酸氧镧,可逆地抑制NO还原反应。然而,关于CO2对分子筛基催化剂上CH4-SCR动力学影响的研究很少,在本研究中未观察到明显的CO2抑制作用。可见,CO2对于分子筛基催化剂上脱硝催化反应的影响不大。
3.5. 反应速率决定步骤
如表1所示,Fe-Mn/H-BEA上CH4-SCR催化脱硝的表观活化能为−0.46 ± 0.1 kcal/mol,明显低于其他文献报道的催化剂 [16] [21] [22]。NO氧化被认为是分子筛基催化剂上SCR反应的初始步骤 [23] [24],并在气相反应中具有负的表观活化能 [24]。根据NO氧化反应的关键作用,在Fe-Mn/H-BEA催化剂上我们观察到O2和NOx有更高的反应级数,而CH4反应级数较低,因此,可认为NO氧化反应是脱硝催化反应的速率决定步骤。
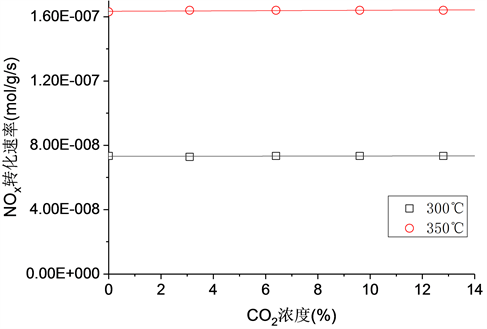
Figure 4. Effect of CO2 concentration on the conversion rate of NOx at various temperature. Reaction conditions: NOx = 9.8 × 10−4, CH4 = 10−3, O2 = 4 vol.%, T=3 00˚C - 450˚C
图4. 不同温度下进口CO2浓度对NOx转化速率的影响。反应条件:NOx = 9.8 × 10−4, CH4 = 10−3, O2 = 4 vol.%, T=3 00˚C ~450˚C
3.6. 反应机理
通过以上分析得出4个主要结论:1) 该反应对于NOx近似一级反应;2) 该反应与甲烷和CO2的体积分数基本无关;3) 在脱硝催化反应中,O2的反应级数随温度的升高而降低;4) Fe-Mn/H-BEA催化剂上CH4-SCR催化脱硝的表观活化能明显低于其他文献报道的催化剂。

Figure 5. Mechanism of catalytic reduction of NOx by CH4 on Fe-Mn/H-BEA catalyst
图5. Fe-Mn /H-BEA催化剂上甲烷催化还原NOx的反应机理
基于上述结论,我们提出了Fe-Mn/H-BEA催化剂上CH4-SCR催化脱硝的反应机理:1) NO氧化催化反应速率控制步骤;2) 脱硝催化反应包括两个反应:主反应是NOx的催化分解,另一个是甲烷催化还原NOx。图5显示了详细的催化脱硝机理,该机理需要同时进行四个催化步骤。在这种机理下,第一步是NO吸附在Fe-Mn/H-BEA催化剂上,并被O2催化氧化为NO2,这是Fe-Mn/H-BEA催化剂上催化脱硝的速率控制步骤。生成的NO2进入第二步,即NO2的催化分解形成N2,这是Fe-Mn/H-BEA催化剂上催化脱硝的主反应,同时部分NO2进入第三步,同时CH4在Fe-Mn/H-BEA催化剂上发生C-H键的断裂而被活化,并与NO2发生氧化还原反应生成中间产物[X],最后中间产物[X]进行第四步,与NOx反应生成N2完成CH4-SCR过程。
4. 结论
1) Fe-Mn/H-BEA催化剂上甲烷催化还原NOx的动力学反应在300℃~450℃时为NOx的拟一级反应(反应级数为0.91~0.95),O2的反应级数为0.26~0.30,当温度范围在300℃至450℃时,脱硝催化反应与甲烷和二氧化碳的浓度无明显相关性。
2) Fe-Mn/H-BEA催化剂上脱硝催化反应以NOx催化分解为主。甲烷催化还原NOx为辅。NO氧化是催化反应的速率决定步骤。
3) Fe-Mn/H-BEA催化剂上脱硝催化反应机理为第一步NO催化氧化为NO2,生成的NO2进入第二步NO2的催化分解形成N2 (主反应),同时部分NO2进入第三步与CH4发生氧化还原反应生成中间产物[X],最后中间体[X]通过在第四步中与NOx反应生成N2完成CH4-SCR过程。
基金项目
浙江省自然科学基金(LY19E080023);浙江树人大学省属高校基本科研业务费专项资金项目资助(2020XZ012)。
文章引用
谭淑宁,潘 华,赵子龙,王 莉. Fe-Mn/H-BEA催化剂上甲烷催化还原NOx的动力学研究
Kinetics of NOx Reduction by CH4 on Fe-Mn/H-Beta Catalyst[J]. 化学工程与技术, 2020, 10(03): 138-145. https://doi.org/10.12677/HJCET.2020.103019
参考文献
- 1. 魏波, 张相俊, 李思漩, 迟姚玲, 王虹, 李翠清, 宋永吉. 制备条件对Ag/ZSM-5催化剂CH4-SCR脱硝性能的影响[J]. 现代化工, 2018, 38(7): 103-106+108.
- 2. 潘华, 建艳飞, 陈宁娜, 刘红霞, 何炽, 贺亚飞. 甲烷催化还原NOx中Co基/分子筛催化剂的助剂和载体优化[J]. 环境科学, 2017, 38(7): 3085-3094.
- 3. 朱泳吉, 朱荣淑, 张改革. 甲烷选择性催化还原NO中In/H-Beta的制备及优化[J]. 环境生态学, 2019, 1(2): 47-52.
- 4. Li, Z.J. and Armor, J.N. (1992) Catalytic Reduction of Nitrogen Oxides with Methane in the Presence of Excess Oxygen. Applied Catalysis B: Environmental, 1, L31-L40. https://doi.org/10.1016/0926-3373(92)80050-A
- 5. Campa, M.C., Pietrogiacomi, D., Tuti, S., Ferraris, G. and Indovina, V. (1998) The Selective Catalytic Reduction of NOx with CH4 on Mn-ZSM5: A Comparison with Co-ZSM5 and Cu-ZSM5. Applied Catalysis B: Environmental, 18, 151-162. https://doi.org/10.1016/S0926-3373(98)00034-4
- 6. Mihaylov, M., Hadjiivanov, K. and Panayotov, D. (2004) FTIR Mechanistic Studies on the Selective Catalytic Reduction of NOx with Methane over Ni-Containing Zeolites: Comparison between NiY and Ni-ZSM-5. Applied Catalysis B: Environmental, 51, 33-42. https://doi.org/10.1016/j.apcatb.2004.02.002
- 7. Lee, T.J., Nam, I.S., Ham, S.W., Baek, Y.S. and Shin, K.H. (2003) Effect of Pd on the Water Tolerance of Co-Ferrierite Catalyst for NO Reduction by CH4. Applied Catalysis B: Environmental, 41, 115-127. https://doi.org/10.1016/S0926-3373(02)00197-2
- 8. Kaucky, D., Vondrova, A., Dedecek, J. and Wichterlova, B. (2000) Activity of Co Ion Sites in ZSM-5, Ferrierite, and Mordenite in Selective Catalytic Reduction of NO with Methane. Journal of Catalysis, 194, 318-329. https://doi.org/10.1006/jcat.2000.2925
- 9. Chen, H.H., Shen, S.C., Chen, X.Y. and Kawi, S. (2004) Selective Catalytic Reduction of NO over Co/Beta-Zeolite: Effects of Synthesis Condition of Beta-Zeolites, Co Precursor, Co Loading Method and Reductant. Applied Catalysis B: Environmental, 50, 37-47. https://doi.org/10.1016/j.apcatb.2003.10.005
- 10. Ferreira, A.P., Henriques, C., Ribeiro, M.F. and Ribeiro, F.R. (2005) SCR of NO with Methane over Co-HBEA and PdCo-HBEA Catalysts: The Promoting Effect of Steaming over Bimetallic Catalyst. Catalysis Today, 107-108, 181-191. https://doi.org/10.1016/j.cattod.2005.07.089
- 11. Berndt, H., Schütze, F.W., Richter, M., Sowade, T. and Grunert, W. (2003) Selective Catalytic Reduction of NO under Lean Conditions by Methane and Propane over In-dium/Cerium-Promoted Zeolites. Applied Catalysis B: Environmental, 40, 51-67. https://doi.org/10.1016/S0926-3373(02)00126-1
- 12. Descorme, C., Gelin, P., Lecuyer, C. and Primet, M. (1998) Catalytic Reduction of Nitric Oxide by Methane in the Presence of Oxygen on Palladium-Exchanged Mor-denite Zeolites. Journal of Catalysis, 177, 352-362. https://doi.org/10.1006/jcat.1998.2112
- 13. Sowade, T., Schütze, F.W., Berndt, H. and Grünert, W. (2004) Kinetic Reaction Models for the Selective Reduction of NO by Methane over Multifunctional Zeolite-Based Redox Catalysts. Chemical Engineering & Technology, 27, 1277-1289. https://doi.org/10.1002/ceat.200402132
- 14. Shimizu, K., Okada, F., Nakamura, Y., Satsuma, A. and Hattori, T. (2000) Mechanism of NO Reduction by CH4 in the Presence of O2 over Pd-H-Mordenite. Journal of Catalysis, 195, 151-160. https://doi.org/10.1006/jcat.2000.2964
- 15. Kato, H., Yokoyama, C. and Misono, M. (1998) Relative Rates of Various Steps of NO-CH4-O2 Reaction Catalyzed by Pd/H-ZSM-5. Catalysis Today, 45, 93-102. https://doi.org/10.1016/S0920-5861(98)00254-5
- 16. Ribotta, A., Lezcano, M., Kurgansky, M., Miró, E., Lombardo, E. and Petunchi, J. (1997) Kinetics, Acid Sites and Deactivation of H-Mordenite during the SCR of NOx with CH4. Catalysis Letters, 49, 77-85. https://doi.org/10.1023/A:1019064112577
- 17. Cowan, A.D., Dümpelmann, R. and Cant, N.W. (1995) The Rate-Determining Step in the Selective Reduction of Nitric-Oxide by Methane over a Co-ZSM5 Catalyst in the Presence of Oxygen. Journal of Catalysis, 151, 356-363. https://doi.org/10.1006/jcat.1995.1038
- 18. Cant, N.W. and Cowan, A.D. (1997) The Mechanism of Nitrogen Oxides Reduction by Hydrocarbons and in Other Systems. Catalysis Today, 35, 89-95. https://doi.org/10.1016/S0920-5861(96)00147-2
- 19. Stevenson, S.A., Vartuli, J.C. and Brooks, C.F. (2000) Kinetics of the Selective Catalytic Reduction of NO over HZSM-5. Journal of Catalysis, 190, 228-239. https://doi.org/10.1006/jcat.1999.2747
- 20. Toops, T.J., Walters, A.B. and Vannice, M.A. (2002) The Effect of CO2, H2O and SO2 on the Kinetics of NO Reduction by CH4 over La2O3. Applied Catalysis B: Environmental, 38, 183-199. https://doi.org/10.1016/S0926-3373(02)00042-5
- 21. Lukyanov, D.B., Lombardo, E.A., Sill, G.A., D’Itri, J.L. and Hall, W.K. (1996) Selective Catalytic Reduction (SCR) of NO with Methane over CoZSM-5 and HZSM-5 Zeo-lites: On the Role of Free Radicals and Competitive Oxidation Reactions. Journal of Catalysis, 163, 447-456. https://doi.org/10.1006/jcat.1996.0346
- 22. Li, Y. and Armor, J.N. (1994) Selective Catalytic Reduction of NO with Methane on Gallium Catalysts. Journal of Catalysis, 145, 1-9. https://doi.org/10.1006/jcat.1994.1001
- 23. Regalbuto, J.R., Zheng, T. and Miller, J.T. (1999) The Bifunctional Reaction Pathway and Dual Kinetic Regimes in NOx SCR by Methane over Cobalt Mordenite Catalysts. Catalysis Today, 54, 495-505. https://doi.org/10.1016/S0920-5861(99)00212-6
- 24. Ogura, M., Hayashi, M. and Kikuchi, E. (1998) Intrapore Catalysis in Reduction of Nitric Oxide with Methane. Catalysis Today, 42, 159-166. https://doi.org/10.1016/S0920-5861(98)00086-8
NOTES
*通讯作者。
