Hans Journal of Chemical Engineering and Technology
Vol.
10
No.
06
(
2020
), Article ID:
38536
,
9
pages
10.12677/HJCET.2020.106051
微米球四氧化三铁的水热合成和对铅离子的吸附研究
葛业玲,袁学文,邹红丽*,卢敏敏,刘振东,穆洪涛,刘凤银,刘依文,梁颖茵
广东第二师范学院生物与食品工程学院,广东 广州

收稿日期:2020年10月20日;录用日期:2020年11月2日;发布日期:2020年11月9日

摘要
本文以FeCl3·6H2O,Na3C6H5O7·2H2O为反应原料,水热法合成Fe3O4微米球。通过X射线衍射(XRD)、扫描电镜(SEM)和傅里叶红外光谱(FTIR)对Fe3O4进行表征。研究了Fe3O4微米球对Pb2+的吸附特性,并使用等温模型、吸附动力学和吸附热力学模型分析吸附机理。结果表明,Fe3O4微米球对Pb2+的吸附过程符合Freundlich等温吸附模型和准二级动力学模型。热力学参数表明对Pb2+的吸附过程是自发和吸热过程。在25℃,pH为6的条件下,对Pb2+的最大吸附容量是74.5 mg·g−1。
关键词
Fe3O4微米球,水热合成,吸附,Pb2+
Hydrothermal Synthesis of Fe3O4 Microsphere and Its Adsorption Performance for Pb2+
Yeling Ge, Xuewen Yuan, Hongli Zou*, Minmin Lu, Zhendong Liu, Hongtao Mu, Fengying Liu, Yiwen Liu, Yingyin Liang
College of Biology and Food Engineering, Guangdong University of Education, Guangzhou Guangdong

Received: Oct. 20th, 2020; accepted: Nov. 2nd, 2020; published: Nov. 9th, 2020

ABSTRACT
Fe3O4 microsphere were synthesized by a hydrothermal method with the reactants of FeCl3·6H2O and Na3C6H5O7·2H2O and characterized by XRD、SEM and FTIR. The adsorption performance of Fe3O4 microsphere for Pb2+ was researched. Isothermal adsorption model, adsorption kinetic model and adsorption thermodynamics model were used to analyze adsorption mechanism. The results showed that the adsorption of Fe3O4 microsphere for Pb2+ was fitted with Freundlich isothermal model and quasi-second-order adsorption kinetic model. Thermodynamic parameters demonstrated that the Pb2+ adsorption process was spontaneous and endothermic. The maximum adsorption capacity of Pb2+ onto Fe3O4 microsphere was 74.5 mg·g−1 when the pH was 6 and the temperature was 25˚C.
Keywords:Fe3O4 Microsphere, Hydrothermal Synthesis, Adsorption, Pb2+

Copyright © 2020 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
随着人口增长和工业化发展,大量含重金属、有机染料的废水排放所导致的环境污染问题越来越受到人们关注,这些污染物在生物体中累积会直接威胁生态环境和人类健康。迄今为止,包括光催化,生物修复,化学沉淀等一系列方法已经用于废水处理。然而由于去除效率、成本效益、二次污染、操作方法等多种因素的制约,许多方法不能推广应用。吸附方法在处理废水时由于灵活性好、去除效率高、吸附剂可再生、操作简单、成本低廉成为当前最有效的处理重金属离子和有机染料的方法 [1] [2] [3]。而吸附剂的质量则决定了分离效果和分离效率的高低。因此,开发新型高效的吸附剂一直是国内外废水处理的研究热点之一。
磁性铁氧化物材料作为吸附剂成本低、吸附效果好、易于分离、便于回收和再生,处理重金属离子和有机染料方面效果最为理想等优点,备受研究工作者们的关注 [4] [5]。其中,以Fe3O4为代表的磁性材料是目前在环境治理问题方面最为常用的材料。但是文献报道的Fe3O4作为吸附剂研究时,通常是纳米尺寸,而表现出团聚性和表面易氧化性等缺陷,限制了单一裸露的Fe3O4在吸附上的应用 [6] [7]。
本论文利用水热法合成了单一分散的微米球四氧化三铁,有效降低了纳米颗粒的沉降和团聚现象,Fe3O4的吸附性能得到了很大的改善。本文研究其对重金属铅离子的吸附,并对吸附结果进行吸附动力学、等温吸附模型以及吸附热力学研究。
2. 实验部分
2.1. 试剂与仪器
试剂:FeCl3·6H2O,Na3C6H5O7·2H2O,Pb(NO3)2,Cd(NO3)2,NaOH,HCl,HNO3等,均为分析纯,实验用水为去离子水。
仪器:恒温磁力搅拌器,pH计,恒温水浴振荡器、高压反应釜,鼓风干燥箱,紫外-可见光分光光度计。
2.2. 材料合成
将2 mmol的FeCl3·6H2O溶于80 ml的乙二醇中,搅拌溶解,再加入0.2 mmol的Na3C6H5O7·2H2O,搅拌20分钟后,转移到100 ml的高压反应釜中,在200℃反应12 h,冷却至室温,抽滤,用乙醇和去离子水洗涤,80℃真空烘干保存。产率约为80%。
2.3. 样品表征
采用德国FE-SEM ZEISS Ultra 55型热场发射扫描仪,Bruker D8 Advance X射线衍射仪、Nicolet360型傅立叶变换红外光谱仪对吸附剂进行表征。
2.4. 吸附实验
称取0.1599 g硝酸铅于1000 ml的容量瓶中,配制成100 µg·mg−1的Pb2+储备液,其它浓度Pb2+的溶液由储备液稀释得到。
称取20 mg吸附剂加入到50 ml的不同浓度Pb2+溶液中,25℃、120 rpm/min的条件振荡12 h,取上清液用0.45 µm滤膜过滤。采用Pb(II)-双硫腙-PAR分光光度法测定溶液中Pb2+含量。其计算公式为:
其中,q为吸附剂的吸附量,mg/g;C0为金属离子初始浓度,mg/L;Ct为吸附后溶液金属离子浓度,mg/L;V为溶液体积,L;m为Fe3O4吸附剂的量,mg。
3. 结果与讨论
3.1. Fe3O4的XRD分析
图1是所制备样品的XRD谱图。所有的衍射峰与标准谱图JCPDS卡中编号为65-3107的Fe3O4衍射峰位置完全一一对应,说明样品的晶体结构完整。属于反尖晶石面心立方结构。按照面心立方结构计算Fe3O4晶胞参数a = b = c= 8.3878 Å。
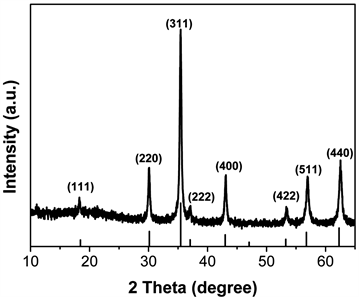
Figure 1. XRD pattern of Fe3O4
图1. Fe3O4的XRD谱图
3.2. Fe3O4的形貌分析
图2给出了样品Fe3O4的SEM图。从图中可看出,样品主要由球形颗粒组成,颗粒尺寸基本均匀,平均直径约为3 µm。Fe3O4微球的形成主要包括2个过程:一是晶核形成并长大成为Fe3O4小颗粒;二是Fe3O4小颗粒二次团聚自组装成Fe3O4亚微米球 [8]。文献报道的Fe3O4球一般是由小颗粒团聚形成的微–纳结构 [9] [10]。但我们合成的Fe3O4微米球表面光滑,未见小颗粒。我们认为是反应中的柠檬酸根离子充当了螯合剂和表面活性剂的双重作用。在合成该球形结构中,柠檬酸根离子通过与铁离子配位形成配合物,以此来减慢反应速度,对形成分散的单个粒子起到重要的作用 [11]。

Figure 2. SEM images of Fe3O4
图2. Fe3O4的SEM图
3.3. Fe3O4的吸附特性
3.3.1. pH对吸附的影响
在25℃,将0.02 g的Fe3O4加入到初始浓度为50 mg/L的Pb2+的溶液中,溶液pH调节为1~7。由于当溶液pH大于7后,会产生氢氧化铅沉淀,因此本实验设置最高pH为7。由图3可知,Fe3O4对Pb2+的吸附量随溶液pH值的升高而增大,当pH = 6时吸附量达到最大,为74.5 mg·g−1。当溶液pH值大于6时,吸附量急剧下降。pH是影响吸附的重要原因之一,不仅影响着吸附剂的表面性质,也决定着金属离子在水溶液中的存在形态。当pH小于3时,溶液中高含量的H3O+会与重金属离子竞争吸附吸附剂表面的吸附位点。一般认为随着pH上升,吸附剂表面的质子化作用减弱,吸附剂与重金属离子的静电斥力减弱,从而使得吸附剂的吸附能力增加 [12]。但当pH值大于6后,Pb2+发生水解,以Pb(OH)+存在或生
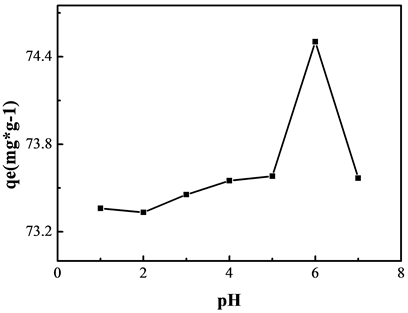
Figure 3. Effect of pH on the adsorption capacity of Fe3O4 to Pb2+
图3. pH对Fe3O4吸附Pb2+的影响
成Pb(OH)2沉淀,降低Fe3O4吸附Pb2+的吸附能力 [13]。图4为Fe3O4吸附Pb2+前后红外光谱图。图中3195.66、1628.57 cm−1分别为H-O-H的伸缩和弯曲振动峰,表明合成的Fe3O4表面吸附有水分子。1557.89、1389.17、1069.92 cm−1为Fe-OH弯曲振动峰,在吸附后这些振动吸收峰几乎消失,说明Fe-OH中的H+可能被Pb2+取代,生成铅的配位化合物。以上分析可以表明Fe3O4吸附Pb2+不是简单的静电吸附,而是存在化学吸附,并且Fe3O4表面的羟基在吸附时起到配位络合作用 [14]。这一结果与在pH影响Fe3O4对Pb2+的吸附有很好的一致性。
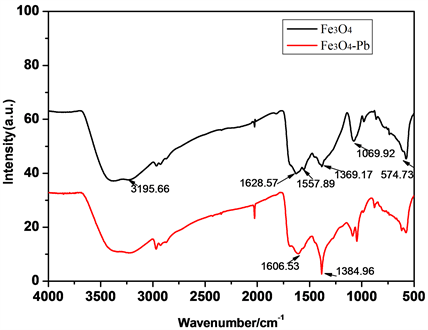
Figure 4. FTIR Spectrometer of Fe3O4 before and after Pb2+ adsorption
图4. Fe3O4吸附Pb2+前后红外光谱图
3.3.2. 吸附动力学
研究吸附动力学可以了解吸附质在吸附剂中迁移的动态规律,揭示吸附反应的机理。准一级反应和准二级反应模型是经典的动力学模型,被广泛用来研究吸附过程的限速步骤和潜在的吸附机理。将0.02 g的Fe3O4加入到初始浓度为50 mg/L、pH = 6的Pb2+溶液中进行吸附,研究其吸附动力学。
1) 准一级动力学模型:准一级反应可表达如下:
式中: (mg/g)为某时刻的吸附容量,t (min)为吸附时间, (min−1)为准一级动力学模型速率常数。
2) 准二级动力学模型:准二级反应方程假设化学反应控制了吸附速率,吸附剂的吸附量与吸附剂上活性吸附位点的数量成正比。其具体表达式为:
式中: (min−1)为准二级动力学模型速率常数。
分别以准一级动力学和准二级动力学对吸附动力学数据进行拟合,通过拟合参数(表1)和相关拟合图5(a)、图5(b)可知,准二级动力学模型能够很好地模拟Fe3O4对Pb2+的吸附,且拟合数据所得饱和吸附量(72.889 mg/g)与实测数据(74.5 mg/g)符合程度很好,表明Fe3O4对Pb2+的吸附主要受化学吸附控制。这与前面的pH和红外光谱实验结果分析吻合。
Table 1. Fitness of dynamics models for Pb2+ adsorption on Fe3O4
表1. Pb2+吸附Fe3O4动力学参数
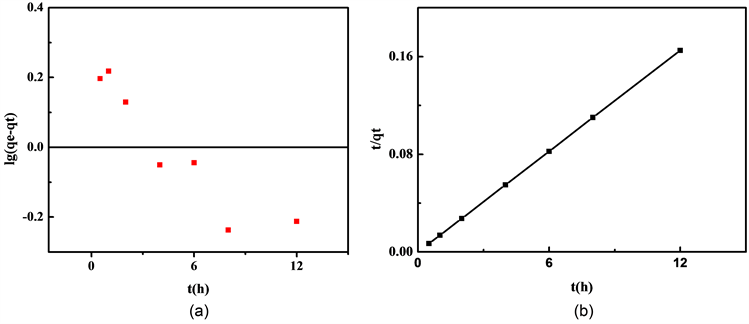
Figure 5. Adsorption kinetics of Pb2+ on Fe3O4
图5. Fe3O4对Pb2+的吸附动力学
3.3.3. 等温吸附模型
等温吸附模型主要用来描述在恒定温度和溶液pH的条件下,平衡吸附量与吸附质浓度之间的关系。将0.02 g的Fe3O4加入到初始浓度为10~60 mg/L、pH = 6的Pb2+溶液中,分别在25℃、35℃、45℃时进行吸附,并采用Langmuir ((式(1))和Freundlich (式(2))等温吸附模型对实验结果进行模拟。
(1)
(2)
式中, 为重金属离子的初始质量浓度, 为平衡吸附量(mg·g−1), 为最大吸附量(mg·g−1), 为Langmuir速率常数(L·mg−1), 是Freundlich速率常数(L·g−1),n是Freundlich吸附常数,通常n > 1,随温度的升高,吸附质数1/n趋于1,一般认为:1/n介于0.1~0.5,则容易吸附,1/n > 2的物质则难以吸附;T为吸附温度(K)。
图6是Fe3O4对Pb2+的吸附等温线。如图可看出,随着Pb2+平衡浓度增大,Fe3O4对其吸附效果增强,吸附量增加。另外,在同一初始浓度下,温度升高,Fe3O4对Pb2+的吸附量随之增加。说明温度升高有利于该吸附过程的进行。
表2为不同温度下Langmuir和Freundlich两种等温吸附模型的拟合参数。由表可知,Freundlich等温模型能对吸附结果进行较好的拟合。
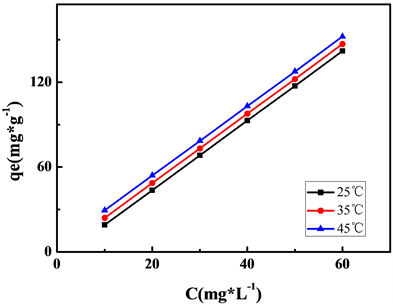
Figure 6. Adsorption isotherms of Pb2+ on Fe3O4
图6. Fe3O4对Pb2+的吸附等温线
Table 2. Constants of Langmuir and Freundlich isotherms
表2. Langmuir和Freundlich吸附等温模型线性拟合参数表
利用吸附热力学参数ΔG、ΔH、ΔS探究Fe3O4对Pb2+的吸附特性。
标准自由能ΔG可通过下式来计算。
式中,KL是吸附平衡常数;T是开尔文温度K;R是理想气体常数,8.314 J·mol−1·K−1; 为标准自由能变化,kJ·mol−1; 是吸附过程焓变,kJ·mol−1; 为吸附过程的熵变,kJ·mol−1·K−1。
利用Freundlich等温式中KF代入式中计算 ,再利用式以 为纵坐标,T为横坐标绘图,曲线的截距和斜率分别为吸附过程的焓变和熵变,热力学参数统计结果见表。
Table 3. Adsorption thermodynamic parameters
表3. 吸附热力学参数表
由表3可知, (−11800.39、−12122.67、12939.80 kJ·mol−1)均为负值,说明Fe3O4对Pb2+的吸附过程是自发进行的,随着温度的增大 逐渐减小,说明高温有利于吸附的进行。 为正值说明Fe3O4对Pb2+的吸附过程为吸热过程, 为正值说明Fe3O4对Pb2+的吸附过程中混乱度会增加。
3.4. 几种Fe3O4基吸附剂的吸附容量比较
为能说明单一分散微米球Fe3O4具有良好的吸附能力,将其与文献报道的Fe3O4基吸附剂对Pb2+的吸附能力进行对比,结果见表4。
Table 4. Comparison of adsorption capacities of several Fe3O4 adsorbents for Pb2+
表4. 几种Fe3O4基吸附剂对Pb2+的吸附容量比较
由表4可看出,Fe3O4微米球和纳米Fe3O4及复合改性后的Fe3O4基吸附剂相比,对Pb2+的吸附表现出较高的吸附容量。该结果说明单一分散的微米球能有效降低在水悬浮液中的聚集和团聚现象而使其保持一定的吸附位点,显著增加对水中Pb2+的去除率。
4. 结论
本文在柠檬酸钠作表面活性剂的条件下,成功合成得到单一分散的Fe3O4微米球。该Fe3O4微米球在水溶液中对Pb2+具有良好的吸附能力。在25℃,pH为6的条件下,对Pb2+的最大吸附容量是74.5 mg·g−1。由吸附动力学和吸附热力学研究发现,Fe3O4微米球对Pb2+的吸附过程符合准二级动力学模型和Freundlich等温吸附模型,吸附过程为均匀表面的单层吸附,且化学吸附为速率控制步骤,热力学参数表明对Pb2+的吸附过程是自发和吸热过程。Fe3O4微米球合成过程简单、成本低廉,吸附性能优良。但从实验中发现单一Fe3O4对Pb2+的吸附能力受溶液中pH影响较大。在实际运用中,可以将Fe3O4和其它材料复合,提供丰富的官能团而提高与Pb2+的亲和力和特定的结合力,这样有望能用于水体中去除重金属离子污染物,成为广泛适用的吸附剂。
基金项目
广东省攀登计划广东大学生科技创新培育专项资金资助项目(pdjh2019b0360)。
文章引用
葛业玲,袁学文,邹红丽,卢敏敏,刘振东,穆洪涛,刘凤银,刘依文,梁颖茵. 微米球四氧化三铁的水热合成和对铅离子的吸附研究
Hydrothermal Synthesis of Fe3O4 Microsphere and Its Adsorption Performance for Pb2+[J]. 化学工程与技术, 2020, 10(06): 398-406. https://doi.org/10.12677/HJCET.2020.106051
参考文献
- 1. 周晓勇, 田亚运, 张举斌. 水葫芦对水溶液中Cu2+和Pb2+的吸附研究[J]. 水处理技术, 2015, 41(2): 56-61.
- 2. 冯冬燕, 孙怡然, 于飞, 等. 石墨烯及其复合材料对水中重金属离子的吸附性能研究[J]. 功能材料, 2015, 46(3): 3009-3015.
- 3. Qin, X., Zhou, J., Huang, A., et al. (2016) A Green Technology for the Synthesis of Cellulose Suc-cinate for Efficient Adsorption of Cd(II) and Pb(II) Ions. RSC Advances, 6, 26817-26825. https://doi.org/10.1039/C5RA27280G
- 4. Guo, S.Z., Duan, N., Dan, Z.G., et al. (2018) g-C3N4 Modified Mag-netic Fe3O4 Adsorbent: Preparation, Characterization, and Performance of Zn(II), Pb(II) and Cd(II) Removal from Aqueous Solution. Journal of Molecular Liquids, 258, 225-234. https://doi.org/10.1016/j.molliq.2018.03.029
- 5. 王佳, 魏俊翀, 熊甜甜, 等. 纳米四氧化三铁沸石微球吸附废水中铅离子研究[J]. 水处理技术, 2019, 45(3): 82-88
- 6. Zou, Y.D., Wang, X.X., Khan, A., et al. (2016) Environmental Remediation and Application of Nanoscale Zero-Valent Iron and Its Composites for the Removal of Heavy Metal Ions: A Review. Environmental Science & Technology, 50, 7290-7304. https://doi.org/10.1021/acs.est.6b01897
- 7. Santhana, K.K.A., Jiang, S.J., et al. (2017) Synthesis and Characterization of Two-Dimensional Transition Metal Dichalcogenide Magnetic MoS2 @Fe3O4 Nano-Particles for Adsorption of Cr(VI)/Cr(III). ACS Omega, 2, 6187-6200. https://doi.org/10.1021/acsomega.7b00757
- 8. 路苹, 张吉林, 孙德慧, 等. 单分散Fe3O4亚微米球的合成与表征[J]. 无机化学学报, 2010, 26(7): 1177-1182.
- 9. Yu, B.Y. and Kwak, S.Y. (2010) Assembly of Magnetite Nanocrystals into Spherical Meso-Porous Aggregates with a 3-D Wormhole-Like Pore Structure. Journal of Materials Chemistry, 20, 8320-8328. https://doi.org/10.1039/c0jm01274b
- 10. 吕庆荣, 方庆清, 刘艳美, 等. 纳米结构四氧化三铁空心微球的合成及磁性研究[J]. 人工晶体学报, 2010, 39(3): 656-659.
- 11. Jiao, F., Harrison, A., Jumas, J.C., et al. (2006) Ordered Mesoporous Fe2O3 with Crystalline Walls. Journal of the American Chemical Society, 128, 5468-5474. https://doi.org/10.1021/ja0584774
- 12. 孙舒雅, 彭映林, 刘肖, 等, 四氧化三铁对水中As(Ⅲ)的吸附性能研究[J]. 环境科学与技术, 2018, 41(S1): 1-5.
- 13. Ren, Y., Yan, N., Feng, J., et al. (2012) Adsorption Mechanism of Copper and Lead Ions onto Graphene Nanosheet/δ-MnO2. Materials Chemistry & Physics, 136, 538-544. https://doi.org/10.1016/j.matchemphys.2012.07.023
- 14. Wen, Z., Zhang, Y., Guo, S., et al. (2017) Facile Tem-plate-Free Fabrication of Iron Manganese Bimetal Oxides Nanospheres with Excellent Capability for Heavy Metals Removal. Journal of Colloid & Interface Science, 486, 211-218. https://doi.org/10.1016/j.jcis.2016.09.026
- 15. Han, L. and Wei, Y. (2012) Low-Temperature Synthesis of Fe3O4 Microroses and Their Application in Water Treatment. Materials Letters, 70, 1-3. https://doi.org/10.1016/j.matlet.2011.11.047
- 16. 蒋彩云, 李亮亮, 徐永才, 等. Fe3O4/Ag磁性纳米颗粒去除水中的铅离子[J]. 环境工程学报, 2013, 7(11): 4178-4184.
- 17. Liu, J.F., Zhao, Z.S., Jiang, G.B., 任翠领. Fe3O4磁性纳米颗粒外包腐植酸用于有效去除水中重金属[J]. 腐植酸, 2015(4): 30-36.
- 18. 余琦粟, 戴康, 宋园, 等. Fe3O4/RGO的制备及其对Pb(II)、Cu(II)、Cd(II)的吸附研究[J]. 水处理技术, 2018, 44(3): 52-57.
- 19. Wang, J., Zheng, S., Shao, Y., et al. (2010) Amino-Functionalized Fe3O4 @SiO2 Core-Shell Magnetic Nanomaterial as a Novel Adsorbent for Aqueous Heavy Metals Removal. Journal of Colloid and Interface Science, 349, 293-299. https://doi.org/10.1016/j.jcis.2010.05.010
- 20. Zhang, W.J., Zhang, Y., Gutha, Y., et al. (2017) Adsorption of Pb(II) Ions from Aqueous Environment Using Eco-Friendly Chitosan Schiff’s Base @Fe3O4 (CSB@Fe3O4 ) as an Adsorbent; Kinetics, Isotherm and Thermodynamic Studies. International Journal of Biological Macromolecules, 105, 422-430. https://doi.org/10.1016/j.ijbiomac.2017.07.063
- 21. Overah, L.C., Iwegbue, C.M., Babalola, J.O., et al. (2019) Fabrication and Characterisation of a Fe3O4/Raphia Farinifera Nanocomposite for Application in Heavy Metal Adsorption. Environmental Technology & Innovation, 13, 11-29. https://doi.org/10.1016/j.eti.2018.09.007
NOTES
*通讯作者。
