Hans Journal of Chemical Engineering and Technology
Vol.
11
No.
05
(
2021
), Article ID:
44973
,
7
pages
10.12677/HJCET.2021.115035
Cu-MOF/FeOOH复合材料在水相中催化合成四氢噻吩类衍生物
惠永海,张永飞,余彪,韩冰,李建鹏*
岭南师范学院化学化工学院,海洋绿色精细化学品实验室,广东 湛江

收稿日期:2021年7月26日;录用日期:2021年8月26日;发布日期:2021年9月2日

摘要
制备了Cu-MOF/FeOOH复合材料,并作为催化剂,在水相中对硝基烯和2,5-二羟基-1,4-二噻烷进行了串联环化反应的催化性能研究。以较高产率(最高达98%)合成了系列四氢噻吩类化合物,并对反应放大量实验和催化剂循环再利用进行了系统研究,最后探讨了可能的反应机理。该方法具有操作简单、反应时间短和环境友好等特点,为四氢噻吩环的构建提供了理论依据。
关键词
Cu-MOF/FeOOH复合材料,2,5-二羟基-1,4-二噻烷,四氢噻吩,串联反应

Cu-MOF/FeOOH Composites Catalyzed Synthesis of Tetrahydrophene Derivatives in Water
Yonghai Hui, Yongfei Zhang, Biao Yu, Bing Han, Jianpeng Li*
Laboratory of Marine Green Fine Chemicals, College of Chemistry and Chemical Engineering, Lingnan Normal University, Zhanjiang Guangdong

Received: Jul. 26th, 2021; accepted: Aug. 26th, 2021; published: Sep. 2nd, 2021

ABSTRACT
Cu-MOF/FeOOH composite was prepared and used as catalyst to study the catalytic performance of series cyclization of nitroene and 2,5-dihydroxy-1,4-dithiane in aqueous phase. A series of Tetrahydrothiophene compounds were synthesized in high yield (up to 98%), and the reaction experiments and catalyst recycling were systematically studied. Finally, the possible reaction mechanism was discussed. The method has the characteristics of simple operation, reaction time and environmental friendliness, which provides a theoretical basis for the construction of tetrahydrothiophene ring.
Keywords:Cu-MOF/FeOOH Composite, 2,5-Dihydroxy-1,4-Dithiane, Tetrahydrothiophenes, Tandem Reaction

Copyright © 2021 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
含硫杂环化合物在医药、农药、合成和材料等领域有着重要的作用,其中四氢噻吩(噻吩类)广泛存在于天然产物分子和药物生物分子中,从合成和生物角度上来看也是一类具有吸引力的明星结构单元,在过去的几十年中,它引起了许多化学家和生物学家的高度重视。以四氢噻吩为骨架的衍生物具有重要的生理药理活性(图1),如:辅酶素Biotin [1] 是一种可溶性的维生素,可参与很多生物学功能;α-葡萄糖苷酶抑制剂Salacinol [2] 和Kotalanol [3] 能减缓小肠对葡萄糖的吸收从而降低血糖,有效避免糖尿病患者发生心血管疾病;盘尼西林衍生物(Penicillin G) [4] 可以破坏细菌的细胞壁来杀死细菌;(R)-Tetrahydrothiophen-3-ol [5] 是一种制备抗菌剂刘培南(Sulopenem)的关键中间体;4′-硫杂阿拉伯核苷(4'-Thioarabinonucleosides) [6] 对几种疱疹病毒具有抗病毒活性,对抑制人体巨细胞病毒特别有效,等等。因此其衍生物的合成方法引起了人们极大地研究兴趣。
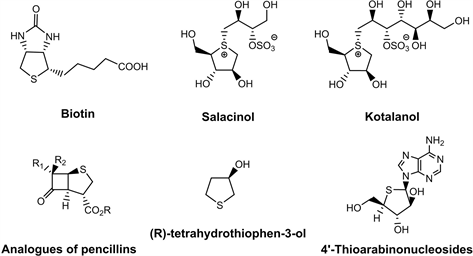
Figure 1. Some bioloigically important tetrahydrophene derivatives
图1. 一些重要的具有生物活性的四氢噻吩类衍生物
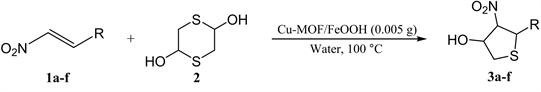
由于四氢噻吩类化合物的重要用途,近年来,越来越多的催化体系被应用到合成四氢噻吩类化合物的合成反应中。已报道的方法有:一、α-巯基酮与α,β-不饱和醛发生的Michael/Michael多米诺反应 [7];二、g-卤代芳酮与硫代磷酸进行的串联反应 [8];三、2,5-二羟基-1,4-二噻烷和α,β-不饱和羰基化合物进行Sulfur-Michael/Aldol串联反应 [9] [10]。在这里,本课题组选用2,5-二羟基-1,4-二噻烷为硫源来合成四氢噻吩类化合物,其中,以硝基烯类化合物为Michael受体的研究较少 [11] [12] [13]。本文将制备的Cu-MOF/FeOOH复合材料应用于水相中催化2,5-二羟基-1,4-二噻烷与硝基烯的串联环化反应(图2),分别考察了催化剂种类、反应温度、反应时间和催化剂用量等因素对反应产率的影响,同时对反应底物普适性进行了研究(最高产率可达98%),并对反应机理进行了分析。

Figure 2. The Friedel-Crafts reaction of Indole and 1-Vinylpyrrolidin-2-one
图2. 吲哚与1-乙烯基吡咯烷-2-酮的傅克反应
2. 实验部分
2.1. 试剂与仪器
1H NMR使用Varian inova-400型核磁共振仪(TMS为内标,CDCl3为溶剂);反应跟踪用ZF-2型三用紫外仪观察;柱层析用硅胶(200~300目,青岛海洋化学公司生产);所用试剂及溶剂均从Adamas-Beta试剂公司订售,用前未经处理。
2.2. 双金属复合材料的合成
2.2.1. Cu-MOF前驱体的制备
称取Cu(NO3)2·3H2O (9 mmol, 2.188 g)在反应釜内衬中,加入20 mL去离子水,磁力搅拌均匀得到溶液A;称取1,3,5-苯三甲酸 (即3 mmol, 1.05 g)和量取20 mL无水乙醇在50 mL烧杯中,超声溶解得到溶液B。随后,在搅拌下将溶液B迅速倒入溶液A中,搅拌十钟后转移至反应釜中,在110℃下保温12 h,待反应结束后,冷却至室温,用无水乙醇作为洗液,离心洗涤四次,得到的样品置于烘箱进行80℃干燥12 h。最后得到Cu-MOF前驱体。
2.2.2. Cu-MOF/FeOOH复合材料的制备
称取FeCl3·6H2O (1 mmol, 0.2703 g)和量取40 mL无水乙醇于50 mL烧杯中,再加入0.5000 g上述制得的Cu-MOF前驱体,超声10 min,在磁力搅拌下加入NH4HCO3 (3 mmol, 0.2703 g),用保鲜膜封住烧杯口,室温搅拌12 h。反应完全后,离心洗涤分离,用无水乙醇作为洗液,离心洗涤三次,所得固体样品放进减压干燥箱干燥,干燥温度为60℃,干燥12 h,得到Cu-MOF/FeOOH复合物材料。
2.3. 目标化合物3a-3m的合成结构分析
目标化合物的合成(以标准反应为例):将硝基苯乙烯1a (0.6 mmol, 0.08949 g)、2,5-二羟基-1,4-二噻烷2 (0.75 mmol, 0.1142 g)、Cu-MOF/FeOOH (0.005 g)和1.5 mL去离子水于反应管中,在100℃下磁力搅拌回流反应10 min。反应结束后,用二氯甲烷萃取三次,减压浓缩,柱层析(乙酸乙酯:石油醚 = 1:4洗涤)分离纯化得目标产物。目标化合物的表征如下:
3a:4-硝基-5-苯基四氢噻吩-3-醇,浅黄色油状物;1H NMR (400 MHz, CDCl3) d:7.48~7.45 (m, 2 H),7.37~7.30 (m, 3 H),5.24 (d, J = 8.0 Hz, 1 H),5.07~4.99 (m, 2 H),3.52~3.48 (m, 1 H),3.07~3.04 (m, 1 H)。
3b:5-(4-氯苯基)-4-硝基四氢噻吩-3-醇,黄色油状物;1H NMR (400 MHz, CDCl3) d:7.33 (d, J = 8.0 Hz, 2H),7.22~7.20 (m, 2H),5.14 (d, J = 8.0 Hz, 1H),4.96~4.85 (m, 2H),3.42~3.38 (m, 1H),2.95~2.91 (m, 1H)。
3c:4-硝基-5-(对甲苯基)四氢噻吩-3-醇,浅黄色油状物;1H NMR (400 MHz, CDCl3) d:7.35~7.27 (m, 2H),7.13 (d, J = 8.0 Hz, 2H),5.22 (d, J = 8.0 Hz, 1H),5.02~4.84 (m, 2H),3.46~3.42 (m, 1H),3.00~2.97 (m, 1H), 2.30 (s, 3H)。
3d:5-(4-异丙基苯基)-4-硝基四氢噻吩-3-醇,浅黄色油状物;1H NMR (400 MHz, CDCl3) d:7.30 (d, J = 8.0 Hz, 2H),7.13 (t, J = 8.0 Hz, 2H),5.16 (d, J = 12.0 Hz, 1H),4.96~4.91 (m, 2H),3.41~3.37 (m, 1H),2.95~2.92 (m, 1H),2.83~2.76 (m, 1H),1.14 (s, 6H)。
3e:5-(4-(苄氧基)苯基)-4-硝基四氢噻吩-3-醇,黄色油状物;1H NMR (400 MHz, CDCl3) d:7.35~7.18 (m, 6H),6.87 (d, J = 4.0 Hz, 1H),6.80~6.73 (m, 2H),5.05 (d, J = 4.0 Hz, 1H),4.86~4.76 (m, 2H),3.81 (s, 2H),3.20~3.16 (m, 1H),3.06~3.01 (m, 1H)。
3f:5-(萘-1-基)-4-硝基四氢噻吩-3-醇,无色油状物;1H NMR (400 MHz, DMSO) d:7.77~7.73 (m, 2H),7.52~7.43 (m, 2H),7.43~7.41 (m, 3H),5.36~5.33 (m, 1H),5.06~5.02 (m, 2H),3.51~3.47 (m, 1H),3.06~3.03 (m, 1H)。
3. 结果与讨论
3.1. 反应条件的优化
Table 1. Different condition effect on the reaction
表1. 不同反应条件的优化a
a反应条件:硝基苯乙烯(0.6 mmol),2,5-二羟基-1,4-二噻烷(0.9 mmol),催化剂(0.005 g)在水(1.5 mL)中回流条件下反应。b柱层析产率。c催化剂用量0.01 g和0.0025 g。
以硝基苯乙烯和2,5-二羟基-1,4-二噻烷在水相中的反应为标准反应,进行系统的反应条件优化(表1)。在没有催化剂的条件下,反应8 h没有检测到目标产物;当Cu-MOF/FeOOH复合材料加入反应体系中,反应8 h后有93%的产物生成。在这里考虑到合成复合材料的原料会对反应有影响,即对CuSO4和FeOOH进行了考察,结果显示CuSO4对反应无催化效果,FeOOH只有很低的催化效果。确定了Cu-MOF/FeOOH复合材料为催化剂后进行了反应时间的考察,当反应进行10 min后,反应就能得到91%的产率;如果继续缩短反应时间,反应产率明显降低。同样,当反应温度降低,即温度没有达到回流状态,产率也出现降低趋势,室温下没有产物生成。最后对催化剂的用量进行了考察,结果显示,增加催化剂用量对反应产率提升不大或无变化;当减少催化剂用量对反应产率有较大影响(0.0025 g Cu-MOF/FeOOH,产率下降到74%)。确定的最佳反应条件为:硝基苯乙烯(0.6 mmol)、2,5-二羟基-1,4-二噻烷(0.9 mmol)和Cu-MOF/FeOOH (0.005 g)在水(1.5 mL)中回流条件下反应10 min。
3.2. 反应底物的扩展
Table 2. Substrate scope of tetrahydrophene cyclization reaction
表2. 四氢噻吩类环化反应底物普适性研究a
a反应底物比例硝基烯:2,5-二羟基-1,4-二噻烷 = 4:5,催化剂Cu-MOF/FeOOH的用量0.0050 g,1.5 mL去离子水作为溶剂,在100℃下反应。b柱层析产率。
在最优条件下研究了含有不同取代基的硝基芳乙烯与2,5-二羟基-1,4-二噻烷的串联环化反应(表2)。随着R芳环4-位上取代基团位阻不断变大(Entry 1,3和4),反应产率呈现下降趋势(91%,88%和73%);当芳基4-位为卤素(如Cl-)取代时,反应可以得到98%的高产率(Entry 2);当芳基4-位是苯甲氧基取代时,反应只能得到15%的目标产物(Entry 5);当底物换成1-(2-硝基乙烯基)萘时,只能得到6%的目标产物(Entry 6)。
3.3. 放大量实验研究
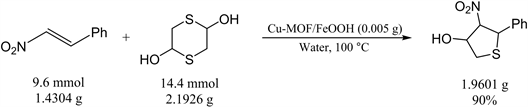
Figure 3. Scale-up version of the reaction
图3. 4-硝基-5-苯基四氢噻吩-3-醇合成的扩大量反应
在最优反应条件下,对标准反应进行了反应放大量实验研究(如图3)。反应物均放大到克级,最终反应依然可以得到90%的产率。
3.4. 催化剂循环使用性
为了验证催化剂Cu-MOF/FeOOH的循环利用能力,我们对反应溶液进行了离心并分离出催化剂,干燥后继续用于第二次催化反应,依此操作进行后续的催化剂循环使用研究实验。如图4所示,催化剂在进行二次利用时,催化剂活性明显降低(42%产率),但在进行第三次循环使用总,反应未获得目标产物。可能双金属复合物结构中的活性组分在水相分离中有大量的流失,以至于无法进一步进行反应催化。于是在后续的“沥滤反应”研究中,发现水相滤液对反应有催化活性,从而说明,催化剂的活性组分溶解到水溶剂中,也说明Cu-MOF/FeOOH的结构在水中不稳定。为了提高此复合材料的稳定性和催化活性,我们对复合材料进行了高温热处理获得Fe3O4/Cu/C纳米材料,然后将其应用到4-硝基-5-苯基四氢噻吩-3-醇合成反应中,只能得到较低产率的目标产物。由此可以得到,配合型复合材料对本反应的催化效果优于金属氧化物复合材料。

Figure 4. Recycling test of Cu-MOF/FeOOH Composites
图4. Cu-MOF/FeOOH复合物材料的循环研究
3.5. 反应机理
硝基苯乙烯与2,5-二羟基-1,4-二噻烷反应制备四氢噻吩类化合物可能的反应机理如图5所示。根据已报道的工作 [10] [11],2,5-二羟基-1,4-二噻烷在反应过程中首先原位生成巯基乙醛,然后与硝基苯乙烯发生硫迈克加成反应,在硝基的α-位生成碳负离子,最后碳负离子进攻醛基发生分子内的Aldol反应,从而生成四氢噻吩类化合物。

Figure 5. Proposed reaction mechanism for the reaction
图5. 反应可能的机理
4. 结论
本文设计了一种简单有效的合成多取代四氢噻吩衍生物的方法。利用制备的Cu-MOF/FeOOH双金属复合材料作为催化剂,水相中能够有效地催化硝基苯乙烯和2,5-二羟基-1,4-二噻烷的串联环化反应,获得了较好的产率,最高可达98%。该反应具有操作简单、反应时间短、原子利用率高和环境友好等特点,极大地丰富和发展了四氢噻吩结构的催化合成方法。
基金项目
广东省基础研究面上项目(2020A1515010252)和岭南师范学院人才专项基金(No. ZL1908)支持。
文章引用
惠永海,张永飞,余 彪,韩 冰,李建鹏. Cu-MOF/FeOOH复合材料在水相中催化合成四氢噻吩类衍生物
Cu-MOF/FeOOH Composites Catalyzed Synthesis of Tetrahydrophene Derivatives in Water[J]. 化学工程与技术, 2021, 11(05): 260-266. https://doi.org/10.12677/HJCET.2021.115035
参考文献
- 1. Amspacher, D.R., Blanchard, C.Z., Fronczek, F.R., Saraiva, M.C., Waldrop, G.L. and Strongin, R.M. (1999) Synthesis of a Reaction Intermediate Analogue of Biotin-Dependent Carboxylases via a Selective Derivatization of Biotin. Organic Letters, 1, 99-102. https://doi.org/10.1021/ol990026z
- 2. Yoshikawa, M., Morikawa, T., Matsuda, H., Tanabe, G. and Muraoka, O. (2002) Absolute Stereostructure of Potent α-Glucosidase Inhibitor, Salacinol, with Unique Thiosugar Sulfonium Sulfate Inner Salt Structure from Salacia Reticulata. Bioorganic & Medicinal Chemistry, 10, 1547-1554. https://doi.org/10.1016/S0968-0896(01)00422-9
- 3. Yoshikawa, M., Murakami, T., Yashiro, K. and Matsuda, H. (1998) Kotalanol, a Potent α-Glucosidase Inhibitor with Thiosugar Sulfonium Sulfate Structure, from Antidiabetic Ayurvedic Medicine Salacia Reticulata. Chemical & Pharmaceutical Bulletin, 46, 1339-1340. https://doi.org/10.1248/cpb.46.1339
- 4. Johnson, J.W., Evanoff, D.P., Savard, M.E., Lange, G., Ramadhar, T.R., Assoud, A., Taylor, N.J. and Dmitrienko, G.I. (2008) Cyclobutanone Mimics of Penicillins: Effects of Substitution on Conformation and Hemiketal Stability. The Journal of Organic Chemistry, 73, 6970-6982. https://doi.org/10.1021/jo801274m
- 5. Volkmann, R.A., Kelbaugh, P.R., Nason, D.M. and Jasys, V.J. (1992) 2-Thioalkyl Penems: An Efficient Synthesis of Sulopenem, a 5R, 6S-6-(1(R-Hydroxyethyl)-2-[(cis-1-oxo-3-Thiolanyl)thiol-2-Penem Antibacterial. The Journal of Organic Chemistry, 57, 4352-4361. https://doi.org/10.1021/jo00042a010
- 6. Yoshimura, Y., Watanabe, M., Satoh, H., Ashida, N., Ijichi, K., Sakata, S., Machida, H. and Matsuda, A. (1997) A Facile, Alternative Synthesis of 4’-Thioarabinonucleosides and Their Biological Activities. Journal of Medicinal Chemistry, 40, 2177-2183. https://doi.org/10.1021/jm9701536
- 7. Brandau, S., Maerten, E. and Jørgensen, K.A. (2006) Asymmetric Syn-thesis of Highly Functionalized Tetrahydrothiophenes by Organocatalytic Domino Reaction. Journal of American Chemical Society, 128, 14986-14991. https://doi.org/10.1021/ja065507+
- 8. Robertson, F.J. and Wu, J. (2012) Phosphorothioic Acids and Related Compounds as Surrogates for H2S Synthesis of Chiral Tetrahydrothiophenes. Journal of American Chemical Society, 134, 2775-2780. https://doi.org/10.1021/ja210758n
- 9. Ling, J.B., Su, Y., Zhu, H.L., Wang, G.Y. and Xu, P.F. (2012) Hydrogen-Bond-Mediated Cascade Reaction Involving Chalcones: Facile Synthesis of Enantioenriched Trisubstituted Tetrahy-drothiophenes. Organic Letters, 14, 1090-1093. https://doi.org/10.1021/ol2034959
- 10. Su, Y., Ling, J.B., Zhang, S. and Xu, P.F. (2013) Organocatalytic Cascade Sulfa-Michael/Aldol Reaction of β,β-Disubstituted Enones: Enantioselective Synthesis of Tetrahydrothiophenes with a Trifluoromethylated Quaternary Center. The Journal of Organic Chemistry, 78, 11053-11058. https://doi.org/10.1021/jo4016024
- 11. Baricordi, N., Benetti, S., Bertolasi, V. and Risi, C.D. (2012) 1,4-Dithiane-2,5-Diol as an Efficient Synthon for a Straightforward Synthesis of Functionalized Tetrahydrothiophenes via Sulfa-Michael/Aldol-Type Reactions with Electrophilic Alkenes. Tetrahedron, 68, 208-213. https://doi.org/10.1016/j.tet.2011.10.064
- 12. Song, J., Moss, J., Yang, D.C., Guan, Z. and He, Y.H. (2014) Catalyst-Free Synthesis of Trisubstituted Tetrahydrothiophenes in Water via a Cascade Sulfamichael/aldol (Henry) Type Reaction. RSC. Advances, 4, 54032-54038. https://doi.org/10.1039/C4RA06273F
- 13. Du, J.G., Tao, M.L. and Zhang, W.Q. (2016) Fiber-Supported Acid-Base Bifunctional Catalysts for Efficient Nucleophilic Addition in Water. ACS Sustainable Chemistry & Engineering, 4, 4296-4304. https://doi.org/10.1021/acssuschemeng.6b00785
