Advances in Analytical Chemistry
Vol.
09
No.
02
(
2019
), Article ID:
30081
,
10
pages
10.12677/AAC.2019.92009
Rapid Determination of Estradiol by Nano-Gold Surface-Enhanced Raman Spectroscopy
Chongwei Kang, Qifan Song, Chengming Zuo, Gengyi Song, Jiajia Chen, Yahong Zhou*
Department of Criminal Science and Technology, Jiangsu Police Institute, Nanjing Jiangsu

Received: Apr. 9th, 2019; accepted: Apr. 30th, 2019; published: May 6th, 2019

ABSTRACT
A rapid method for the determination of estradiol was developed by nano-gold surface-enhanced Raman spectroscopy. The optimal addition amount of nano gold, estradiol and nitric acid solution as well as the better acquisition time of Raman spectra were determined by single factor analysis method. Combined with Raman spectra, the characteristic peaks in the surface enhanced Raman spectra of estradiol were attributed. Thus, a qualitative and quantitative analysis model for the rapid determination of estradiol was established. The standard curve equation was established based on the estradiol concentration and the characteristic peak strength at 915.4 cm−1, which could reach the minimum detection concentration of 0.04 μg∙mL−1. The reaction and test time of this method is only 30 s, and the average recovery is 90%-110%. This method is expected to be applied to the rapid detection of estradiol residues in the environment.
Keywords:Nano Gold, Surface Enhanced Raman Spectroscopy, Estradiol, Qualitative and Quantitative Analysis, Rapid Detection
纳米金表面增强拉曼光谱法快速检测雌二醇
康崇伟,宋奇凡,左成明,宋庚益,陈佳佳,周亚红*
江苏警官学院刑事科学技术系,江苏 南京

收稿日期:2019年4月9日;录用日期:2019年4月30日;发布日期:2019年5月6日

摘 要
采用纳米金表面增强拉曼光谱法,建立快速检测雌二醇的方法。利用单因素分析法确定了纳米金、雌二醇和硝酸溶液的最优加入量以及拉曼光谱的较佳采集时间,结合拉曼谱图对雌二醇表面增强拉曼谱图中的特征峰进行了归属,从而建立雌二醇快速检测的定性定量分析模型。以雌二醇浓度与915.4 cm−1处特征峰峰强建立标准曲线方程,可达到0.04 μg·mL−1的最低检测浓度。该方法反应、测试时间只需30 s,平均回收率在90%~110%。该方法有望应用于环境中雌二醇残留的快速检测。
关键词 :纳米金,表面增强拉曼光谱,雌二醇,定性定量分析,快速检测

Copyright © 2019 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
现如今,环境激素(又称内分泌干扰性物质)正在成为影响人类健康的一大重要问题。作为环境激素中的重要组成部分,雌激素由于具有环境滞留性、脂溶性和富集性给人类带来了严重的危害,其过量摄取会导致发育障碍、生殖异常、器官病变、畸胎率增加 [1] [2] [3] 。目前常采用气相色谱质谱联用(GC-MS) [4] [5] 和液相色谱质谱联用(LC-MS) [6] [7] 等方法检测雌激素。因此,探索快速、简便、高效的雌激素检测方法,建立有效的安全监控体系,对于相关食药环机构具有重要的现实意义。
表面增强拉曼光谱(surface-enhanced Raman scattering, SERS)技术是在普通拉曼光谱法的基础上,结合表面增强技术而研发出来的一种新技术。由于表面增强拉曼光谱技术具有稳定性强、受水与荧光干扰小、方便快捷等特点,自1970年被发现以来 [8],其已经被广泛应用在DNA和细胞内分子的检测 [9] [10] [11] [12] 、癌症的诊断以及痕量化学物质的检测 [13] 、农药残留 [14] 等许多领域,已成为一种高效实用的快速检测分析工具。纳米金颗粒具有高电子密度、介电特性和催化作用,能与多种生物大分子结合,且不影响其生物活性的特性,利用此特性,便可有效快速地检测雌激素。但是,现阶段对于纳米金增敏拉曼光谱法检测雌激素的研究的报道较少 [15] 。
基于此,本研究利用表面增强拉曼对雌激素(以雌二醇为例)在纳米金基底表面的SERS行为进行了研究、对SERS测试条件进行了优化,拟探索出采用纳米金表面增强拉曼光谱法建立快速检测雌二醇残留的定性定量方法,并应用此方法为蜂蜜中的雌二醇残留检测提供技术支持。
2. 材料与方法
2.1. 试剂与仪器
氯金酸、硝酸银、1:5硝酸、1%醋酸、5%醋酸、1%酒石酸、5%酒石酸:上海国药集团化学试剂有限公司;甲醇、雌二醇、铬酸洗液、柠檬酸三钠:南京化学试剂厂,上述试剂均为分析纯;蜂蜜:南京苏果超市;实验用水为三次去离子水。
Milli-Q Intergral 5纯水机:Millipore公司;
FA1104N电子天平:上海精密仪器有限公司;
KQ500E超声波清洗器:昆山舒美超声仪器有限公司;
Fresco21台式高速冷冻离心机:THERMO FISHER公司;
85-2型磁力搅拌器:上海司乐仪器有限公司;
ZF-5手提紫外分析仪:上海勤科分析仪器有限公司;
Lambda 25-PerkinElmer紫外可见分光光度计:美国珀金埃尔默公司(Perkin Elmer);
SSR-3010简智仪器便携式拉曼光谱分析仪:南京简智仪器设备有限公司;相关仪器参数设置如下:500 mW的激光器的激光发射功率,分辨率6 cm−1,积分时间10 s,积分平均2次,平滑度为1,并选取扫描光谱波段为200 cm−1~4000 cm−1进行研究。
FirstDefender RM手持式拉曼光谱仪:美国赛默飞世尔科技公司;
HG202A-2电热鼓风干燥箱:南京金恒实验仪器厂;
移液枪:北京大龙医疗设备有限公司。
2.2. 实验内容
2.2.1. 纳米金的合成及表征
利用柠檬酸三钠还原氯金酸法 [16] [17] 合成纳米金,具体步骤为:用铬酸和三次去离子水清洗玻璃容器和磁子;移取2 mL 1%的氯金酸至装有100 mL水和磁石的烧杯中,将烧杯置于磁力加热搅拌器上加热至沸腾,开动磁力搅拌器搅拌的同时迅速加入2 mL 1%柠檬酸三钠水溶液,开始有些变黑,经过一段时间变蓝,再加热出现红色。煮沸两到三分钟后,出现透明的酒红色,继续加热搅拌5分钟,移去热源同时停止搅拌。冷却至室温,避光保存即得1:1纳米金溶液,保持其他因素不变,增加1%氯金酸的加入量制得1.1:1和1.15:1的纳米金溶液,并用紫外分光计对上述制得的三种不同配比的纳米金溶液进行表征。
2.2.2. 拉曼光谱检测条件优化
固定加入400μL 1:1纳米金溶液、100 μL雌二醇(10 μg∙mL−1)和20μL的表面增强剂(pH = 4, pH = 6.86, pH = 9.18),再用三次去离子水定容到2 mL,对比结果,只有在酸性情况下反应明显,其余条件下没有变化。
根据上一实验,固定加入400 μL 1:1纳米金溶液、100 μL雌二醇(10 μg∙mL−1)和20 μL的酸试剂,改变加入的酸试剂种类(1%醋酸,5%醋酸,1%酒石酸,5%酒石酸,1:5硝酸),构成5组实验样品,用便携拉曼光谱仪对这5组实验样品进行检测,保存每组样品的拉曼光谱图并进行比对,选取效果最佳的试剂作为本实验的表面增强剂。
2.2.3. 定性定量检测方法建立
1) 表面增敏纳米金量的选择
固定加入20 μL 1:5硝酸以及100 μL雌二醇(10 μg∙mL−1),改变加入1:1纳米金溶液的量(50 μL, 100 μL, 150 μL, 200 μL, 250 μL, 300 μL, 350 μL, 400 μL, 500 μL),再用三次去离子水定容到2 mL,最后用便携拉曼光谱仪进行检测。确定纳米金溶液的最优加入量。
2) 表面增强剂量的选择
固定加入400 μL 1:1纳米金溶液以及100 μL雌二醇(10 μg∙mL−1),改变加入1:5硝酸的量(10 μL, 20 μL, 30 μL, 40 μL),再用三次去离子水定容到2 mL,最后用便携拉曼光谱仪进行检测。确定1:5硝酸的最优加入量。
3) 检测时间的影响
向400 μL 1:1纳米金溶液中加入100 μL雌二醇(10 μg∙mL−1),20 μL 1:5硝酸,充分振荡,然后分别静置0 s,30 s,60 s,90 s,120 s,240s,用便携拉曼光谱仪对其进行测定,得出图谱。确定最优检测时间。
4) 表面增敏拉曼光谱定性定量方法的建立
分别在三次去离子水中添加不同量的雌二醇得到含有不同雌二醇浓度的样品,分别为(0.01 μg∙mL−1, 0.02 μg∙mL−1, 0.04 μg∙mL−1, 0.1 μg∙mL−1, 0.2 μg∙mL−1, 0.3 μg∙mL−1, 0.4 μg∙mL−1, 1.0 μg∙mL−1, 5.0 μg∙mL−1, 6.0 μg∙mL−1, 7.5 μg∙mL−1, 10.0 μg∙mL−1),对其在最佳检测条件下进行增敏拉曼光谱检测,建立定性检测和定量检测模型;每个浓度样品平行配制5份进行分析,确定方法的精密度。
2.2.4. 应用所建立的方法检测蜂蜜中雌二醇的含量
称取约5 g蜂蜜放入50 mL离心管中,加入10 mL无水甲醇,经涡旋、超声震荡,3600 r/min离心10 min,取上层清液,经0.25 um有机系微孔膜过滤后得到蜂蜜提取液备用 [18] 。
将400 μL纳米金、100 μL含雌二醇的蜂蜜提取液和20 μL 1:5硝酸溶液依次加入到石英瓶中,定容至2 mL,进行振荡以充分混合,30 s后将其放入样品池中进行拉曼光谱的采集。并以915.4 cm−1处的拉曼强度的平均值,采用(0.04 μg∙mL−1~1.0 μg∙mL−1)的标准曲线,计算蜂蜜中雌二醇的浓度。
3. 结果与分析
3.1. 纳米金的合成与表征结果
按照2.2.1的操作方法制备纳米金,得到不同深浅的酒红色溶液,如图1;用紫外可见光谱仪在400 nm~700 nm波长范围内表征不同配比(1:1, 1.1:1, 1.15:1)的纳米金溶液,并考察其稳定性,得到图2。实验结果表明,在现有条件下,合成纳米金溶液,氯金酸与柠檬酸三钠的最佳配比为1:1,此时波长为520.37 nm,吸光度为2.11 A。
 1:1
1:1
 1.1:1
1.1:1
 1.15:1
1.15:1
Figure 1. Nanogold prepared with different proportions
图1. 不同配比制得的纳米金

Figure 2. UV spectra of gold nanoparticles with different proportions of chloroauric acid and trisodium citrate
图2. 氯金酸和柠檬酸三钠不同配比下的纳米金紫外光谱图
3.2. 定性检测分析
采用纳米金表面增强拉曼光谱法对雌二醇的定性检测可选择它的特征峰作为鉴定标准,541.7 cm−1、720.6 cm−1、915.4 cm−1、1247.1 cm−1、1554.7 cm−1处峰强度较高见图3,所以选定以上5个峰为定性峰。本研究将915.4 cm−1处的峰作为后续检测样品中雌二醇含量的最佳拉曼特征峰 [19] 。

Figure 3. Selection of SERS spectrum for the characteristic peak of estradiol qualitative detection
图3. 雌二醇定性检测的特征峰的选择SERS光谱图
3.3. 定量检测分析
3.3.1. 纳米金量的确定
本研究中自制的纳米金是雌激素(雌二醇)产生SERS效应的必需条件。因此,有必要考察纳米金的加入量对SERS信号强度的影响。图4为加入不同量的纳米金时,在915.4 cm−1拉曼位移处的SERS信号强度随纳米金的加入量增加的变化趋势图。从图4可以看出,拉曼散射强度随着纳米金加入量的增大,呈先增后减趋势,而在纳米金加入量为0.04 μg∙mL−1时拉曼散射强度达到最高。因此,在后续试验中纳米金加入量都建立在0.04 μg∙mL−1的基础上进行分析。

Figure 4. Influence of the amount of added nano-gold on SERS signal strength
图4. 纳米金的加入量对SERS信号强度的影响
3.3.2. 表面增强剂的确定及量的选择
样品中的雌二醇如仅仅在本研究中纳米金颗粒的吸附作用下,产生的拉曼信号非常弱,必须在表面增强剂存在的条件下才能够得到明显的增强,可能是表面增强剂对纳米金颗粒有诱导和活化效果,可改变样品中雌二醇分子与增强基底之间的凝聚程度,进而影响电磁场的增强,从而增强样品中分子的SERS [20] 。
通过对2.2.2中的五种试剂进行拉曼光谱图的比较,如图5,因为当添加的表面增强剂为1:5硝酸时,特征峰较为明显,故而选取1:5硝酸为最佳的表面增强剂,来改变纳米金粒子的凝聚状态。
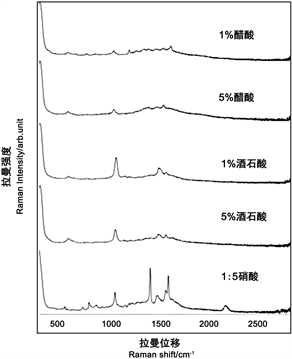
Figure 5. Selection of surface enhancer
图5. 表面增强剂的选择
图6为1:5硝酸不同的加入量对915.4 cm−1处特征峰峰强的影响。根据图6中的变化曲线可发现,当硝酸溶液的体积 < 20 μL时,915.4 cm−1处的拉曼强度逐渐升高。这可能是少量的硝酸可增强蜂蜜提取液中的雌二醇分子与纳米金颗粒的凝聚状态,从而增强雌二醇分子在915.4 cm−1处的拉曼信号强度。当硝酸溶液的体积 >20 μL时,过量的硝酸可能引起了金纳米颗粒的聚沉,反而降低了雌二醇分子在915.4 cm−1处的拉曼信号强度。基于20 μL时特征峰蜂强最为显著,表明纳米金与雌激素的相互作用最为强烈,将1:5硝酸的最佳加入量定为20 μL (溶液总体积2 mL)。
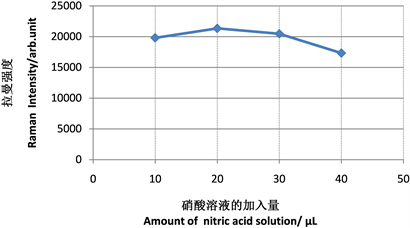
Figure 6. Influence of the amount of added nitric acid on SERS signal strength
图6. 硝酸的加入量对SERS 信号强度的影响
3.3.3. 时间的优化
研究 [21] 发现在表面增强拉曼散射中,会出现一些纳米粒子聚集点(称为“热点”),能使吸附在上面的样品分子或官能团的光散射强度得到最高可达106倍的增强;过长的吸附反应时间,可能会使纳米金粒子产生聚沉,减少热点数目,降低拉曼光谱强度。为了获得最佳效果,对时间进行了优化。我们考察了雌二醇的SERS特征峰强度与时间的动力学曲线。将加入了硝酸的纳米金–雌激素混合液,间隔不同时间连续采集它的SERS光谱,对所采集数据进行处理,再以拉曼位移为横坐标,915.4 cm−1处特征峰峰强为纵坐标建立关系曲线。如图7所示,特征峰强度随着吸附反应时间增长有下降趋势,虽然吸附反应0 s时的特征峰强度最高,但因0 s时的吸附反应时间操作较困难,易引起操作误差,故在试验中均选择30 s采集拉曼光谱。

Figure 7. Influence of reaction time on SERS signal strength
图7. 反应时间对SERS信号强度的影响
3.3.4. 定量方法和检出限
对含不同浓度雌二醇(0.04 μg∙mL−1, 0.1 μg∙mL−1, 0.2 μg∙mL−1, 0.3 μg∙mL−1, 0.4 μg∙mL−1, 1.0 μg∙mL−1, 5.0 μg∙mL−1, 6.0 μg∙mL−1, 7.5 μg∙mL−1, 10.0 μg∙mL−1)样本的SERS光谱进行定量分析,以915.4 cm−1拉曼位移处的特征峰强度为依据,绘制出样本中各雌二醇浓度在915.4 cm−1处特征峰峰强的标准曲线,横坐标为样本中雌二醇的浓度,纵坐标为915.4 cm−1拉曼位移处的特征峰强度。得到图8(a),发现随着雌二醇浓度的增加,915.4 cm−1拉曼位移处的特征峰峰强也随之增高,之后呈现下降趋势,而雌二醇浓度在0.04 μg∙mL−1~1.0 μg∙mL−1时,呈现良好的线性关系,其线性方程为 ,决定系数(R2)为0.9337,如图8(b)所示。经5次平行试验,其相对标准偏差(RSD)为4.3%。
在选定的最优条件下,将纳米金和一系列浓度的雌激素(雌二醇)进行吸附反应30 s,达到平衡后得到系列溶液SERS光谱见图8(c)。由图8(c)可见,当雌二醇溶液的浓度降至0.04 μg∙mL−1时,541.7 cm−1、720.6 cm−1、915.4 cm−1、1247.1 cm−1、1554.7 cm−1等峰仍能看出有SERS增强峰的存在,因而此方法的检出限(LOD)为0.04 μg∙mL−1。
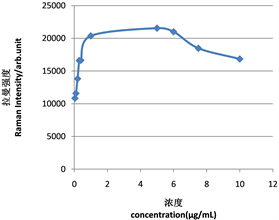 (a)
(a)
 (b)
(b)
 (c)
(c)
Figure 8. (a) Equilibrium adsorption curve of characteristic peak strength and concentration; (b) Linear relation curve; (c) Determination of detection limit
图8. (a) 特征峰峰强与浓度的平衡吸附曲线;(b) 线性关系曲线;(c) 检测限的确定
为进一步验证该方法的可靠性,对含不同雌激素(雌二醇)浓度(0.05 μg∙mL−1, 0.25 μg∙mL−1, 0.45 μg∙mL−1, 0.65 μg∙mL−1, 0.85 μg∙mL−1)的样本进行实际值与预测值的比较实验。图9给出了预测集样本中雌激素(雌二醇)含量的实际值与预测值之间的关系,它们之间的决定系数(R2)为0.9866,均方根误差(RMSEP)为0.3244 μg∙mL−1。对样本进行回收率实验,样本回收率为90%~110%。实验结果表明,基于本研究的自制增强基底的SERS技术应用于快速检测样品中雌激素(雌二醇)是可行的,方法重现性良好,在现场检测中有较好的推广使用价值。

Figure 9. Prediction of set sample relation
图9. 预测集样本关系
3.3.5. 方法的应用
将400 μL纳米金、100 μL含雌二醇的蜂蜜提取液和20 μL 1:5硝酸溶液依次加入到石英瓶中,定容到2 mL,进行振荡以充分混合,30 s后将其放入样品池中进行拉曼光谱的采集。得到图10,其915.4 cm−1处的拉曼强度平均值为13819,由 计算得到蜂蜜中雌二醇的浓度为0.26 μg∙mL−1。

Figure 10. Results of sensitized Raman detection in honey
图10. 蜂蜜中增敏拉曼检测结果
4. 结论
本研究初步建立了一种基于纳米金基底的环境中残留雌二醇的SERS快速分析检测方法。实验结果得到:采用1:1柠檬酸三钠还原法得到纳米金具有较好的增敏作用。当纳米金、硝酸溶液的加入量分别为0.04 μg∙mL−1,20 μL (溶液总体积2 mL),测试时间为30 s时,拉曼光谱的增敏效果最佳。在此研究基础上,得到拉曼位移为915.4 cm−1处特征峰峰强与浓度建立的标准曲线方程呈现良好的线性关系,检出限达到0.04 μg∙mL−1。本方法的样本前处理简单快速,可以避免有机流动相的污染、节省检测成本,SERS增强基底可低成本自制且便于携带,一定程度上满足了环境中雌二醇残留快速检测的要求,适用于批量样品的现场快速检测,有较好的应用前景。
基金项目
江苏省高等学校大学生创新训练项目(省级重点项目):项目编号:201810329010Z;公安部软课题项目(2016LLYJJSST025);江苏省教育厅自然科学重大项目(18KJA620001);江苏警官学院科研创新团队(2018SJYTD03);江苏省“十三五”一级学科省重点建设学科资助项目。
文章引用
康崇伟,宋奇凡,左成明,宋庚益,陈佳佳,周亚红. 纳米金表面增强拉曼光谱法快速检测雌二醇
Rapid Determination of Estradiol by Nano-Gold Surface-Enhanced RamanSpectroscopy[J]. 分析化学进展, 2019, 09(02): 61-70. https://doi.org/10.12677/AAC.2019.92009
参考文献
- 1. Chang, H.S., Choo, K.H., Lee, B. and Choi, S.J. (2009) The Methods of Identification, Analysis, and Removal of Endocrine Disrupting Compounds (EDCs) in Water. Journal of Hazardous Materials, 172, 1-12.
https://doi.org/10.1016/j.jhazmat.2009.06.135 - 2. Sun, M.M., Du, L.Y., Gao, S.Q., Bao, Y.H. and Wang, S.H. (2010) Deter-mination of 17β-Oestradiol by Fluorescence Immunoassay with Streptavidin-Conjugated Quantum Dots as Label. Steroids, 75, 400-403.
https://doi.org/10.1016/j.steroids.2010.02.002 - 3. Ying, G.G., Kookana, R.S. and Ru, Y.J. (2002) Occurrence and Fate of Hormone Steriods in the Environment. Environment International, 28, 545-551.
https://doi.org/10.1016/s0160-4120(02)00075-2 - 4. Quintana, J.B., Carpinteiro, J., Rodriguez, I., et al. (2004) Determination of Natural and Synthetic Estrogens in Water by Gas Chromatography with Mass Spectrometric Detection. Journal of Chromatography A, 1024, 177-185.
https://doi.org/10.1016/j.chroma.2003.10.074 - 5. 廖涛, 吴晓翠, 王少华, 等. 固相萃取——气相色谱/质谱联用法同时检测水体中9种环境雌激素[J]. 分析化学, 2013, 41(3): 422-426.
- 6. Yan, W., Zhao, L.X., Feng, Q.Z., Wei, Y.L. and Lin, J.M. (2009) Simultaneous Determination of Ten Estrogens and Their Metabolites in Waters by Improved Two-Step SPE Followed by LC-MS. Chromatographia, 69, 621-628.
https://doi.org/10.1365/s10337-009-0957-7 - 7. Guo, F., Liu, Q., Qu, G.B., et al. (2013) Simultaneous Determination of Five Estrogens and Four Androgens in Water Samples by Online Solid-Phase Extraction Coupled with High-Performance Liquid Chro-matography-Tandem Mass Spectrometry. Journal of Chromatography A, 1281, 9-18.
https://doi.org/10.1016/j.chroma.2013.01.044 - 8. Chen, L. and Choo, J. (2008) Recent Advances in Surface-Enhanced Raman Scattering Detection Technology for Microfluidic Chips. Electrophoresis, 29, 1815-1828.
https://doi.org/10.1002/elps.200700554 - 9. Park, H., Lee, S., Chen, L., et al. (2009) SERS Imaging of HER2-Overexpressed MCF7 Cells Using Antibody-Conjμgated Gold Nanorods. Physical Chemistry Chemical Physics, 11, 7444-7449.
- 10. Bell, S.E.J. and Sirimuthu, N.M.S. (2006) Surface-Enhanced Raman Spectroscopy (SERS) for Sub-Micromolar Detection of DNA/RNA Mono-nucleotides. Journal of the American Chemical Society, 128, 15580-15581.
https://doi.org/10.1021/ja066263w - 11. Barhoumi, A. and Halas, N.J. (2010) Label-Free Detection of DNA Hybridization Using Surface Enhanced Raman Spectroscopy. Journal of the American Chemical Society, 132, 12792-12793.
https://doi.org/10.1021/ja105678z - 12. Sha, M.Y., Xu, H., Penn, S.G., et al. (2007) SERS Nanoparticles: A New Optical De-tection Modality for Cancer Diagnosis. Nanomedicine, 2, 725-734.
https://doi.org/10.2217/17435889.2.5.725 - 13. 欧阳雨. 乐果涂膜表面增强拉曼光谱研究[J]. 分析测试学报, 2012, 32(8): 996-1000.
- 14. Mosier-Boss, P.A., Lieberman, S.H. (2003) Sur-face-Enhanced Raman Spectroscopy (SERS) and Molecular Modeling of the Chromate Interaction with 4-(2-Mercaptoethyl)Pyridinium. Langmuir, 19, 6826-6836.
https://doi.org/10.1021/la030052c - 15. 牛书操, 吕珍珍, 刘金钏, 蒋小玲, 李诚, 陈爱亮. 基于适配体的纳米金比色法快速检测雌二醇研究[J]. 分析测试学报, 2014(7): 835-839.
- 16. Frens, G. (1973) Controlled Nucleation for the Regulation of the Particle Size in Monodisperse Gold Suspensions. Nature Physical Science, 241, 20-22.
https://doi.org/10.1038/physci241020a0 - 17. Turkevich, J., Stevenson, P.C. and Hillier, J. (1951) A Study of the Nucleation and Growth Processes in the Synthesis of Colloidal Gold. Discussions of the Faraday Society, 11, 55-75.
https://doi.org/10.1039/df9511100055 - 18. 陶进江, 潘桂根, 刘木华, 袁海超, 赵进辉. 基于表面增强拉曼光谱的鸭肉中己烯雌酚残留检测[J/OL]. 食品与机械, 2018(12): 3-11.
- 19. 王乐, 张爱霞, 陈晞, 等. 表面增强拉曼光谱法快速检测饮料中玫瑰红B[J]. 食品研究与开发, 2018, 39(7): 126-130.
- 20. 高书燕, 张树霞, 杨恕霞, 等. 表面增强拉曼散射活性基底[J]. 化学通报, 2007, 70(12): 908-914.
- 21. 张亚南. 多吡啶铜配合物的合成及与 DNA 的相互作用研究[D]: [硕士学位论文]. 新乡: 河南师范大学, 2013: 38-51.
NOTES
*通讯作者。