Advances in Clinical Medicine
Vol.05 No.03(2015), Article ID:15907,30
pages
10.12677/ACM.2015.53025
Progress in Research of Activity of Anti-Ebola Virus and Effect of Pharmacology of Tetrandrine
Ying Zhang, Wenxiang Hu*
Beijing Excalibur Space Military Academy of Medical Sciences, Beijing
*通讯作者。
Email: *13820087285@163.com
Received: Jun. 25th, 2015; accepted: Aug. 12th, 2015; published: Aug. 19th, 2015
Copyright © 2015 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
The Ebola virus is one of the world’s most threatening pathogens. Ebola virus disease (EVD) which began in 13 September 2013 in Guinea, West Africa was the worst breakout since its first outbreak. Up till now we lack effective drugs. Some studies have found the Ebola virus completed virus replication by endosomal calcium channels called two-pore channels (TPCs) release genome, and by blocking endosomal calcium channels TPCs, tetrandrine (Tet) prevented the release of the Ebola virus genome in order to stop the replication of the virus. Pharmacological effect and mechanism of action and other pharmacological activities of Tet in anti-Ebola virus in this review were summarized in detail; Tet as muscle loose medicine of the structure of benzylisonicotinamide was transformed and synthesized. At the same time, the prospects of several pending further study of calcium antagonists including blocking calcium TPCs such as verapamil applied for the possibility of anti-Ebola virus drugs were discussed, which provided important references for promoting the in-depth study of those muscle relaxant drugs.
Keywords:Ebola Virus, Two-Pore Channels (TPCs), Tetrandrine (Tet), Benzylisoquinoline, Calcium Antagonists

汉防己碱药理作用及抗埃博拉病毒活性研究进展
张莹,胡文祥*
北京神剑天军医学科学院,北京
Email: *13820087285@163.com
收稿日期:2015年7月25日;录用日期:2015年8月12日;发布日期:2015年8月19日

摘 要
埃博拉病毒是世界上最具威胁的病原体之一,2013年9月13日始于西非几内亚的埃博拉病(Ebola virus diseases, EVD),是记载以来最严重的一次爆发。目前缺乏有效的治疗药物,研究发现埃博拉病毒通过胞内钙双孔通道(TPCs)释放基因组来完成病毒复制,汉防己甲素通过阻断胞内钙双孔通道(TPCs)来阻止埃博拉病毒基因组的释放从而阻止了病毒的复制。本文综述汉防己甲素(Tet)的抗埃博拉病毒的药理作用和作用机制及其它方面的药理活性;汉防己碱(Tet)肌松药中的苄基异奎琳的结构改造合成。同时展望了目前几种待进一步研究的钙离子拮抗剂包括钙双孔通道(TPCs)阻断剂如维拉帕米等应用于抗埃博拉病毒药物的可能性,为进一步推进汉肌松类药物深入研究提供重要参考。
关键词 :埃博拉病毒,双孔通道(TPCs),汉防己甲素(Tet),苄基异奎琳,钙离子拮抗剂

1. 引言
由于生态环境破坏,全球化进程加快,已被控制的传染病会卷土重来,重新流行;一些新型传染病,更以每年1至2种的惊人速度出现,而且治愈难度越来越大,对现有药物的抗药性越来越强,让临床和药物研发专家头痛不已。世界卫生组织总干事陈冯富珍博士坦言:不会再出现像艾滋病、埃博拉或者“非典”这样的疾病的想法是极其天真和自负的,出现这样的传染病灾难只是迟早的事。人类与传染病的较量已进入了一个新时代——面临新老传染病的双重威胁[1] 。
埃博拉病毒(Ebola virus)与马尔堡病毒(Mar. burg virus)因分别首次自扎伊尔(刚果民主共和国)病毒感染暴发所在村庄附近的埃博拉河及德国马尔堡分离而得名。埃博拉病毒病(EVD)是由埃博拉病毒引起的一种急性传染病,主要通过接触病人或感染动物的血液、体液、分泌物和排泄物等而感染,临床表现主要为突起发热、呕吐、腹泻、出血和多脏器损害,病死率为30%~90% [1] 。EVD的患者和非洲大陆热带雨林感染EVD的大猩猩、黑猩猩、猴、羚羊、豪猪等野生动物为本病传染源。人类对埃博拉病毒普遍易感。本病潜伏期为2~21 d。埃博拉病毒属丝状病毒科RNA病毒,共分5种病毒亚型,其中扎伊尔型毒力最强也最常见,历史上该型病毒引起的EVD死亡率曾高达90%。埃博拉病毒生物安全等级为4级,是生物安全等级最高的病毒。埃博拉病毒一般通过黏膜表面、擦伤的皮肤或污染的针头进入人体。病毒通过宿主细胞表面C-型凝集素(C. typelectin) DC. SIGN或其他受体,首先在局部的巨噬细胞、树突细胞(dendritic cell, DC)等抗原呈递细胞(antigen-presenting cell, APC)中复制,导致APC失去原有功能,而不能表达共刺激分子或激活T细胞。埃博拉病毒感染单核细胞与巨噬细胞后,大量促炎症因子释放,包括白细胞介素1B (interleukin 1J3, IL-1p)、IL-2、IL-6、IL. 10、肿瘤坏死因子α (tumor necrosis factor-α, TNF-α)、单核细胞趋化蛋白1 (monocyte chemoat-tractant protein 1, MCP. 1)等。细胞因子的大量释放又可吸引更多APC至感染部位并增加病毒复制,最后出现晚期病变,包括内皮细胞通透性增加、血管漏出增加,使感染病毒的APC播散至全身多个器官,包括次级淋巴器官、肝、肺等。EVD于1976年在非洲首次发现,2013年9月始于西非几内亚的EVD疫情,后蔓延至利比里亚、塞拉利昂,并有病例侵入至尼日利亚和塞内加尔,甚至越过大洋,从非洲扩散至欧洲和美国 [1] 。根据世界卫生组织(WHO)的通报,截至2015年6月初,在埃博拉疫情最严重的三个国家塞拉利昂、利比里亚和几内亚,共26,593人感染,11,005人死亡。
对于埃博拉,目前缺乏有效的治疗药物。ZMapp是美国和加拿大共同开发的一种抗埃博拉病毒新药,由3种人源化的鼠单克隆抗体组成。TKM-Ebola药物为诊断药物,用于确诊或者疑似感染埃博拉病毒患者。实验中对非灵长类动物具有一定保护作用的BCX-4430和AVI-7537。还有一些明确安全用法但用于其它疾病药物,如,氯喹、伊马替尼、雌激素受体调节剂(克罗米芬和托瑞米芬)、葛兰素史克公司开发的ChAd和美国纽约琳基因公司开发的抗埃博拉病毒VSV疫苗已进入I期临床。抗艾滋病的药物如拉米夫定等也曾经用于埃博拉病毒患者。钙通道阻滞剂(胺碘酮、维拉帕米)等,也在体外实验中体现出抗埃博拉病毒活性,具有钙离子通道阻滞作用的汉防己甲素通过阻断胞内钙离子双孔通道(TPCs)来阻止埃博拉病毒基因组的释放从而阻止了病毒的复制,在体外实验中体现了强于维拉帕米的抗埃博拉病毒的活性 [2] 。
2. 肌松药的分类及合成
神经肌肉阻断剂(Neuro muscular block agents)又称肌松药。按照作用方式的不同,肌松药可分为两类。
2.1. 非去极化型肌松药
这类肌松药和乙酰胆碱竞争,与运动终板膜上的乙酰胆碱受体结合,因为无内在活性,不能激活受体,但是由于阻断了一线胆碱的受体结合,使不能产生去极化,从而使骨骼肌松弛,因此称竞争性肌松药,临床上使用的肌松药大多为此类。
2.2. 去极化型肌松药
这类肌松药与运动终板膜上的乙酰胆碱受体结合并激动受体,使终板膜及临近肌细胞膜长时间去极化,阻断神经冲动的传递,导致骨骼肌松弛。琥珀胆碱是现在唯一使用的去极化神经肌肉阻断剂。1 min起作用,作用时间7~8分钟,副作用:术后肌肉痛,可发生高血钾和眼内压,胃内压和颅内压升高等不良反应。这些副作用与其去极化型的作用方式有关。因此去极化肌松药最终会被非去极化肌松药所取代。所以非去极化肌松药是我们研究的重点。
2.3. 非去极化肌松药的分类
早期的药物,如氯筒箭毒碱、加拉碱铵和氯二甲箭毒,大多已被氨基甾体类化合物及新型的苄基异喹啉类化合物所取代。肌松药无论是去极化或是非去极化均是季铵化合物。多数的肌松药含有两个季铵基,肌松药在两个季铵基之间为一亲脂性桥式结构相联,不同桥式结构,对肌松药强度均有重要影响。
1) 氨基甾体类药物
非去极化肌松药目前在国外临床上应用较多的有长时效的潘库溴铵、哌库溴铵,中时效的维库溴铵、罗库溴铵,短时效的瑞库溴铵 [3] 。这类药物的结构、参数及特点见表1。
2) 苄基异喹啉药物
具有新型苄基异喹啉季铵结构的化合物是另一类非去极化肌松药,这类药物的结构、参数及特点见表2。
理想的肌松剂应该是非去极化型的,起效快,且对神经肌肉接头有高度的特异性。如果有可能的话,它应该是短效的或者是其作用易于被抗胆碱脂酶药迅速逆转的。目前,尚无一种非去极化型药物具备所有上述特点。因此,起效快如琥珀胆碱,作用特异性如美维松相似,无不良心血管反应和排出。不依赖于器官功能的非去极化型药物仍待开发。我国有丰富的中草药资源,具有苄基异喹啉结构的天然产物进行结构改造合成,寻找比较理想的肌松药。70年代我国从防己科植物汉防己的根中分离出生物碱——汉防己甲素,经季铵化得到碘化二甲汉防己碱,定名汉肌松,该药具有明显的肌肉松弛作用,可使腹肌松
Table 1. Amino steroidal drugs
表1. 氨基甾体类药物
注:起效时间极快的氨基甾体类药物正在开发中。
Table 2. Benzylisoquinoline drugs
表2. 苄基异喹啉类药物
弛,呼吸肌没有明显影响。对具有苄基异喹啉结构的天然产物进行结构改造合成,期望由此为突破点找到比较理想的肌松药;我们通过文献检索发现汉防己甲素是抑制巨噬细胞感染埃博拉病毒的主要目标物质,为钙离子拮抗剂,有抗埃博拉病毒感染的作用,同时期望依次通过结构改造合成出治疗埃博拉病毒感染及其它病毒感染的更有效药物 [4] 。
2.4. 汉防己碱和其化合物的发明
1) 中国科学院上海药物研究所瑟维尔实验室在汉防己碱和汉防己碱化合物合成和应用上首先取得了中国发明专利(专利公开号:CN17202332A)。本发明涉及汉防己碱和其化合物,并涉及式I化合物,见图1。

Figure 1. Tetrandrine and other compounds
图1. 汉防己碱及其它化合物
2) 本专利的自主权项
(I)化合物、其对映体和非对映体及其与可药用酸或碱的加成盐,其中·R1代表烷基,R2代表氢原子或烷基羰基,卤代烷基羰基或芳基羰基,Y代表基团或其中R7和R7’相同或不同且各自代表烷基,和Z-代表卤原子,R3代表羟基或烷氧基,R4和R4’各自代表氢原子或一起形成另一键,或R3和R4一起形成氧代基团或=N-OR8,其中R8代表氢原子或烷基,R6代表羟基,其中烷基部分可以被羟基、烷氧基、羧基或烷氧羰基取代的烷基羰氧基,或烷氧基,R5和R5’各自代表氢原子或一起形成另一键,或R5和R6一起形成氧代基团、=N-OR9或=N-NR10R11,其中R9、R10和R11可以相同或不同且各自代表氢原子或烷基,以及X代表卤原子,条件是式(I)化合物不能代表1-溴-4-羟基-3,7-二甲氧基-17-甲基-7,8-二脱氢吗啡喃-6-酮,应当理解的是:-“烷基”是指含有1-6个碳原子的直链或支链烷基,-“烷氧基”是指含有1-6个碳原子的直链或支链烷氧基 [5] 。
3) 本专利的摘要
本发明涉及汉防己碱和其化合物,并涉及式(I)化合物,其中R1代表烷基;R2代表氢原子或烷基羰基,卤代烷基羰基或芳基羰基;Y代表基团(II)、(III)或(IV);R3、R4、R4’、R5、R5’和R6如说明书中所定义;X是卤原子。本发明还涉及药物 [5] 。
2.5. 对具有苄基异喹啉结构的天然产物进行结构改造合成 [4]
汤晓霞、黄文龙教授等 [4] 对汉防己甲素季铵衍生物(TH) (见图2)进行了合成前的设计,主体设计思路见图3反应式:
合成了TH类五个化合物,见表3。并对其进行了初步的药理筛选,筛选表明THL、THX、THC、THS THB肌松活性强于汉肌松(TH),但起效时间比较慢,THS的起效剂量、起效时间与汉防己甲素无差别,并在SGI-40 25G计算机上应用以QUANTA(90.0919)为主程序的POLYGEN软件包对部分化合物分子结构的能量进行优化,获得优势构象。
2.6. 合成化合物与汉肌松比较的结果
THX、THL、THC、THB化合物的肌松作用均强于汉肌松,但起效时间比汉肌松慢,其中THS与汉肌松比较,起效剂量起效时间没有明显区别,见表4。
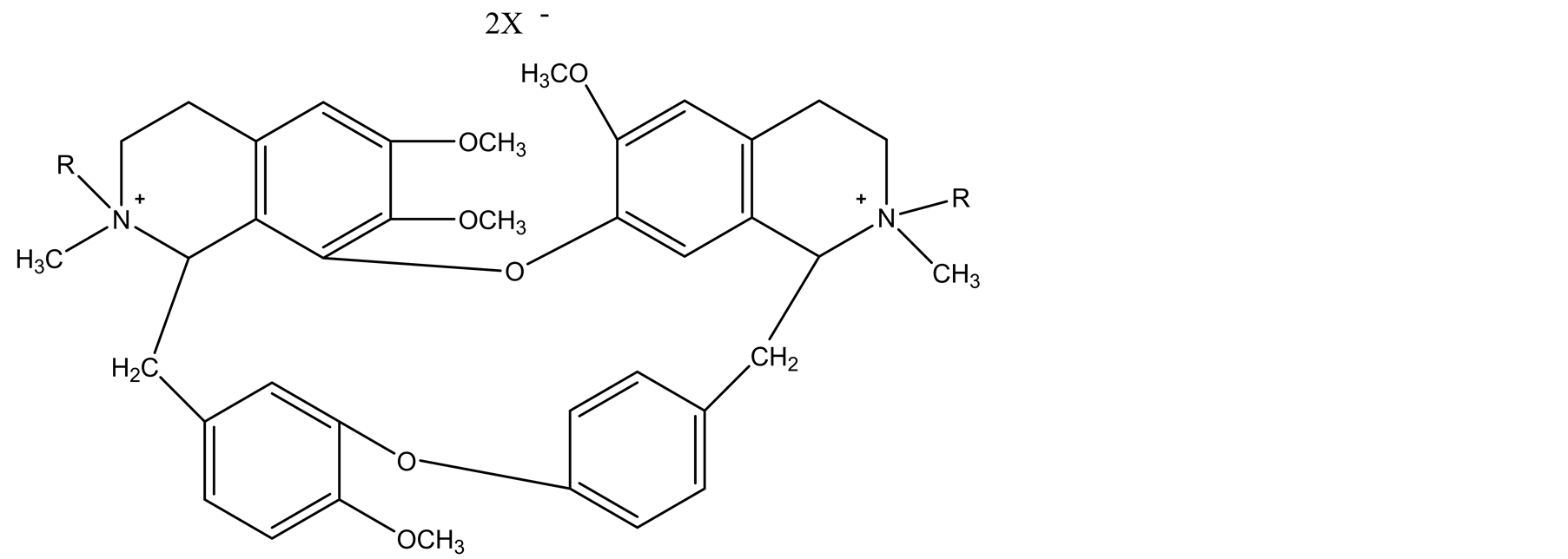
Figure 2. Tetrandrine quatemary ammonium
图2. 汉防己甲素季铵化合物

Figure 3. Design idea
图3. 设计思路
Table 3. The synthesis of tetrandrine and its derivatives [4]
表3. 汉防己碱及其衍生物的合成 [4]
Table 4. The onset time of neuromuscular-blocking effects after the test compound were injected into mice by hypodermic [4]
表4. 小鼠皮下注射受试化合物后神经肌肉阻断作用的起效时间 [4]
3. 汉防己碱的药理作用
粉防己碱又名汉防己碱(tetrandine, Tet)是从防己科植物粉防己根中提取的双苄基异喹啉类生物碱之一,含量约1%。具有广泛的生理活性。Tet具有消炎、镇痛、降压、抗矽肺等作用;Tet是天然的非选择性的钙通道阻滞剂,也是钙调蛋白的拮抗剂,还有较强的抗肿瘤作用;Tet还有降低血糖和抗自由基损伤的作用。临床上用于治疗高血压、心绞痛、阵发性室上性心动过速、矽肺、肝硬化等疾病,具有良好的效果。近年来的研究表明,Tet有着广泛的药理作用和应用前景 [6] 。现总结分析了粉防已碱药理作用的研究进展,现报道如下。
3.1. 抗肿瘤作用
粉防己碱在癌症中的应用以肺癌居多。目前普遍认为其抗肿瘤机制是抑制癌细胞生长,促进其凋亡,作用机制可能与调节Bcl-2和Bax表达有关。
1) 鼻咽癌:鼻咽癌是指发生于鼻咽腔顶部和侧壁的恶性肿瘤。Sun等 [7] 在研究中测试了由粉防己碱所诱导的鼻咽癌CNE细胞系细胞凋亡和辐射敏感度结果,发现粉防己碱可诱导鼻咽癌CNE细胞系细胞凋亡,在逆转录聚合酶链反应过程中用粉防己碱进行干扰会导致细胞Bcl-2 mRNA减少而Bax mRNA增加,阻止由X射线所诱导的G2过程,表明粉防己碱可促进鼻咽癌细胞的凋亡和阻止由x射线所诱导的G2过程。
2) 肝癌:肝癌是指发生于肝脏的恶性肿瘤,包括原发性肝癌和转移性肝癌2种。Li等 [8] 在研究中将紫杉醇和粉防己碱合用,采用纳米载药技术给药,发现粉防己碱可有效地稳定紫杉醇的载药量;通过体内试验评估进一步发现,粉防己碱可有效控制紫杉醇在肿瘤细胞内部的着陆部位和集聚浓度,大大延长鼠H22肝癌模型的存活时间,从另外的一个方面,阐述了粉防己碱对抗肿瘤增效的可能机制。孙瑜等 [9] 通过阿霉素(ADM)浓度梯度递增诱导法,建立人肝癌多药耐药细胞Hep-3B/ADM. MTT几法检测细胞对化学疗法药物的敏感性,发现细胞表面P-170的表达明显降低,表明粉防己碱可逆转肝癌细胞的耐药性,作用机制与逆转多药耐药基因有关。
3) 血液肿瘤:慢性粒细胞白血病(CML)是一种影响血液及骨髓的恶性肿瘤。Xu等 [10] 发现粉防己碱柠檬酸盐可有效逆转细胞异种移植建立起的CML的裸小鼠模型K562细胞系的伊马替尼耐受,显著减少伊马替尼耐受的K562细胞系的P210 (Bcr-Ab1)和β-连环蛋白的水平,导致Bcr-Abl mRNA的减少,诱导CML细胞在有丝分裂G1阶段的停止。
4) 乳腺癌:乳腺癌是女性排名第一的常见恶性肿瘤,且发病率呈逐年上升趋势。Hou等 [11] 发现粉防己碱可有效提高多柔比星对肿瘤细胞的毒性,极大地抑制MCF-7/ADM细胞生长。作用机制可能是粉防己碱和多柔比星联用可以使肿瘤细胞停留在G2或M阶段累积同时伴随肿瘤细胞在G1或G0阶段的衰减,极大地增加多柔比星对多药耐受MCF-7/ADM细胞的细胞毒性。
5) 结肠直肠癌:直肠癌是由直肠组织细胞发生恶变而形成。He等 [12] 发现粉防己碱抑制癌症细胞的活性的效果几乎等同于喜树碱、长春新碱、紫杉醇和阿霉素,甚至优于5-Fu和卡铂,还可与5-Fu产生较好的协同作用,有效地抑制HCT116细胞的转移以及入侵,认为粉防己碱的对肿瘤的抑制作用与诱导β-catenin的抑制有关。邢陈 [13] 也对汉防已甲素对人结肠癌细胞株放射增敏性进行了研究,其结果与He等的结论相吻合。
6) 粉防己碱对血管生成的影响:血管生成过度或抑制血管系统退化,易导致肿瘤发生和转移。Qian等 [14] 用MTT实验的方法观察粉防己碱对人脐静脉内皮细胞(HUVECs)和人结肠癌LoVo细胞增殖的影响,并用MVD技术指标观察异种移植了结肠癌LoVo细胞并用灌胃方式给予粉防己碱的裸小鼠的状况。通过体外和动物实验指出粉防己碱可通过抑制内管形成,细胞增殖和转移的方式有效抑制血管生成,其机制可能是诱导了细胞的凋亡和减少了HUVECs的DNA合成。粉防己碱也是一种可有效对抗LoVo细胞导致的血管生成的药物。
7) 汉防己甲素其化学结构属双苄基异喹啉类,汉防己甲素是这类药物的一个代表,通过膜转运及在细胞内的分布利用。汉防已甲素对胰腺癌、食道癌及乳腺癌等实体瘤与白血病均有一定直接抑制作用。汉防己甲素是一种有效的放射增敏剂,通过改善癌细胞的乏氧状态而起增敏作用 [15] 。天然药物汉防己甲素除具备通过增加肿瘤细胞内化疗药物浓度逆转胰腺SWl990/Gem细胞株多药耐药性,达到促进化疗药物诱导肿瘤细胞凋亡的作用之外,还可以抑制肿瘤细胞增殖并具有促进其凋亡作用,提示临床上肿瘤晚期患者可采用抗肿瘤药物联合应用天然有效成分以提高治疗效果。本研究表明,经汉防己甲素作用后的耐药株胰腺癌细胞其RF由处理前的4.70降至1.69,说明汉防己甲素可以逆转SWl990/Gem耐药胰腺癌细胞对吉西他滨的耐药,其作用途径可能与下调化疗耐药胰腺癌细胞MRP蛋白表达有关。同时,吉西他滨直接激活MRP基因启动子使转录水平的MRP基因表达增强,汉防己甲素有协同吉西他滨增强对化疗耐药胰腺癌细胞凋亡作用 [15] 。
8) 粉防己碱是目前报道最多的中药单体逆转剂。许文林等 [16] 发现,低剂量能显著增强柔红霉素和长春新碱对白血病细胞的杀伤效应,并有一定剂量依赖关系。有学者使用MTT法研究发现联合应用汉防己甲素和它莫西芬部分逆转K56长春碱耐药细胞株对长春新碱的耐药,且联用效果大于二者单一用药 [17] 。
3.2. 抗菌作用
1) 耐甲氧西林金黄色葡萄球菌:是一种比较棘手的细菌,一般用万古霉素、去甲万古霉素等抗菌药物治疗。有学者从粉防己碱抑制的17种耐甲氧西林金黄色葡萄球菌菌株,选择了其中3种菌株进行较长时间的试验,发现在粉防己碱的干预下细菌的生长规模明显缩小;又将粉防己碱和多数药物耐药的流出泵酶作用物溴化乙锭共同使用,发现相对于溴化乙锭的单独使用,加入粉防己碱可更好的抑制耐甲氧西林金黄色葡萄球菌的增长 [6] 。
2) 白色念珠菌:白假丝酵母菌(Candida albicans)又称白色念珠菌,为条件致病性真菌。Zhang等 [18] 观察到粉防己碱在运用氟康唑治疗白色念珠菌试验中能产生协同作用,并通过运用流式细胞术和荧光分光光度法来研究16种同源但对氟康唑有不同敏感性的C白色念珠菌从而阐明此种协同的机制:通过蓄积试验、流出泵试验表明了粉防己碱通过对MDR1,FLU1,CDRI和CDR2的作用,有效抑制了细菌对药物的泵出率,从而减慢了白色念珠菌的耐药产生。吴斯 [19] 以CA-3号菌株为实验对象,通过二维电泳和时间-飞行质谱仪等方法进行差异蛋白组学的研究。得出汉防已甲素可能通过影响白念珠菌细胞壁的合成和抑制白念珠菌的糖酵解,能量代谢等环节中产物的生成,以达到协同氟康唑的增效作用的结论,增效活性与药物作用时间及剂量相关,在汉防己甲素浓度为250 ug/ml,作用6 h药效最强。
3.3. 对心血管系统的作用
1) 抗高血压作用:在许多双苄基异喹啉类生物碱中,Tet的降血压作用最强,在许多动物模型上显示了明显的降压作用,包括麻醉的猫、狗、豚鼠,清醒的正常大鼠和高血压大鼠等。临床研究显示,Tet对高血压患者具有良好的降压作用,却没有明显的反射性心动过速。高血压的许多临床症状如头痛、眩晕、心悸、失眠等均减轻或消失。舒血管药的典型副作用,在这些病人中均未出现 [18] 。
2) 抗心肌缺血及再灌注损伤:Tet能使结扎冠状动脉左前降支的狗心肌梗死范围减小,心电图段降低,血中心肌肌磷酸激酶减少。Tet对心肌缺血再灌注损伤也具有保护作用,尤以对心肌舒张功能及冠脉循环的保护为优。调节心脏M受体能影响Tet的心肌保护作用 [20] 。
3) 抗心律失常作用:Tet可拮抗氯仿诱发的豚鼠心律失常,延长猫乳头肌功能,不应期及降低肾上腺素引起的自律性。单盲法分别给阵发性室上性心动过速静脉注射Tet和维拉帕米,可迅速逆转心律失常至正常窦性心律,Tet有效率为83.9%,维拉帕米为85%。对WPW (Wollf-Parkinson-White)综合征,Tet具有良好的效果,逆转率为75%。Tet对兔窦房结传导和自律功能有明显抑制作用,抑制室上性传导,而对室内传导无影响,这可能是Tet抗室上性心律失常的原因 [20] 。
4) 对心肌肥大细胞的作用:心肌肥大是一种强有力的代偿形式,Shen等 [21] 给予老鼠防己碱口服持续1月后,用大动脉结扎(AB)方式制造控制组,用超声波心动描技术测量老鼠的心脏功能,经过对心脏功能的综合评估,发现粉防己碱可有效减缓由AB引起的心肌细胞过度肥大趋势,还可减少心脏的纤维化和炎性反应。有学者认为这种现象的机制可能是防己碱能有效抑制活性氧的产生且有效的激活了针对心肌细胞过度肥厚的ERK1/2-依赖性核因子Kappa B和T细胞活化核因子。有学者提出用防己碱作用于信号转导蛋白逆转左心室肥厚的研究。另有学者对该研究进行了深化,补充和完善。证明了防己碱是通过抑制活性氧依赖的ER ERK1/2信号通路,从而改善心肌细胞的功能,减轻心脏的过度肥大 [6] 。
5) 对心房颤动的作用:粉防己碱对钠离子通道的组织作用很少被提及,有学者观察了粉防己碱对心房颤动(AF)和窦性节律(SR)患者心肌中的钠离子通道的药理作用,运用全细胞膜片钳技术记录钠离子的流动情况,观察到防己碱不仅可减少浓度依赖方式的钠离子聚集,还可使压敏电阻器的激活曲线转化到正电压;受到粉防己碱的影响后,钠离子的压敏电阻器的失活曲线转化成了负电压;粉防己碱还以抑制钠离子浓度聚集依赖的方式延缓了钠离子的时间依赖复位。提出粉防己碱抗心律失常的机制可能就是通过影响钠离子的复位实现 [6] 。
3.4. 对骨质疏松的治疗
粉防己碱对骨骼方面的疾病的作用,很少见于报道。Takahashi等 [22] 进行了这方面的研究。通过用粉防己碱可有效地抑制模型小鼠得骨质疏松。通过细胞层面的研究,有学者发现粉防己碱不仅通过影响骨髓细胞,还通过影响鼠科动物破骨细胞的前体细胞从而减少破骨细胞的分化。粉防己碱抑制由RANKL诱导的NFATc1增值。Takahashi等 [22] 推断防己碱将成为抑制骨质疏松和破骨细胞的一种有效药物或至少成为治疗此类骨骼疾病的前体药物,有着远大的发展前景。
3.5. 对膈疝的作用
膈疝(CDH)是内疝的一种,可分为创伤性膈疝与非创伤性膈疝。吉毅等 [23] 对粉防己碱作用于先天性膈疝大鼠的药理作用和其可能机制进行了观察研究。将妊娠大鼠用草醚诱导膈疝并用粉防己碱干预,部分妊娠大鼠进行剖宫手术取出胎鼠并收集羊水,胎鼠进行是否患者有先天性膈疝检查。用光镜和免疫组织评估,运用ELISA技术检查水平中的TNF-α。其余妊娠大鼠则待自然分娩,观察胎鼠的24小时存活率。结果显示粉防己碱可有效降低除草醚诱导的膈疝,大大提高大鼠的存活率,其可能机制是降低了TNF-α的表达。
3.6. 拮抗Ca2+通道作用
经临床观察实验证实:Tet具有拮抗Ca2+通道的作用。6 pm的Tet可阻断50%以上的跨膜钙离子内流,去除Tet的介质后,钙离子内流可恢复正常;另外,Tet可完全阻断钙通道阻滞剂地尔硫革,部分阻断D-600与钙通道阻滞剂受体复合物的结合。认为Tet是一种天然的可逆性慢钙通道(L)型阻滞剂,作用位点是钙通道阻滞剂受体复合物。负性肌力作用是频率依赖性和电压依赖性的,Tet对心肌收缩力的抑制作用可被外钙加入而逆转。该作用提示Tet类似于典型的Ca2+通道阻滞剂。Tet可抑制缺血情况下导致神经元电压依赖性K+通道开放而对缺血脑细胞产生保护作用。Tet抑制高K+引起的肾动脉、肺动脉、肠系膜动脉及冠状动脉的收缩,Tet也可松弛高K+和催产素引起的大鼠离体子宫收缩。这些结果显示,Tet阻断电压依赖性Ca2+通道的作用强于阻断受体操纵型Ca2+通道,同时抑制在细胞内的积聚 [6] 。
3.7. 抗炎及免疫抑制
Tet抑制人单核巨噬细胞产生IL-1和TNF-α,抑制淋巴细胞产生TNF,Tet还能抑制大鼠肥素和ADP诱导的人血小板聚集反应,具有抗血小板聚集形成血栓的作用。Tet选择性抑制T细胞依赖性免疫反应。尤其是淋巴细胞增殖和分化阶段。Tet在体外抑制丝列原诱导的淋巴细胞转化,混合淋巴细胞反应和NK细胞的细胞毒作用。Tet抑制迟发型超敏反应,抑制小鼠心脏排斥反应,延长其存活时间。Tet在体外实验中均能抑制抗体形成。实验研究发现Tet以时间和剂量依赖方式抑制Con A刺激的人淋巴细胞磷酸肌醇代谢、胞浆Ca2+升高和蛋白激酶C的活性,即抑制了以磷酸肌醇分解产物三磷酸肌醇和二酰甘油为第二信使的跨膜信号传递系统 [24] 。由于该信号传递系统广泛存在于各种器官和组织的细胞中。Tet抑制此系统可能是其广谱抗炎和抑制免疫的共同机制。Tet对急性胰腺炎(AP)的治疗作用。Tet能降低血清淀粉酶和脂肪酶水平。减少炎症介质(如磷酯酶A2:一氧化氮、核因子-кB等的释放.激活Ca-Mg ATP酶,减轻钙超载对胰腺的病理损伤。改善胰腺的组织结构和功能。降低胰腺炎并发症,从而提高动物的存活率。此外,Tet对各种炎症都有一定的抗炎作用,如对炎症吞噬细胞、血小板集聚、淋巴细胞功能都有一定的抑制作用。因此,Tet作为一种广谱抗炎药,对局部和全身的多种急、慢性炎症、免疫性炎症、烟雾吸人性肺损伤、四氯化碳性肝损伤均有显著的抑制作用。其抗炎作用是多方面的,包括抑制炎症细胞功能、抗自由基损伤,抑制炎症介质释放或对抗炎症介质的效应,其作用机制可能主要是通过抑制细胞内游离钙浓度升高,抑制磷酯酰肌醇代谢并增加细胞内cAMP水平,从而干扰跨膜信号传递 [25] 。
3.8. 抗矽肺作用
目前认为矽肺中胶原合成增加是由于硅尘粒诱导巨噬细胞产生强烈的炎症反应的结果,IL-1和TNF-α是巨噬细胞产生的两种细胞因子,它们均能刺激纤维母细胞增生。Tet抑制IL-1和TNF-α的产生,从而抑制胶原合成,防止矽肺的形成。Tet还能与肺泡巨噬细胞膜稳定结合并抑制其活性,同时还抑制反应性氧代谢产物释放,减轻肺实质损伤 [26] 。
3.9. 抗糖尿病作用
Tet有抗糖尿病作用。用Tet 20 mg/(kg∙d)给糖尿病大鼠ig(灌胃),可明显降低糖尿病的累积发病率,胰岛炎的发病率也明显降低 [26] 。
3.10. 抗自由基损伤作用
Tet不但能抑制巨噬细胞活性而且能抑制由酵母菌多糖诱导的巨噬细胞氧耗和氧自由基的产生,具有抗自由基损伤作用。Tet可抑制嗜酸性粒细胞产生超氧阴离子,加入次黄嘌呤一黄嘌呤氧化酶后,Tet仍能明显抑制中性粒细胞产生自由基,但是该酶系的终产物尿酸并未减少,这说明Tet本身具有清除自由基作用。Tet有减弱大鼠缺血脑组织中SOD降低的趋势,明显抑制丙二醛升高,减少MDA含量,对脑组织有明显的保护作用 [27] 。
3.11. 粉防己碱抑制瘢痕的形成
刘德伍等 [28] 采用瘢痕成纤维细胞体外培养和免实验性瘢痕模型,观察粉防己碱对瘢痕成纤维细胞增殖和胶原合成的作用。结果:体外试验粉防己碱组3H TdR掺入率和3H 脯氨酸掺入率均较对照组明显降低,呈剂量依赖关系;动物实验粉防己碱能明显减少瘢痕组织中成纤维细胞的数量,降低胶原面密度,减轻瘢痕纤维化程度。结论:粉防己碱对瘢痕成纤维细胞过度增殖和胶原沉积具有抑制作用,可能是其抗瘢痕纤维化的主要机制之一。有研究表明,作为钙离子拮抗剂的粉防己碱可有效抑制多种组织修复细胞如巨噬细胞、成纤维细胞等释放多种生长因子、多肽等,而这些活性物质均在成纤维细胞增殖和胶原合成与降解过程中发挥重要作用 [28] 。
3.12. 汉防己甲素抑制巨噬细胞感染埃博拉病毒
埃博拉病毒会引起人类致命的出血热零星爆发,但目前还没有批准的治疗方法。细胞首先通过巨胞饮接受埃博拉病毒,其次是通过胞内囊泡转运。然而,已知的几个因素控制的胞内病毒运动,发现埃博拉病毒进入宿主细胞的胞内钙通道需要调用双孔通道(TPCs)。采用基因敲除破坏TPC这个通道的功能,小干扰RNA (siRNAs),或小分子抑制了病毒感染和防止了转运。汉防己甲素,Sakurai等 [29] 经过其在小鼠体内疗效的验证,汉防己甲素是抑制巨噬细胞感染埃博拉病毒的主要目标物质,TPC通道蛋白在埃博拉病毒感染起了一个关键的作用。可能是抗病毒治疗的有效指标 [29] 。
4. 汉防己甲素抗埃博拉病毒作用
4.1. 埃博拉病毒对细胞感染需要特定的钙离子通道
Sakurai等 [29] 通过表明钙通道称为双孔通道2 (TPC2)是所必须的病毒基因组的释放入宿主细胞中添加其他元素的病毒进入的通道。埃博拉病毒表面的糖蛋白和受体结合后,其可以是无特异性,可能包括大量的糖结合蛋白病毒通过宏胞饮进入细胞,非选择性的吞没过程。一旦内在至膜结合囊泡(内体),埃博拉病毒切割糖蛋白,当暴露在越来越酸性还原环境,这一切都发生在胞内体必不可少的叫胞膜蛋白(NPCI)的蛋白质相互作用,提出了称引起这一过程为融合的病毒遗传物质释放。
小分子干扰RNA图像确定在宿主细胞里的钙信号,其它融合对埃博拉病毒的入口是有必要的。然而,五个化合物阻断这些通道并没有阻止埃博拉病毒的感染,这表明其他机制也参与。有效的抑制剂烟酸九二核苷酸磷酸(NAADP)刺激细胞阻断内钙通道称为TPCS。这些渠道主要定位于内涵体和溶酶体(酸性舱的内容物被降解)。Sakurai等 [29] 人通过使用细胞缺乏TPC2,小分子干扰RNA和小分子抑制剂,确定TPC2是埃博拉进入的通道。此外,已证明是针对埃博拉病毒的糖蛋白对TPC2的要求,暗示一个非常具体的内体的加工途径。以前的研究工作表明,NPCI和埃博拉病毒进入也和作为胞内受体触发的融合至关重要,建议NPCI可能不需要融合本身,因为晚期内涵体表达TPC2但不是NPCI,和培养的细胞增殖性感染相关。这表明,NPCI在和TPC2融合之前,NPCI与糖蛋白相互作用,相互作用的糖蛋白发生裂解。进一步证明了关联TPC2与药物粉防己碱阻断通道活性,提高小鼠在感染埃博拉病毒的存活,由此可见在埃博拉病毒感染上TPC2的重要作用。
来自于中国传统中药粉防己,还没有用在人类身上来对付埃博拉病毒,另外,Sakurai等 [29] 人多次组织培养半数抑制剂量给小鼠,观察到的剂量,并可能超过剂量,认为对人是安全的。汉防己甲素治疗可能优于最先进的埃博拉病毒爆发后的治疗(包括鸡尾酒三单克隆抗体和小分子干扰RNA治疗)。几乎所有的65个左右的抗病毒药物在美国已经批准其用于临床使用的治疗慢性病毒感染(免疫缺陷病毒,乙型肝炎病毒,丙型肝炎病毒)药物的急性病毒性感染(如,更多的流感病毒,痘病毒,和herpes病毒)。由于埃博拉感染通常进展迅速,降低病毒滴度50%标准度量,说明病毒感染得到有效的控制。降低50%病毒的浓度,目前的临床治疗还达不到这样的效果;相反,除用组合治疗外,汉防己甲素为病毒进入抑制剂,可针对性的减少90%或99%的埃博拉病毒,其有更好的预防治疗作用。目前,有超过60多种化合物已提议用于埃博拉的有效治疗,但是这些化合物的大部分没有一个清晰的作用机制,而粉防己碱在机理上已有一些这样的认识。一些化合物具有先进的临床试验,对抗埃博拉病毒感染(例如:brincidofovir和favipiravir)是有说服力的,但临床数据缺乏 [30] 。粉防己碱等药物的结构改造可能最终形成一种治疗方法(同样适用于其他抗埃博拉病毒的化合物)。研究人员接下来的实验包括灵长类动物测试和人体临床测试。Darryl估计,汉防己碱疗法可望于两到五年内用于埃博拉病毒的治疗。不过,《科学》杂志配发的另一篇评论文章泼冷水说,汉防己碱研究并不能表明“一个切实可行的治疗方法尽在眼前”,原因是尚未在更能说明疗效的恒河猴中进行测试。
4.2. 埃博拉病毒的侵入
图4表明:埃博拉病毒通过特定的钙通道侵入细胞。病毒一旦内化为一体,病毒糖蛋白裂解结合到胞膜蛋白(NPCI)。然后激活TPC2通道,释放病毒基因进入细胞。药物粉防己碱可阻断TPC2通道(见图4) [30] 。
4.3. 汉防己碱抗埃博拉病毒的作用
埃博拉病毒结合到细胞表面蛋白的几种类型开始进入宿主细胞,在这之后被巨胞饮和如下达到酸性舱室,胞内途径那里,宿主蛋白酶如组织蛋白酶裂解病毒糖蛋白(GPs),它结合到胞膜蛋白(NPCI),并最终促进病毒核心在细胞的细胞质中复制开始的地方释放。以前的研究表明宿主钙信号蛋白对于埃博拉病毒进入宿主细胞是重要的,但无法识别其是否可以作为治疗目标的功能机制和位点。
在埃博拉病毒感染的上下转换关系方面识别和扫描上游的效应调节钙信号传导。Sakurai等 [29] 测试

Figure 4. Ebola virus’ entry [30]
图4. 埃博拉病毒的侵入 [30]
的重要性在常见的四种渠道类型的钙离子拮抗剂,只有这组化合物(异搏定、尼莫地平、硫氮卓酮)阻断L-型钙离子通道,抑制Hela埃博拉病毒感染细胞。异搏定由美国食品药品监督管理局(FDA),用于治疗心血管病,用4 umol的IC50= (50%的抑菌浓度)有效的抑制埃博拉病毒。同样,其他两种结构不同的L-型钙离子通道拮抗剂尼莫地平、硫氮卓酮,同时降低埃博拉病毒的感染效率,来自于中国汉防己甲素(提取或合成)是特别的有效。55 nM的IC50就有效。相比之下,加巴喷丁,第五类独特的L-型钙离子通道抑制剂即使在高浓度没有影响。这一发现表明:经典的L-型钙离子通道不是埃博拉病毒依赖的钙通道的上游因子,也证明:异搏定,尼莫地平,地尔硫卓可以抑制由烟酸腺嘌呤二核苷酸磷酸(NAADP)触发的钙离子信号。NAADP是一个高效能细胞内钙离子动员剂,并刺激细胞内钙离子通道从内涵体和溶酶体释放钙离子。小分子的拮抗剂Ned19特异性的堵塞这个通道,Sakurai等发现Ned19这种拮抗剂也能堵塞埃博拉病毒感染,所有的抑制试验显示,所有的抑制剂在最高浓度使用无细胞毒性。如,维拉帕米(异博定)和Ned19,汉防己甲素也是一个有效的NAADP刺激钙离子释放的抑制剂,这些结果表明在埃博拉病毒感染中NAADP刺激钙离子通道,汉防己甲素能够阻断宿主因子。
表明NAADP通过合并和转运在囊泡融合中成熟,这也表明病毒进入细胞担任一个角色。这里与假病毒的测试,感染细胞的重组,水泡性口炎病毒中心的糖蛋白(GP),汉防己甲素、异搏定、Ned19对埃博拉病毒(rVSV-埃博拉病毒-GP)敏感,汉防己甲素则高度敏感。表明NAADP刺激通道活性特别影响GP介导的埃博拉病毒进入步骤。此外,汉防己甲素和异搏定有效的抑制马尔堡病毒糖蛋白重组(rVSV-埃博拉病毒-GP)的关系。但只有微弱的抑制感染马尔堡病毒、拉沙病毒、狂犬病毒、委内瑞拉马脑炎病毒,还暗示丝状病毒和其他类型的病毒相比更依赖这个路径。为了获得进一步进展,观察NAADP介质通道和埃博拉感染之间进一步的关系。Sakurai等试图发现感染所需的钙通道效应。最近研究显示这双孔通道(TPCS)是通过NAADP介导的主要钙的活性通道。他们还通过激活磷脂酰肌醇3,5-二磷酸[PI(3.5)P2]和存在于人类小鼠和其它动物的TPC1和TPC2,发现小鼠胚胎成纤细胞(MEFS)缺少TPC1或TPC2(TPCN1−/−或TPCN2−/−)通道,MEFS表达抵抗埃博拉病毒,在人类的表达突变细胞的感染明显恢复,表明基因的具体作用:基因敲除。同样,尽管抑制小干扰RNA的TPC的表达,(siRNAs)是不完整的,埃博拉病毒感染无论是在传染HeLa细胞还是在TPC1或TPC2 siRNAs是减少的。另外可有效的阻塞NANDP刺激钙释放,抑制埃博拉病毒作用,此外,埃博拉病毒颗粒(VLPs)在细胞内以TPC1和TPC2的阳性的胞内舱培养。路径分析显示PI(3.5)P2和NAADP引起的调触电流使胞内含粉防己碱甲素阻塞了TPC1和TPC2通道。对照组,加巴喷丁,没有抑制病毒感染,没有作用在TPC2的功能,同时,数据显示TPCs中PI(3.5)P2和NAADP介导的信号传导在埃博拉病毒感染方面是起重要作用通道。可能当病毒在细胞内体,汉防己甲素靶向的抑制了钙离子通道TPCs,具有强效能。发现仍然局限于溶酶体相关的膜蛋白1 (LAMP1)阳性的病毒样颗粒在TPCN1−/−和TPCN2−/−细胞囊泡,以及作为抑制剂对细胞处理,表明这一步是不受影响的。然后,发生内吞体半胱氨酸蛋白酶前病毒体膜融合埃博拉病毒GP,所以下一步研究是可以克服抑制药物的作用使用rVSV埃博拉病毒GP与蛋白酶预处理。用Ned19,汉防己甲素,或维拉帕米仍然有效地阻止病毒感染,但控制半胱氨酸蛋白酶抑制剂的保护作用,没有表明钙通道抑制剂影响后期进入GP蛋白水解后的步骤内。对膜融合与病毒含量释放法进行评价,表明这些抑制剂显著使内容混合信号降低,表明逮捕了病毒体膜释放到融合和病毒衣壳细胞的细胞质。
最近研究显示,阻塞通道TPC2的结果,显示阻塞物在这些酸性的舱体内转运,这些阻塞物在表皮生长因子(EGF)里累积存在于LAMP1阳性胞内舱。Sakurai等 [29] 发现,用汉防己甲素处理Hela细胞显示表皮生长因子类似的积累,以及为TPCN2−/−MEFs,而TPCN2−/−MEFs显示EGF积累较少。此外,VLPS和EGF和汉防己甲素作用过的细胞共存,这表明通过TPCs调节他们使用或收敛于一个共同的内涵体运输路线。此前证明,埃博拉病毒进入是依赖于另一个胞膜蛋白(NPC1),这小分子U18666A,诱导表型模拟NPCI缺陷,导致胆固醇聚集在胞内体。当细胞用U18666A处理后,EGF聚集的模式和汉防己处理后是相似的模式。然而用异搏定和U18666A治疗rVSV-埃博拉病毒-GP感染细胞,揭示了类似的抑制动力学,当感染后1.5~2小时添加药物,显示每一个受病毒感染的宿主接近相同的时间,每个变成无效。埃博拉病毒通过TPCs通道感染的各步奏、关系和表征,研究了病毒与NPC1通道和TPC2通道的共存。在未经处理的细胞中,病毒样颗粒含有NPC1和TPC2的舱体,以及一个独特的舱体只含TPC2通道。然而,汉防己甲素治疗显著(与其他通道抑制剂更有效)病毒颗粒的积累增加TPC2(+)通道中/NPC1(−)间隔共存。这个结果显示,汉防己甲素破坏胞内体运输,汉防己甲素能有效改变病毒传播,这样,在NPC1舱体保留VLPS。因为用舱体中TPC2(+)通道中/NPC1(−)减少共存来降低感染。埃博拉病毒可能使用本室进入宿主细胞,用U18666A治疗再次导致埃博拉病毒(VLP)定位相似,观察到U18666A抑制了钙通道,这可能是由最近的一份报告显示,治疗引起胞内钙缺乏。此外细胞,携带有缺陷的NPC1有一个失去NAADP响应,表明在宿主细胞的病理和NPC1关系密切,这可能会影响埃博拉病毒感染。
Sakurai等 [29] 讨论了是否TPC通道功能可以作为抗埃博拉病毒的治疗靶点,首先,原性巨噬细胞,在人类和其他动物病毒感染的最初目标,进行评论。在Hela细胞中的作用类似,汉防己甲素强效阻断人类单核细胞原性巨噬细胞感染埃博拉病毒,异搏定和Ned19有效,但需要高剂量,没有表现出细胞毒性。汉防己甲素是动物实验最好的药物,因为它高效、低毒。其中,汉防己甲素是最好的候选物,因为当前动物试验显示高效力和较低的细胞毒性。此外,所需抑制病毒感染的粉防己碱的剂量(IC50 = 55 nM)至少低于安全有效浓度40倍并在小鼠身上起到较好的药理特性,长效,很好的耐受性。因此,Sakurai等[29] 在埃博拉病毒病的小鼠模型上评价治疗效果,小鼠感染埃博拉病毒后,然后,给予汉防己甲素或生理盐水,每2天一次持续1周。汉防己甲素治疗开始后不久,感染小鼠的生存率显著提高。没有用汉防己甲素治疗的小鼠,感染开始后不久,显著提高生存率,在小鼠身上没有任何可检测到的副作用。治疗组小鼠的临床评分与对照组评分相比,显示较对照组小鼠感染Ebola病毒较低(生理盐水为对照组)。在3天测得的血清病毒滴度。接种后,9天没有检测到病毒。此外,当开始治疗,攻毒后1天,一半的小鼠存活。这些结果表明,汉防己甲素可非常有效的治疗患埃博拉病毒病小鼠。
总之,Sakurai等 [29] 确定汉防己碱的抗埃博拉病毒作用。含有病毒颗粒的胞内体这些钙离子通道表现负责控制运动。通过破坏TPC功能,防止病毒从胞内体TPC逃离进入细胞、细胞质,阻止感染。TPC被证明双苄基异喹啉类生物碱是有效的现有的药物作用靶点,证明粉防己碱,生物碱,是最有效的。这可能是由于在胞内体转运的不同阶段阻止TPC1和TPC2调节的能力。汉防己甲素是这类药物的一个代表;在植物周围世界发现其它成员,也可以阻止埃博拉病毒感染。因为一个丝状病毒有关的远亲马尔堡病毒的进入,也受到影响,所有的丝状病毒需要TPC通道这是可能的 [29] 。抗埃博拉病毒试验药物名称、药理作用机制和体外试验抗埃博拉病毒效果及结构见表5。
5. 新型钙离子拮抗剂的研究近况
钙离子拮抗剂又称钙通道阻滞剂,是在通道水平上选择性地阻滞钙离子经细胞膜上的钙离子通道进入细胞内,减少细胞内钙离子浓度的药物。它主要作用于心脏和血管,具有抑制钙离子内流的作用,可改变心肌、平滑肌兴奋-收缩耦联过程,松弛血管平滑肌,减轻负荷,降低血压,被广泛应用于高血压和冠心病治疗。钙离子拮抗剂对末梢血管选择性高,对代谢系统的影响小,并且安全性高,是治疗高血压的首选药物,钙通道在正常情况下为细胞外Ca2+内流的离子通道。膜上存在两大类钙离子通道,即电压控制钙通道和受体激活的钙通道。目前已克隆出L、N、T、O、P、Q和R6种亚型的电压依赖性钙通道,其中L-亚型钙通道是细胞兴奋时外钙内流的最主要途径,分布于各种兴奋细胞,是心肌动作电位2相平台期形成的主要离子流。L-型钙通道a1亚基至少含有三种不同类的钙通道阻滞药的结合受体。这些结合
Table 5. Activity of compounds of anti-Ebola virus
表5. 化合物的抗埃博拉病毒活性
受体是不同的,其中苯烷胺类(如,维拉帕米)及硫氮卓类结合点在细胞膜内侧,拮抗剂:二氢吡啶类(如,硝苯地平)的结合位点在细胞膜外侧。钙通道阻滞药与通道上的受体结合体通过降低通道的开放概率P来减少Ca2+内流量 [32] 。
5.1. 二氢吡啶类钙离子拮抗剂
大多数二氢吡啶类钙离子拮抗剂起效比较快,容易激发短期反射性交感活性增强,扩张肾小球出球小动脉比较弱,不能有效降低肾小球内压,因此可能减弱降压治疗过程中对心脏和肾脏的保护作用。近年来新型钙离子拮抗剂发展的一个重要方向是研制起效缓慢的膜控型和对特定血管有高度选择性的药物。此类药物包括:硝苯地平、非洛地平、尼莫地平、氨氯地平、伊拉地平、拉西地平、尼伐地平、乐卡地平、贝尼地平 [33] 。
5.2. 非二氢吡啶类钙离子拮抗剂
主要包括苯硫氮卓类、苯烷基胺类等以及其他类型新的药物。此类药物包括:地尔硫卓、米贝地尔、法舒地尔、维拉帕米、加洛帕米、噻帕米等 [33] 。
6. 未来的研究方向
6.1. 老药新用开辟新前景
汉防己碱具有苄基异喹啉结构的天然产物,是钙离子拮抗剂,一方面对其进行结构改造合成,寻找比较理想的肌松药,另一方面对其结构改造合成寻找抗埃博拉病毒或其它病毒的有效药物,并通过药理研究在现有的苄基异喹啉结构肌松药如,维美松等中寻找对胞内钙离子双孔通道(TPCs)有阻断作用,且有抗埃博拉病毒作用或抗其它病毒作用的肌松药,为老药新用开辟前景。
6.2. 钙离子拮抗剂有望成为抗埃博拉病毒的先导化合物
Angela L. Rasmussen等 [34] 发现钙离子拮抗剂汉防己甲素强效阻断人类单核细胞原性巨噬细胞感染埃博拉病毒,维拉帕米(异搏定)、尼莫地平、硫氮卓酮等钙离子拮抗剂可阻断人类单核细胞原性巨噬细胞感染埃博拉病毒,但需要高剂量,且没有表现出细胞毒性。因此寻找抵抗埃博拉病毒的结构改造合成物质离不开对钙离子拮抗剂的相关药理作用及此类化合物结构的研究。
6.3. 汉防己碱有可能成为一类新型的抗炎药物的先导化合物
围绕着汉防己碱新发现的临床应用和药理作用以及其作用的特殊靶点(Tet以时间和剂量依赖方式抑制Con A刺激的人淋巴细胞磷酸肌醇代谢、胞浆Ca2+升高和蛋白激酶C的活性,即抑制了以磷酸肌醇分解产物三磷酸肌醇和二酰甘油为第二信使的跨膜信号传递系统)。由于该信号传递系统广泛存在于各种器官和组织的细胞中。Tet抑制此系统可能是其广谱抗炎和抑制免疫的共同机制。开发合成及结构改造成新的有效药物,Tet是一种非类固醇激素的广谱抗炎药,同时也具有一定的免疫抑制作用。通过对Tet和对其双苄基异喹啉类似物结构与活性关系的研究,期望找到一类新的抗炎和免疫抑制药物,用于临床,治疗慢性炎症及自身免疫性疾病。目前Tet治疗急性胰腺炎(AP)还停留在动物实验阶段,Tet没有明显的毒性,也没有甾体类抗炎药的激素样副作用。因此,Tet有可能成为一类新型的抗炎药物的先导化合物,具有广阔的前景。
6.4. 双孔通道是拮抗埃博拉病毒的靶点
粉防己碱用于埃博拉病毒的治疗已有一个清晰的作用机制。埃博拉病毒进入宿主细胞的胞内钙通道需要调用双孔通道TPCS。经典的L型钙离子通道不是埃博拉病毒依赖的钙通道的上游因子,汉防己甲素、异搏定、尼莫地平、地尔硫卓等可以抑制由烟酸腺嘌呤二核苷脸酸NAADP触发的钙离子信号。TPCS通道功能可以作为抗埃博拉病毒治疗的靶点,汉防己甲素与异搏定相比有很强的阻断人类单核细胞原性巨噬细胞感染埃博拉,没有细胞毒性。有望通过寻找对TPCs通道有拮抗作用的物质进行药理研究,找到更多的拮抗埃博拉病毒的有效物质。扩展安全性的临床药物用途,为治疗埃博拉病毒提供新的有效方法。
6.5. 汉防己碱中药配方及钙离子通道阻滞剂中药是抗埃博拉病毒的两个值得关注的研究方向
汉防己甲素类同结构苄基异奎琳药物,如维美松的抗埃博拉病毒作用是否存在,甚至扩展到抗其他病毒的药物是否也具有抗埃博拉病毒的作用,这方面是值得进一步研究的。由此含汉防己碱的植物及中药配伍的抗埃博拉病毒作用也是值得研究的,另外寻找钙离子通道阻滞剂的中药及中药的有效成分的抗埃博拉病毒作用也是一个研究方向。
6.6. 有钙离子拮抗作用的中药及有效成分
一川加男等 [35] 对134味中药热水提取物的Ca2+拮抗作用进行了筛选性研究。试验方法:用每10 g生药加沸水100 ml提取,过滤后冷冻干燥而成,试验时再用水溶解,最终浓度为3 × 10−4、10−3、3 × 10−3 g/ml,水不溶样品加分子量为4万的PVP助溶。所致豚鼠结肠条痉挛的抑制作用于通95% O2、5% CO2的盛37℃ Krebs溶液的浴槽内进行,用40 mM的高张KCl引起痉挛。测定加入试样后痉挛的抑制以10−5 M利血平对KCl所致结肠条收缩的抑制定为100%。有研究发现茵陈蒿、乌梅、黄芩、黄柏、藿香、菊花、金钱草、厚朴、牛芬子、蛇床子、青皮、大黄、泽泻、肉豆蔻、补骨脂、粉防己、北豆根、青风藤、金果榄等中药材有钙离子拮抗作用,并随浓度的增加而增加。其中粉防己、北豆根、青风藤、金果榄、千金藤(石蟾蜍的根)、马兜玲科的广防己都含有汉防己碱 [27] 。消化不良、咳嗽、呕吐、腹泻的原因部分是由于平滑肌过度收缩所致,而藿香、乌梅民间广泛用于治疗这些疾病,其机理可能是抑制了钙离子通过胞膜流入胞内,从而抑制了平滑肌的过度兴奋。有趣的是,从构效关系看,钙离子拮抗剂似乎无共同的结构特征,见表6。因此,从天然植物中寻找新型钙离子拮抗剂的前景令人乐观。
对于现有猜测的很多钙离子拮抗剂作用的中药还有很多未经研究证实的部分,如罗布麻叶,牛膝,杜仲,稀蔹草,大枣,夜交藤等。根据钙阻滞剂治疗高血压及心律失常的作用,依据辨证论治的原则,其应用范围应该在中风、眩晕、心悸、失寐等,因此中药钙离子拮抗剂研究领域的发展还有很广阔的空间。同时,研究人员尚可以投入更大的精力在研究钙拮抗中药的有效成分和有效部位,为钙拮抗中药的成药化奠定坚实的基础。有研究发现埃博拉病毒通过胞内钙离子双孔通道(TPCs)释放基因组来完成病毒复制的,从这些有钙离子拮抗作用的中药或其有效成分(生物碱等)中或方药或对其有效成分进行结构改造,优选出有效对抗埃博拉病毒的药物大有可为 [60] 。
6.7. L-型钙离子通道靶点
L-型钙离子通道(L-type Ca2+ channels, LTCCs),也称为Cavl家族通道,是对钙离子通道阻滞剂敏感,并在许多可兴奋性细胞表达的蛋白通道。在前列腺癌的发生、发展过程中,LTCCs的异常表达与肿瘤细胞的增殖和凋亡密切相关。LTCCs主要分布于可兴奋性细胞(组织),如骨骼肌、心肌、神经元它不仅与骨骼肌、心肌、平滑肌的兴奋–收缩偶联密切相关,而且参与调控内分泌细胞和神经细胞释放激素及神经递质,并与基因表达有关。除了在可兴奋性细胞(组织),在非兴奋性细胞(组织)中也见表达,包括正常前列腺及前列腺肿瘤细胞。在前列腺组织的外周区、中央区及移行区的间质是由大量的平滑肌组成,LTCCs在这些平滑肌中表达,并参与调节平滑肌的自发电活动,改变动作电位的振幅和频率从而影响平滑肌的收缩,参与调节前列腺液及尿液的排出。人和动物膀逼尿肌、尿道以及前列腺标本中均检测到LTCCs的存在,认为慢性前列腺炎的发病机制可能与钙离子通道的表达有关,推测前列腺平滑肌中LTCCs的变化有可能引起前列腺收缩活性的改变而导致前列腺尿液返流,引起慢性前列腺炎的发生。而在肿瘤细胞中,LTCCs主要是在细胞的非增殖阶段表达。LTCCs在细胞上的表达改变可能与前列腺癌的发生、发展密切相关,也可能因钙稳态的破坏而介导前列腺癌细胞的凋亡,也许LTCCs对前列腺癌不仅在肿瘤细胞增殖或凋亡中起作用,可能在其转移、侵袭方面也扮演重要角色,而随着前列腺癌的治疗的深入研究,从LTCCs的角度对前列腺癌进行治疗是一种有效的手段,LTCCs也必将成为前列腺癌治疗的新靶点。有望通过寻找对LTCCs有拮抗和激活作用的物质进行药理实验寻找到能治疗前列腺癌的有效物质 [61] 。
Table 6. Effective components of Chinese herbal medicine in the action of calcium antagonists
表6. 有钙离子拮抗剂作用的中药中的有效成分
6.8. 从汉防己组方的中药方剂中筛选抗埃博拉病毒的方药
东汉末年,张仲景的《伤寒杂病论》中,其中《金溃要略》载有防己黄芪汤、防己地黄汤、术防已汤、防己茯苓汤和己椒苈黄丸5个含防己的方剂。防己黄芪汤具有益气祛风、健脾利水之功效。药理研究证实,本方具有利水,改善血液循环,促进消化机能,并有降压、镇静、镇痛、解热及消炎作用与防己黄芪汤的利水消肿功效和保护肺表面活性物质有关。近年来有研究表明,肺缺血再灌注损伤产生机制有以下五个方面:氧化应激反应,细胞内钙超载,炎症反应和微血管损伤细胞因子,细胞的凋亡,肺表面活性物质减少。从汉防己组方的中药方剂中筛选抗埃博拉病毒的方,也是有效预防和治疗埃博拉病毒的一个方向。
6.9. 对粉防己碱在对抗埃博拉病毒机理上的认识
汉防己甲素作用于TPCs通道,阻塞了TPCs-钙离子通道,阻断了埃博拉病毒从钙离子通道释放基因组,使得埃博拉病毒不能在细胞内复制,汉防己甲素阻断了埃博拉病毒的感染;TPC通道蛋白在埃博拉病毒感染起了一个关键的作用,可能是抗病毒治疗的有效指标。这提示粉防己碱等药物和植物世界的其它成员也可以阻止埃博拉病毒、马尔堡病毒等的感染,也提示人们,其它病毒也有可能需要TPCs通道,故对其它病毒进入细胞的路径研究,特别是TPCs通道在病毒感染方面的研究使寻找新的有效的抗病毒药物成为可能。
6.10. 汉防己碱抗肿瘤药物多药耐药性逆转剂
汉防己碱是目前报道最多的中药单体抗肿瘤药物多药耐药性的逆转剂,具有临床研究价值。
总之,汉防己碱及其类似物是抗埃博拉病毒重要的先导化合物,因此可以通过结构优化和构效关系研究找到活性高、毒性低的理想药物;另外可以从钙离子通道或双通道拮抗剂(包括中药在内)中优选抗埃博拉病毒药物;还有一个重要方向是从具有多种药理作用的抗病毒中药中筛选有效成分,并更进一步进行合理组方,有望得到具有中国特色的抗埃博拉病毒药物。
文章引用
张 莹,胡文祥. 汉防己碱药理作用及抗埃博拉病毒活性研究进展
Progress in Research of Activity of Anti-Ebola Virus and Effect of Pharmacology of Tetrandrine[J]. 临床医学进展, 2015, 05(03): 136-165. http://dx.doi.org/10.12677/ACM.2015.53025
参考文献 (References)
- 1. 孟现民, 董平, 卢洪洲 (2014) 埃博拉病毒的治疗及新药研究进展. 上海医药, 21, 1-5.
- 2. 瞿涤, 袁正宏, 闻玉梅 (2014) 埃博拉病毒及其致病机制. 微生物与感染, 4, 197-201.
- 3. 庄心良, 曾周明, 陈伯意, 主编 (1987) 现代麻醉学. 第三版, 人民卫生出版社, 北京, 562-589.
- 4. 汤晓霞, 黄文龙, 张灿 (2001) 新型肌肉松弛剂的研究-双苄基四氢异喹啉类化合物的合成. 硕士论文, 中国药科大学, 南京.
- 5. 秦国伟, 唐希灿, 王蕊, 等 (2006) 汉防己碱和汉防己碱化合物合成和应用. 中国发明专利公开号: CN1720232A.
- 6. 韩彬, 王国俊, 罗恒列 (2014) 粉防己碱药理作用研究进展. 临床合理用药, 7, 198-199.
- 7. Sun, X.C., Xu, R.Z., Deng, Y.X., Cheng, H.Y., Ma, J., Ji, J.Z., et al. (2007) Effects of tetrandrine on apoptosis and radio sensitivity of nasopharyngeal carcinoma cell lines CNE. Acta Biochemical et Biophysi Sinica, 39, 869-878. http://dx.doi.org/10.1111/j.1745-7270.2007.00349.x
- 8. Li, X.L., Xu, H., Dai, X.Z., Zhu, Z.S., Liu, B.R. and Lu, X.W. (2012) Enhanced in vitro and in vitro therapeutic efficacy of codrug-loaded nanoparticles against liver cancer. International Journal of Nanomedicine, 7, 5183-5190. http://dx.doi.org/10.2147/IJN.S34886
- 9. 孙瑜, 贺克俭, 等 (2008) 汉防己甲素逆转人肝癌耐药细胞株多药耐药性的研究. 中国医药, 2, 790-791.
- 10. Xu, X.H., Gan, Y.C., Xu, G.B., Chen, T., Zhou, H., Tang, J.F., et al. (2012) Tetrandrine citrate eliminates in imatinib-resistant chronic myeloid leukemia cells in vitro and in vivo by inhibiting Bcr-Abl/β-catenin axis. Journal of Zhejiang University SCIENCE B, 13, 867-874. http://dx.doi.org/10.1631/jzus.B1200021
- 11. Hou, Y., Guo, T., Wu, C.F. and He, X. (2008) Effect of tetrandrine combined with epirubicin on the growth of human breast carcinoma multidrug resistance cell line. Yakugaku Zasshi, 128, 663-666. http://dx.doi.org/10.1248/yakushi.128.663
- 12. He, B.C., Gao, J.L., Zhang, B.Q., Luo, Q., Shi, Q., Kim, S.H., et al. (2011) Tetrandrine inhibits Wnt/β-catenin signaling and suppresses tumor growth of human colorectal cancer. Molecular Pharmacology, 79, 211-219. http://dx.doi.org/10.1124/mol.110.068668
- 13. 邢陈 (2011) 汉防己甲素对人结肠癌细胞株放射增敏性研究.硕士论文, 南京中医药大学, 南京.
- 14. Qian, X.P., Liu, B.R., Hu, J., Li, M., Hu, W.-J. and Sun, J. (2008) Inhibitory effect of tetrandrine on angiogenesis. Chinese Journal of Cancer, 27, 1050-1055.
- 15. 郭飞, 解基良 (2011) 汉防己甲素和吉西他滨协同使用对化疗耐药胰腺癌细胞的凋亡. 硕士学位论文, 天津医科大学, 天津.
- 16. 许文林, 敖忠芳, 等 (2001) 汉防己甲素逆转血液系统肿瘤细胞多药耐药的临床研究. 中华内科杂志, 9, 632-633.
- 17. 钱均强, 孙培, 等 (2011) 抗肿瘤药物多药耐药性的研究进展. 中国肿瘤临床, 11, 684-687.
- 18. Zhang, H., Gao, A., Li, F.X., et al. (2009) Mechanism of action of tetrandrine, a natural inhibitor of Candida albicans drug efflux pumps. Yakugaku Zasshi, 129, 623-630. http://dx.doi.org/10.1248/yakushi.129.623
- 19. 吴斯 (2010) 汉防己甲素与氟康唑协同抗白色念珠菌作用的比较蛋白组学. 硕士论文, 中山大学, 广州.
- 20. 王文英, 李祥华 (2005) 粉防己碱的心血管药理研究进展. 时珍国药, 10, 327-329.
- 21. Shen, D.-F., Tang, Q.-Z., Yan, L., Zhang, Y., Zhu, L.-H., Wang, L., et al. (2010) Tetrandrine blocks cardiac hypertrophy by disrupting reactive oxygen species-dependent ERK1/2signalling. British Journal of Pharmacology, 159, 970-981. http://dx.doi.org/10.1111/j.1476-5381.2009.00605.x
- 22. Takahashi, T., Tonami, Y., Tachibana, M., Nomura, M., Shimada, T., Aburada, M., et al. (2012) Tetrandrine prevents bone loss in sciatic-neurectomized mice and inhibits re-ceptor activator of nuclear factor κB ligand-induced osteoclast differentiation. Biological & Pharmaceutical Bulletin, 35, 1765-1774.
- 23. 吉毅, 刘文英, 等 (2011) 汉方己甲素对先天性隔疝大鼠的保护作用. 中国当代儿科杂志, 5, 401-405.
- 24. 王辉, 罗顺德, 等 (2000) 粉防己碱的药理学研究进展. 中国药学杂志, 12, 800-802.
- 25. 王文英, 李祥华 (2005) 粉防己碱抗急性胰腺炎的研究进展. 长江大学学报(自科版), 9, 327-329.
- 26. 甄攀 (2004) 粉防己碱的研究进展. 医学研究通讯, 8, 1039-1041.
- 27. 张永刚, 等 (1997) 粉防己碱药理研究进展. 国外医学中医中药分册, 4, 6-8.
- 28. 刘德伍, 李国辉 (2000) 粉防己碱抑制瘢痕形成机理的研究. 中药药理与临床, 6, 10-12.
- 29. Sakurai, Y., Kolokoltsov, A.A., Chen, C.-C., Tidwell, M.W., Bauta, W.E., Klugbauer, N., et al. (2015) Two-pore channels control Ebola virus host cell entry and are drug targets for disease treatment. Science, 347, 995-998. http://dx.doi.org/10.1126/science.1258758
- 30. Falzarano, D. and Feldmam, H. (2015) Delineating Ebola entry. Science, 347, 947-948. http://dx.doi.org/10.1126/science.aaa8121
- 31. 江川裕之, 古田要介, 杉田淳, 等 (2006) 新的吡嗪衍生物或其盐、以及含有该衍生物或盐的药物组合物. 日本发明专利公开号: 1418220.
- 32. 石咏梅, 葛金文 (2014) 脑缺血/再灌注神经元钙离子通道的研究进展. 医药综述, 14, 2567-2509.
- 33. 袁春妮 (2013) 新型钙离子拮抗剂的研究近况. 现代中西医结合杂志, 32, 3644-3645.
- 34. Rasmussen, A.L., Okumura, A., Ferris, M.T., Green, R., Feldmann, F., Kelly, S.M., et al. (2014) Host genetic diversity enables Ebola hemorrhagic fever pathogenesis and resistance. Science, 346, 987-991. http://dx.doi.org/10.1126/science.1259595
- 35. 一川和男, 等 (1990) 中药中钙离子拮抗剂的筛选. 中药药理与临床, 5, 41.
- 36. 张文杰, 等 (2008) 人参皂苷单体Rb1对缺血心室肌细胞动作电位及L-型钙离子通道的影响. 吉林大学学报(医学版), 978-981.
- 37. 江岩石, 等 (1994) 黄芪皂苷对培养心肌细胞跨膜电活动与自发性搏动的影响. 白求恩医科大学学报, 6, 538-539.
- 38. 黄从新 (1997) 当归提取液对豚鼠心室细胞钠、钙离子通道的影响. 中国心脏起搏与心电生理杂志, 2, 96-98.
- 39. 杜怡峰, 等 (2004) 川芎嗪对神经母细胞株SH-SY5Y细胞L型通道电流的影响. 中国神经免疫学和神经病学杂志, 1, 43-45.
- 40. Paradis, P., Dali-Yoacef, N., Paradis, F.W., Thi-bault, G. and Nemer, M. (2000) Overexpression of angiotensin II type I receptors in cardiomyocytes induces cardiac hypertrophy mid remodeling. Proceedings of the National Academy of Sciences of the United States of America, 97, 931-936. http://dx.doi.org/10.1073/pnas.97.2.931
- 41. 李永胜, 等 (2007) 丹参酮IIA对主动脉内皮细胞功能损伤的保护机制. 中国急救医药, 8, 720-723.
- 42. 郭蕾, 等 (2010) 三七总皂苷治疗冠心病心绞痛的研究进展. 现代中西医结合杂志, 10, 1290-1292.
- 43. 张岩松 (2003) 三七总皂苷、川芎嗪抑制病毒性心肌炎小鼠钙超载的机制研究. 博士论文, 浙江大学, 杭州.
- 44. 黑爱莲, 等 (1998) 黄芩苷对培养的大鼠主动脉平滑肌细胞内游离钙浓度的营销. 中药药理与临床, 4, 6-8.
- 45. 李倜, 迟晓玲 (2004) 黄连素治疗高血压临床及机理研究概述. 中医药信息, 4, 12-13.
- 46. 唐景荣, 石林 (1991) 丹皮酚对体外培养乳鼠心肌细胞钙摄取的影响. 中国药理学与毒理学杂志, 2, 108.
- 47. 何丽娜, 等 (2005) 赤芍总苷对氯化钾及N-甲基-D-门冬氨酸诱导的PCl2细胞超载损伤的保护作用. 中国临床药理学与治疗学, 2, 120-123.
- 48. 于永红 (1996) 尼莫地平对家兔实验性动脉粥样硬化病灶的消退作用. 临床心血管病杂志, 3, 164-177.
- 49. 赵颖, 等 (1997) 莲心碱对豚鼠心室肌细胞钙离子通道的阻滞作用. 中国心脏起搏与心电生理杂志, 4, 171.
- 50. 刘飞, 黄树模 (1993) 和厚朴酚对钙调素拮抗作用研究. 中国药理学通报, 1, 48-51.
- 51. 王群, 李江疆 (1998) 钩藤碱对心血管系统部分药理作用研究. 宁夏医学杂志, 1, 48-51.
- 52. 李娜, 丁伯平, 等 (2014) 钩藤碱阻滞钙离子通道的药理作用研究进展. 现代药物与临床, 9, 1073-1076.
- 53. 付敏, 等 (2009) 五味子乙素抑制海马神经元网络自发同步钙震荡. 西华大学学报(自然科学版), 2, 60-62.
- 54. 郭晓刚, 陈君社, 等 (2004) 葛根素对大鼠心肌细胞L型钙离子通道的影响. 中国中药杂志, 3, 248-250.
- 55. 裴德安, 李庚山, 等 (1999) 关附甲素对单个心肌细胞钙通道和内向整流钾通道的阻断作用. 中国心脏起搏与心电生理杂志, 2, 108-110.
- 56. Kozawa, T., Sakai, K., Uchida, M., Okuyama, T. and Shibata, S. (1981) Calcium antagonistic action of a coumarin isolated from “Qian-Hu”, a Chinese traditional medicine. Journal of Pharmacy and Pharmacology, 33, 317-320. http://dx.doi.org/10.1111/j.2042-7158.1981.tb13789.x
- 57. 刘小叶 (2008) 白花前胡丙素的心血管药理作用研究进展. 辽宁医学院学报, 6, 555-556.
- 58. 刘玉, 等 (2004) 缺氧及血管紧张素II体外诱导人大动物内皮细胞损伤与银杏叶提取物对豚鼠心室肌细胞动作电位及L型钙离子通道的影响. 中国临床药理学与治疗学, 1, 48-51.
- 59. 张绪国, 等 (2004) 银杏叶提取物对豚鼠心室肌细胞动作电位及L型钙离子通道影响. 中国临床药理学与治疗学, 3, 345-349.
- 60. 黄晓谨, 等 (2011) 中药钙离子拮抗剂的研究概况. 中医杂志, 20, 1789-1792.
- 61. 邝祥醒, 李本义 (2013) L型钙离子通道与前列腺癌的研究进展. 现代泌尿生殖肿瘤杂志, 4, 249-251.
