Advances in Clinical Medicine
Vol.
10
No.
03
(
2020
), Article ID:
34447
,
7
pages
10.12677/ACM.2020.103028
Diagnosis of Helicobacter pylori Infection
Yali Cai, Wen Wang
Fujian Medical University, Fuzhou Fujian

Received: Feb. 17th, 2020; accepted: Mar. 3rd, 2020; published: Mar. 10th, 2020

ABSTRACT
Diagnosis of Helicobacter pylori infection in recent years has mainly involved endoscopic techniques and molecular techniques. This includes both invasive and non-invasive tests of traditional laboratory tests, such as bacterial culture, histology, rapid urease and urea respiration tests, serological tests, and faecal antigen tests. New endoscopic techniques including narrowband magnification imaging and other techniques can visualize the sense of H. pylori and greatly improve the diagnostic rate of H. pylori.
Keywords:Helicobacter pylori, Diagnosis, Laboratory Detection, Gastroscopy

幽门螺旋杆菌感染诊断进展
蔡雅莉,王雯
福建医科大学,福建 福州

收稿日期:2020年2月17日;录用日期:2020年3月3日;发布日期:2020年3月10日

摘 要
这些年幽门螺旋杆菌感染诊断主要涉及内镜技术和分子技术。包括传统实验室检测的侵入性及非侵入性检查,如细菌培养、组织学检测、快速尿素酶试验及尿素呼气试验、血清学试验、粪便抗原检测。新的内镜技术包括放大窄带成像等技术,使幽门螺旋杆菌感染可视化,大大提高幽门螺旋杆菌的诊断率。
关键词 :幽门螺旋杆菌,诊断,内镜,实验室检测

Copyright © 2020 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
幽门螺旋杆菌(Helicobacter pylori, H. pylori)是定殖于胃上皮的一种螺旋弯曲或弧形的细菌,为革兰氏阴性菌。研究发现,它是慢性胃炎、消化性溃疡、胃黏膜相关淋巴瘤、胃癌的主要危险因素 [1]。1994年,国际癌症研究机构将幽门螺杆菌感染列为I类致癌因子。目前幽门螺旋杆菌检测包括侵入性检查和非侵入性检查,内镜技术的发展提高了幽门螺旋杆菌的诊断率。
2. 侵入性检查
侵入性检查是指胃镜下取胃黏膜进行活检,进而进行细菌培养、组织学检查、快速尿素酶试验、PCR等。但由于Hp在胃黏膜中分布不规则,有研究发现胃窦部数量较多,而在胃体部较少 [2] [3],也有研究发现某些患者胃窦部并未检测到Hp感染,而在胃体部检测到Hp阳性 [4]。因此Hp感染部位可能存在不同,不一定集中分布在胃窦部。如果胃镜下仅在单一部位采样活检,有可能造成Hp漏检,进而对患者的治疗产生影响。因此,胃镜下多部位采样活检有助于避免假阴性的出现,提高活检率。
1、细菌培养
微生物培养法具有100%的特异性,可作为细菌感染的金标准。但由于幽门螺旋杆菌培养条件较为严格,在常规实验室进行培养难度大,加上其他污染菌的过度繁殖将抑制幽门螺旋杆菌的生长,使得细菌培养不能取得理想诊断结果。
2、组织学检测
组织学检测就是应用一些染料包括苏木素和署红,来识别组织中的幽门螺旋杆菌。如感染水平较低,或需要进一步观察时,如应用其他染料进行复染(包括Giemsa,Genta,Gimenez,Warthin-Starry silver,Creosyl,violet)。组织学检测常作为内镜下检测幽门螺杆菌感染的首选,但它的准确性受活检部位、大小、数量、染料、质子泵抑制剂(PPI)使用、抗生素使用、病理医师经验的影响。组织学检测时,如使用PPI,建议停用2周再做检查。染色是组织学检测的关键步骤,临床中,常规的HE染色就可以诊断幽门螺杆菌感染。但对于中、重度慢性胃炎,HE染色未发现幽门螺杆菌感染时,通常建议辅助染色。免疫组化染色作为辅助染色的首选,如果没有免疫组化染色,可选Giemsa染色,因为它简单、敏感性高、价格便宜 [5]。
3、快速尿素酶试验
幽门螺旋杆菌能产生尿素酶,通过尿素酶降解尿素,可生成氨和二氧化碳。使周围的PH升高。通过PH指示剂就可检测标本的幽门螺旋杆菌。快速尿素酶试验是诊断幽门螺旋杆菌感染快速而简单的方法之一,其敏感性高于细菌培养及组织学检测。但它受一些因素影响,如细菌的密度、黏液层的厚度、胃组织的PH值等。
4、基因诊断技术
主要包括核酸分子杂交和多聚酶链式反应(PCR),核酸分子杂交技术具有较高的特异性和敏感性。PCR技术应用一对特异性引物和Ta q DNA聚合酶,使标本中的目的核酸片断在几小时内扩增10^9~10^12倍,扩增后的DNA再通过凝胶电泳或分子杂交进行检测。与常规培养方法相比,PCR可以定量、缩短诊断时间和减低成本。针对幽门螺旋杆菌基因的PCR,即使是在质量较差的样品中,也能够检测到10个拷贝。
5、耐药率检测以及Hp亚型检测,还有Cag检测等。
随着抗菌素的广泛应用及Hp菌株的自身突变,较多的耐药菌株产生,使得抗菌素的效力降低。同样的治疗方案针对Hp耐药菌及敏感菌的根除率存在显著性差异,因此在使用抗菌药物前,将耐药基因检测常规化进行,可用以指导临床用药。原位荧光杂交技术可应用于甲醛固定的活组织标本中幽门螺旋杆菌及其耐药性的检测。应用免疫组化技术可检测组织标本中幽门螺旋杆菌cagA和VacA抗原,从而对细菌进行分型。PCR不仅能够检测有无幽门螺旋杆菌的感染,同时也能检测细菌的基因型,基因检测不受临床治疗用药的干扰。
3. 非侵入性检测
非侵入性检测指不需获得胃黏膜组织,而是采用胃液、血清、唾液、粪便等标本的检测方法,包括尿素呼气试验、血清中幽门螺旋杆菌抗体检测和粪便及其他标本中幽门螺旋杆菌基因的测定、粪便幽门螺旋杆菌抗原检测。
1、尿素呼气试验
让患者口服含同位素标记的尿素,利用幽门杆菌产生尿素酶,尿素酶将服下的含同位素标记的尿素分解,产生含同位素标记的二氧化碳。这种含有同位素的二氧化碳由患者肺部呼出体外,用特殊的仪器检测到。包括碳13及碳14两种同位素,C13是天然存在的稳定性同位素,而C14则具有微弱的放射性;因C13呼气试验无创伤、无放射性,尤其适用于儿童、孕妇、年老体弱等人群。C14呼气试验价格较便宜。在所有非侵入性检测中,尿素呼气试验具有高度敏感性和特异性,它被推荐作为除菌治疗后幽门螺旋杆菌是否根除评估的首选 [6]。
2、血清学试验
幽门螺旋杆菌菌体表面的鞭毛及其分泌的许多抗原组分都可以激发宿主的免疫应答,从而产生抗体。检测血清中的特异性抗体可以反映幽门螺旋杆菌感染情况。这些抗体主要是IgG和IgA,IgM较少见。但由于这些抗体需要在感染后数周才能形成,而且即使幽门螺旋杆菌根除后,这些抗体依然会在体内维持6个月以上。故幽门螺旋杆菌抗体阳性不能代表患者正处于活动性感染,阴性也不能排除既往有无感染。所以这些检测更适用于流行病学筛查 [7]。
3、粪便抗原检测
幽门螺旋杆菌定植于人体胃黏膜上皮细胞表面,随胃黏膜上皮细胞的快速更新脱落而脱落,随粪便排出体外,通过检测粪便抗原可了解有无Hp的感染。但因为各种因素的影响,检测粪便抗原尚不能完全得到满意的结果 [8]。
4. 内镜技术检查
《京都共识》明确指出,经过培训的医师可以通过高清内镜(染色内镜、高分辨率的放大内镜等)准确诊断胃黏膜的萎缩和肠化。内镜下对幽门螺旋杆菌感染的诊断也具有可行性。
1、普通内镜
普通内镜检查可直接观察胃黏膜的颜色、皱襞、黏膜下血管和表面光滑情况。据相关研究报道 [9],Hp感染者通常胃镜下可观察到胃黏膜形态有典型特征,一般肉眼能直接识别。全国第五次幽门螺旋杆菌感染处理共识报告表明白光下发现的结节状胃炎提示Hp感染可能性大。日本内镜协会也作了普通内镜与病理Hp感染对比相关研究,结论是内镜下黏膜肿胀、点状红斑可协助Hp感染诊断 [10]。国内王万亮等人的实验 [11] 结果提示内镜下胃黏膜弥漫性充血、黏膜肿胀、皱襞肿大,蛇形、白色黏液、点状发红、鸡皮样、增生性息肉、萎缩、肠上皮化生及黄色瘤均可作为考虑Hp阳性的特征(如图1~6)。普通白光内镜检查具有一定准确性和临床价值,但受不同年资操作者经验的影响 [12]。

Figure 1. Plica enlargement
图1. 皱襞肿大

Figure 2. Xanthoma
图2. 胃窦黄色瘤

Figure 3. Mucous membrane swelling
图3. 黏膜肿胀

Figure 4. White mucus
图4. 白色黏液
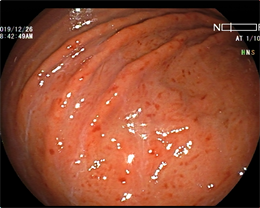
Figure 5. Punctate redness
图5. 点状发红

Figure 6. Chicken skin
图6. 鸡皮样改变
2、色素内镜
将染色剂对胃肠道黏膜进行局部染色,使病变部位及表面形态显现,通过内镜观察,染色可改善消化道黏膜的可视化特征。利用Hp产生尿素酶分解尿素产生氨,氨能使胃内PH值升高,遇染色剂变色来观察是否有无Hp感染。色素内镜的优点是:反应快速,喷洒识别液后1~2 min就可显色,定位精准,其大小范围可推测菌落的多少,色对比度好,易辨别,可为不愿意接受胃黏膜活检提供一个检测Hp感染可接受的方式。缺点是:有些指示剂(如溴甲酚紫) PH敏感阈值低,且染色可能与一些病变染色相同,易形成假阳性 [13]。某些染色剂(如碘、美兰)可能损伤胃黏膜。
3、放大胃镜
放大胃镜是一种诊断内镜,它的放大倍数介于显微镜和肉眼之间,可将物象放大到数十倍到数百倍之间,与实体显微镜所视相当,可用来观察胃黏膜表面腺体和微小血管形态结构。集合静脉是胃部黏膜最次级与毛细血管直接相通的微小静脉。胃黏膜表面微细形态基本单位是胃小凹。Hp感染后,胃黏膜微细结构的改变主要在胃小凹及集合静脉。日本内镜学者发现了放大内镜下胃体部无数微小红点规则排列的集合静脉是没有Hp感染的正常胃黏膜的典型特点 [14]。由于集合静脉在胃窦深层,放大胃镜不能很好地观察到。相比之下,胃体是内镜下诊断Hp感染的较好之处 [15]。放大胃镜有较高的准确性,放大内镜下“胃小凹 + 血管”模式预测Hp感染的敏感性和特异性是96%和91% [15],白光放大与染色放大诊断Hp无显著差异。
4、电子染色内镜
4.1、窄带成像技术(Narrow Band Imaging, NBI)
利用滤光器过滤内镜白光中的宽带光谱,仅留下蓝、绿窄带光谱,可增加黏膜浅层上皮及黏膜下血管结构的对比度及清晰度。胃窦小凹形态分为4型,B型:成短小棒状,小凹较深,可有分支和弯曲;C型:小凹稀疏而粗大,小凹延长、迂曲,分支弯曲明显增多,可相互连接呈树枝状;D型:小凹呈斑块状、网格状改变,小凹较C型粗大并相互连接;E型:小凹呈绒毛状、指头样突起,貌似肠绒毛样改变。研究发现C型Hp感染最高 [16]。胃体下部大弯侧集合静脉形态,在放大内镜及NBI,按其不同特征分为3型。R型(规则型):小静脉直径0.4~0.5 mm,有2级或3级分支,呈蜘蛛样或水母状规则性分布;I型(不规则型):隐约可见集合静脉,形态不规则,数量稀少,边缘不清,其形态和分布均不符合R型;D型(消失型):不能见到集合静脉。研究发现I型、D型集合静脉Hp的阳性率明显高于R型。在Hp相关性胃炎中NBI-ME胃窦胃小凹形态主要表现为小凹稀疏而粗大、延长、迂曲、小凹开口扩大、表面不均匀发红;而集合静脉主要表现为模糊紊乱甚至消失 [17]。Hp感染亦可表现为棒状胃小凹有明显沟槽、毛玻璃样结构、棕黑色斑片状黏膜等特征 [17]。NBI-ME操作简便,可随时在染色及染色前之间切换,反复对比观察病变,而传统色素内镜染色后不可重新观察病变。
4.2、智能分光技术(Fuji intelligent chromo endoscopy, FICE)
FICE成像系统是利用光谱分析技术原理,将普通内镜图像经处理、分析产生特定波长的分光图像,分光图像的单一波长被赋予红、绿、蓝三种颜色,不同组合的分光图像再经处理产生FICE特定图像。不同波长可穿透不同深度从而观察胃黏膜病变情况。FICE放大内镜有利于观察胃黏膜表明结构、毛细血管形态结构。参考Sakaki胃小凹分型及Nakagawa等标准,发现D型和I型Hp阳性患者明显高于R型 [18]。FICE放大胃镜有助于靶向定位活检,减少多点活检所致的创伤。
4.3、联动成像内镜(Linked color imaging, LCI)
联动成像内镜是一种激光成像技术,使用激光光源,扩大不同病变黏膜之间的色差,使红色的区域更红,白色的区域更白,从而提高不同胃黏膜病变的可识别性。OSAMU [19] 发现LCI可利用强调胃底黏膜的弥漫性红色来分析判断Hp感染的有无,其准确性达85.8%,较白光高,但其缺点是此方法依赖于内镜医师的主观判断。
5、共聚焦激光显微技术(Confocal laser endomicroscopy, CLE)
共聚焦激光显微内镜,将图像放大1000倍,显示细胞水平上一定深度黏膜的实时断层扫描成像。研究发现共聚焦激光显微技术Hp感染的诊断标准为:白亮圆斑、中性粒细胞集中、隐窝脓肿,其准确性为92.8%,特异性为95.7% [20]。故CLE对Hp感染具有可靠的诊断价值,其优点是快速、无创、有效,缺点是目前CLE只能观察黏膜层,对于病变浸润深度的评估有一定局限性,且图像质量易受呼吸、心跳等影响,价格昂贵。
5. 结论
虽然目前并不存在Hp感染诊断的金标准检查,诊断Hp感染的方式多种多样,但各有各自的优缺点,选择不同检查时取决于每个患者不同的临床情况。随着内镜技术的发展,内镜下观察Hp感染征象已成为可能,大大提高Hp感染诊断的准确性,内镜下病理活检不再盲目,病理结果更准确,从而提高Hp的根除率。将两项或两项以上的检测结果相结合,在临床实践中可获取最可靠结果。随着技术的发展,我们相信未来将有更可靠、更便利的Hp感染诊断检测方法造福人们。
文章引用
蔡雅莉,王 雯. 幽门螺旋杆菌感染诊断进展
Diagnosis of Helicobacter pylori Infection[J]. 临床医学进展, 2020, 10(03): 172-178. https://doi.org/10.12677/ACM.2020.103028
参考文献
- 1. Hiyama, T., Haruma, K., Kitadai, Y., et al. (2001) Clinicopathological Features of Gastricmucosa-Associated Lymphoid Tissue Lymphoma: A Comparison with Diffuse Large B-Cell Lymphoma without Amucosa-Associated Lymphoid Tissue Lymphoma Component. Journal of Gastroenterology and Hepatology, 16, 734-739. https://doi.org/10.1046/j.1440-1746.2001.02519.x
- 2. Watada, M., Shiota, S., Matsunari, O., et al. (2011) Asso-ciation between Helicobacter pylori cagA-Related Genes and Clinical Outcomes in Colombia and Japan. BMC Gas-troenterology, 11, Article No. 141. https://doi.org/10.1186/1471-230X-11-141
- 3. Larsen, A.L., Ragnhildstveit, E., Moayeri, B.A., et al. (2013) Resistance Rates of Metronidazole and Other Antibacterials in Helicobacter pylori from Previously Untreated Patients in Norway. APMIS, 121, 353-358. https://doi.org/10.1111/apm.12009
- 4. 康佳蕊, 齐东东, 王宏伟. RT-PCR法检测不同部位胃镜活检样本中幽门螺杆菌感染及耐药性的意义[J]. 诊断病理学杂志, 2018(10): 689-691+696.
- 5. Wang, Y.-K., et al. (2015) Diagnosis of Helicobacter pylori Infection: Current Options and Developments. World Journal of Gastroenterology, No. 40, 11221-11235. https://doi.org/10.3748/wjg.v21.i40.11221
- 6. Skrebinska, S., Mégraud, F. and Bessède, E. (2018) Diagnosis of Helicobacter pylori Infection. Helicobacter, 23, e12515. https://doi.org/10.1111/hel.12515
- 7. Ji, R., Li, Y.Q., Gu, X.M., et al. (2010) Confocal Laser Endomicroscopy for Diagnosis of Helicobacter pylori Infection: A Prospective Study. Journal of Gastroenterology & Hepatology, 25, 700-705. https://doi.org/10.1111/j.1440-1746.2009.06197.x
- 8. 李会强. 幽门螺旋杆菌实验室诊断方法[J]. 中国慢性病预防与控制, 2007, 15(2): 187-188.
- 9. Arents, N.L., van Zweet, A.A., Thijs, J.C., et al. (2001) The Accuracy of Helicobacter pylori Stool Antigen Test in Diagnosis H. pylori in Treated and Untreated Patients. European Journal of Gastroenterology & Hepatology, 13, 383-386. https://doi.org/10.1097/00042737-200104000-00013
- 10. 汪剑波, 付丽霞, 刘俊伟, 等. 胃镜下肉眼观察胃黏膜形态直接判断幽门螺杆菌感染的临床价值[J]. 世界华人消化杂志, 2017, 25(28): 2568-2574.
- 11. Lopes, A.I., Vale, F.F. and Oleastro, M. (2014) Helicobacter pylori Infection Recent Developments in Diagnosis. World Journal of Gastroenterology, 20, 9299-9313.
- 12. 王万亮, 秦青, 王伟, 侯兰兰. 内镜下胃黏膜形态变化判断幽门螺杆菌感染的价值[J]. 现代消化及介入诊疗, 2019, 24(6): 668-671.
- 13. 樊艳华, 刘积庆, 刘继喜, 刘芳, 沙雪菲, 李小春. 胃镜下根据胃黏膜形态判断幽门螺杆菌感染的临床价值[J]. 中日友好医院学报, 2016, 30(5): 267-269.
- 14. 周立君, 孙韬, 陈德娇. 溴甲酚紫色素内镜诊断胃幽门螺杆菌感染的价值[J]. 胃肠病学和肝病学杂志, 2008, 17(3): 181.
- 15. Gonen, C., Simsek, I., Sarioglu, S., et al. (2009) Comparison of High Resolution Magnifying Endoscopy and Standard Video Endoscopy for the Diagnosis of Helicobacter pylori Gastritis in Routine Clinical Practice: A Prospective Study. Helicobacter, 14, 12-21. https://doi.org/10.1111/j.1523-5378.2009.00650.x
- 16. Qi, Q., Guo, C., Ji, R., et al. (2016) Diagnostic Performance of Magnifying Endoscopy for Helicobacter pylori Infection: A Meta-Analysis. PLoS ONE, 11, e0168201. https://doi.org/10.1371/journal.pone.0168201
- 17. 马永华, 刘志斌. 放大内镜结合窄带成像技术在幽门螺旋杆菌相关性胃炎中的诊断价值[J]. 临床消化病杂志, 2016, 28(6): 338-341.
- 18. Tongtawee, T., Kaewpitoon, S., Kaewpitioon, N., et al. (2015) Correlation between Gastric Mucosal Morphologic Patterns and Histopathological Severity of Helicobacter pylori Associated Gastritis Using Conventional Narrow Band Imaging Gastroscopy. Biomed Research International, 2015, Article ID: 808505. https://doi.org/10.1155/2015/808505
- 19. 肖玲, 阮巍山, 杨玉宇, 徐莉. 放大内镜智能分光比色成像对幽门螺旋杆菌感染时胃黏膜改变的分析[J]. 中华消化病与影像杂志(电子版), 2013, 3(2): 10-12.
- 20. Dohi, O., Yagi, N., Onozawa, Y., et al. (2016) Linked Color Imaging Improves Endoscopic Diagnosis of Active Helicobacter pylori Infection. Endoscopy International Open, 4, 800-805. https://doi.org/10.1055/s-0042-109049