Pharmacy Information
Vol.
09
No.
02
(
2020
), Article ID:
34399
,
7
pages
10.12677/PI.2020.92006
Molecular Mechanisms of Research on Liver Regeneration
Feng Ge, Sensen Lin
China Pharmaceutical University, Nanjing Jiangsu
Received: Feb. 14th, 2020; accepted: Feb. 29th, 2020; published: Mar. 3rd, 2020

ABSTRACT
Liver regeneration is a highly organized tissue regeneration process when the liver is stimulated by injury. Partial hepatectomy (PHx), liver transplantation, and treatment of hepatitis all depend on the liver regeneration mechanism for repair in clinic. Liver regeneration is divided into three stages: the priming phase, the proliferation phase and the termination phase with different molecules participating in different stages. At present, the molecular mechanism and the search for drugs of liver regeneration have become hotspots for scientific researchers. This article will review the mechanisms of liver regeneration from cytokines, growth factors and signaling pathways, and provide a clinical basis for liver regeneration medicine. The research provides valuable research information.
Keywords:Liver Regeneration, Molecular Mechanism, Signaling Pathway, Drug Therapy

肝再生分子机制的研究进展
葛峰,林森森
中国药科大学,江苏 南京
收稿日期:2020年2月14日;录用日期:2020年2月29日;发布日期:2020年3月3日

摘 要
肝再生是肝脏受到损伤刺激时一个高度组织化的组织再生过程,临床上,肝部分切除术(PHx)、肝脏移植、肝炎的治疗都需要依赖肝脏再生机制进行修复。肝再生分为三个阶段:启动阶段、增殖阶段和终止阶段,在不同的阶段由不同的分子参与。目前,肝脏再生的分子机制以及寻找促进肝再生的药物已成为科研人员研究的热点,本文将从细胞因子、生长因子和信号通路等方面对肝脏再生的机制进行综述,为肝再生药物治疗的临床研究提供有价值的研究信息。
关键词 :肝再生,分子机制,信号通路,药物治疗

Copyright © 2020 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
我国是世界上肝脏疾病高发国家之一,不仅病毒性肝炎的发病率和患病率高,近年来,酒精性肝病和非酒精性肝病的发病人数也逐年升高。临床上,大多肝脏疾病的治疗均需要肝再生机制进行修复。肝再生是一个复杂的过程,不仅可以通过肝脏初始重量的减少(例如部分肝切除术或部分肝移植)来诱发,还可以通过病毒性肝炎,药物损伤或脂肪变性等肝脏疾病引起的肝脏质量的继发性降低诱发 [1] 。过去几十年的研究表明,肝再生是通过多种细胞因子和生长因子调节的复杂过程,再生过程包括三个过程 [2] :首先,在启动阶段,静止的肝细胞在多种刺激下,由G0期转变为G1期;在增殖阶段,肝细胞突破G1期进行有丝分裂;最后在一些负性调节因子如TGF-β的调节下进入终止阶段。在这三个阶段,各种细胞因子或生长因子通过多种生物学效应的细胞信号传导途径发挥关键作用。
2. 肝再生分子机制
2.1. 细胞因子
炎症是一种复杂的生物反应,其特征是一系列炎症细胞和免疫细胞的募集、增殖和激活,减轻感染,消除受损细胞并启动组织修复和再生过程 [3] 。炎症诱导的再生主要由炎症细胞释放的细胞因子和生长因子触发,研究最广泛的促炎细胞因子是TNF-α和IL-6。在肝脏损伤急性期反应中,IL-6能够发挥诱导细胞保护和促进有丝分裂功能 [4] ,IL-6与白介素6受体(IL-6R)结合,IL-6/IL-6R复合物与糖蛋白130亚基结合,从而导致JAk/STAT,MAPK和PI3K/AKT激活 [5] ,进而调节肝细胞增殖,促进肝再生过程。已有文献报道,阻断IL-6的信号转导会导致CCl4诱导的肝损伤加剧 [6] 。肿瘤坏死因子-α (tumor necrosis factor, TNF-α)在部分肝切除后由Kupffer细胞诱导表达,TNF-α在Kupffer细胞表面与与肿瘤坏死因子受体1 (tumor necrosis factor receptor 1, TNFRl)结合,从而激活核因子-κB (nuclear factor kappa B, NF-κB),刺激IL-6的产生,进而激活STAT3以及细胞外调节蛋白激酶1和2 (ERK1/2)等信号通路 [7] 。
IL-6和TNF-a主要在肝再生早期起重要调控作用,二者共同调节肝细胞由G0期进入细胞周期,促进肝再生的进程。
2.2. 生长因子
肝细胞生长因子(hepatocyte growth factor, HGF)在体内主要是由肝星形细胞产生的。在肝损伤或部分肝切除后,肝星形细胞释放肝细胞生长因子前体,然后经过尿激酶型纤溶酶原激活剂(urokinase-type plasminogen activator, uPA)和纤溶酶原蛋白酶的切割释放HGF,HGF与肝细胞上的c-Met受体结合后可激活下游信号通路,引发肝细胞增殖动员 [8] 。TGF-α表皮生长因子(Epidermal growth factor, EGF)家族中的一员,它是肝再生过程中的另一个重要生长因子。TGF-α主要由肝细胞分泌,它在肝细胞中可以直接刺激DNA的合成 [9] [10] ,与c-Met受体作用类似,表皮生长因子受体(Epidemal growth factor receptor, EGFR)作为酪氨酸激酶受体也能够促进细胞的增殖。血管内皮生长因子(vascular endothelial growth factor, VEGF)能直接作用于血管内皮细胞,促进其分裂、增殖诱导血管形成,在肝再生过程中,VEGF能够促进肝血窦内皮细胞增殖,启动血管再生,为肝细胞提供血液支持,并且有利于肝脏结构的重建 [11] 。
HGF、TGF-α和VEGF主要在肝再生的增殖阶段起调控作用,这些生长因子覆盖细胞分裂G1期限制点(R点),使肝细胞可依次进入细胞周期,通过促进细胞周期进程实现DNA复制和细胞分裂周期循环 [12] 。
转化生长因子-β (TGF-β)主要是由肝星形细胞产生,是一个负性调节因子,主要在肝再生的终止阶段起调控作用,它可以通过调节相关细胞周期蛋白的表达阻断生长因子的信号传导,从而抑制细胞DNA合成 [13] 。TGF-β的表达上调可能会导致导致肝纤维化和细胞凋亡。细胞因子和生长因子信号途径如图1所示。
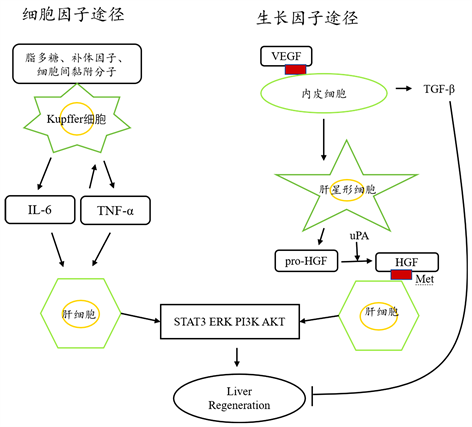
Figure 1. Growth factor and cytokine pathways during liver regeneration
图1. 肝再生过程中生长因子和细胞因子途径
2.3. 信号通路
2.3.1. Notch信号通路
Notch信号途径主要调控细胞的增殖和分化活动,已有研究表明,Notch信号通路在肝再生过程中起重要作用。在哺乳动物中,已被证实有四种Notch受体(Notch1-4)和两种类型配体(Jagged1-2和DLL1,DLL3-4)。Notch1主要在肝细胞中表达,主要在调节细胞增殖中起发挥作用 [14] ,Notch1与配体Jagged1受体结合后,Notch信号通路可以被激活,Notch信号通路激活后,Notch受体被γ-分泌酶复合物裂解,并向细胞内释放Notch1细胞内结构域NICD1,NICD是Notch的活性形式。NICD1可以转位进入细胞核并引起Notch靶基因(细胞增殖与细胞周期相关基因)的转录 [15] 。Xu [16] 等人近期研究证明薯蓣皂苷能增强γ-分泌酶的活性,通过激活Notch1/Jagged1信号通路来促进肝脏再生。在以后的科研中,关于肝再生过程中Notch信号通路完整分子机制必会被深入研究,并应用于临床从而获得更大的价值和收益。
2.3.2. Hippo信号通路
Hippo信号通路是在果蝇体内发现的一条抑制细胞生长的信号通路,可以对器官大小和体积进行调控 [17] 。该通路主要包括三部分:上游调控元件(NF2、Mer等)、核心组件(主要是Mst1/2、Lats1/2)及下游效应分子(YAP)。在正常机体内,胞外环境的生长抑制信号作用于Hippo信号通路上游的膜蛋白受体,磷酸化下游效应分子YAP,磷酸化的YAP和TAZ继而与细胞骨架蛋白相互作用,被滞留在胞质内,无法进入细胞核行丧失转录激活功能,以限制组织的过度生长。来自厦门大学、北京大学的研究人员发现一种小分子抑制剂(XMU-MP-1),在小鼠70%肝切除后,通过特异性的靶向抑制Hippo信号通路促进肝再生,并且对CCl4造成的慢性肝损伤以及葡聚糖硫酸钠(DSS)诱导的结肠炎具有保护作用 [18] 。有研究报道,HIPPO信号能够影响肝星形细胞的转分化、增殖和凋亡,进而影响药物及胆汁淤积引起的肝纤维化的发生和进展 [19] 。越来越多的证据表明,Hippo信号通路是调控肝再生过程中的重要信号通路之一。
2.3.3. mTOR信号通路
mTOR (雷帕霉素靶蛋白)是一种丝氨酸/苏氨酸激酶,mTOR信号通路具有促进物质代谢、参与细胞凋亡、自噬的作用,在多种疾病中扮演着不可忽视的角色。mTOR信号通路可以通过PI3K/Akt途径的激活,然后介导下游的信号分子S6K1和4E-BP1促进蛋白质合成和细胞生长 [20] 。已有研究证明,抗癫痫药物卡马西平能够通过激活mTOR信号通路在在部分肝切除的小鼠模型中促进肝细胞增殖,加速肝再生进程。卡马西平能够介导mTOR上游PI3K/Akt信号途径的激活,然后通过mTOR下游效应器S6K和4EBP1的上调,调节几种细胞周期蛋白的表达,如cyclin E和cyclin A,促进细胞周期进程 [21] 。综上所述,mTOR 信号通路在部分切除术后能够发挥促肝再生的作用,但是关于此信号通路在临床中的应用还需要进行深入研究。
2.3.4. Wnt/β-Catenin信号通路
Wnt配体主要由肝非实质细胞主要是Kupffer胞和内皮细胞分泌的糖蛋白 [22] 。Wnts可以激活主要的下游效应子β-catenin,并启动经典的wnt/β-catenin信号级联,并最终导致靶基因,例如c-myc和cyclinD1的表达 [23] 。Wnt/β-catenin通路是Wnt信号通路中的一种,该途径会使β-catenin在细胞质中积累并形成T细胞因子(TCF)转录因子家族复合物易位至细胞核。Wnt/β-catenin信号通路在是多个发育过程起关键作用。β-catenin被认为是启动肝再生所必需的,在肝再生过程中适度控制肝细胞的增殖。已有文献指出,经典的wnt/β-catenin信号传导有利于促进再生进程 [24] 。当小鼠wnt蛋白的核心受体LRP5/6被敲除,部分肝切除后显示,经典的wnt/β-catenin信号传导受损,并且肝再生过程延迟 [25] 。并且,Wnt/β-catenin信号传导参与肝移植后再生的调控,通过激活肝移植物中Wnt/β-catenin信号传导可以加速肝移植模型后的肝再生过程 [26] 。这些研究可能为解决临床上肝脏疾病治疗提供的新方法。
2.3.5. 胆汁酸的合成代谢
胆汁酸仅在肝脏中合成,由胆固醇7α-羟化酶1 (CYP7A1)控制的胆汁酸合成是最重要的胆汁酸合成途径,占总胆汁酸合成的90% [27] 。高达95%分泌到肠道的胆汁酸被重新吸收并通过门静脉返回肝脏,这一过程称为肠肝循环 [28] 。然而,肝胆汁酸占生物体总胆汁酸池的不到5% [29] 将胆汁酸的浓度维持在一定水平对于避免肝脏毒性很重要,胆汁酸过多会引起肝细胞损伤。越来越多的证据表明,胆汁酸参与肝再生过程,在小鼠部分肝切除后,饲喂补充了无毒浓度的胆汁酸(0.2%胆酸)的饮食可促进肝细胞的增殖,给予含2%消胆胺的饲料喂养后肝再生过程受到抑制 [30] ,这说明维持机体适度的胆汁酸含量对保证正常的肝再生过程是必要的。还有研究表明,泻醇B醋酸酯通过激活法尼酯衍生物X受体(FXR),从而介导下游靶基因Cyp7a1表达降低,Bsep (胆盐输出泵)表达升高,控制胆汁酸的过度合成,促进小鼠部分肝切除后的肝再生过程 [31] 。研究胆汁酸合成代谢及其相关信号通路,进一步明确其在肝再生过程中发挥的作用机制,对一些相关的临床问题如肝移植和部分肝切除术后的残肝再生及肝功能恢复等都具有指导意义。
2.3.6. 脂代谢
早有研究证明,在肝再生早期,肝细胞会储存大量的脂质,包括甘油三酯、脂肪酸和胆固醇酯,这些脂质可能作为新细胞膜的来源,用于促进肝细胞增殖 [32] [33] 。近期研究表明 [34] ,NCoR1 (核受体共抑制因子1)可以通过调控脂肪酸的合成影响肝再生。研究发现,肝脏特异性切除NCoR1的小鼠可以通过增加脂肪酸从头合成的相关分子表达,促进肝再生过程中脂肪合成从而增强肝脏再生。早期研究报道,在啮齿动物部分肝切除后12~48小时会发生短暂的脂肪变性,在部分肝切除36~48小时脂解反应和脂肪酸的β-氧化反应升高对于肝再生是必要的 [35] 。在部分肝切除后,破坏脂肪酸的β-氧化反应会延迟再生反应。如脂联素缺陷的小鼠参与脂肪酸的β-氧化反应的基因下调,从而阻碍了肝再生 [36] 。所以,在肝再生过程中,肝脏脂肪过多或不足可能都会对肝再生产生不利影响。
3. 总结与展望
尽管有关肝再生的机制研究多年,但是大部分研究结果由于物种差异并不能直接用于临床,临床上对于如何促进肝脏再生目前并没有达成很好的共识,对于相关肝再生的药物也并没有系统的研究,关于如何促进肝再生也没有明确的靶点,肝脏移植、肝衰竭或其他晚期肝病,对肝脏再生的需求迫切,它是一个多因素和多路径网络,确切的机制尚不完全清楚,所以,肝再生这一领域具有广泛的研究前景,科研工作者还有很长的一段路要走。
文章引用
葛 峰,林森森. 肝再生分子机制的研究进展
Molecular Mechanisms of Research on Liver Regeneration[J]. 药物资讯, 2020, 09(02): 40-46. https://doi.org/10.12677/PI.2020.92006
参考文献
- 1. Viebahn, C.S. and Yeoh, G.C.T. (2008) What Fires Prometheus?: The Link between Inflammation and Regeneration Following Chronic Liver Injury. The International Journal of Biochemistry and Cell Biology, 40, 855-873. https://doi.org/10.1016/j.biocel.2007.11.025
- 2. Pahlavan, P.S., Feldmann, R.E., Zavos, C. and Kountouras, J. (2006) Prometheus’ Challenge: Molecular, Cellular and Systemic Aspects of Liver Regeneration. Journal of Surgical Research, 134, 238-251. https://doi.org/10.1016/j.jss.2005.12.011
- 3. Karin, M. and Clevers, H. (2016) Reparative Inflammation Takes Charge of Tissue Regeneration. Nature, 529, 307-315. https://doi.org/10.1038/nature17039
- 4. Fujiyoshi, M. and Ozaki, M. (2011) Molecular Mechanisms of Liver Regeneration and Protection for Treatment of Liver Dysfunction and Diseases. Journal of Hepato-Biliary-Pancreatic Sciences, 18, 13-22. https://doi.org/10.1007/s00534-010-0304-2
- 5. Schaper, F. and Rose-John, S. (2015) Interleukin-6: Biology, Signaling and Strategies of Blockade. Cytokine & Growth Factor Reviews, 26, 475-487. https://doi.org/10.1016/j.cytogfr.2015.07.004
- 6. Gewiese-Rabsch, J., Drucker, C., Malchow, S., Scheller, J. and Rose-John, S. (2010) Role of IL-6 Trans-Signaling in CCl4 Induced Liver Damage. Biochimica et Biophysica Acta, 1802, 1054-1061. https://doi.org/10.1016/j.bbadis.2010.07.023
- 7. Taub, R. and Taub, R. (2004) Liver Regeneration: From Myth to Mechanism. Nature Reviews Molecular Cell Biology, 5, 836-847. https://doi.org/10.1038/nrm1489
- 8. Ishikawa, T., Factor, V.M., Marquardt, J.U, et al. (2012) Hepatocyte Growth Factor(HGF)/c-Met Signaling Is Required for Stem Cell Mediated Liver Regeneration. Hepatology, 55, 1215-1226. https://doi.org/10.1002/hep.24796
- 9. Scheving, L.A., Stevenson, M.C., Taylormoore, J.M., Traxler, P. and Russell, W.E. (2002) Integral Role of the EGF Receptor in HGF-Mediated Hepatocyte Proliferation. Biochemical & Biophysical Research Communications, 290, 197-203. https://doi.org/10.1006/bbrc.2001.6157
- 10. Tomiya, T., Ogata, I., Yamaoka, M., et al. (2000) The Mitogenic Activity of Hepatocyte Growth Factor on Rat Hepatocytes Is Dependent upon Endogenous Transforming Growth Factor-Alpha. American Journal of Pathology, 157, 1693-1701. https://doi.org/10.1016/S0002-9440(10)64806-7
- 11. 张文学, 孙卫华, 裴云飞, 等. 血管内皮生长因子(VEGF)与肝再生[J]. 河南师范大学学报: 自然科学版, 2004, 32(3): 65-68.
- 12. 解景东, 杨宝山. 肝再生机制研究现况[J]. 肝脏, 2014, 19(12): 978-982.
- 13. Liang, I.K., Wendy, M. and George, M. (2012) Signals and Cells Involved in Regulating Liver Regeneration. Cells, 1, 1261-1292. https://doi.org/10.3390/cells1041261
- 14. Morell, C.M. and Strazzabosco, M. (2014) Notch Signaling and New Therapeutic Options in Liver Disease. Journal of Hepatology, 60, 885-890. https://doi.org/10.1016/j.jhep.2013.11.028
- 15. Köhler, C., Bell, A.W., Bowen, W.C., et al. (2004) Expression of Notch-1 and Its Ligand Jagged-1 in Rat Liver during Liver Regeneration. Hepatology, 39, 1056-1065. https://doi.org/10.1002/hep.20156
- 16. Xu, L., Gu, L., Tao, X., et al. (2017) Effect of Dioscin on Promoting Liver Regeneration via Activating Notch1/Jagged1 Signal Pathway. Phytomedicine, 38, 107-117. https://doi.org/10.1016/j.phymed.2017.11.006
- 17. Halder, G. and Johnson, R. L. (2011) Hippo Signaling: Growth Control and Beyond. Development, 138, 9-22. https://doi.org/10.1242/dev.045500
- 18. Fan, F., He, Z., Kong, L.L., et al. (2016) Pharmacological Targeting of Kinases MST1 and MST2 Augments Tissue Repair and Regeneration. Science Translational Medicine, 8, 352ra108-352ra108. https://doi.org/10.1126/scitranslmed.aaf2304
- 19. 张祎婕, 肖俊丽, 张小燕, 等. 肝纤维化过程中HIPPO信号通路调控机制的研究进展[J]. 华中科技大学学报: 医学版, 2019(3): 350-354.
- 20. 闫洪涛, 陈平, 朱瑾, 等. 大鼠肝部分切除术后mTOR信号通路对肝再生的作用[J]. 现代生物医学进展, 2007, 7(3): 338-340.
- 21. Kawaguchi, T., Kodama, T., Hikita, H., et al. (2013) Carbamazepine Promotes Liver Regeneration and Survival in Mice. Journal of Hepatology, 59, 1239-1245. https://doi.org/10.1016/j.jhep.2013.07.018
- 22. Ding, B.S., Nolan, D.J., Butler, J.M., et al. (2010) Inductive Angiocrine Signals from Sinusoidal Endothelium Are Required for Liver Regeneration. Nature, 468, 310-315. https://doi.org/10.1038/nature09493
- 23. Monga, S.P.S. (2011) Role of Wnt/β-Catenin Signaling in Liver Metabolism and Cancer. International Journal of Biochemistry & Cell Biology, 43, 1021-1029. https://doi.org/10.1016/j.biocel.2009.09.001
- 24. Tao, Y.C., Wang, M.L. and Chen, E.Q. (2017) Liver Regeneration: Analysis of the Main Relevant Signaling Molecules. Mediators of Inflammation, 2017, Article ID: 4256352. https://doi.org/10.1155/2017/4256352
- 25. Yang, J., Mowry, L.E., Kari, N.N., et al. (2014) β-Catenin Signaling in Murine Liver Zonation and Regeneration: A Wnt-Wnt Situation! Hepatology, 60, 964-976. https://doi.org/10.1002/hep.27082
- 26. Ma, Y., Lv, X., He, J., et al. (2016) Wnt Agonist Stimulates Liver Regeneration after Small-for-Size Liver Transplantation in Rats. Hepatology Research, 46, E154-E164. https://doi.org/10.1111/hepr.12553
- 27. Rudnick, D.A. and Davidson, N.O. (2012) Functional Relationships between Lipid Metabolism and Liver Regeneration. International Journal of Hepatology, 2012, Article ID: 54924. https://doi.org/10.1155/2012/549241
- 28. Hofmann, A.F. (2009) The Enterohepatic Circulation of Bile Acids in Mammals: Form and Functions. Frontiers in Bioscience, 14, 2584-2598. https://doi.org/10.2741/3399
- 29. Setchell, K.D., Rodrigues, C.M., Clerici, C., et al. (1997) Bile Acid Concentrations in Human and Rat Liver Tissue and in Hepatocyte Nuclei. Gastroenterology, 112, 226. https://doi.org/10.1016/S0016-5085(97)70239-7
- 30. Huang, W. (2006) Nuclear Receptor-Dependent Bile Acid Signaling Is Required for Normal Liver Regeneration. Science, 312, 233-236. https://doi.org/10.1126/science.1121435
- 31. Meng, Q., Chen, X., Wang, C., et al. (2014) Alisol B 23-Acetate Promotes Liver Regeneration in Mice after Partial Hepatectomy via Activating Farnesoid X Receptor. Biochemical Pharmacology, 92, 289-298. https://doi.org/10.1016/j.bcp.2014.09.009
- 32. Glende Jr., E.A. and Morgan, W.S. (1968) Alteration in Liver Lipid and Lipid Fatty Acid Composition after Partial Hepatectomy in the Rat. Experimental and Molecular Pathology, 8, 190-200. https://doi.org/10.1016/0014-4800(68)90015-4
- 33. Farrell, G.C. (2004) Probing Prometheus: Fat Fueling the Fire? Hepatology, 40, 1252-1255. https://doi.org/10.1002/hep.20522
- 34. Ou-Yang, Q., Lin, X.-M., Zhu, Y.-J., et al. (2018) Distinct Role of Nuclear Receptor Corepressor 1 Regulated de Novo Fatty Acids Synthesis in Liver Regeneration and Hepatocarcinogenesis in Mice. Hepatology, 67, 1071-1087. https://doi.org/10.1002/hep.29562
- 35. Kohjima, M., Tsai, T.H., Tackett, B.C., et al. (2013) Delayed Liver Regeneration after Partial Hepatectomy in Adipose Differentiation Related Protein-Null Mice. Journal of Hepatology, 59, 1246-1254. https://doi.org/10.1016/j.jhep.2013.07.025
- 36. Pol, A., Martin, S., Fernandez, M.A., et al. (2004) Dynamic and Regulated Association of Caveolin with Lipid Bodies: Modulation of Lipid Body Motility and Function by a Dominant Negative Mutant. Molecular Biology of the Cell, 15, 99-110. https://doi.org/10.1091/mbc.e03-06-0368