Advances in Environmental Protection
Vol.
08
No.
06
(
2018
), Article ID:
27660
,
9
pages
10.12677/AEP.2018.86057
Review of Halogenated Flame Retardants Environmental Toxicology
Yuanshu Ge
Environmental School of Shanghai, Shanghai
Received: Oct. 30th, 2018; accepted: Nov. 15th, 2018; published: Nov. 22nd, 2018

ABSTRACT
Halogenated flame retardants are kinds of halogenated organic compound which can prevent the ignition of polymer materials or the spread of flame. Because of its low price and good flame retardant effect, halogenated flame retardants are widely used in plastics, textiles, electronic appliances and other products. Halogenated flame retardants as the most widely used flame retardant in the world today, although a small amount of halogenated flame retardants can obtain excellent flame retardant effect, however, halogenated flame retardants in combustion process is easy to generate toxic and corrosive gases, is harmful to the potential biological, HFRs in the process of the production and use will be released to the environment, they are persistent in the environment, of long distance migration enrichment, and potential toxicity to human and organism. The pollution of halogenated flame retardants has been a persistent concern in the field of environmental science in recent decades. According to different halogen atoms, halogenated flame retardants can be divided into brominated flame retardants and chlorinated flame retardants. Tetrabromobisphenol A (TBBPA), Hexabromocyclododecane (HBCD), Dechlorane Plus (DP) are three typical halogenated flame retardants.
Keywords:Halogenated Flame Retardants (HFRs), Tetrabromobisphenol A (TBBPA), Hexabromocyclododecane (HBCD), Dechlorane Plus (DP)
卤代阻燃剂环境毒效应和机理研究进展
葛渊数
上海市环境学校,上海
收稿日期:2018年10月30日;录用日期:2018年11月15日;发布日期:2018年11月22日

摘 要
卤代阻燃剂(Halogenated Flame Retardants, HFRs)是一类能阻止聚合物材料引燃或抑制火焰传播的含卤有机化合物,由于其价格低廉,阻燃效果好,被广泛添加于塑料、纺织品和电子电器等产品中。卤代阻燃剂作为当今世界上使用最为广泛的阻燃剂,虽然少量卤代阻燃剂即可获得优异的阻燃效果,然而卤代阻燃剂在燃烧过程中容易产生有毒和有腐蚀性的气体,具有潜在的生物危害性,HFRs在生产和使用过程中还会释放到环境中,其在环境中具有持久性、长距离迁移性和生物可富集性,对人体和生物体有潜在毒性。卤代阻燃剂的污染是近几十年环境学界持续关注的问题。根据卤原子不同,卤代阻燃剂可以分为溴代阻燃剂和氯代阻燃剂。四溴双酚A(TBBPA)、六溴环十二烷(HBCD)、得克隆(DP)是三种典型的卤代阻燃剂(HFRs),本文主要介绍了这三种典型阻燃剂的分布以及毒性研究进展。
关键词 :卤代阻燃剂(HFRs),四溴双酚A(TBBPA),六溴环十二烷(HBCD),得克隆(DP)

Copyright © 2018 by author and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
卤代阻燃剂(Halogenated Flame Retardant, HFRs)是当今世界上使用最为广泛的阻燃剂,它在分解时产生卤化氢(HX),卤化氢消除高分子材料燃烧反应产生活性自由基。如HX与火焰中链反应活性物质HO作用,使上述游离基浓度降低,从而减缓或终止燃烧的链式反应,达到阻燃的目的。卤代阻燃剂包括氯代和溴代阻燃剂等 [1] ,被广泛用于油漆、纺织品、电路板,尤其是电器电子产品的塑料外壳中。其中,溴系阻燃剂阻燃效率高(相同质量比氯高50%),可同时在气相及凝聚相起阻燃作用,这样可减少材料中阻燃剂用量,从而不致过多恶化基材的物理机械及电气性能,且由于C-Br键的键能较低,大部分溴系阻燃剂在200℃~300℃下分解,此温度范围与很多常用聚合物分解温度重叠(这也是溴系阻燃剂效率高的主要原因之一),所以溴系阻燃剂适用范围很广,在阻燃剂中占有主导地位。
溴系阻燃剂有“添加量最少、效果最好”的美称,是世界上消费量最大的卤素有机阻燃剂。目前世界的年总用量约在30万吨左右,在阻燃剂中所占比例达20%以上。全球电子电气产品所用的阻燃剂约有80%左右是溴系阻燃剂 [2] 。常见的BFRs有四溴双酚A (TBBPA);六溴环十二烷(HBCD);得克隆(DP)等。BFRs的生产和使用已经有五十多年的历史,相关报告显示,BFRs的使用量仍在持续增长 [3] 。
BFRs作为当今世界上使用最为广泛的阻燃剂,虽然少量HFRs即可获得优异的阻燃效果,然而卤代阻燃剂在燃烧过程中容易产生有毒和有腐蚀性的气体,具有潜在的生物危害性,HFRs在生产和使用过程中还会释放到环境中,其在环境中具有持久性、长距离迁移性和生物可富集性,对人体和生物体有潜在毒性,如干扰人体内分泌系统与神经系统 [4] [5] 。这也是近年来,卤系阻燃剂的使用逐渐受到质疑的原因。
BFRs按照使用方法可以分为反应型和添加型,其中反应型BFRs以化学键与基质结合,不容易逸散出来;而添加型BFRs以分子间作用力与底物结合,容易从底物扩散到环境中 [6] 。大量的生产和使用致使BFRs广泛分布于全球各地,在水体、大气、土壤、沉积物、生物体及人体中均检测到这些物质。研究表明,BFRs在环境中难降解,可以长期存在,并随环境介质进行长距离迁移。BFRs也可对生态环境及动物造成伤害,如对动物的大脑、肝脏、肾脏等器官以及内分泌系统、生殖发育系统和神经系统都有毒性 [7] ,因而受到各研究领域的广泛关注。
2. 卤代阻燃剂的分布
卤代阻燃剂根据所含卤原子的不同,可以分为氯代阻燃剂和溴代阻燃剂 [8] 。本实验研究的四溴双酚A (TBBPA),作为反应性溴代阻燃剂,常应用在塑料聚合体电路板中,如电气设备,打印机,手机,电视机和洗衣机等等,目前已经在土壤,水体,沉积物和大气等环境介质以及生物体和人体内检测到;六溴环十二烷(HBCDs),作为添加型阻燃剂,常应用在聚苯乙烯泡沫,沙发和家具中。目前在空气,灰尘,沉积物,水生生物,海洋动物,鸟类和人体中都能检测到 [9] ;德克隆(DP),被广泛应用于纺织和聚合产品中 [10] 。目前在空气,灰尘,沉积物,土壤和人体中都能检测到 [11] 。
3. 卤代阻燃剂的毒性研究
3.1. TBBPA
TBBPA是生产量最大的BFRs,化学式为C15H12Br4O2,结构式为: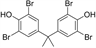 主要作为反应型阻
主要作为反应型阻
燃剂用于印刷线路板,也被广泛用作反应型阻燃剂以制造含溴环氧树脂和含溴聚碳酸酯以及作为中间体合成其他复杂的阻燃剂,也作为添加型阻燃剂用于ABS、HIPS、不饱和聚酯、硬质聚氨酯泡沫塑料、胶黏剂以及涂料等。它的使用量占BFRs的一半以上,由于TBBPA的阻燃性能好,其使用量仍在持续增长 [12] 。近年来的相关研究认为,TBBPA具有潜在的持久性、生物累积性和毒性,是一种类似于POPs的环境内分泌干扰物,对环境产生严重影响。国际上关于TBBPA毒理效应的研究已取得一定的进展,证明TBBPA可以对内分泌产生干扰,具有肝肾毒性、生殖毒性、神经毒性和免疫毒性 [13] [14] [15] 。
3.1.1. TBBPA的内分泌干扰效应
TBBPA的内分泌干扰效应主要体现在对甲状腺系统平衡的干扰 [16] [17] 。研究表明,TBBPA暴露可以引起动物体内甲状腺激素水平的变化。Wistar等 [18] 大鼠口服暴露于16 mg∙kg−1的TBBPA28d后,雄性大鼠血清T4水平升高,T3水平降低;雌性T4水平升高,T3水平变化不明显;幼鼠在TBBPA以5 mg∙kg−1的剂量口服暴露16d后,血清促甲状腺激素水平上升,但甲状腺激素水平没有明显变化 [19] 。
一些学者研究了TBBPA影响甲状腺激素的作用机制,Kitamura等 [17] 用GH3细胞体系研究了TBBPA与甲状腺激素受体(TR)之间的相互作用,结果显示,TBBPA (5.4~540 ugL−1)可以抑制T3与TR的结合。Goto等 [20] 在非洲爪蟾(Xenopus laevis)体内也有类似的发现,TBBPA不仅抑制T3与TR的结合,还抑制TR介的甲调基因的表达。Meerts等 [17] 发现TBBPA与甲状腺激素运载蛋白(TTR)的体外结合能力很强,是甲状腺素T4的10.6倍。
3.1.2. TBBPA的肝肾毒性
有相关研究发现,TBBPA对动物有一定的肝脏和肾脏毒性 [21] 。孕期的小鼠摄入含1%TBBPA的食物可以导致母体和幼体肝肾的损伤 [22] 。
Nakagawa等 [23] 研究发现,TBBPA可以通过破坏线粒体毒害肝实质细胞,导致肝脏细胞的膜功能紊乱,并抑制混合功能氧化酶细胞色素的活性。陈玛丽等 [24] 发现,TBBPA暴露(0.01和0.1mgL-1)能够引起红鲫肝脏脂肪化、空泡化和线粒体囊泡化,剂量增大则能够导致肝脏细胞核损伤和细胞间隙增大。关于TBBPA肾脏毒性的研究较少,Fukada等 [25] 认为,TBBPA可导致幼鼠肾的多囊损伤。
3.1.3. TBBPA的生殖毒性
TBBPA的生殖毒性主要体现在对性腺器官发育的影响上。Wistar大鼠暴露于TBBPA 28d后,雄性大鼠性腺质量增加,雌性则性发育延迟 [26] 。陈玛丽等 [22] 研究了TBBPA (0.01,0.05和0.1 mg∙L−1)对斑马鱼性腺组织结构的影响,结果显示TBBPA暴露导致雌性卵巢中卵泡发育受到抑制,滞留在发育早期。雄性精巢中生精细管管壁变薄。TBBPA还可以导致斑马鱼早熟卵母细胞增多,产卵率、孵化率和仔鱼成活率下降,成活下来的幼鱼中雌性个体占多数,表现出明显的生殖毒性 [27] 。
3.1.4. TBBPA的神经毒性
TBBPA暴露可以导致动物自发行为的改变,如记忆力学习能力减退。Lihenthal等 [28] 的研究表明,TBBPA暴露可对子代Wistar大鼠的听觉反应和应激等神经行为产生影响。TBBPA可以在小鼠的脑部区域累积,抑制小鼠突触小泡对多巴胺、Y一氨基丁酸和谷氨酸的摄取,并导致小鼠自发行为的改变,原因可能在于TBBPA可以降低膜的通透力,从而减少对这些神经递质的摄取 [29] [30] 。
3.1.5. TBBPA的免疫毒性
近期的研究发现,TBBPA可以通过降低细胞表面蛋白表达的方式减弱人体内自然杀伤(Natural Killer, NK)细胞的结合能力,NK细胞可以裂解肿瘤细胞和受病毒感染的细胞,NK细胞结合能力的减退使个体易发生癌症和受到病毒感染 [31] 。Reistad等 [30] 将人体嗜中性粒细胞暴露于TBBPA,发现TBBPA能够通过胞外信号调节酶ERK1/2的途径诱导NADPH氧化酶的活性,导致人体嗜中性粒细胞呼吸爆发,最终形成过量的ROS。
3.2. HBCD
HBCD是一种高溴含量的脂环族添加型阻燃剂,分子式为C12H18Br6,结构式为: 它具有阻燃
它具有阻燃
效率高、用途较广、有时不需采用锑协效剂等优点,其低填充性对聚合物性能影响极小,保证了聚合物的优良性能。被广泛应用于各类聚苯烯类树脂、纺织物及电子电器产品中 [32] 。HBCD具有较高的辛醇-水分配系数(LogKow = 5.4 − 5.8),易于在脂肪中蓄积,是一种高生物累积性物质,已被认为是一种潜在的持久性有机污染物 [33] 。在PBB/PBDE被限制后,作为替代物被大量应用。尽管HBCDD具有优良的阻燃效果,但其对人类和环境会构成潜在的长期的危害。国际环保组织已将其列入《关于持久性有机污染物的斯德哥尔摩公约》(POPs)名单;目前世界各国特别是发达国家都在自觉控制HBCD的产量和排量。
3.2.1. HBCD的肝脏毒性
目前的研究普遍认为肝脏是HBCD作用的主要靶器官,大鼠肝脏经HBCD诱导后出现体积增大、肝小叶增生和脂质淤积。Chengelis [34] 根据对大鼠90d的灌胃研究显示:以肝脏重量增加为指标,HBCD的最小有害作用剂量(LOAEL)为100 mg/kgbwd。Silke等 [35] 研究了HBCD对大鼠肝细胞色素P450水平的影响。雌性或雄性Wistar大鼠经灌胃(管饲法)给予HBCD28d后,发现HBCD可诱导CYP2B1基因高度转录,CYP2B1/2B2蛋白含量的增多,此作用和苯巴比妥的诱导相似。
Rocio等 [36] 以为期28d的HBCD重复剂量实验来检测大鼠肝脏基因表达的变化。结果显示雌性大鼠有较多的调节基因表达比雄性大鼠对HBCD更加敏感。同时还发现几个受HBCD暴露的具体途径,如PPAR-介导的脂质代谢,甘油三酯代谢调控和胆固醇生物合成途径等。
3.2.2. HBCD的神经毒性
刘芳等 [37] 研究环境暴露水平的HBCD对发育期大鼠的胆碱能神经系统的神经毒性作用,发现HBCD染毒可对脑发育期大鼠的胆碱能系统产生损伤作用,进而对神经发育产生影响。van de Ven等 [38] 通过饮食暴露的方式考察HBCD对大鼠的毒性,脑干听觉诱发电位实验中,脑干听觉诱发电位的变化提示对HBCD染毒对耳蜗功能产生了显著影响。Dingemans等 [39] 发现HBCD能抑制由于去极化引起的细胞内钙离子增高并且抑制PC12细胞释放神经递质。
3.2.3. HBCD的内分泌干扰效应
冀秀玲等 [40] 发现新生3d大鼠暴露于0.2和1 mg/kg剂量的HBCD 21d后,暴露组大鼠血清中总三碘甲状腺原氨酸TT3、游离三碘甲状腺原氨酸FT3的含量显著升高;总甲状腺激素TT4、游离甲状腺激素FT4含量下降约20%,促甲状腺激素水平上升30%~230%,说明HBCD可能通过对甲状腺激素T3的协同或替代作用产生直接和间接的甲状腺干扰效应。
Lilienthal等 [41] 用玉米油和HBCD混合溶液作为Wistar大鼠的饲料,剂量为0~100 mg/kg·d。在亲代雄性大鼠交配前的10周开始饲喂,雌性大鼠交配前2周开始饲喂,持续到妊娠期和哺乳期。并且饲喂子一代大鼠(从出生到死亡后尸检)。子一代评价显示肝脏中HBCD浓度的升高具有剂量依赖性,雌性大鼠胫骨骨小梁矿物密度的降低也呈剂量依赖性,雄性大鼠羊绵红细胞免疫后抗体反应增加。此外还发现睾丸重量降低和中性粒细胞增加,雌性大鼠非极性维甲酸及血浆碱性磷酸酶浓度降低。卵巢中CYP19的浓度与肝脏中HBCD的浓度具有相关性,可见HBCD对动物内分泌系统有较大的影响。
3.2.4. HBCD的免疫毒性
Hinkson等 [42] 发现HBCD对人自然杀伤细胞N的溶解作用和NK细胞中ATP的水平起抑制作用。Koike等 [43] 研究HBCD在体外是否影响免疫细胞的表型和功能,发现HBCD可以增强小鼠骨髓来源的树突状细胞MHCⅡ类、CD80、CD86和CD11c的表达,可诱发或增加抗原递呈相关分子的表达和IL-4的产生。
3.2.5. HBCD的生殖与发育毒性
Ema等 [44] 研究了HBCD暴露对SD大鼠两代繁殖的影响,染毒剂量在0~15,000 ppm之间,从第一代大鼠交配前10周开始每日经口灌胃染毒,连续繁殖两代,其中F0代和F1代连续染毒。结果发现染毒剂量1500 ppm及以上的F0及F1代大鼠代雌鼠卵巢中原始卵泡数量下降,而F2幼崽的生存指数下降。研究结果表明六溴环十二烷具有潜在的生殖毒性,但估计人体摄入的六溴环十二烷的量远低于目前的研究。
Saegus等 [45] 从SD大鼠妊娠第10天至产后20天给予含100~10,000 ppm HBCD染毒剂量的大豆饮食,结果发现口服10,000 ppm HBCD大豆的大鼠后代甲状腺滤泡细胞肥大、甲状腺功能明显减退,促甲状腺素TSH浓度升高,血清三碘甲状腺原氨酸T3浓度降低;口服1000 ppm HBCD大豆的大鼠后代甲状腺增大,血清T3浓度降低;另外在大脑发育方面,HBCD还可以影响其后代CNPase阳性的少突胶质细胞的密度。
3.3. DP
DP是一种高氯代脂环族含卤阻燃剂,分子式为C18H12Cl12,结构式为: 含氯质量
含氯质量
分数可达65%。工业用DP是由2 mol六氯环戊二烯和1mol,5-二氯环辛烯经狄尔斯–阿德尔反应合成,产率在70%左右,反应时间要12 h。DP是Hooker公司作为Mirex的替代品于20世纪60年代生产的,主要用作阻燃剂 [46] 。其阻燃方式与多溴联苯醚(PBDEs)相似,同属于添加型阻燃剂。DP具有典型持久性有机污染物的特性:高亲脂性、不宜光解和生物分解,且可以在鱼体中富集。对鱼类有明显的生态毒理效应;对兔子的真皮暴露实验也显示出其潜在的生殖毒性 [47] ,被认为是一类新型有机污染物。DP在国外已广泛应用于塑料、纤维等高分子材料的阻燃,它有良好的着色性、热稳定性、优异的电气性能及低生烟量等一系列的优点。但在国内还未见有关该阻燃剂的研究和生产的报道。
尽管DP已经被使用了几十年,然而直到近年才得到广泛关注。DP首先被发现于大湖地区的大气、沉积物和鱼体中 [48] [49] [50] [51] ,此后,亚洲和欧洲的一些环境介质中也发现了这类污染物 [52] [53] 。目前,已开展了环境样品中该类污染物的研究 [53] [54] ,但人体样品中DP研究还未见报道。同时,DP作为一种新兴污染物,在环境中分布广泛,且易生物累积,不仅会威胁生态系统的安全,也可能对人类健康产生潜在影响。目前关于得克隆的研究主要集中在空气、水体、土壤、生物体内含量的分析,毒理学数据仍缺乏。
4. 结论
TBBPA、HBCD和DP三种都为比较常见的卤代阻燃剂,在生产生活中的应用也比较普遍。TBBPA作为最常见的一种卤代阻燃剂,具有潜在的持久性、生物累积性和毒性,是一种类似于POPs的环境内分泌干扰物,对环境产生严重影响。国际上已证明TBBPA可以对内分泌产生干扰,具有肝肾毒性、生殖毒性、神经毒性和免疫毒性。而HBCD易于在脂肪中蓄积,是一种高生物累积性物质,也被认为是一种潜在的持久性有机污染物。目前已证明HBCD可以对内分泌产生干扰,具有肝脏毒性、生殖和发育毒性、神经毒性和免疫毒性。对于DP来说,DP具有典型持久性有机污染物的特性:高亲脂性、不宜光解和生物分解,且可以在鱼体中富集,对鱼类有明显的生态毒理效应;对兔子的真皮暴露实验也显示出其潜在的生殖毒性。在环境中分布广泛,且易生物累积,不仅会威胁生态系统的安全,也可能对人类健康产生潜在影响。
5. 展望
进入21世纪,随着新型产业的发展和人们生活方式的改变,出现了一些新型的污染物:如多溴联苯醚(PBDEs)等溴化阻燃剂(BFR)、药品(包括各类兽药和抗生素)和个人护理用品(PPCPs/PCPs)、全氟锌酸铵以及芳香族磺酸类污染物(PFOS/PFOA)和植物毒性物质等。这些污染物在环境中的浓度较低,但对生态系统的危害和对人体健康的影响却较大,其中的溴化阻燃剂对环境造成的负面影响极有可能成为“21世纪的PCBs”,促使人们将关注的热点从PCBs转向溴化阻燃剂。TBBPA作为溴化阻燃剂中最广泛使用的一种阻燃剂,在今后的研究中尤其要重视以下方面的研究:1) 到目前为止,在世界范围内对TBBPA的研究,主要是针对TBBPA的分布状况,而对其生物可降解和生态毒性的研究却较少,特别是对TBBPA衍生物的毒性研究更少,所以应加强TBBPA尤其是它的衍生物对生态系统的毒性研究;2) 溴化阻燃剂类和烷基酚类物质存在于环境中,我国目前没有相关的基准值或限值来对其约束和管制,国外对四溴双酚进行过评估,但是国内几乎没有系统的进行过危害评估。阻燃剂正向高效、低烟、低毒的方向发展,提高阻燃效率,减少用量,特别是减少对健康和环境的危害。实现阻燃剂无卤化已是势在必行。我国生产的阻燃剂多为低水平、低效能和有毒的产品,需大力研究和跟踪发达国家阻燃剂技术的进展情况,发展适合于我国现状的新型高效阻燃剂。
文章引用
葛渊数. 卤代阻燃剂环境毒效应和机理研究进展
Review of Halogenated Flame Retardants Environmental Toxicology[J]. 环境保护前沿, 2018, 08(06): 457-465. https://doi.org/10.12677/AEP.2018.86057
参考文献
- 1. Kierkegaard, A., Bignert, A., Sellstrom, U., Olsson, M., Asplund, L., Jansson, B. and deWit, C.A. (2004) Polybrominateddiphenyl Ethers (PBDEs) and Their Methoxylated Derivatives in Pike from Swedish Waters with Emphasis on Temporal Trends, 1967-2000. Environmental Pollution, 130, 187-198. https://doi.org/10.1016/j.envpol.2003.12.011
- 2. 朱克银, 曹亮. 天然沸石处理氨氮废水及农作物应用研究[J]. 安徽化工, 2001, 27(2): 32-35.
- 3. Boers, P., Ballegooijen, L.V. and Uunk, J. (2010) Changes in Phosphorus Cycling in a Shallow Lake Due to Food Web Manipulations. Freshwater Biology, 25, 9-20. https://doi.org/10.1111/j.1365-2427.1991.tb00468.x
- 4. Kuriyama, S.N., Wanner, A., Fidalgo-Neto, A.A., Talsness, C.E., Koerner, W. and Chahoud, I. (2007) Developmental Exposure to Low-Dose PBDE-99: Tissue Distribution and Thyroid Hormone Levels. Toxicology, 242, 80. https://doi.org/10.1016/j.tox.2007.09.011
- 5. Herbstman, J.B., Sjodin, A., Kurzon, M., Lederman, S.A., Jones, R.S., Rauh, V., Needham, L.L., Tang, D., Niedzwiecki, M., Wang, R.Y. and Perera, F. (2010) Prenatal Exposure to PBDEs and Neurodevelopment. Environmental Health Perspectives, 118, 712-719. https://doi.org/10.1289/ehp.0901340
- 6. Mazzio, C. (1998) Sins of the Tongue in Early Modern England. Modern Language Studies, 28, 95-124. https://doi.org/10.2307/3195467
- 7. 杜苗苗, 张娴, 颜昌宙. 溴系阻燃剂的毒理学研究进展[J]. 生态毒理学报, 2012, 7(6): 575-584.
- 8. 朱冰清, 史薇, 胡冠九. 中国海洋环境中卤代阻燃剂的污染现状与研究进展[J]. 环境化学, 2017, 36(11): 2408-2423.
- 9. 张帆, 余应新, 张东平, 等. 溴系阻燃剂在环境及人体中的存在和代谢转化[J]. 化学进展, 2009, 21(6): 1364-1372.
- 10. 赵坦. 底泥和土壤中德克隆类物质和六溴环十二烷异构体分析方法研究及应用[D]: [硕士学位论文]. 北京: 北京化工大学, 2016.
- 11. 王晓溪, 孙莹, 孙艳, 等. 德克隆亚慢性接触的靶器官毒理学研究[J]. 黑龙江医学, 2016, 40(9): 789-792.
- 12. Zalba, B., Marı́n, J.M., Cabeza, L.F., et al. (2003) Review on Thermal Energy Storage with Phase Change: Materials, Heat Transfer Analysis and Applications. Applied Thermal Engineering, 23, 251-283. https://doi.org/10.1016/S1359-4311(02)00192-8
- 13. Hausmann, R., Hidalgo, C.A., Bustos, S., et al. (2014) The Atlas of Eco-nomic Complexity: Mapping Paths to Prosperity. The MIT Press, Cambridge, 46, 234.
- 14. 刘丽华, 罗贤丽, 等. 四溴双酚-A的降解性和毒性研究进展[J]. 中央民族大学学报(自然科学版), 2010, 19(2): 5-10.
- 15. Itamura, S., Kato, T., Iida, M., et al. (2005) Anti-Thyroid Hormonal Activity of Tetrabromobisphenol A, a Flame Retardant, and Related Compounds: Affinity to the Mammalian Thyroid Hormone Receptor, and Effect on Tadpole Metamorphosis. Life Sciences, 76, 1589-1601. https://doi.org/10.1016/j.lfs.2004.08.030
- 16. Kitamura, S., Jinno, N., Ohta, S., et al. (2002) Thyroid Hormonal Activity of the Flame Retardantstetra-Bromobisphenol A and Tetrachlorobisphenol A. Biochemical & Biophysical Research Communications, 293, 554. https://doi.org/10.1016/S0006-291X(02)00262-0
- 17. Altarelli, R., Casalbuoni, D., Dominici, et al. (1990) Z Width and Branching Ratios in Extended Gauge Models. Modern Physics Letters A, 5, 495-508. https://doi.org/10.1142/S0217732390000573
- 18. Letcher, R.J., Hoving, S., Marsh, G., et al. (2001) In Vitro Estrogenicity of Polybrominated Diphenyl Ethers, Hydroxylated PBDEs, and Polybrominated Bisphenol A Compounds. Environmental Health Per-spectives, 109, 399-407. https://doi.org/10.1289/ehp.01109399
- 19. Goto, Y., Kitamura, S., Kashiwagi, K., et al. (2006) Suppression of Amphibian Metamorphosis by Bisphenol A and Related Chemical Substances. Journal of Health Science, 52, 160-168. https://doi.org/10.1248/jhs.52.160
- 20. Li, F., Jiang, B., Nastold, P., et al. (2015) Enhanced Transformation of Tetrabromobisphenol A by Nitrifiers in Nitrifying Activated Sludge. Environmental Science & Technology, 49, 4283-4292. https://doi.org/10.1021/es5059007
- 21. Huang, X., Molema, G., King, S., et al. (1997) Tumor Infarction in Mice by Anti-body-Directed Targeting of Tissue Factor to Tumor Vasculature. Science, 275, 547-550. https://doi.org/10.1126/science.275.5299.547
- 22. 陈玛丽. 四溴双酚-A对鱼类的毒性效应[D]: [硕士学位论文]. 上海市: 华东师范大学, 2008.
- 23. Heong, K.L., Aquino, G.B. and Barrion, A.T. (1991) Arthropod Community Structures of Rice Ecosystems in the Philippines. Bulletin of Entomological Research, 81, 407-416. https://doi.org/10.1017/S0007485300031977
- 24. Jakubowski, N., Waentig, L., Hayen, H., et al. (2008) Labelling of Proteins with 2-(4-isothiocyanatobenzyl)-1,4,7,10 tetraazacyclododecane-1,4,7,10-tetraacetic Acid and Lanthanides and Detection by ICP-MS. Journal of Analytical Atomic Spectrometry, 23, 1497-1507. https://doi.org/10.1039/b800346g
- 25. El Presidente, N. (2015) Del Principado se reunióen Bruselas con representantes de regionesafectadaspor el efectoestadístico. Environmental Research, 7, 6175-6189.
- 26. Jakobsson, K., Thuresson, K., Rylander, L., et al. (2002) Exposure to Polybrominateddiphenyl Ethers and Tetrabromobisphenol A among Computer Technicians. Chemosphere, 46, 709-716. https://doi.org/10.1016/S0045-6535(01)00235-1
- 27. Birnbaum, L.S. and Staskal, D.F. (2004) Brominated Flame Retardants: Cause for Concern. Environmental Health Perspectives, 112, 1-9. https://doi.org/10.1289/ehp.6559
- 28. Lilienthal, H., Verwer, C.M., et al. (2008) Exposure to Tetrabromobisphenol A (TBBPA) in Wistarrats: Neurobehavioral Effects in Offspring from a One-Generation Reproduction Study. Toxicology, 246, 2-45. https://doi.org/10.1016/j.tox.2008.01.007
- 29. Cubells, J.F., Rayport, S., Rajendran, G., et al. (1994) Methamphetamine Neu-rotoxicity Involves Vacuolation of Endocytic Organelles and Dopamine-Dependent Intracellular Oxidative Stress. Journal of Neuro-science, 14, 2260-2271. https://doi.org/10.1523/JNEUROSCI.14-04-02260.1994
- 30. Gomez, M., Orellana, A., et al. (2001) Detection of Specific My-coplasma Conjunctivae Antibodies in the Sera of Sheep with Infectious Keratoconjunctivitis. Veterinary Research, 32, 3-155.
- 31. Vahdat, L., Ward, M., Chuang, E., et al. (2009) A Phase II Trial Tetrathiomolybdate (TM), a Copper Depleting Compound, and Its Effect on Circulating Endothelial Progenitor Cells (EPCs) in Patients with Breast Cancer (BC) at High Risk of Recurrence. Cancer Research, 69, 6090. https://doi.org/10.1158/0008-5472.SABCS-09-6090
- 32. Cato, A., Celada, L., Kibakaya, E.C., et al. (2014) Brominated Flame Retardants, Tetrabromobisphenol A and Hexabromocyclododecane, Activate Mitogen-Activated Protein Kinases (MAPKs) in Human Natural Killer Cells. Cell Biology and Toxicology, 30, 345-360. https://doi.org/10.1007/s10565-014-9289-y
- 33. Sellström, U., Kierkegaard, A., Wit, C.D., et al. (1998) Polybrominateddiphenyl Ethers and Hexabromocyclododecane in Sediment and Fish from a Swedish River. Environmental Toxicology & Chemistry, 17, 1065-1072. https://doi.org/10.1002/etc.5620170612
- 34. Szabo, D.T., Diliberto, J.J., Huwe, J.K., et al. (2011) Accumulation and Distribution of HBCD Alpha and Gamma in Developing Mice Differs From That in Adults. Toxicological Sciences, 45, 343-570.
- 35. Ronisz, D., Finne, E.F., Karlsson, H., et al. (2004) Effects of the Brominated Flame Retardants Hexabromocyclododecane (HBCD), and Tetrabromobisphenol A (TBBPA), on Hepatic Enzymes and Other Biomarkers in Juvenile Rainbow Trout and Feral Eelpout. Aquatic Toxicology, 69, 229-245. https://doi.org/10.1016/j.aquatox.2004.05.007
- 36. 孙兆海, 毛丽, 冯政, 等. 腐殖酸对土壤吸附四溴双酚A的影响[J]. 中国环境科学, 2008, 28(8): 748-752.
- 37. 刘芳, 冀秀玲, 唐蔚, 等. 发育期六溴环十二烷染毒对雌性大鼠脑组织中乙酰胆碱含量及其相关酶活力的影响[J]. 环境与健康杂志, 2011, 28(11): 947-949.
- 38. van der Ven, L.T., van de Kuil, T., Leonards, P.E., et al. (2009) Endocrine Effects of Hexabromocyclododecane (HBCD) in a One-Generation Reproduction Study in Wistar Rats. Toxicology Letters, 185, 51-62.
- 39. Dingemans, M.M., Heusinkveld, H.J., De, G.A., et al. (2009) Hexabromocyclododecane Inhibits Depolarization-Induced Increase in Intracellular Calcium Levels and Neurotransmitter Release in PC12 Cells. Toxicological Sciences: An Official Journal of the Society of Toxicology, 107, 490. https://doi.org/10.1093/toxsci/kfn249
- 40. 冀秀玲, 刘洋, 刘芳, 等. 六溴环十二烷转甲状腺素蛋白结合活性及其发育期暴露的甲状腺激素干扰效应研究[J]. 环境科学, 2010, 31(9): 2191-2195.
- 41. Lilienthal, H., Lt, V.D.V., Piersma, A.H., et al. (2009) Effects of the Brominated Flame Retardant Hexabromocyclododecane (HBCD) on Dopamine-Dependent Behavior and Brainstem Auditory Evoked Potentials in a One-Generation Reproduction Study in Wistar Rats. Toxicology Letters, 185, 63-72. https://doi.org/10.1016/j.toxlet.2008.12.002
- 42. Hinkson, N.C. and Whalen, M.M. (2009) Hexabromocyclododecane Decreases the Lytic Function and ATP Levels of Human Natural Killer Cells. Journal of Applied Toxicology, 29, 656. https://doi.org/10.1002/jat.1453
- 43. Koike, E., Yanagisawa, R., Takigami, H., et al. (2013) Brominated Flame Retardants Stimulate Mouse Immune Cells in Vitro. Journal of Applied Toxicology, 33, 1451-1459. https://doi.org/10.1002/jat.2809
- 44. Tyl, R.W., Myers, C.B., Marr, M.C., Sloan, C.S., Castillo, N.P., Veselica, M.M., Seely, J.C., Dimond, S.S., Van Miller, J.P., Shiotsuka, R.N., Beyer, D., Hentge-s, S.G. and Waechter, J.M. (2008) Two-Generation Reproductive Toxicity Study of Dietary Bisphenol A in CD-1 (Swiss) Mice. Toxicological Sciences, 104, 362-384. https://doi.org/10.1093/toxsci/kfn084
- 45. Fujimoto, H., Woo, G.H., Inoue, K., et al. (2011) Impaired Oligodendroglial Development by Decabromodiphenyl Ether in Rat Offspring after Maternal Exposure from Mid-Gestation through Lactation. Reproductive Toxicology, 31, 86-94. https://doi.org/10.1016/j.reprotox.2010.09.003
- 46. Wu, J.P., Chen, X.Y., Si-Kang, W., et al. (2018) Dechlorane Pl218-225us Flame Retardant in a Contaminated Frog Species: Biomagnification and Isomer-Specific Transfer from Females to Their Eggs. Chemosphere, 211, 218-225.
- 47. Ren, G.F., Luo, X.F., Sheng-Tao, M.A., et al. (2011) Quantification of Dechlorane plus in Human Serum by Gas Chromatography Coupled with Negative Chemical Ionization Mass Spectrometry. Chinese Journal of Analytical Chemistry, 39, 235-238. https://doi.org/10.1016/S1872-2040(10)60418-5
- 48. Hoh, E., Zhu, L. and Hites, R.A. (2006) Dechlorane plus, a Chlorinated Flame Retardant, in the Great Lakes. Environmental Science & Technology, 40, 1184-1189. https://doi.org/10.1021/es051911h
- 49. Gauthier, L.T., Hebert, C.E., Weseloh, D.V., et al. (2007) Current-Use Flame Retardants in the Eggs of Herring Gulls (Larusargentatus) from the Laurentian Great Lakes. Environmental Science & Technology, 41, 4561-4567. https://doi.org/10.1021/es0630487
- 50. Qiu, X., Marvin, C.H. and Hites, R.A. (2007) Dechlorane plus and Other Flame Retardants in a Sediment Core from Lake Ontario. Environmental Science & Technology, 41, 6014-6019. https://doi.org/10.1021/es070810b
- 51. Sverko, E., Tomy, G.T., Marvin, C.H., et al. (2008) The Relationship between Caregiver Burden, Caregivers’ Perceived Health and Their Sense of Coherence in Caring for Elders with Dementia. Journal of Clinical Nursing, 17, 790-799. https://doi.org/10.1111/j.1365-2702.2007.02066.x
- 52. Qiu, X. and Hites, R.A. (2008) Dechlorane plus and Other Flame Retardants in Tree Bark from the Northeastern United States. Environmental Science & Technology, 42, 31-36. https://doi.org/10.1021/es072039a
- 53. Ren, N., Sverko, E., Li, Y.F., et al. (2008) Levels and Isomer Profiles of Dechlorane plus in Chinese Air. Environmental Science & Technology, 42, 6476-6480. https://doi.org/10.1021/es800479c
- 54. Ren, G., Yu, Z., Ma, S., et al. (2009) Determination of Dechlorane plus in Serum from Electronics Dismantling Workers in South China. Environmental Science & Technology, 43, 9453-9457. https://doi.org/10.1021/es901672m