Bioprocess
Vol.08 No.02(2018), Article ID:25325,8
pages
10.12677/BP.2018.82005
Primary Studies on Fermentation Conditions of the Recombinant Human Keratinocyte Growth Factor-2
Shiming Yang1, Bo Liang2, Xinxing Wang2, Hong Feng1*
1College of Life Sciences, Sichuan University, Chengdu Sichuan
2Chengdu Farwits Biotechnology Co., Ltd., Chengdu Sichuan

Received: May 12th, 2018; accepted: May 31st, 2018; published: Jun. 7th, 2018

ABSTRACT
The human keratinocyte growth factor-2 (hKGF-2) plays an important role in the proliferation of epithelial cells and wounding repairing, and then showing great application prospective in clinic therapeutics and cosmetic industry. Therefore, large-scale production and preparation of rhKGF-2 becomes a pre-requisite for the commercial exploitation. In this study, optimal fermentation conditions of the genetic engineering E. coli [Pet26b/KGF-2/BL(DE)21] that can recombinantly express the rhKGF-2, have been studied in the flasks by the orthogonal experiment design, including the medium components (glucose, tryptone, yeast extract and pH). The optimal conditions for the cell growth and rhKGF-2 expression were obtained as: glucose 10 g/L, tryptone 20 g/L, yeast extract 10 g/L, and induction time 5-6 h. Based on these data, fed-batch fermentation was carried out on the BLBIO-15SIA automatic fermenter. The dissolved oxygen concentration was maintained around 20%; and the recombinant cells were harvested at 4 h after IPTG induction. An average cell biomass was approximately 100 g/L (DCW) and the expression level of rhKGF-2 protein was achieved by about 30% of the whole-cell proteins. This result might be helpful for development of the pilot-scale fermentation of rhKGF-2.
Keywords:Human Keratinocyte Growth Factor-2, Recombinant Expression, Fermentation Conditions, Orthogonal Experiment
重组人角质细胞生长因子-2工程菌的发酵条件研究
杨诗明1,梁波2,王新星2,冯红1*
1四川大学,生命科学学院,四川 成都
2成都远睿生物技术有限公司,四川 成都

收稿日期:2018年5月12日;录用日期:2018年5月31日;发布日期:2018年6月7日

摘 要
人角质细胞生长因子-2对烧伤、割伤等造成的皮肤损伤具有良好的促进修复和愈合功能,在临床、化妆品等方面具有极大的应用潜力。为此,人角质细胞生长因子-2的规模化生产和制备成为开发应用的一项重要前提。本文利用正交实验设计,在摇瓶条件下优化了培养基组分和pH等培养条件对大肠杆菌工程菌细胞生长和重组人角质细胞生长因子-2重组表达的影响。结果表明工程菌生长及表达的最优培养基组分和条件确定为葡萄糖10 g/L、蛋白胨20 g/L、酵母提取物10 g/L、pH7.5及IPTG诱导时间5~6 h。最后,在100升的BLBIO-15SIA发酵罐中以优化的发酵条件进行了3个独立批次的发酵实验,工程菌的生物量达到100 g/L (DCW)、重组人角质细胞生长因子-2表达量占全细胞总蛋白约为30%。这些结果为进一步中试开发奠定了基础。
关键词 :人角质细胞生长因子-2,重组表达,发酵条件,正交实验设计

Copyright © 2018 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
角质细胞生长因子-2 (keratinocyte growth factor-2,KGF-2),又名成纤维细胞生长因-10 (FGF-10),属成纤维细胞生长因子超家族的成员。1997年,Emoto等 [1] 首先分离到人KGF-2的cDNA,编码208个氨基酸残基组成的单链多肽,其中N-端40个氨基酸残基组成信号肽序列,成熟的人KGF-2相对分子质量约为19.3 kD。它特异性作用于上皮细胞的成纤维细胞生长因子受体(FGFR-2b),对烧伤、溃疡、切割伤的修复与再生比其他生长因子具有更显著的促进愈合和减少瘢痕的作用 [2] [3] ;并且对体外培养的人角膜上皮细胞有明显的促生长作用;可提高辐射后小鼠肠干细胞的存活率;对辐射引起气道上皮细胞的通透性升高具有拮抗作用,可以加速辐射诱导的DNA损伤的修复;此外,还对维持细胞骨架蛋白F-肌纤蛋白的稳定和保护细胞间连接具有重要作用 [4] [5] [6] [7] [8] 。因此,KGF-2很有希望发展成为临床上多功能的生物制剂。
鉴于KGF-2潜在的应用前景,应用基因工程技术重组表达和制备KGF-2已取得了一些进展,目前已经能够在大肠杆菌中可溶性重组表达具备生物学活性的KGF-2 [9] [10] [11] 。为了开发生产KGF-2重组蛋白,成都远睿生物技术有限公司根据KGF-2成熟肽的编码序列及其特点,利用大肠杆菌密码子的偏爱性设计、合成了编码人KGF-2的基因序列,然后将KGF-2基因克隆到大肠杆菌表达载体pET26b中,最后在大肠杆菌中成功地表达出可溶性的重组人角质细胞生长因子-2 (rhKGF-2)。在此基础上,本文对表达rhKGF-2的大肠杆菌工程菌的生长条件与表达规律进行了的探索,使rhKGF-2重组蛋白在大肠杆菌工程菌中的表达量提高到30%,为确立生产rhKGF-2的发酵工艺奠定了基础。
2. 材料方法
2.1. 材料
2.1.1. 菌株与试剂
大肠杆菌工程菌[pET26b/KGF-2/BL(DE)21]由成都远睿生物技术有限公司构建并保存,胰蛋白胨和酵母提取物购自英国Oxoid公司,异丙基β-D-硫代半乳糖苷(IPTG)购自美国Sigma公司,其它试剂均为国产分析纯。
2.1.2. 主要仪器
BLBIO-15SIA发酵罐(上海百仑),HZO-OX全温振荡器(哈尔滨东联电子技术开发有限公司),φ 10 pH meter (梅特勒,瑞士),GS-700 Imaging Densitometer (Bio-Rad,意大利),721分光光度计(上海第三分析仪器厂)。
2.1.3. 培养基
种子培养基:LB培养基,其配方含胰蛋白胨10 g/L,酵母提取物5 g/L,NaCl 5 g/L,发酵时加入浓度为0.1 g/L的氨苄青霉素;发酵培养基:胰蛋白胨20 g/L,酵母提取物10 g/L,NaCl 5 g/L,K2HPO4 3.5 g/L,KH2PO4 6.0 g/L,MgSO4 3.5 g/L,葡萄糖10 g/L,微量金属元素2 mL/L (每升微量金属元素含1.9 g CuSO4,0.012 g Na2MoO4,0.5 g硼酸,0.012 g AlCl3,0.0144 g ZnCl2,0.162 g FeCl3,0.006 g CaCl2)。
2.2. 方法
2.2.1. 种子液制备
将保存于甘油中的大肠杆菌工程菌划线接种于LB琼脂平板上(含0.1 g/L氨苄青霉素),37˚C过夜培养。然后从平板上挑取单菌落,接种于5 mL LB中;在37˚C、220 r/min培养12 h。最后,按2%接种量扩种到100 mL LB中,继续在37˚C、220 r/min条件下培养至对数生长期,4˚C保存。
2.2.2. 发酵培养基的优化
发酵培养基的组分对工程菌的生长和目的蛋白的表达往往产生较大的影响。因此,以发酵培养基为基础,选定胰蛋白胨、酵母提取物、葡萄糖及培养基pH值等4个因素,进行了三个水平的正交试验L9(34)。其因素和水平见表1。
2.2.3. 菌体密度测定
在特定时间,从大肠杆菌工程菌培养物中取样,适当稀释后用721分光光度计在波长600 nm处读取光密度值(A600),以此表示菌体生长的细胞密度。
2.2.4. 重组蛋白表达量的测定
在不同时间,分别取1 mL培养的菌液,8000 rpm离心收集菌体,加入上样缓冲液,沸水处理5 min,
Table 1. Levels of medium factors in orthogonal test design
表1. 正交试验各因素及水平设计
进行SDS-PAGE(凝胶浓度15%)电泳,染色后根据rhKGF-2重组蛋白条带所占全细胞总蛋白的百分比(%)表示目的蛋白的相对表达量。即将考马斯亮蓝染色的电泳凝胶用Bio-Rad GS-700扫描仪扫描,用Molecular Analyst软件对条带进行处理,计算目的蛋白条带的相对含量。
3. 结果与讨论
3.1. 基因工程菌的生长和诱导时间对目的蛋白表达的影响
大肠杆菌工程菌在LB摇瓶培养中的生长曲线见图1。当菌体培养3 h后,A600约0.5,此时进入对数生长期;在不加IPTG诱导时,A600在7 h达到3.9。此时,细胞生长的对数期结束,进入稳定期。当A600达到1.0左右时(培养时间4 h),在无菌条件下取出100 mL培养物,加入IPTG诱导表达,然后每隔l h取样,测定菌体密度和目的蛋白的相对表达量。当诱导5 h时后,目的蛋白rhKGF-2的表达量达到最大、此时约占全细胞总蛋白的21%,6 h后表达量基本保持稳定(图1,图2)。因此,摇瓶发酵表明rhKGF-2重组蛋白启动诱导表达的时间为4 h左右,最适诱导表达时间为5~6 h。
3.2. 发酵培养基的优化
为了进一步优化rhKGF-2重组蛋白表达的发酵条件,采用摇瓶正交试验优化了葡萄糖、胰蛋白胨、酵母提取物的不同浓度及培养基初始pH值对大肠杆菌工程菌细胞的生长和rhKGF-2蛋白重组表达的影响。实验结果如图3 (1~9道),正交实验的9个组合实验中目标蛋白(rhKGF-2)的表达水平存在差异。定量后,将9个实验组合的蛋白相对表达量以及工程菌细胞的生长密度归纳于图4,结果显示各因素对rhKGF-2蛋白重组表达和菌体生长影响的作用大小依次为:pH值>酵母提取物>胰蛋白胨>葡萄糖;而且细胞密度与重组蛋白的表达水平呈正比。在此实验条件下,正交实验设定的酵母提取物和胰蛋白胨的最高水平(20 g/L)效果最好,说明充足的氮源不仅促进大肠杆菌细胞生长,也能支撑重组蛋白高水平表达。相反,过高的碳源,如20 g/L葡萄糖反而抑制细胞的生长和重组蛋白的表达。但当葡萄糖浓度过低时,也会导致细菌生长和外源表达所需碳源和代谢能量不足。因此,在大肠杆菌的培养基中添加适量的葡萄糖可以加快工程菌的生长速率,并缩短发酵周期。但要注意“葡萄糖效应”对目的蛋白表达的影响 [12] [13] ,高浓度

Figure 1. Growth curve of engineering E. coli and rhKGF-2 expression level
图1. 工程菌的生长曲线和rhKGF-2的表达水平

Figure 2. SDS-PAGE analysis of rhKGF-2 expression levels at various times after induction. Lane 0, 1, 2, 3, 4, 5, 6 indicating the time (h) after induction, M, Standard protein marker; Arrow indicating the target protein rhKGF-2.
图2. rhKGF-2在不同诱导时间的表达
的葡萄糖可能导致大肠杆菌发酵产生乙酸等“杂物”,并抑制重组蛋白的表达 [14] 。所以,在发酵过程中应控制葡萄糖的浓度,减少有机酸的生成,从而促进工程菌细胞的生长,并提高外源蛋白的表达水平。通过上述分析和实验结果,归纳总结出rhKGF-2重组表达的最佳培养基组合为:胰蛋白胨20 g/L、酵母提取物10 g/L,葡萄糖10 g/L,pH7.5。为了验证正交试验得出的优化条件,以此条件进行了3次独立的重复试验,结果显示大肠杆菌工程菌的细胞生长和rhKGF-2的表达量(图4,10~12道)均略高于正交试验中的9个试验组合(图4,1~9道),三次独立实验中rhKGF-2重组蛋白的相对表达量平均接近25%,细胞密度达到4.0左右。
3.3. 发酵罐放大实验
在摇瓶条件下,采用正交试验得到了优化的培养基组合(胰蛋白胨20 g/L、酵母提取物10 g/L、葡萄糖10 g/L、pH7.5)。以此为条件,在100 L的发酵罐中进行了放大试验。图5显示在此发酵过程中大肠杆菌工程菌细胞的生长密度和溶氧之间的关系。据报道,在含葡萄糖的大肠杆菌发酵培养基中,细菌的比生长率(μ)高,乙酸的产率也高,当大肠杆菌的比生长率超过临界值就会伴随乙酸的产生,乙酸浓度过大,将抑制目的蛋白的重组表达 [14] 。因此,在工业发酵过程中,采用合理的操作方式(如恒速补料、变速补料等)可以控制葡萄糖的有效浓度。此外,通过提高搅拌速度和通气,以及及时补充细胞生长所需的营养物质,也能延长细胞的对数生长期,降低乙酸浓度。从而提高菌体密度,保证目的蛋白的高效表达。由于自动化的发酵罐有利于控制各种发酵参数,如增加搅拌和通气,因此比摇瓶发酵更能满足工程菌对氧气和营养的需求,所以发酵罐往往能够得到比摇瓶发酵更好的效果 [10] 。图6显示在BLBIO-15SIA发酵罐中进行的3次独立发酵rhKGF蛋白重组表达的结果。经测算,大肠杆菌工程菌的细胞生物量平均达到约100 g/L (DCW),rhKGF-2重组蛋白占全细胞总蛋白约30%,分别超过和达到以往的研究结果 [9] [11] 。
4. 结论
大肠杆菌工程菌的发酵过程可分为两个阶段:即菌体生长培养阶段和IPTG诱导重组表达阶段。一般在细胞生长培养阶段,通过添加足够的营养物质和设置优化的培养条件,可促进工程菌的细胞生长,提高菌体密度,为重组表达奠定基础。当加入IPTG后,细胞继续生长,并转入诱导重组蛋白的高效表达。

Figure 3. SDS-PAGE analysis of rhKGF-2 expression levels in various treatments of orthogonal test design. Lane 1, 2, 3, 4, 5, 6, 7, 8 and 9 represent the whole cell protein of post-induction, respectively, Lane 0 indicating the pre-induction.
图3. 正交试验不同处理rhKGF-2表达水平的电泳分析

Figure 4. Effects of medium components on bacterial growth and rhKGF-2 expression
图4. 培养基组份对工程菌生长和rhKGF-2表达水平的影响
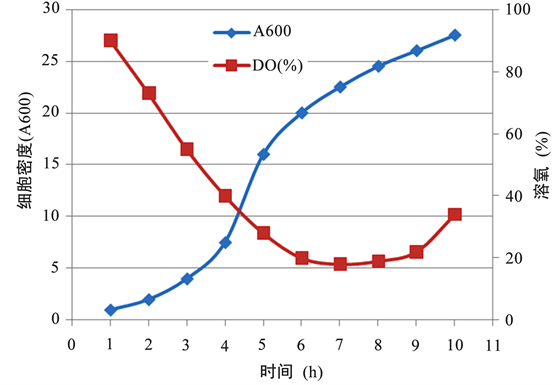
Figure 5. The relationship between the cell density and oxygen consumption in the BLBIO-15SIA fermenter
图5. BLBIO-15SIA发酵过程中工程菌生长的细胞密度(A600)与溶氧(%)之间的关系

Figure 6. SDS-PAGE analysis of rhKGF-2 expression levels of three dependent experiments in the BLBIO-15SIA fermenter
图6. 在BLBIO-15SIA发酵罐中三批发酵实验的rhKGF-2表达水平的电泳分析
本实验通过摇瓶正交试验,优化获得了rhKGF-2重组表达的培养基组合:即胰蛋白胨20 g/L,酵母提取物10 g/L,葡萄糖10 g/L,pH7.5,目的就是期望获得高密度细胞和重组蛋白高效表达的发酵参数。采用此优化条件,用BLBIO-15SIA发酵罐进行的放大实验中,取得了菌体生物量约100 g/L (DCW)、rhKGF-2重组蛋白的相对表达量约30%的发酵水平,均超过了摇瓶发酵的实验,为重组人角质细胞生长因子-2的中试和生产奠定了基础。
基金项目
本研究由成都远睿生物技术有限公司资助。
文章引用
杨诗明,梁波,王新星,冯红. 重组人角质细胞生长因子-2工程菌的发酵条件研究
Primary Studies on Fermentation Conditions of the Recombinant Human Keratinocyte Growth Factor-2[J]. 生物过程, 2018, 08(02): 40-47. https://doi.org/10.12677/BP.2018.82005
参考文献
- 1. Emoto, H., Tagashira, S., Matte, M.G., et al. (1997) Structure and Expression of Human Fibroblast Growth Factor-10. Journal of Biological Chemistry, 272, 23191-23194. https://doi.org/10.1074/jbc.272.37.23191
- 2. Xia, Y.P., Zhao, Y., Marcus, J., et al. (1999) Effects of Keratinocyte Growth Factor-2 (KGF-2) on Wound Healing in an Ischaemia Impaired Rabbit Ear Model and on Scar Formation. Journal of Pathology, 188, 431-438. https://doi.org/10.1002/(SICI)1096-9896(199908)188:4<431::AID-PATH362>3.0.CO;2-B
- 3. Smith, P.D., Polo, M., Soler, P.M., et al. (2000) Efficacy of Growth Factors in the Accelerated Closure of Interstices in Explanted Meshed Human Skin Grafts. Journal of Burn Care & Rehabilitation, 21, 5-9. https://doi.org/10.1097/00004630-200021010-00003
- 4. Kaye, J.A. (1998) FDA Licensure of NEUMEGA to Prevent Severe Chemotherapy-Induced Thrombocytopenia. Stem Cells, 16, 207-223. https://doi.org/10.1002/stem.5530160724
- 5. Jimenez, P.A. and Rampy, M.A. (1999) Keratinocyte Growth Factor-2 Ac-celerates Wound Healing in Incisional Wounds. Journal of Surgical Research, 81, 238-242. https://doi.org/10.1006/jsre.1998.5501
- 6. Miceli, R., Hubert, M., Santiago, G., et al. (1999) Efficacy of Keratinocyte Growth Factor-2 in Dextran Sulfate Sodium Induced Murine Colitis. Journal of Pharmacology & Experimental Therapeutics, 290, 464-471.
- 7. 王小华, 余争平, 程天民. 角质细胞生长因子及其辐射防护作用[J]. 国外医学放射医学核医学分册, 1999(5): 233-235.
- 8. 钟兴武, 龚向明. 角质细胞生长因子促进角膜上皮损伤修复的研究[J]. 中华眼科杂志, 1998(1): 15-18.
- 9. 马雁冰, 李擎, 谢天宏, 等. 重组人角质细胞生长因子-2基因克隆、表达、纯化与活性分析[J]. 中国生物化学与分子生物学报, 2001, 17(6): 761-765.
- 10. 田海山, 唐禄, 王晓杰, 等. 重组人角质细胞生长因子-2基因的克隆、表达及活性[J]. 吉林大学学报(理学版), 2011, 49(6): 1150-1156.
- 11. 孙卫国, 张灵霞, 熊志红, 等. 人角质细胞生长因子2在不同原核表达系统中的表达差异[J]. 生物技术通讯, 2014, 25(5): 669-671.
- 12. Luli, G.W. and Strohl, W.R. (1990) Comparison of Growth, Acetate Production, and Acetate Inhibition of Escherichia coli Strains in Batch and Fed-Batch Fermentations. Applied & Environmental Microbiology, 56, 1004-1011.
- 13. Doelle, H.W., Ewings, K.N. and Hollywood, N.W. (1982) Regulation of Glucose Metabolism in Bacterial Systems. Advances in Biochemical Engineering, 23, 1-35. https://doi.org/10.1007/3540116982_1
- 14. Han. K., Lim, H.C. and Hong, J. (1992) Acetic Acid Formation in Escherichia coli Fermentation. Biotechnology & Bioengineering, 39, 663-671. https://doi.org/10.1002/bit.260390611
NOTES
*通讯作者。
