World Journal of Cancer Research
Vol.04 No.01(2014), Article ID:12938,6
pages
10.12677/WJCR.2014.41002
Synergistic Cytotoxic Effect of Anti-EGFR/Gelonin Immunotoxin Combined with Taxol Anti-Tumor Effects and Its Mechanism*
Nongyu Huang, Xikun Zhou, Ji Qiu, Zhen Wang, Jiong Li
State Key Laboratory of Biotherapy, West China Hospital, Sichuan University, Chengdu
Email: hnyu-001015@163.com
Copyright © 2014 Nongyu Huang et al. This is an open access article distributed under the Creative Commons Attribution License, which permits unrestricted use, distribution, and reproduction in any medium, provided the original work is properly cited. In accordance of the Creative Commons Attribution License all Copyrights © 2014 are reserved for Hans and the owner of the intellectual property Nongyu Huang et al. All Copyright © 2014 are guarded by low and by Hans as a guardian.
Received: Nov. 8th, 2013; revised: Nov. 14th, 2013; accepted: Nov. 22nd, 2013



ABSTRACT
Abstract: Objective: This study was designed to determine whether an anti-EGFR/gelonin immunotoxin (E/rG) in combination with Taxol was against EGFR-expressing tumor xenografts, and investigated the possible mechanisms of synergistic effect. Methods: The in vitro activity of E/rG immunotoxin in combination with Taxol against the EGFR-expressing cell lines was evaluated using cytotoxicity assays. The anti-tumor activity of this combination was evaluated in nude mice bearing A549 tumor xenografts, measured the anti-tumor effect of the drug combination. EGFR ELISA kits analyzed the expression of EGFR of Serum and Extracellular fluid (ECF) in nude mice. Results: In vitro studies failed to show the synergy of E/rG immunotoxin plus Taxol against the EGFR-expressing cells. In contrast, in vivo setting, there was a marked synergy when E/rG Immunotoxin was combined with Taxol for the treatment of A549 tumor xenografts. The ELISA results showed the low concentration of EGFR of serum and ECF in nude mice treated Taxol. Conclusion: There was synergistic effect in vivo but not in vitro with anti-EGFR/gelonin Immunotoxin combined Taxol. We propose that synergy is due to the Taxol-induced fall in shed EGFR levels, improved the rate that E/rG Immunotoxin targeted to the tumor. This combination could be potentially useful for the treatment of human cancers that express EGFR and are responsive to E/rG Immunotoxin therapy.
Keywords:Anti-EGFR/Gelonin Immunotoxin; Taxol; EGFR; Tumor; Synergistic Effect
抗EGFR单链抗体融合Gelonin免疫毒素与紫杉醇协同 抗肿瘤作用及机制研究*
黄浓郁,周西坤,邱 吉,王 振,李 炯
四川大学华西医院生物治疗国家重点实验室,成都
Email: hnyu-001015@163.com
收稿日期:2013年11月8日;修回日期:2013年11月14日;录用日期:2013年11月22日
摘要
目的:研究抗EGFR单链抗体融合gelonin免疫毒素(E/rG)与紫杉醇是否具有协同抗肿瘤作用,进一步探讨两种药物联合作用产生协同效应的机制。方法:在体外实验中,利用MTT方法研究两种药物联合抑制EGFR阳性癌细胞的生物学效应;在体内试验中,建立人肺癌A549细胞裸鼠移植瘤模型,两种药物联合治疗评价两者的协同抗肿瘤作用。利用ELISA检测紫杉醇单独给药治疗后小鼠血清和肿瘤ECF中的EGFR水平。结果:在体外未检测到E/rG免疫毒素与紫杉醇的协同作用,在体内检测到两种药物具有显著的协同作用。ELISA检测结果显示紫杉醇治疗能够降低小鼠血清和肿瘤ECF中的EGFR水平。结论:在体外实验中,未发现两种药物协同抑制肿瘤细胞生长的作用,而在体内实验中,两种药物具有显著的协同抗肺癌肿瘤作用,其作用机制是紫杉醇给药后降低了小鼠血液中和肿瘤组织间隙液中的游离EGFR含量,减少了游离EGFR对免疫毒素的靶向抗肿瘤作用的影响。为抗EGFR单链抗体融合gelonin免疫毒素临床使用方案具有重要的指导意义。
关键词 ::抗EGFR单链抗体融合Gelonin免疫毒素;紫杉醇;表皮生长因子受体;肿瘤;协同作用

1. 引言
免疫毒素是由具有导向能力的载体(抗体或细胞因子)和具有细胞毒性的分子(毒素)偶联而成的具有特异性细胞杀伤能力的杂合分子,是一种靶向药物,又称“生物导弹”[1]。免疫毒素的靶向杀伤作用使其广泛应用于肿瘤的治疗。重组免疫毒素,是通过基因重组技术,经表达和纯化制备后制备的能够特异性靶向杀伤肿瘤细胞的毒素蛋白,具有广阔的应用前景[2-4]。表皮生长因子受体(epithelial growth factor receptor,EGFR)是一种酪氨酸激酶受体,属于人表皮生长因子受体(HER)家族中的一员。EGFR在肿瘤细胞的生长、修复和存活等方面发挥重要作用,在许多上皮性肿瘤中EGFR可以被异常活化,与肿瘤发生发展及预后相关[5],抑制EGFR的信号传导途径可以显著抑制肿瘤的生长。已有的抗EGFR单抗的作用机理主要是与EGFR的胞外段特异结合,阻止其和配体结合,阻断细胞内信号转导途径,从而抑制癌细胞的增殖,诱导癌细胞凋亡,减少基质金属蛋白酶和血管内皮生长因子的产生。在先前的研究中[6,7],我们将抗EGFR单链抗体基因与Gelonin毒素基因进行融合表达,制备的抗EGFR单链抗体融合gelonin免疫毒素(anti-EGFR /gelonin Immunotoxin, E/rG),和单独的gelonin毒素相比,显示出对EGFR过表达肿瘤细胞特异性的杀伤能力。紫杉醇(Taxol)作为广谱抗肿瘤药物对于多种临床恶性肿瘤治疗具有显著的疗效。该研究拟在前期实验结果的基础上,对抗EGFR免疫毒素E/rG与紫杉醇(Taxol)的联合抗肿瘤作用及机制进行深入的探讨。
2. 材料与方法
2.1. 材料
裸鼠(雌性18~20 g重、4~5周龄):购自北京华阜康生物科技股份有限公司,所用的动物都是SPF级别。人非小细胞肺癌H460、H1975、A549和HCC827细胞株:均购自ATCC,本实验室保存。紫杉醇:购自sigma公司,使用时6 mg/ml紫杉醇以1:5比例稀释至0.9%氯化钠中;抗EGFR单链抗体融合gelonin免疫毒素:本实验室自制;MTT:购自Sigma公司;细胞培养基:均购自Gibco公司;EGFR ELISA试剂盒:购自美国R&D公司。MK3酶标仪为美国赛默飞世尔公司产品。
2.2. 方法
2.2.1. 细胞培养及处理
人非小细胞肺癌H460、H1975和A549细胞株采用含10%胎牛血清的RPMI 1640培养基(内含100 U/ml青霉素,100 μg/ml链霉素)。HCC827细胞采用含10%胎牛血清的DMEM培养基(内含100U/ml青霉素,100 μg/ml链霉素),在37℃,5% CO2的恒温孵箱中培养。
2.2.2. MTT细胞毒性检测
取对数生长期H460、H1975、A549和HCC827细胞,并调整每1 ml 含2.0 × 104个/ml的单细胞悬液,每孔100 μl接种于96孔板中,于37℃、5%二氧化碳培养箱培养。24 h后将E/rG免疫毒素和Taxol单独或联合按终浓度所需溶于100 μl培养液加入96孔板,每一浓度设3个复孔,同时设立空白对照组。继续培养72 h。在每孔加入MTT溶液20 μl,4 h后,再向上述各孔加10% SDS 100 μl,混合均匀后,培养过夜,次日放入酶标仪,以630 nm为参比波长,于波长570 nm处测定吸收光度,记录测定结果。
2.2.3. 细胞毒性试验药物联合作用评价
采用两药相互作用指数(coefficient of drug interaction, CDI)评价两药相互作用性质,按下列公式计算:CDI = AB/(A × B),根据肿瘤细胞存活率进行计算,AB为两药联合组的肿瘤细胞存活率;A或B是各药物单独使用组肿瘤细胞存活率。当CDI < 1时,两药作用性质为协同;当CDI < 0.7时,协同作用显著;CDI = 1,则两药的作用性质为相加;CDI > 1,则两药作用性质为拮抗[8]。
2.2.4. 小鼠皮下瘤模型
收集对数生长期的A549细胞,1500 rpm离心3分钟,细胞沉淀用1640双无培养基洗涤3次,最终调整浓度为1 ml培养液中含肿瘤细胞1 × 108个。无菌条件下送到动物室,将细胞悬液接种到各小鼠右侧背部皮下100 μl。每天观察荷瘤裸鼠的饮食情况和精神状态,隔三天测量一次肿瘤大小(体积V = π/6 × 肿瘤长 × 肿瘤宽2)及裸鼠体重。当肿瘤体积达到80~100 mm3时,开始给药治疗。单纯Taxol组给药剂量20 mg/kg,静脉注射,每隔6天给药1次,共2次;单独E/rG免疫毒素组给药剂量为20 mg/kg,静脉注射,每隔3天给药1次,共4次;联合给药组Taxol 20 mg/kg静脉注射,每隔6天给药1次,共2次,E/rG免疫毒素20 mg/kg,静脉注射,每隔3天给药1次,共4次;NS组皮下注射100 μl 0.9%氯化钠做空白对照。同样每天观察荷瘤裸鼠的饮食情况和精神状态,隔三天测量一次肿瘤体积大小和裸鼠体重,当肿瘤体积达到1000 mm3时,处死小鼠。肿瘤抑制率(Tumor weight Inhibition, TWI)计算公式:TWI% = 100-T:C%,T(给药组裸鼠平均体积),C(对照组裸鼠平均体积),金正均法[9]计算q值来评价两药合用的效果,q = (EA + B)/[EA + (l-EA) × EB],EA + B为两药合用时的抑瘤率,EA和EB为各药单独应用时的抑瘤率。Q < 0.85表示两药有拮抗作用,0.85 ≤ q ≤ 1.15表示两药有相加作用,q > 1.15表示两药有协同作用。
2.2.5. 肿瘤间隙液中EGFR检测
同2.2.4.步骤,建立小鼠A549细胞肿瘤模型,当肿瘤体积达到80~100 mm3时,Taxol组给药剂量20 mg/kg,NS组皮下注射100 μl 0.9%氯化钠做空白对照。第五天后,处死小鼠分离血清,取下空白对照和Taxol组肿瘤,通过离心获得肿瘤间隙液(Extracellular fluid, ECF),ELISA检测小鼠血清和ECF中EGFR的含量。用EGFR ELISA试剂盒检测小鼠血清和ECF中的EGFR的含量。将样品对应微孔按序编号,每板应设阴性对照2孔、阳性对照2孔、空白对照1孔(空白对照孔不加样品及酶标试剂,其余各步操作相同)分别在阴、阳性对照孔中加入阴性对照、阳性对照50 μl。然
后在待测样品孔先加样品稀释液40 μl,然后再加待测样品10 μl。加样将样品加于酶标板孔底部,尽量不触及孔壁,轻轻晃动混匀。用封板膜封板后置37℃温育30分钟。小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30秒后弃去,如此重复5次,拍干。每孔加入酶标试剂50 μl,空白孔除外,37℃温育30分钟。再次洗涤最后每孔先加入显色剂A 50 μl,再加入显色剂B 50 μl,轻轻震荡混匀,37℃避光显色15分钟。每孔加终止液50 μl,终止反应。以空白空调零,450 nm波长依序测量各孔的吸光度(OD值)。
2.2.6. 统计学方法
本实验数据采用SPSS15.0 软件进行统计分析,所获数据以(x ± s)表示,多个样本均数比较采用单因素方差分析(One-way ANOVA),当p < 0.05时表明组间差异具有统计学意义,当p < 0.01时表明差异显著。
3. 结果
3.1. 体外协同作用检测
通过用100 nM E/rG免疫毒素和不同浓度的Taxol (详见表1)混合进行对不同肿瘤细胞H460,H1975,A549和HCC827体外抑制试验,表明在上述4种细胞中,两药联合都没有协同作用。如图1所示,联合药物对不同肿瘤细胞的两药相互作用指数都大于1详见表2,在体外没有协同抑制效果。
3.2. 体内检测效应
之前的研究结果表明,E/rG免疫毒素在A549动物模型治疗有效的。为了检测紫杉醇和E/RG免疫毒素联合的治疗效果,我们还用A549动物模型。将肿瘤细胞A549接种到裸鼠体内,当肿瘤体积到80~100 mm3,进行治疗:生理盐水,Taxol、E/rG及两种联合药物,给药后每隔三天测量肿瘤体积。联合给药,Taxol 20 mg/kg静脉注射24小时后,再静脉注射E/rG免疫毒素20 mg/kg,6天给药2次。Taxol共给药2次,E/rG免疫毒素共给药4次。结果如图2和表3所示, 在A549模型中,联合组在第一次给药6天后就显示出协同效果,甚至一直持续到最后一次检测。从实验结果表明Taxol和E/rG免疫毒素联合治疗的效果比单独使用E/rG免疫毒素或Taxol的治疗效果明显。
3.3. 协同作用的机制初步分析
对于E/rG 和Taxol联合治疗在体外不具有而在体内具有协同效应的机制进行了深入的探讨。有研究发现,肿瘤ECF和血液中体内存在从脱离下来的细胞表面受体,且这类游离细胞表面受体会影响免疫毒素进入肿瘤细胞中[10]。我们假设紫杉醇给药后降低了小鼠血液中和肿瘤组织间隙中的游离EGFR,从而减少了其对免疫毒素进入肿瘤的的影响作用,使得出现本
研究中E/rG 和Taxol联合作用在体外不具有而在体内具有协同效应的情况。
为了验证这个假设,用ELISA试剂盒检测了Taxol对荷瘤小鼠血清和ECF中的EGFR表达水平。如图3表明,在A549模型老鼠,经过紫杉醇给药治疗后肿瘤间隙液的EGFR表达量约为9530 pg/ml,Saline组的EGFR表达量约为28000 pg/ml,与Saline组相比具有显著意义,p < 0.01。经过紫杉醇给药治疗后小鼠血清EGFR表达量为900 pg/ml,也低于对照组。
Table 1. In vitro experimental groups according to drug concentration and combination
表1. 体外实验中两种药物的结合浓度
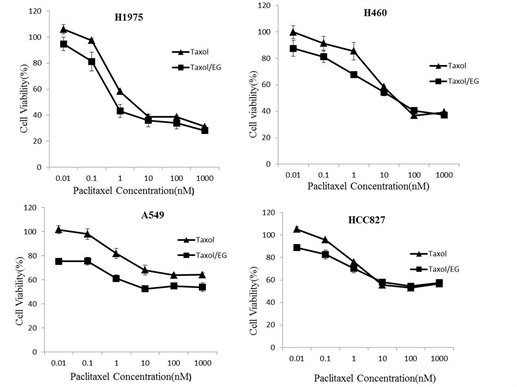
Figure 1. Cultured H460, H1975, A549 and HCC827 cells were treated with various concentrations of Taxol and 100 nM E/rG Immunotoxin and viability was measured with MTT
图1. 用MTT法检测不同浓度的Taxol和100 nM E/rG免疫毒素联合处理H460,H1975,A549和HCC827细胞株协同效应
Table 2. The coefficient of drug interaction (CDI) of E/rG Immunotoxin plus Taxol against the EGFR-expressing cells in vitro
表2. 体外实验中E/rG免疫毒素用于肿瘤细胞的两药相互作用指数

Figure 2. Effect of Taoxl and E/rG immunotoxin on A549 tumors
图2. Taxol和E/rG免疫毒素在A549肿瘤的治疗效应
Table 3. The combination index (q) of E/rG immunotoxin combined with Taxol to treat A549 tumors
表3. A549动物肿瘤模型中联合药物治疗协同系数(q)

Figure 3. Presence of shed EGFR in tumor ECF. Left: EGFR levels in the ECF, Right: EGFR levels in serum
图3. 检测肿瘤间隙液中EGFR表达量。左图为肿瘤间隙液中的EGFR表达量,右图为血清中的EGFR表达量
因此认为,E/rG和Taxol联合作用在体外不具有而在体内具有协同效应可能与Taxol治疗降低ECF和Serum的EGFR水平相关。
4. 讨论
抗体药物在肿瘤靶向治疗中起重要的作用,这些抗体药物包括人源化抗体、完全人抗体,还有抗体偶联物如免疫毒素、放射免疫偶联物、化学免疫偶联物。靶向性差和穿透性差是抗体靶向治疗肿瘤的主要障碍。穿透性差的原因包括:肿瘤血管异常;实体肿瘤的细胞被致密的基质包裹,使抗体难以穿透这一屏障;大多数实体瘤都存在淋巴回流障碍,导致间质内压力升高,阻止了抗体进入实体瘤。而小部分进入实体肿瘤内部的抗体,首先结合到血管附近的肿瘤细胞,无法到达距离血管较远的肿瘤细胞[11-13]。研究表明,抗体药物与化疗药物联合使用可以提高肿瘤的治疗效果[14,15]。因为很多做为肿瘤靶向的肿瘤抗原脱落到血液中,它们在肿瘤组织的浓度很可能很高,可能降低抗体治疗效果,这些治疗包括HER2/neu,EGF receptor,VEGF,CD25,和CD20,如与化学药物联合治疗,能提高治疗效果。目前有很多抗体药物和化学药物联合治疗如:贝伐珠单抗联合厄洛替尼提高结直肠癌疗效[16];口服三重血管激酶抑制剂BIBF 1120联合紫杉醇、卡铂可以有效治疗妇科恶性肿瘤[17]等。
在该研究中,通过体外MTT实验未检测到免疫毒素联合紫杉醇药物协同抑制EGFR阳性肿瘤细胞生长的作用。建立人肺癌A549细胞裸鼠移植瘤模型,免疫药物与紫杉醇联合给药,结果发现体内两种药物具有明显的抗肿瘤协同效应。用特异性的ELISA试剂盒检测发现经紫杉醇给药治疗后的移植瘤模型鼠肿瘤间隙液和血清中的EGFR表达量减少,与Saline组相比具有非常显著性差异(p < 0.01)。因此免疫毒素和紫杉醇联合用药体内具有明显的协同效应而体外检测却没有的现象可能与紫杉醇使用后体内EGFR水平的降低有关。紫杉醇治疗降低了组织间隙液压,杀死肿瘤组织细胞,降低肿瘤体积,促进免疫毒素进入肿瘤组织内[15]。
综上所述,抗EGFR单链抗体融合gelonin免疫毒素和紫杉醇联合在体内具有协同抗肿瘤作用。该研究报道,为抗EGFR单链抗体融合gelonin免疫毒素临床使用方案具有重要的指导意义。
参考文献 (References)
- 1. Hassan, R., Broaddus, V.C., Wilson, S., et al. (2007) Anti-mesothelin immunotoxin SS1P in combination with gemcitabine results in increased activity against mesothelin-expressing tumor xenografts. Clinical Cancer Research, 13, 7166-7171.
- 2. Hsu, C.H., Kang, Y.K., Yang, T.S., et al. (2013) Bevacizumab with erlotinib as first-line therapy in Asian patients with advanced hepatocellular carcinoma: A multicenter phase II study. Oncology, 85, 44-52.
- 3. Kreitman, R.J. (2009) Recombinant immunotoxins containing truncated bacterial toxins for the treatment of hematologic malignancies. BioDrugs, 23, 1-13.
- 4. Li, Y.M. and Hall, W.A. (2010) Targeted toxins in brain tumor therapy. Toxins (Basel), 2, 2645-2662.
- 5. FitzGerald, D.J., Wayne, A.S., Kreitman, R.J., et al. (2011) Treatment of hematologic malignancies with immunotoxins and an-tibody-drug conjugates. Cancer Research, 71, 6300-6309.
- 6. Ira, P., Raffit, H., David, J., et al. (2007) Immunotoxin treatment of cancer. Annual Review of Medicine, 58, 221-237.
- 7. Karamouzis, M.V., Grandis, J.R. and Argiris, A. (2007) Therapies directed against epidermal growth factor receptor in aerodigestive carcinomas. The Journal of the American Medical Association, 298, 70-82.
- 8. 邱吉, 李倩, 李小磊等 (2011) 抗EGFR单链抗体融合gelonin毒素的原核表达载体的构建及其生物活性研究. 四川大学学报(医学版), 42, 621-624.
- 9. Zhou, X., Qiu, J., Wang, Z., et al. (2012) In vitro and in vivo anti-tumor activities of anti-EGFR single-chain variable fragment fused with recombinant gelonin toxin. Cancer Research and Clinical Oncology, 138, 1081-1090.
- 10. 徐淑萍, 孙国平, 王华等 (2006) 丹皮酚增强顺铂对人肝癌细胞SMMC-7721的增殖抑制作用. 安徽医科大学学报, 41, 63-65.
- 11. 金正均 (1980) 合并用药中的相加. 中国药理学报, 1, 70-73.
- 12. Zhang, Y.J., Xiang, L.M., Raffit, H., et al. (2007) Immunotoxin and Taxol synergy results froma decrease in shed mesothelin levels in the extracellular space of tumors. Proceedings of the National Academy of Sciences of the USA, 104, 17099-17104.
- 13. 甄永苏 (2007) 抗体药物与肿瘤靶向治疗. 医学研究杂志, 36, 1-2.
- 14. Chauhan, V.P., Stylianopoulos, T., Boucher, Y., et al. (2011) Delivery of molecular and nanoscale medicine to tumors: Transport barriers and strategies. Annual Review of Chemical and Biomolecular Engineering, 2, 281-298.
- 15. Multhoff, G. and Vaupel, P. (2012) Radiation-induced changes in microcirculation and interstitial fluid pressure affecting the delivery of macromolecules and nanotherapeutics to tumors. Frontiers in Oncology, 15, 165.
- 16. Zhang, Y., Xiang, L., Hassan, R., et al. (2006) Synergistic antitumor activity of Taxol and immunotoxin SS1P in tumor-bearing mice. Clinical Cancer Research, 12, 4695-4701.
- 17. Du Bois, A., Huober, J., Stopfer, P., et al. (2010) A phase I open-label dose-escalation study of oral BIBF 1120 combined with standard paclitaxel and carboplatin in patients with advanced gynecological malignancies. Annals of Oncology, 21, 370-375.
