World Journal of Cancer Research
Vol.
08
No.
04
(
2018
), Article ID:
26767
,
7
pages
10.12677/WJCR.2018.84021
Paclitaxel Combined with TLR7/8 Agonist 3M-052 Inducing the Apoptosis of Mouse Colon Cancer CT26 Cells
Wending An, Jianqin Mao, Yun Lin, Zirui Zheng*
Zhejiang HISUN Pharmaceutical CO., LTD, Taizhou Zhejiang

Received: Aug. 17th, 2018; accepted: Sep. 4th, 2018; published: Sep. 11th, 2018

ABSTRACT
Objective: To investigate the effect and mechanism of paclitaxel combined with Toll-like receptor 7/8 agonist 3M-052 on the apoptosis of mouse colon cancer CT26 cells. Methods: CT26 cells were treated with different concentrations of 3M-052 and PTX. The cell viability was measured after 24 h, and the synergistic concentration of PTX and 3M-052 was analyzed. The expression of Bax, Bcl-2, active-Caspase3 and cleaved-PARP I in CT26 cells were detected by Western blot. Results: 3M-052 could induce TNF-α production in mouse PBMC. Exclusive or combined use of 3M-052 and PTX could up-regulate the proportion of Bax/Bcl-2 in cells, promote the shearing of Caspase3 and PARP I protein, therefore induce cell apoptosis. Conclusion: Both 3M-052 and PTX can promote the apoptosis of CT26 cells, and inhibit its proliferation, while the effect would be better when combined.
Keywords:Paclitaxel, 3M-052, Drug Combination, Colon Cancer, Apoptosis
紫杉醇联合TLR7/8激动剂3M-052诱导小鼠结肠癌CT26细胞凋亡的研究
安稳定,毛剑琴,林赟,郑子瑞*
浙江海正药业股份有限公司,浙江 台州

收稿日期:2018年8月17日;录用日期:2018年9月4日;发布日期:2018年9月11日

摘 要
目的:探讨紫杉醇联合Toll样受体7/8激动剂3M-052诱导小鼠结肠癌CT26细胞凋亡的作用及其机制。方法:使用不同浓度的3M-052和PTX联合处理CT26细胞,24 h后检测细胞活力,分析PTX与3M-052协同作用的浓度;并采用Western blot法检测CT26细胞中的Bax、Bcl-2、active-Caspase3以及cleaved-PARP I的表达情况。结果:3M-052可以明显上调小鼠PBMC分泌的TNF-α;3M-052与PTX单药或联用时均可上调Bax/Bcl-2比例,促进Caspase3活化,增强PARP I蛋白剪切,最终导致细胞凋亡。结论:3M-052或PTX单独使用均可促进CT26细胞凋亡,抑制其增殖,联用时效果更佳。
关键词 :紫杉醇,3M-052,联合用药,结肠癌,凋亡

Copyright © 2018 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
结肠癌是常见的发生于结肠部位的消化道恶性肿瘤。在我国,结肠癌的发病率和死亡率正呈上升趋势 [1],五年生存率仅为57.6%,低于韩国、日本等东亚国家 [2]。早期结肠癌可以通过手术根治,但是结肠癌早期症状多不明显,常被漏诊,仍有很多患者会进展到晚期,因此研究及寻找新的治疗方案具有重要的临床意义。
紫杉醇(Paclitaxel,PTX,商品名Taxol)是植物红豆杉的树皮中提取得到的一种具有广谱抗癌作用的抗微管药物,曾被称为“晚期癌症的最后一道防线”,在临床上作为一线药物用于卵巢癌、乳腺癌等的治疗,其对结肠癌 [3][4]等恶性肿瘤也有一定治疗效果。3M-052由3M Drug Delivery System Division公司设计的一种新型Toll样受体7/8 (toll-like receptor 7/8, TLR7/8)双重激动剂,它通过靶向于TLR 7和TLR 8来激活多种天然免疫细胞,从而使机体产生更强的免疫反应,达到抗肿瘤的效果,有望成为新一代抗肿瘤药物 [5]。本文旨在研究紫杉醇联合3M-052诱导小鼠结肠癌CT26细胞凋亡的作用及其机制。
2. 材料与方法
2.1. 主要试剂及细胞株
小鼠结肠癌CT26细胞株购自国家实验细胞资源共享平台;紫杉醇原料药(API)由浙江海正药业生产;3M-052由3M Drug Delivery System Division公司设计,结构式已公布,购自MedKoo Bioscience,Inc (CAT#527,804);1640培养基购自Gibco公司(22,400-089);胎牛血清购自Gibco公司(10,099-158);胰蛋白酶购自Sigma公司(59,428C);淋巴细胞分离液Percoll购自Sigma公司(P4937);磷酸盐缓冲液PBS购自Gibco公司(10,010-023)细胞活力检测试剂盒Cell Titer-Glo ® Luminescent Cell Viability Assay kit购自Promega公司(G7572);抗Bax兔单克隆抗体(ab32,503)、抗Bcl-2鼠单克隆抗体(ab692)、抗active Caspase-3兔多克隆抗体(ab49,822)以及抗Cleaved-PARP I兔单克隆抗体(ab32,064)均购自Abcam公司;TNF-α ELISA检测试剂盒购自深圳达科为公司(DKW12-2720-096);Annexin V-FITC/PI凋亡双染试剂盒购自BD公司(556,547)。
2.2. 小鼠外周血淋巴细胞(mPBMC)的提取
ICR小鼠(雄性,22~26 g)心脏采集血液1~2 mL,置于抗凝采血管中,轻柔颠倒混匀后备用;用PBS将Percoll配置成67.5%的工作液;取与血液等量的Percoll工作液置于15 mL离心管中,再将取得的小鼠血液缓慢加入到工作液上层,注意不要混合;室温2000 rpm离心20 min,小心取出离心管,溶液分为三层,吸取乳白色中间层,再次加入到Percoll工作液,离心取中间层;将中间层用PBS洗涤2次除去Percoll后得到mPBMC。
2.3. 细胞培养
小鼠结肠癌CT26细胞用含10%胎牛血清、100 μg/mL链霉素和100 U/mL青霉素的1640培养基,于37℃、5% CO2饱和湿度的恒温培养箱传代培养。取对数生长期细胞进行实验。3M-052用DMSO溶解成20 mmol/L储液,PTX用DMSO溶解成50 mmol/L储液,使用时均用DMSO稀释成1000 × 储液加入到培养基中,所有对照均加入等量的DMSO。
2.4. ELISA检测TNF-α
将mPBMC用1640培养基稀释到4 × 105个/mL,传至6孔板,每孔1 mL,再加入2 mL 1640培养基充分混匀,静置后加入不同浓度的3M-052,24 h后,收取上清,按照达科为ELISA试剂盒说明书检测TNF-α水平,操作如下:取100 μL上清及标准品分别加入对应的样品孔,加入对应的生物素标记抗体,室温孵育1.5 h,用洗液洗3次,在滤纸上扣干,加入亲和素-HRP标记物,室温孵育30 min,用洗液洗3次,最后在滤纸上扣干,加入TMB显色液,室温避光孵育10 min,加入终止液,在10 min内测定λ = 450 nm (参比波长630 nm)处光密度值,并依照标准曲线计算TNF-α的浓度。
2.5. 细胞活力检测
将CT26细胞传至96孔板,每孔1 × 104个,待细胞贴壁后,去除原培养基,加入上述3M-052处理的mPBMC上清100 μL,再加入不同浓度的PTX,共孵育24 h后,Cell Titer-Glo ® Luminescent Cell Viability Assay kit检测细胞活力:在96孔板中加入100 μL检测液,37℃震摇10 min,500 nm处检测自发荧光(Luminescence),该读值与细胞活力成正比,反映活细胞的数量。抑制率计算公式为:抑制率 = (1 − Luminescence实验组/Luminescence对照组) × 100%。
2.6. Western blot检测
CT26细胞传至T25培养瓶,每瓶1 × 106个,贴壁后用3M-052处理过的mPBMC培养液上清和PTX联合处理CT26细胞,24 h后胰酶消化收集细胞,NP40裂解液裂解,等量蛋白上样,经SDS-PAGE 电泳后,低温转印至PVDF膜,封闭,与相应的一抗、二抗杂交,显色,用数字成像仪对图像进行拍照和分析。
2.7. 细胞凋亡检测
将CT26细胞按每孔5 × 105个接种于6孔板中,贴壁后用3M-052处理过的mPBMC培养液上清和PTX联合处理CT26细胞。共孵育18 h后,胰酶消化收集细胞,PBS洗涤1次,用300目无纺布过滤除去细胞团块。再次离心收集细胞,用Binding buffer重悬调整细胞悬液浓度为1 × 106个/mL,取100 μL (1 × 105个细胞),加入5 μL FITC标记的Annexin V和5 μL碘化丙啶(PI),轻轻混匀后室温下避光孵育30 min;加入400 μL Binding buffer充分混匀,立即上流式细胞仪检测,Cell quest软件分析数据。
2.8. 统计学分析
数据统计和半数抑制浓度(half maximal inhibitory concentration, IC50)计算采用SPSS 22.0软件进行,用Duncan’s多重分析进行组间显著性检验,显著水平为P < 0.05,极显著水平为P < 0.01;联合用药系数(Combination Index, CI)采用compusyn 2.0进行分析,计算公式为:CI = D1/DX1 + D2/DX2 + αD1D2/DX1DX2,其中D1、D2为合用时产生X效应时两药各自所需的浓度,DX1、DX2为两药单用时产生X效应时各自的浓度。α = 1为两种相互非排斥性药物,α = 0为两种相互排斥性药物。CI ≥ 1.1为拮抗作用,0.9 ≤ CI < 1.1为叠加作用,0.8 ≤ CI < 0.9为低度协同作用,0.6 ≤ CI < 0.8为中度协同作用,0.4 ≤ CI < 0.6为高度协同作用,0.2 ≤ CI < 0.4为强协同作用 [6]。
3. 结果
3.1. 3M-052促进mPBMC分泌TNF-α
将3M-052用DMSO配置成1.25、2.5、5、10 mmol/L,使用前按1:1000加入到1640培养基中,使终浓度为1.25、2.5、5、10 μmol/L。24 h后,收集上清,以ELISA法检测细胞上清TNF-α表达水平。结果显示,以上不同浓度的3M-052均能够促进mPBMC细胞分泌TNF-α (P < 0.05),且呈剂量效应关系(图1)。
3.2. 与3M-052联用降低紫杉醇对CT26细胞的IC50
将3M-052加入到mPBMC的培养基中,使终浓度分别为0、1.25、5、10 μmol/L,24 h后收集上清加入到CT26细胞中,同时加入PTX,使终浓度分别为0、0.1、1、5、50 μmol/L,每个联合浓度三个复孔,24 h后检测细胞活力,以不加药组为对照,计算联合用药对CT26细胞的抑制率(表1)。根据抑制率计算联合用药指数,结果如表2所示:PTX浓度为50 μmol/L时无叠加作用,3M-052和PTX其余浓度联用时均具有叠加或协同作用。以抑制率为纵坐标,以浓度数值的以10为底的对数值为横坐标做图(图2),从而得到PTX在3M-052浓度分别为0、1.25、5、10 μmol/L时的IC50分别是5.37、1.68、1.40、0.53、0.27 μmol/L,可见与3M-052联用可以降低PTX对CT26细胞的IC50,且呈剂量依赖效应,说明3M-052能够加强PTX对CT26细胞的杀伤作用。
3.3. 3M-052、PTX单药及联合用药对CT26细胞凋亡的影响
取3M-052和PTX具有强协同作用(CI = 0.25)的给药浓度3M-052 5 μmol/L、PTX 1 μmol/L进行后续实验:分别以DMSO (Ctrl),3M-052 5 μmol/L,PTX 1 μmol/L以及3M-052 5 μmol/L + PTX 1 μmol/L
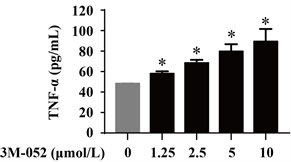 *:P < 0.05,与Ctrl比较
*:P < 0.05,与Ctrl比较
Figure 1. 3M-052 promotes TNF-α secretion of mPBMC
图1. 3M-052促进mPBMC分泌TNF-α
Table 1. Inhibition of CT26 cell proliferation by 3M-052 combined with PTX (%)
表1. 3M-052与PTX联用对CT26细胞增殖的抑制作用(%)
注:Value = Mean ± SD,N = 3;*P < 0.05,**P < 0.01,与Ctrl比较。
Table 2. Combination index
表2. 联合用药指数

Figure 2. Inhibition of CT26 cell proliferation by 3M-052 combined with PTX
图2. 3M-052与PTX联用对CT26细胞增殖的抑制作用
处理CT26细胞18 h,Annexin V-FITC/PI双染,流式细胞仪检测CT26细胞凋亡水平,结果显示(图3):3M-052、PTX单独处理组或联合处理CT26细胞均能引起细胞凋亡,联用时效果更强。
3.3. 3M-052、PTX单药及联合用药对CT26细胞凋亡相关蛋白的影响
分别以DMSO (Ctrl),3M-052 5 μmol/L,PTX 1 μmol/L以及3M-052 5 μmol/L + PTX 1 μmol/L处理CT26细胞24 h,以Western blot法检测细胞中Bax、Bcl-2、active-Caspase3及cleaved-PARP I的表达水平。结果发现,与对照组相比,3M-052、PTX单独处理组和联合处理组细胞中Bax/Bcl-2比值和a-Caspase3、c-PARP水平均增加;联合用药组细胞中Bax/Bcl-2比值、a-Caspase3和c-PARP水平均高于3M-052或PTX单独处理组(见图4)。
4. 讨论
结肠癌是最常见的消化道恶性肿瘤之一,而且绝大多数发现时都已到中晚期,现在的治疗手段主要是适当手术和术后化疗,但预后较差。因此开发新的并且有效的化疗方案,对提升结肠癌防治的整体水平具有重要意义。
 A:Ctrl;B:3M-052 5 μmol/L;C:PTX 1 μmol/L;D:3M-052 5 μmol/L + PTX 1 μmol/L
A:Ctrl;B:3M-052 5 μmol/L;C:PTX 1 μmol/L;D:3M-052 5 μmol/L + PTX 1 μmol/L
Figure 3. Annexin V/PI staining for detection of apoptosis of CT26 cells
图3. Annexin V/PI双染检测CT26细胞凋亡水平

Figure 4. Effects of 3M-052 and PTX monotherapy or combination drugs on apoptosis-related proteins in CT26 Cells
图4. 3M-052、PTX单药及联合用药对CT26细胞凋亡相关蛋白的影响
紫杉醇的抗肿瘤作用主要是通过稳定微管使细胞停滞在G2/M期,导致有丝分裂无法完成,从而诱导细胞凋亡 [7]。但是其对正常的细胞也同样具有促凋亡的作用,在临床上亦表现出剂量依赖的药物毒性,主要包括骨髓抑制和神经毒性 [8]。临床上长期大量使用紫杉醇,会导致癌细胞的抗药性,使治疗效果减小。本研究结果显示,与3M-052联用,紫杉醇对CT26细胞的IC50随着3M-052浓度的升高逐渐降低,预示着与3M-052联用可能减少紫杉醇在临床上治疗结肠癌的使用剂量,具有重大意义。
3M-052分子具有长链脂肪酸尾,微溶于水,在肿瘤内部注射后能达到缓释效果,通过促进单核吞噬细胞、淋巴细胞在肿瘤部位的积累,并同时激活多种细胞因子的释放从而诱导肿瘤组织死亡,3M-052的瘤内注射亦可抑制远端肿瘤的生长 [9]。当小鼠肌肉注射3M-052后其血液中的TNF-α、IL-6、TGF-β等细胞因子会出现剂量依赖的升高。本研究采用ELISA方法检测mPBMC上清中的TNF-α用以验证3M-052对mPBMC的激活作用。由于紫杉醇对PBMC具有很强的杀伤作用,因此本实验未考虑采用将3M-052活化的PBMC细胞直接加入到CT26中的方法,而是将mPBMC的培养基加入到细胞中,模拟远端肿瘤的抑制。
促凋亡蛋白Bax属于Bcl-2基因超家族成员,在胞内,Bax与Bcl-2形成异源或同源二聚体作为细胞凋亡通路的分子开关。当Bax表达量多于Bcl-2时,则同源二聚体Bax/Bax多于异源二聚体Bcl-2/Bax,线粒体膜通透性增加,细胞色素C释放,进而激活caspase级联反应,促进PARP I的剪切导致细胞凋亡 [10]。因此Bax/Bcl-2的比值、active-Caspase3和cleaved-PARP I的水平可以反映细胞凋亡的程度。在本实验中Western Blot结果显示3M-052和紫杉醇单药处理均能诱导CT26细胞Bcl-2蛋白水平下调以及active-Caspase3蛋白水平上调;同时紫杉醇促进Bax的表达,但是3M-052无明显增加;两药联用时Bcl-2水平下降更为明显,推测联合组可能通过促进Bcl-2的大量降解,形成更多的Bax/Bax同源二聚体,从线粒体途径诱导细胞凋亡。
本实验从细胞活力、细胞凋亡方面论证了3M-052和紫杉醇联合用药的可能性,以减少紫杉醇用量,降低其对机体的毒副作用。同时为新的减少紫杉醇耐药性治疗方案的开发提供理论依据。
文章引用
安稳定,毛剑琴,林 赟,郑子瑞. 紫杉醇联合TLR7/8激动剂3M-052诱导小鼠结肠癌CT26细胞凋亡的研究
Paclitaxel Combined with TLR7/8 Agonist 3M-052 Inducing the Apoptosis of Mouse Colon Cancer CT26 Cells[J]. 世界肿瘤研究, 2018, 08(04): 132-138. https://doi.org/10.12677/WJCR.2018.84021
参考文献
- 1. Chen, W., Zheng, R., Baade, P.D., et al. (2016) Cancer Statistics in China, 2015. CA: A Cancer Journal for Clinicians, 66, 115-132.
https://doi.org/10.3322/caac.21338 - 2. Allemani, C., Matsuda, T., Di Carlo, V., et al. (2018) Global Surveillance of Trends in Cancer Survival 2000-14 (CONCORD-3): Analysis of Individual Records for 37,513,025 Patients Diagnosed with One of 18 Cancers from 322 Population-Based Registries in 71 Countries. Lancet, 391, 1023-1075.
https://doi.org/10.1016/S0140-6736(17)33326-3 - 3. Guo, X.Y., Wang, P., Du, Q.G., et al. (2015) Paclitaxel and Gemcitabine Combinational Drug-Loaded Mucoadhesive Delivery System in the Treatment of Colon Cancers. Drug Research (Stuttg), 65, 199-204.
- 4. Xiong, M., Lei, Q., You, X., et al. (2017) Mannosylated Liposomes Improve Therapeutic Effects of Paclitaxel in Colon Cancer Models. Journal of Microencapsulation, 34, 513-521.
https://doi.org/10.1080/02652048.2017.1339739 - 5. Zhao, B.G., Vasilakos, J.P., Tross, D., et al. (2014) Combination Therapy Targeting Toll Like Receptors 7, 8 and 9 Eliminates Large Established Tumors. Journal for ImmunoTherapy of Cancer, 2, 12.
https://doi.org/10.1186/2051-1426-2-12 - 6. Soriano, A.F., Helfrich, B., Chan, D.C., et al. (1999) Synergistic Effects of New Chemopreventive Agents and Conventional Cytotoxic Agents against Human Lung Cancer Cell Lines. Cancer Research, 59, 6178-6184.
- 7. Xu, M., Li, M., Yang, J., et al. (2014) Adenovirus-Mediated Interleukin-24 Enhances the Inhibitory Effect of Paclitaxel on the Growth of Lung Cancer A549 Cells. Xi Bao Yu Fen Zi Mian Yi Xue Za Zhi, 30, 1150-1153.
- 8. Tanimukai, H., Kanayama, D., Omi, T., et al. (2013) Paclitaxel Induces Neurotoxicity through Endoplasmic Reticulum Stress. Biochemical and Bi-ophysical Research Communications, 437, 151-155.
https://doi.org/10.1016/j.bbrc.2013.06.057 - 9. Mullins, S.R., Vogel, K., Vasilakos, J.P., et al. (2017) Intratumoral Immuno-therapy with TLR7/8 Agonist MEDI9197 Modulates the Tumor Microenvironment and Holds Potential for Combination with Immune Checkpoint Inhibitors. Cancer Research, 77, 4697.
https://doi.org/10.1158/1538-7445.AM2017-4697 - 10. Porichi, O., Nikolaidou, M.E., Apostolaki, A., et al. (2009) BCL-2, BAX and P53 Expression Profiles in Endometrial Carcinoma as Studied by Real-Time PCR and Immunohistochemistry. Anticancer Research, 29, 3977-3982.
NOTES
*通讯作者。
