Hans Journal of Agricultural Sciences
Vol.
11
No.
12
(
2021
), Article ID:
47025
,
6
pages
10.12677/HJAS.2021.1112153
菟丝子属六种杂草籽DNA条形码鉴定研究
姚 磊1*,尤 波1,张 箭1,赵黎明2,郑 超3
1绥芬河海关综合技术中心,黑龙江 牡丹江
2黄岛海关综合技术中心,山东 青岛
3哈尔滨海关技术中心,黑龙江 哈尔滨
收稿日期:2021年11月1日;录用日期:2021年11月28日;发布日期:2021年12月8日

摘要
本研究通过比较用于植物鉴定的DNA条形码序列ITS1、ITS2、rbcL、matK在菟丝子属(Cuscuta L.) 6个种的杂草籽的种间差异,分析研究菟丝子属DNA条形码鉴定的主要特征。通过对样品进行DNA提取、扩增、测序,利用NCBI中的Nucleotide BLAST、邻接法(Neighbor-Joining)进行鉴定分析。经综合比较可以看出利用DNA条形码能够准确地鉴别菟丝子属杂草,其中ITS2、rbcL序列的鉴定成功率较高,适合作为鉴别菟丝子属杂草籽的条形码序列。本研究结果以期为DNA条形码技术在菟丝子属杂草籽的筛选鉴定中提供依据。
关键词
菟丝子属,杂草种子,DNA条形码,ITS2,rbcL

Identification of DNA Barcodes in Six Weed Species of Cuscuta L.
Lei Yao1*, Bo You 1, Jian Zhang1, Liming Zhao2, Chao Zheng3
1Technology Center of Suifenhe Customs District, Mudanjiang Heilongjiang
2Technology Center of Huangdao Customs District, Qingdao Shandong
3Technology Center of Harbin Customs District, Harbin Heilongjiang
Received: Nov. 1st, 2021; accepted: Nov. 28th, 2021; published: Dec. 8th, 2021

ABSTRACT
In this study, four DNA barcode fragments, ITS1, ITS2, rbcL and matK were used for plant identification in six species of Cuscuta L. to analyze the main characteristics of DNA barcoding identification of Cuscuta L.. Nucleotide BLAST and neighbor-joining in NCBI were used for DNA extraction, amplification and sequencing. Through comprehensive comparison, it can be seen that DNA barcoding can be used to identify weeds of Cuscuta accurately, and ITS2 and rbcL sequences have a higher success rate of identification, which is suitable for identifying Cuscuta L. seeds. The results are designed to establish the DNA barcode technique in the identification of Cuscuta L. seeds.
Keywords:Cuscuta L., Weed Seeds, DNA Barcode, ITS2, rbcL

Copyright © 2021 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
菟丝子属(Cuscuta L.)是双子叶植物旋花科一年生寄生缠绕草本植物,为《中华草本》收录的草药,有较高的药用价值,但因其生命力极强,一旦在农田发生,很难根除,易对大豆、玉米等产生直接危害,该属所有种都是《中华人民共和国进境植物检疫性有害生物名录》中的检疫性杂草。菟丝子属在黑龙江口岸截获率较高,是进境大豆截获的主要检疫性有害生物之一 [1]。主要是因为菟丝子可借助种子形态随寄主及其产品远距离传播,而且俄罗斯为提高产量,未完全遵循科学轮作制度,重茬种植现象较多,导致田间杂草增加 [2] [3]。在实际检疫鉴定中,菟丝子属主要依靠形态特征进行鉴定,而由于该属种类多、种子小、形态特征相似,同时由于货物的装卸、远距离运输等原因,种子的外表形态被磨损的几率很大,因而成为鉴定的一大难题,此时利用DNA条形码技术进行鉴定显得尤为重要。在此背景下,本研究通过比较用于植物鉴定的DNA条形码序列ITS1、ITS2、rbcL、matK在田野菟丝子、中国菟丝子、南方菟丝子、欧洲菟丝子、单柱菟丝子及杯花菟丝子6个种的杂草籽的种间差异,比较其对菟丝子属杂草种类的鉴别能力,分析研究菟丝子属DNA条形码鉴定的主要特征,为口岸地区日常检疫工作中针对检疫性杂草筛选鉴定提供新的思路,在防止外来有害菟丝子属杂草籽的入侵等方面具有重要的意义。
2. 材料与方法
2.1. 供试种子材料
本研究供试种子为绥芬河海关标本馆馆藏的菟丝子属6个近似种的种子标本,标本均来自原农业部植检所杂草室(1995年),共6个样品(编号为1~6)。具体品种名称及来源见表1。
Table 1. Code, scientific name and source of test materials
表1. 供试材料代码、学名和来源
2.2. 主要仪器设备及试剂
冷冻离心机Z36HK (德国HERMEL)、体视显微镜OLYMPUS SZX12 (日本)、PCR仪EPPENDORF (德国)、电泳仪EC 1000XL (美国)、凝胶成像系统ImageQuant 300 (美国)、Premix Ex Taq、ROX Reference Dye II (50×) * 4试剂以及检测引物和探针均购于宝生物工程(大连)有限公司、营养琼脂(Nutrient Agar, BD)、植物基因组DNA提取试剂盒均购于北京天根生化科技有限公司。
2.3. 引物
选用四对特异性引物,具体引物序列见表2。
Table 2. Specific primer sequences for each DNA bar code amplification
表2. 各DNA条形码扩增的特异性引物序列
3. 方法
3.1. 总DNA的提取
分别取菟丝子属不同种杂草籽3粒,加入液氮迅速研磨至粉末状,并将粉末转移到1.5 mL的离心管中,提取DNA的方法采用改良后的天根新型植物基因组提取试剂盒,具体方法参照试剂盒说明书进行操作。
3.2. RT-PCR技术扩增基因序列片段
PCR反应使用天根PCR反应预混液进行扩增,反应采用25 uL体系:2 uL DNA模板,上、下游引物各1 uL,补充dH2O至25 uL。ITS、ITS2、rbcL、matK的PCR扩增条件见表3。PCR产物经1.0%琼脂糖凝胶电泳检测后,由上海生工进行测序。
Table 3. PCR amplification conditions of DNA barcodes
表3. 各DNA条形码的PCR扩增条件
3.3. 系统进化分析
测序后将所得DNA条形码序列利用NCBI中的Nucleotide BLAST进行比对,利用MEGA 7.0软件进行多重比对(Clustal W方法),分析不同基因片段间的核酸序列相似性;使用MEGA 7.0软件,邻接法(Neighbor-Joining)构建系统发育树,通过自举(bootstrap)对系统发育树进行检验,1000次重复。
4. 结果与分析
4.1. 样品PCR检测结果
由ITS、ITS2、rbcL、matK的DNA提取电泳图,可以看出6个菟丝子种的DNA均被成功提取。由ITS、ITS2、rbcL、matK的PCR产物电泳图,可以看出ITS2,rbcL对上述六种菟丝子鉴定成功率较高,而ITS、matK对上述六种菟丝子的鉴定成功率为0,所以仅ITS2、rbcL可以用来鉴别菟丝子属种子。
4.2. DNA条形码序列的多态性分析
本实验所测得的6个样品的ITS2、rbcL的序列长度、GC含量见表4。可以看出rbcL DNA条形码所扩增出的DNA序列长度均约为727 bp,GC含量相对较低,在41%~43%之间;由ITS2 DNA条形码序列扩增出的DNA序列长度在447~452 bp之间,GC含量在49%~54%之间,且ITS2基因所扩增出的DNA序列中GC含量差异要更显著一些。由于许多基因重要调控区域大都由高GC含量的DNA序列组成,因此,高GC含量的DNA条形码如果有较高的序列多态性,更适宜用于较低级别分类单元(如种,变种)的鉴定 [4]。
Table 4. Analysis of sequence length and GC content of samples amplified based on two DNA barcode sequences
表4. 基于2个DNA条形码序列扩增的样品序列长度及GC含量分析
4.3. 基于2种DNA条形码构建的系统进化树分析
利用MEGA 7.0软件,采用Neighbor-Joining方法对6个测序样品构建出NJ系统发育树。基于ITS2条形码序列,系统发育树分为两大支,其中南方菟丝子(Cuscuta australis)、欧洲菟丝子(Cuscuta europaea)、田野菟丝子(Cuscuta campestris)、中国菟丝子(Cuscuta chinensis)、单柱菟丝子(Cuscuta monogyna)被分为一支;杯花菟丝子(Cuscuta cupulata Engelm)单独分为一支,从系统进化树可以看出ITS2序列可将杯花菟丝子、单柱菟丝子与其他四个种区分开来(见图1)。基于rbcL条形码序列,同样也聚为两类,系统发育树分为两大支,其中南方菟丝子、欧洲菟丝子、中国菟丝子被分为一支,单柱菟丝子、田野菟丝子、杯花菟丝子被分为一支。南方菟丝子与欧洲菟丝子、田野菟丝子与杯花菟丝子的序列关系获得100%支持率,说明此二者的种群亲缘关系较近,独立性相对较弱(见图2)。

Figure 1. NJ phylogenetic tree constructed based on ITS2 DNA barcodes
图1. 基于ITS2 DNA条形码构建的NJ系统进化树
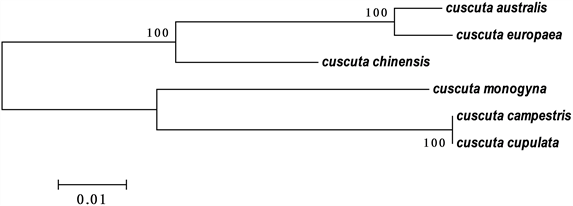
Figure 2. Phylogenetic tree of NJ based on rbcL DNA barcodes
图2. 基于rbcL DNA条形码构建的NJ系统进化树
由以上数据可以得出,ITS2序列构建的NJ树相对于rbcL序列的区分度更好,更加适用于菟丝子属杂草的鉴别。
5. 讨论
目前,菟丝子的鉴定方法有常规的形态学特征鉴定、化学分类标记法、色谱法、细胞学鉴定等 [5]。DNA条形码技术是一种利用一段高变异的标准基因片段,快速、精确地进行物种鉴定的信息鉴别技术 [6],研究表明,ITS、rbcL是植物中较为常用的DNA条形码 [7],然而在实际检疫鉴定中,DNA条形码的应用依然有很多阻碍,例如:入境杂草多为子实形态,未形成健全完善的鉴定信息,无法利用DNA检查鉴定 [8]。本研究比较分析了ITS1、ITS2、rbcL、matK四条DNA条形码对田野菟丝子、中国菟丝子、南方菟丝子、欧洲菟丝子、单柱菟丝子及杯花菟丝子6种菟丝子属杂草籽的鉴别情况。经综合比较可以看出ITS2、rbcL序列的鉴定成功率较高,适合作为鉴别菟丝子属杂草籽的条形码序列。既可为菟丝子属不同种DNA鉴定提出探讨及对比分析,同时也可为菟丝子属种子检疫鉴定提供基础资料。
基金项目
原黑龙江出入境检验检疫局项目(2016HK011)。
文章引用
姚 磊,尤 波,张 箭,赵黎明,郑 超. 菟丝子属六种杂草籽DNA条形码鉴定研究
Identification of DNA Barcodes in Six Weed Species of Cuscuta L.[J]. 农业科学, 2021, 11(12): 1118-1123. https://doi.org/10.12677/HJAS.2021.1112153
参考文献
- 1. 魏尊苗, 艾嘉亮, 尤波, 等. 黑龙江口岸进口俄罗斯大豆疫情分析与建议[J]. 植物检疫, 2018, 32(4): 78-81.
- 2. 白雪梅, 西涅果夫斯基•米哈伊尔•奥列戈维奇. 俄罗斯大豆生产现状考察报告[J]. 黑龙江农业科学, 2017(4): 140-141.
- 3. Селихова, О.А., 魏然, 杰印, 等. 俄罗斯阿穆尔州大豆种植现状分析[J]. 黑龙江农业科学, 2021(1): 139-141.
- 4. Yan, H.F., Liu, Y.J., Xie, X.F., et al. (2015) DNA Barcoding Evaluation and ITS Taxonomic Implications in the Species-Rich Genus Primula L. in China. PLoS ONE, 10, 12-23. https://doi.org/10.1371/journal.pone.0122903
- 5. 庄蓉, 黄可辉, 郭琼霞, 等. 菟丝子鉴定方法的研究进展[J]. 武夷科学, 2007, 23(12) : 214-218.
- 6. Hebert, P.D.N., Cywinska, A., Ball, S.L., et al. (2003) Biological Identifica-tions through DNA Barcodes. Proceedings of the Royal Society B: Biological Sciences, 270, 313-321. https://doi.org/10.1098/rspb.2002.2218
- 7. Kress, W.J. and Erickson, D.L. (2007) A Two-Locus Global DNA Barcode for Land Plants: The Coding rbcL Gene Complements the Non-Coding trnH-psbA Spacer Region. PloS ONE, 2, e508. https://doi.org/10.1371/journal.pone.0000508
- 8. 于璇, 何瑞芳, 彭梅. 出入境检验检疫领域中植物DNA条形码技术的应用探究[J]. 中国新技术新产品, 2017(8): 14-15.
NOTES
*第一作者。
