World Journal of Forestry
Vol.
08
No.
01
(
2019
), Article ID:
28347
,
7
pages
10.12677/WJF.2019.81002
Induction of Octoploid and Its Phenotypic and Physiological Analysis in Switchgrass “Jingji31”
Haiyan Wu1,2, Xifeng Fan2, Juying Wu2, Sechenbaater1, Wenjun Teng2, Hui Zhang2, Haifeng Wen2, Yuesen Yue2*
1College of Life Science and Technology, Inner Mongolia Normal University, Hohhot Inner Mongolia
2Research & Development Center for Grass and Environment, Beijing Academy of Agriculture and Forestry Sciences, Beijing

Received: Dec. 14th, 2018; accepted: Dec. 31st, 2018; published: Jan. 7th, 2019

ABSTRACT
In this study, callus was induced from young inflorescences of tetraploid upland switchgrass “Jingji31”, an ornamental plant, and homologous octoploids were obtained by colchicine induction. Detection of Flow cytometry showed that the relative DNA content of leaves in it was twice as high as that of tetraploid. Stomatal frequency reduced but stomatal size increased significantly (P < 0.01) in leaf epidermis of octoploid compared with its tetraploid. Phenotypic analysis showed that plant height and tiller decreased significantly (P < 0.01) in octoploid plants, while stem diameter and leaf width increased significantly (P < 0.01), and leaf length did not change. Moreover, octoploid plants have more chlorophyll content and higher photosynthesis (P < 0.05) than tetraploid.
Keywords:Switchgrass, Ornamental Plant, Colchicine, Octoploid
柳枝稷“京稷31”八倍体诱导及其表型与生理分析
吴海燕1,2,范希峰2,武菊英2,斯琴巴特尔1,腾文军2,张辉2,温海峰2,岳跃森2*
1内蒙古师范大学生命科学与技术学院,内蒙古 呼和浩特
2北京市农林科学院草业与环境研究发展中心,北京

收稿日期:2018年12月14日;录用日期:2018年12月31日;发布日期:2019年1月7日

摘 要
本研究以观赏植物四倍体高地型柳枝稷“京稷31”的幼穗为外植体诱导出愈伤组织,采用秋水仙素诱导处理获得其同源多倍体。流式细胞仪测定表明,其叶片DNA相对含量为四倍体的2倍;与四倍体相比,八倍体植株叶片下表皮的气孔密度显著降低而气孔大小明显增大(P < 0.01)。表型分析结果表明,八倍体柳枝稷株高、分蘖显著降低(P < 0.01),而茎粗和叶片宽度显著增加(P < 0.01),叶长无显著差异;进一步研究表明,八倍体植株的叶绿素含量和光合作用比四倍体植株显著增加(P < 0.05)。
关键词 :柳枝稷,观赏植物,秋水仙素,八倍体

Copyright © 2019 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
柳枝稷(Panicum virgatum L.)原产于北美,为禾本科(Gramineae)黍属(Panicum),是一种多年生暖季型C4植物。柳枝稷具有抗逆性强、生物量高、养护成低、生命周期长、适宜在边际土地上种植等特点,在国内外也广泛用于水土保持、生态建设、以及纤维素乙醇研究 [1] [2] [3]。此外,柳枝稷叶挺直,呈灰色或灰绿色,少数品种有金属光泽,秋季变为黄色或棕褐色。圆锥花序,外稃黄色,雄蕊明黄色或紫色,夏末开放,一直持续到冬季。由于长势强健、抗病虫害、管理方便,柳枝稷在欧美国家园林绿化中得到了普遍应用 [4] [5]。
柳枝稷于20世纪80年代被引入我国,并在北京、宁夏、山西、陕西等地开展了生态适应性、生态功能、生物产量与品质等发面的研究,发现该植物不仅生物产量高,而且能够改良土壤,增加土壤有机碳含量,减少坡地水土及土壤养分流失,吸收二氧化硫和滞降粉尘等生态效益 [6] [7] [8] [9]。此外,柳枝稷作为观赏草在北京地区构建节约型园林建设中也得到了研究和利用,在园林景观中有多种应用方式,如作地表覆盖植物、作边界屏障,或与其他花卉组合成花境,可以营造出自然、优美的园林景观。在我国北方地区表现出了良好的开发利用前景 [10] [11]。
美国从19世纪30年代开始了柳枝稷育种工作,在长期资源收集、评价的基础上开展了单株选择、有性杂交及分子标记辅助选育等研究工作,并培育出“Shenandoah”、“Heavy Metal”等多个柳枝稷观赏品种,而我国对柳枝稷的研究尚处于起步阶段,观赏柳枝稷育种的研究鲜有报道 [5]。本研究以观赏植物四倍体高地型柳枝稷“京稷31”的幼穗为外植体诱导出愈伤组织,采用秋水仙素诱导处理获得其同源八倍体,并在田间对获得的新种质进行表型分析,为今后观赏柳枝稷新品种(系)培育奠定基础。
2. 材料与方法
2.1. 试验材料
四倍体高地型柳枝稷品种“京稷31”的幼穗采自北京市农林科学院小汤山试验基地种质资源圃。
2.2. 试验方法
2.2.1. 柳枝稷组织培养与多倍体的诱导
柳枝稷组织培养与多倍体的诱导参考Yang等的报道 [12]。取“京稷31”的幼穗,先用70%乙醇消毒30 s,再用10% NaClO溶液消毒15 min,最后用无菌水清洗3~4遍。用灭菌滤纸将幼穗表面水分吸干后,纵切为两半,接种至含有5 mg/L 2,4-D、1.2 mg/L 6-BA、30 g/L麦芽糖和8 g/L凝胶的MS培养基上(PH 5.8),在黑暗条件下诱导愈伤组织,温度为26℃ ± 2℃,2周后将愈伤组织转接至含有5 mg/L 2,4-D、1.2 mg/L 6-BA、2 g/L脯氨酸、30 g/L麦芽糖和8 g/L凝胶的MS培养基上(PH 5.8)进行增殖培养4周,每两周采用新的培养基继代一次。然后,将愈伤组织转移至含有0或0.03%秋水仙素的液体诱导培养基中,于28℃黑暗条件下振荡培养13天,转速120 rpm;处理完毕,用液体诱导培养基冲洗愈伤组织2~3次,然后转接至最后,将愈伤组织转接至含有0.5 mg/L GA3、30 g/L麦芽糖和6 g/L凝胶的MS培养基上(PH 5.8)诱导芽分化;待诱导芽长至2~3厘米时,将再生芽转移到1/2 MS培养基中诱导生根8;再生苗长有3~5条根时,将其移栽至含有等体积花土和蛭石育苗盆中在日光温室中培养。
2.2.2. 柳枝稷倍性鉴定
当再生苗有4~5叶时,根据Huang等人的方法 [13],用流式细胞仪对其倍性进行鉴定。取1 cm2的嫩叶,用蒸馏水洗净表面并用滤纸擦干放入培养皿中,加入1 mL细胞提取液,刀片快速切碎;取培养皿内的解离液,加入1 mL细胞提取液,静置5 min。再用400目滤膜将上述提取液过滤到2 mL离心管,并于4℃条件下离心6 min,转速1100 rpm。弃除上清液,加入200 μL碘化丙啶(PI)染色液,避光染色20 min。将染色的样品用流式细胞仪(BD Accuri C6)进行检测其DNA相对含量,以未经秋水仙素处理的再生植株作为对照。
2.2.3. 叶片气孔分析
叶片气孔分析采用无色指甲油印迹法 [12]。上午10时左右,选取植株中上部成熟叶擦拭干净后,取叶片中部1 cm左右。在叶片的下表面涂一层薄薄的无色指甲油,待指甲油干燥后用镊子小心将油膜取下放于载玻片上,盖上盖玻片,电子显微镜下观察气孔密度与大小,随机选10个视野和10个气孔拍照、记录。
2.2.4. 田间表型分析
经流式细胞仪鉴定的八倍体柳枝稷和四倍体对照在温室中培育,并于2017年5月初移栽至试验田。试验田位于北京市昌平区小汤山镇(N40˚10', E116˚26'),属典型的暖温带大陆性季风气候,海拔50 m,年均气温12℃~17℃,年均降雨量640 mm,年积温4200℃左右(≥10℃),年无霜期约为190天。试验地土壤pH值为7.6,土壤含1.5%有机质,84.0 mg/kg碱解氮,16.5 mg/kg速效磷和129.0 mg/kg速效钾 [14]。在盛花期,随机抽取“京稷31”的八倍体和四倍体各株6进行田间表型测定。调查株高、分蘖、茎粗、叶长和叶宽等生长指标,用卷尺测量植株株高、叶片大小,游标卡尺量茎粗。
2.2.5. 叶绿素含量测定
叶绿素含量测定采用乙醇浸提法参考 [15],随机选取“京稷31”八倍体和四倍体各取6株,取倒三叶叶片鲜样0.05 g,避开叶脉部分,剪碎,分别投入装有8 mL无水乙醇的离心管中,在黑暗条件下浸提24 h,并定时摇动,待叶片变白。以乙醇作为空白对照,测定总叶绿素含量。
2.2.6. 光合作用的测定
光合作用的测定参考万正林等的报道 [16],于晴天9:00~11:00,随机选取“京稷31”八倍体和四倍体各取6株,采用LI-6400光合仪测定相同节位叶片的净光合速率,每株相同节位叶片重复3次,使用自然光,温度为(28 ± 2)℃。
2.2.7. 数据分析
采用Excel 2010进行数据统计,使用SPASS 22.0软件进行独立样本T检验。
3. 结果与分析
3.1. 八倍体植株的获得
当有4~5片时,以未经秋水仙素处理的再生苗为对照,利用流式细胞仪对柳枝稷再生苗进行倍性分析。通过比较再生苗叶片DNA相对含量图,可以鉴定出多倍体植株(图1(b))的荧光通道值在四倍体倍体(图1(a))荧光通道值的2倍处,判断该类植株为八倍体。共计获得9个八倍体“京稷31”再生植株。
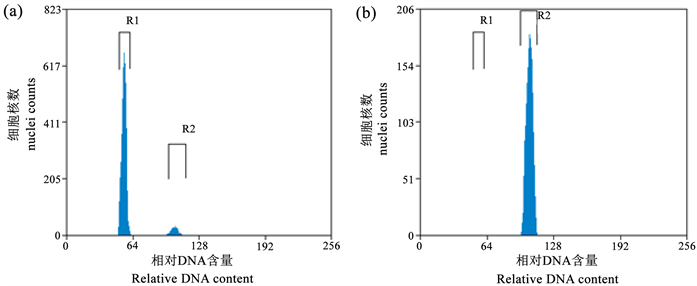
Figure 1. Ploidy level analysis in switchgrass “Jingji31” by flow cytometry, (a) Tetraploid, (b) Octoploid
图1. 柳枝稷“京稷31”流式细胞仪倍性分析,(a) 四倍体,(b) 八倍体
3.2. 叶片气孔特征分析
在体式镜下观察“京稷31”四倍体与八倍体叶片气孔特征发现,八倍体柳枝稷叶片气孔大小和气孔密度与四倍体有明显的差异(图2)。四倍体植株平均每个视野的气孔数为13.8个,而八倍体植株平均每个视野的气孔数为8.2个,八倍体植株叶片气孔密度比四倍体显著降低。八倍体植株叶片气孔长与宽分别为47.2 μm、22.6 μm,而四倍体植株叶片气孔长与宽分别为38.1 μm、15.1 μm,八倍体植株叶片气孔大小比四倍体显著增加,其叶片气孔长与宽分别是四倍体增加的23.9%和49.7% (表1)。

Figure 2. Leaf stomatal characteristic in switchgrass “Jingji31” (400×), (a) Tetraploid, (b) Octoploid
图2. 柳枝稷“京稷31”叶片气孔特征(400×),(a) 四倍体,(b) 八倍体
Table 1. Leaf tomatal characteristic analysis in tetraploid and octoploid switchgrass “Jingji31”
表1. 柳枝稷“京稷31”四倍体与八倍体叶片气孔特征分析
经t检验,均值 ± SE,*和**表示分别在P < 0.05和P < 0.01时有显着性差异。
3.3. 田间表型分析
通过对“京稷31”四倍体和八倍体田间表型调查与统计分析,结果表明,四倍体和八倍体柳枝稷的株高分别为133.4 cm和106.3 cm,八倍体植株株高比四倍体显著降低,减小20.3%;四倍体和八倍体柳枝稷的单株分蘖数为193.4个和118.6个,八倍体植株分蘖数比四倍体显著降低,减少38.7%;四倍体和八倍体柳枝稷的茎粗为3.4 mm和4.1 mm,八倍体植株茎粗比四倍体显著增加,增幅为20.6%;八倍体植株叶片宽度比四倍体植株明显增加,增幅为44.4%;而八倍体植株的叶长跟四倍体植株无明显差异(表2)。
Table 2. Phenotypic analysis of tetreploid and octoploid plants of switchgrass “Jingji31”
表2. 柳枝稷“京稷31”四倍体与八倍体柳枝稷表型分析
经t检验,均值 ± SE,*和**表示分别在P < 0.05和P < 0.01时有显着性差异。
3.4. 叶绿素含量和光合作用分析
通过对“京稷31”四倍体和八倍体植株叶片叶绿素和光合作用测定与统计分析,结果表明,四倍体和八倍体植株叶片叶绿素含量分别为2.4 mg/g和2.7 mg/g,八倍体植株的叶绿素含量比四倍体显著增加,增幅为12.5%;四倍体和八倍体柳枝稷植株叶片光合作用分别为17.8 μmol CO2/m2 s−1和20.2 μmol CO2/m2 s−1,八倍体植株的光合作用比四倍体提高了13.5% (表3)。
Table 3. Chlorophyll content and photosynthesis in switchgrass “Jingji31”
表3. 柳枝稷“京稷31”叶绿素含量和光合作用
经t检验,均值 ± SE,*和**表示分别在P < 0.05和P < 0.01时有显着性差异。
4. 讨论
多倍体植物在自然界中普遍存在,并被认为是推动植物进化的重要因素,是物种形成的途径之一。多倍体由于染色体组成倍数增加,而导致细胞内含物增多,通常会使植株在外部形态、生理特征、营养成分及生态适应性等方面发生相应改变,使植株体现多倍体优越性。秋水仙素离体诱导同源多倍体在种质创新和新品种选育上发挥了重要作用,已在园艺作物、药用植物、园林植物等上得到广泛应用 [17] [18]。
除了抗逆性强、生物量高、养护成低、生命周期长等特点外,柳枝稷作为一种能源植物还具有木质纤维素含量高、容易转化等优点,被认为是发展纤维乙醇“模式植物” [1] [2] [19]。近年,科研人员报道了多倍体育种技术在柳枝稷上应用的研究,他们为了解决柳枝稷四倍体低地型品种与八倍体高地型品种之间杂交不亲和的问题,采用秋水仙素诱导创制了八倍体低地型柳枝稷新种质 [12] [20] [21]。Yang等以四倍体低地型柳枝稷Alamo成熟种子为材料诱导愈伤组织,采用0.04%的秋水仙碱处理愈伤组织,借助组织培养再生植株手段,成功获得了八倍体Alamo植株 [12]。Yue等在此基础上,以柳枝稷幼穗为外植体诱导愈伤组织,经秋水仙素诱导获得三个柳枝稷品种(Alamo、Kanlow和Ranlow)的加体植株 [20]。Sangwoong Yoon等则采用秋水仙素处理柳枝稷Liberty的幼苗,并成功获得加倍植株 [21]。本研究在前人研究基础上,以四倍体高地型柳枝稷“京稷31”的幼穗为外植体诱导出愈伤组织,采用秋水仙素诱导处理并获得其同源八倍体植株。
多倍体植物鉴定最传统的方法是制作染色体装片,通过显微镜检进行染色体计数,进而确定倍性。该方法直观、准确,但是费时费力,对于鉴定那些染色体小且染色体数目多的植物存在较大困难。2010年之后出现一种新的采用流式细胞仪测定植物细胞核DNA含量来鉴定其倍性的方法 [22] [23],其特点是准确、快速、简便,尤其适合样本数量较多的鉴定。本研究即采用流式细胞仪测定柳枝稷再生苗叶片DNA相对含量鉴定其同源八倍体(图1),并结合气孔保卫细胞大小和密度等特征确认再生植株的倍性。与四倍体柳枝稷相比,其八倍体植株叶片单个视野内的气孔数量明显减少,而气孔面积则显著增大(图2和表1),这与前人对八倍体柳枝稷、八倍体花生等的报道一致 [12] [21] [22]。这种开度更大的气孔,能减少蒸腾阻力,有利于柳枝稷植株体内水分和矿物营养的运输;同时,增强光合作用中气体交换力度,有利于光合作用的进行 [23]。
前人的研究表明,与四倍体植株相比较,八倍体柳枝稷的株高明显变矮、分蘖显著减少、生物产量显著降低 [12] [20] [21],本研究结果与前人的研究结果一致(表2)。对于观赏植物,其适度株高的降低和分蘖数量的减少会使其株型更加圆正,增加其观赏价值;而株高的降低有利于增强其抗倒伏性。此外,多倍化能使植物内含物增多、光合作用增强等特点 [15] [22] [24],与上述研究一致,本研究发现八倍体柳枝稷叶绿素含量比四倍体增加,光合作用增强。由于光合色素是植物吸收光能进行光合作用的重要物质(包括叶绿素a和b、类胡萝卜素等),其含量直接影响光合作用效率,光合作用效率的提高可以则加速有机物的合成、积累,有利于增强其生态适应性和抗逆性 [15] [22] [23] [24]。
基金项目
北京市农林科学院科技项目(QNJJ201626, KJCX20161502-1, KJCX20170110)和北京市科技计划项目(171100007217001)。
文章引用
吴海燕,范希峰,武菊英,斯琴巴特尔,腾文军,张辉,温海峰,岳跃森. 柳枝稷“京稷31”八倍体诱导及其表型与生理分析
Induction of Octoploid and Its Phenotypic and Physiological Analysis in Switchgrass “Jingji31”[J]. 林业世界, 2019, 08(01): 10-16. https://doi.org/10.12677/WJF.2019.81002
参考文献
- 1. Sanderson, M.A., Reed, R.L. and McLaughlin, S.B. (1996) Switchgrass as a Sustainable Bioenergy Crop. Bioresource Technology, 56, 83-93. https://doi.org/10.1016/0960-8524(95)00176-X
- 2. Sharma, N. (2003) Switchgrass (Panicurnvirgatum L.) Cultivars. Energy Conversion and Management, 44, 2953-2958. https://doi.org/10.1016/S0196-8904(03)00049-9
- 3. 刘吉利, 朱万斌, 谢光辉, 林长松, 程序. 能源作物柳枝稷研究进展[J]. 草业学报, 2009(3): 232-240.
- 4. 袁小环. 观赏草与景观[M]. 北京: 中国林业出版社, 2015: 4-5.
- 5. 张爽. 柳枝稷幼穗再生体系建立与八倍体诱导研究[D]: [硕士学位论文]. 北京: 中国林业科学研究院, 2015.
- 6. 李代琼, 梁一民, 刘国彬, 黄瑾, 姜峻,一前宣正, 西尾孝佳. 半干旱黄土丘陵区多元化草地建设技术研究[J]. 西北植物学报, 2003, 23(7): 1258-1265.
- 7. 李世锋. 关于河岸缓冲带拦截泥沙和养分效果的研究[J]. 水土保持科技情报, 2004(6): 41-43.
- 8. 侯新村, 范希峰, 武菊英, 左海涛. 京郊挖沙废弃地能源草生产潜力评价[J]. 自然资源学报, 2011, 26(10): 1768-1774.
- 9. 邓瑞芬, 王百群, 刘普灵, 陈龙飞, 刘栋. 黄土丘陵区典型草地土壤有机碳及微生物量碳的分布特征[J]. 水土保持通报, 2012, 32(6): 98-101.
- 10. 武菊英, 滕文军, 袁小环. 适宜北京地区的观赏草评价与应用[J]. 中国园林, 2009(12): 21-24.
- 11. 武菊英. 观赏草[M]. 北京: 中国林业出版社, 2007: 1-5.
- 12. Yang, Z.Y., Shen, Z.X. and Tetreault, H. (2014) Production of Autopolyploid Lowland Switchgrass Lines through in Vitro Chromosome Doubling. Bioenergy Research, 7, 232-242. https://doi.org/10.1007/s12155-013-9364-x
- 13. Huang, Z., Xu, C., Li, Y., Wang, P., Li, Y. and Kang, X. (2015) In-duction of Somatic Embryogenesis by Anther-Derived Callus Culture and Plantlet Ploidy Determination in Poplar (Populus × beijingensis). Plant Cell Tissue and Organ Culture, 120, 949-959. https://doi.org/10.1007/s11240-014-0649-3
- 14. Yue, Y., Hou, X., Fan, X., Zhu, Y., Zhao, C. and Wu, J. (2017) Bio-mass Yield Components for 12 Switchgrass Cultivars Grown in Northern China. Biomass and Bioenergy, 102, 44-51. https://doi.org/10.1016/j.biombioe.2017.05.001
- 15. 向芬, 李维, 刘红艳, 周凌云, 丁玎, 曾振. 茶树叶绿素测定方法的比较研究[J]. 茶叶通讯, 2016, 43(4): 37-40.
- 16. 万正林, 王秀明, 周艳霞, 邓俭英, 李立志, 龙明华. 同源四倍体及其原二倍体黑皮冬瓜光合参数比较[J]. 黑龙江农业科学, 2018(4): 18-21.
- 17. 蒋淑磊, 李志斌, 徐立军, 李国松. 观赏植物多倍体育种研究进展[J]. 河北林业科技, 2015(6): 82-85.
- 18. 彭静, 魏岳荣, 熊兴华. 植物多倍体育种研究进展[J]. 中国农学通报, 2010, 26(11): 47-48.
- 19. Mclaughlin, S.B. and Kszos, L.A. (2005) De-velopment of Switchgrass (Panicum virgatum) as a Bioenergy Feedstock in the United States. Biomass and Bioenergy, 28, 515-535. https://doi.org/10.1016/j.biombioe.2004.05.006
- 20. Yue, Y., Zhu, Y., Fan, X., et al. (2017) Gener-ation of Octoploid Switchgrass in Three Cultivars by Colchicine Treatment. Industrial Crops and Products, 107, 20-21. https://doi.org/10.1016/j.indcrop.2017.05.021
- 21. Yoon, S., Aucar, S. and Hernlem, B.J. (2017) Generation of Octaploid Switchgrass by Seedling Treatment with Mitotic Inhibitors. Bioenergy Research, 10, 344-352. https://doi.org/10.1007/s12155-016-9795-2
- 22. 田新民, 周香艳, 弓娜. 流式细胞术在植物学研究中的应用——检测植物核DNA含量和倍性水平[J]. 中国农学通报, 2011, 27(9): 21-27.
- 23. 梅辉, 韦琴, 付秀芹, 江楠. 不同倍性花生光合特性研究[J]. 花生学报, 2016, 45(1): 31-32.
- 24. 于永畅, 王厚新, 李承秀, 孙忠奎, 牛田, 孙芳, 王长宪, 张林. 四倍体与二倍体紫薇光合特性研究[J]. 中国农学通报, 2013(22): 10-14.
NOTES
*通讯作者。
