Hans Journal of Ophthalmology
Vol.05 No.02(2016), Article ID:17860,8
pages
10.12677/HJO.2016.52007
The Effect of GDNF on the Expression of Retinal EAAT-1 and GS of Rats after Optic Nerve Axotomy
Zhengru Huang1, Haiying Chen1, Xiaoli Xiang1, Huaijin Guan2*
1Department of Ophthalmology, Chagshu No. 2 Hospital, Changshu Jiangsu
2Department of Ophthalmology, Affiliated Hospital of Nantong University, Nantong Jiangsu

Received: May 21st, 2016; accepted: Jun. 20th, 2016; published: Jun. 23rd, 2016
Copyright © 2016 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
Objective: To investigate the effect of exogenous Glial cell derived neurotrophic factor (GDNF) on the expression of retinal excitatory amino acid transporter-1 (EAAT-1) and glutamine synthetase (GS) of rats after optic nerve axotomy. Methods: Right unilateral optic nerve crush (ONA) model of Sprague-Dawley rats (56) was established, and divided into 4 groups randomly. Right eyes of each group were injected intravitreously 1 µg (test 1 group), 2 µg (test 2 group ), 3 µg ( test 3 group) GDNF, and 0.1 M phosphate buffered saline (negative control group) after ONA immediately. Injections were repeated 7 days after ONA. The left eyes of negative control group were intact, and served as normal control group. FluoroGold was injected into the superior colliculi of 2 rats out of each group to retrogradely label retinal ganglion cells in order to examine the optic nerve axotomy. The expression of GS, EAAT-1 of each group was tested with immnohistochemisty 14 and 21 days after ONA. Results: Retinal ganglion cells axotomy were confirmed by FluoroGold retrogradely labeling. The expression of EAAT-1, GS of normal control group and test 2 group was high significantly than that of negative control group at 14, 21 days after ONA. The expression of GS of test 3 group was also high significantly than that of negative control group at 14 days after ONA. The expression of EAAT-1, GS of test 1 group was lower than that of normal control group at 21 days after ONA. Conclusion: Exogenous GDNF injected intravitreously with adequate dose can enhance the expression of EAAT-1, GS after optic nerve axotomy.
Keywords:Optic Nerve Crush, Glial Cell Derived Neurotrophic Factor, Excitatory Amino Acid Transporter-1, Glutamine Synthetase

GDNF对视神经轴突切断后大鼠视网膜EAAT-1和GS表达的影响
黄正如1,陈海英1,项晓丽1,管怀进2*
1常熟市第二人民医院眼科,江苏 常熟
2南通大学附属医院眼科,江苏 南通

收稿日期:2016年5月21日;录用日期:2016年6月20日;发布日期:2016年6月23日

摘 要
目的:研究玻璃体腔注射外源性胶质细胞源神经营养因子(Glial cell derived neurotrophic factor, GDNF)对视神经轴突切断(optic nerve axotomy, ONA)大鼠视网膜兴奋性氨基酸转运蛋白-1(Excitatory Amino Acid Transporter-1, EAAT-1)和谷氨酰胺合酶(Glutamine synthetase, GS)表达影响。方法:建立Sprague-Dawley (SD)大鼠单眼视神经轴突切断模型56只,并随机分为4组,各组16只SD大鼠。伤后即刻、7 d玻璃体腔内分别注射GDNF(Glial cell derived neurotrophic factor) 1 µg (实验组1)、2 µg (实验组2)、3 µg (实验组3)和0.1 M磷酸缓冲液(阴性对照组),阴性对照组大鼠的对侧眼作为正常对照组。各组于术后7 d随机选择2只大鼠上丘脑逆行标记荧光金视神经轴突切断状况。术后14 d、21 d随机选择6只实验大鼠,免疫组织化学分析视网膜EAAT-1和GS的表达。结果:视网膜神经节细胞逆行标记显示视神经夹伤后视神经轴突被完全切断。ONA后14 d、21 d,正常对照组、实验组2的EAAT-1、GS表达均高于阴性对照组;ONA后14 d,实验组3的GS表达高于阴性对照组。ONA后21 d,实验组1的EAAT-1、GS表达低于正常对照组。结论:玻璃体腔注射适当剂量的外源性GDNF能促进视神经损伤后大鼠视网膜EAAT-1、GS的表达。
关键词 :视神经损伤,胶质细胞源性神经营养因子,兴奋性氨基酸转运蛋白-1,谷氨酰胺合酶

1. 引言
视神经损伤不同程度地损害视网膜神经节细胞(Retinal ganglion cells, RGCs)的轴突并导致不可逆性的RGCs退变死亡 [1] [2] 。既往的研究表明视神经损伤能影响Müller细胞兴奋性氨基酸转运蛋白(Excitatory Amino Acid Transporter, EAAT)-1和谷氨酰胺合酶(glutamine synthetase, GS)的表达 [3] - [5] 。Müller细胞的重要功能之一是摄取、转运、转化视网膜内的兴奋性神经递质谷氨酸以避免其兴奋性毒性作用,在维持视网膜内谷氨酸的动态稳定起着决定性作用 [6] [7] 。胶质细胞源性神经营养因子(Glial cell derived neurotrophic factor, GDNF)能通过结合受体GFRα-1和酪氨酸激酶受体Ret,以PI3K和MAPK途径传导抗凋亡信号 [8] 。哺乳动物视网膜内大部分GFRα-1受体位于Müller细胞表面,小部分存在于RGCs细胞膜上 [9] 。因此,我们研究GDNF能否影响轴突切断后Müller细胞谷氨酸代谢相关的EAAT-1、GS的表达。
2. 材料与方法
2.1. 大鼠右眼视神经夹伤
体重200~250 g的成年清洁级(Sprague-Dawley, SD)雌性大鼠(中科院上海动物实验中心)56只,随机分实验组1、实验组2、实验组3、阴性对照组,阴性对照组的对侧眼作为正常对照组,各组14只眼。3%戊巴比妥钠(50 mg/kg)腹腔内注射麻醉及0.4%盐酸奥布卡因(倍诺喜TM)结膜囊表面麻醉,按照文献报道的方法切开右眼外眦角,分离暴露视神经,在球后2 mm后以动脉夹钳夹实验组和阴性对照组视神经30秒 [10] ,同时避免损伤视网膜动脉;正常对照组不予钳夹。
2.2. 玻璃体腔内注射GDNF
视神经夹伤后,立即注射GDNF (R&D SYSTEMS,美国) 1 µg (实验组1)、2 µg (实验组2)、3 µg (实验组3)和0.1 M等体积磷酸缓冲液(phosphate buffered saline, PBS)(阴性对照组);7 d后相同剂量重复注射1次。正常对照组不予注射。
2.3. RGCs逆行标记
视神经夹伤后7 d,各组随机分别选取2只大鼠,麻醉后沿颅骨中线切开皮肤,暴露颅骨。前囟门后6.5 mm,旁开1.8 mm颅骨钻孔,5 µl Hamilton注射器针头进入4 mm缓慢注射2 μl 5% FluoroGold (Sigma, 美国)于上丘脑 [10] 。5-0丝线缝合皮肤。上丘脑注射后5 d,2只大鼠麻醉后左心室灌注4%多聚甲醛100 ml,摘取眼球后继续固定1 h,30%蔗糖4℃过夜,赤道部开窗摘除晶状体,OCT (optimal cutting temperature compound)冷冻包埋,16 µm切片,荧光正置显微镜(Nikon Eclipse50i)观察RGCs标记状况。
2.4. EAAT-1、GS表达的免疫组织化学检测
视神经夹伤后14 d、21 d,各组未行FluoroGold标记的大鼠中分别随机取6只大鼠,麻醉后左心室灌注4%多聚甲醛100 ml,摘取眼球后继续固定1 h,赤道部开窗摘除晶状体,低梯度脱水,软蜡包埋,8 µm厚度连续切片,取经视盘的视网膜横切片。切片水化,以3%过氧化氢处理后抗原修复,山羊血清封闭,室温孵育后加豚鼠抗大鼠EEAT-1、GS (北京博奥森生物技术有限公司,1:200),4℃过夜,PBS冲洗后滴加HRP标记的山羊抗豚鼠IgG(1:100),37℃孵育后DAB显色,脱水后中性树胶封片。同时做常规苏木精-伊红染色。以大鼠脑组织为阳性对照;PBS代替一抗为阴性对照。每只眼取过视盘的切片4张,每张切片40倍物镜下以视盘为中心两侧对称各摄取5个部位图像(Nikon Eclipse50i),以ImageJ软件测量内核层EAAT-1、GS免疫组织化学染色的平均灰度值。
2.5. 统计分析
以Stata11.2统计软件对各组EAAT-1、GS免疫组织化学染色的平均灰度值作单因素方差分析及Bonferroni法两两分析(α = 0.05)。
3. 结果
3.1. RGCs的FluoroGold逆行标记结果
为证实视神经夹伤是否一致地完全切断了RGCs的轴突,各组随机选取2大鼠眼球做冷冻切片观察RGC的标记状况。在正常对照组的视网膜冷冻切片中,视网膜神经节细胞层可见FluoroGold的荧光标记的RGCs胞体及神经突起(图1(a)),而各实验组及阴性对照组,视网膜神经节细胞层均未见FluoroGold的标记荧光(图1(b))。这表明视神经夹伤后上丘脑至RGCs的逆行运输通道被完全阻断,提示视神经夹伤
 a:正常大鼠的视网膜冷冻切片,视网膜神经节细胞层可见FluoroGold的荧光标记的RGCs胞体及神经突起。b:视神经夹伤大鼠视网膜冷冻切片,视网膜神经节细胞层未见FluoroGold的标记荧光
a:正常大鼠的视网膜冷冻切片,视网膜神经节细胞层可见FluoroGold的荧光标记的RGCs胞体及神经突起。b:视神经夹伤大鼠视网膜冷冻切片,视网膜神经节细胞层未见FluoroGold的标记荧光
Figure 1. Retinal frozen sections retrograde labeled RGCs with FluoroGold
图1. FluoroGold逆行标记RGCs后大鼠视网膜冷冻切片荧光图像
后RGCs轴突被完全切断。
3.2. GS的表达
Müller细胞构成视网膜的支架,贯穿视网膜神经上皮层。视网膜内GS主要存在于Müller细胞的胞浆内。因此,GS染色表现为内核层的颗粒状和贯穿内外界膜的垂直走向的丝状棕色染色(图2(a)-(j))。ONA后14 d、21 d,各组内界膜至外核层GS免疫组织化学染色的平均灰度值的差异具有显著性(单因素方差分析:F = 5.25,p = 0.0033、F = 5.54,p = 0.0025);ONA后14 d,组间两两分析显示正常对照组与阴性对照组、实验组2与阴性对照组、实验组3与阴性对照组的灰度值的差异具有显著性(p = 0.015, 0.028, 0.044);ONA后21 d,组间两两分析显示正常对照组与阴性对照组、实验组1与正常对照组、实验组2与阴性对照组的灰度值的差异具有显著性(p = 0.007, 0.040, 0.034)。结果表明ONA后14 d、21 d,大鼠视网膜GS的表达均降低;而ONA当日及7 d,玻璃体腔注射2 µg、3 µg GDNF能提高ONA 14 d时的GS表达、玻璃体腔注射2 µg GDNF能提高ONA 21d时的GS表达(图2(k))。
3.3. EEAT-1的表达
EAAT-1主要存在于Müller细胞和星形胶质细胞的细胞膜。因此,EAAT-1染色也表现为内核层的颗粒状和贯穿内外界膜的垂直走向的丝状棕色染色(图2(l)-(u)。ONA后14 d、21 d,各组内界膜至外核层EAAT-1免疫组织化学染色的平均灰度值的差异具有显著性(单因素方差分析:F = 6.84,p = 0.0008、F = 7.14,p = 0.0006);ONA后14 d,组间两两分析显示正常对照组与阴性对照组、实验组2与阴性对照组的灰度值的差异具有显著性(p = 0.002, 0.004);ONA后21 d,组间两两分析显示正常对照组与阴性对照组、实验组1与正常对照组、实验组2与阴性对照组的灰度值的差异具有显著性(p = 0.001, 0.032, 0.007)。结果表明ONA后14 d、21 d,大鼠视网膜EAAT-1的表达均降低;而ONA当日及7 d,玻璃体腔注射2 µg GDNF能促进ONA 14 d、21 d时的EAAT-1的表达(图2(v))。
4. 讨论
Müller细胞是脊椎动物贯穿视网膜神经上皮层的大胶质细胞,对视网膜各级神经元起营养、支持作用。摄取、转化神经递质谷氨酸、γ-氨基丁酸是Müller 细胞的功能之一。至今已发现5种不同的谷氨酸
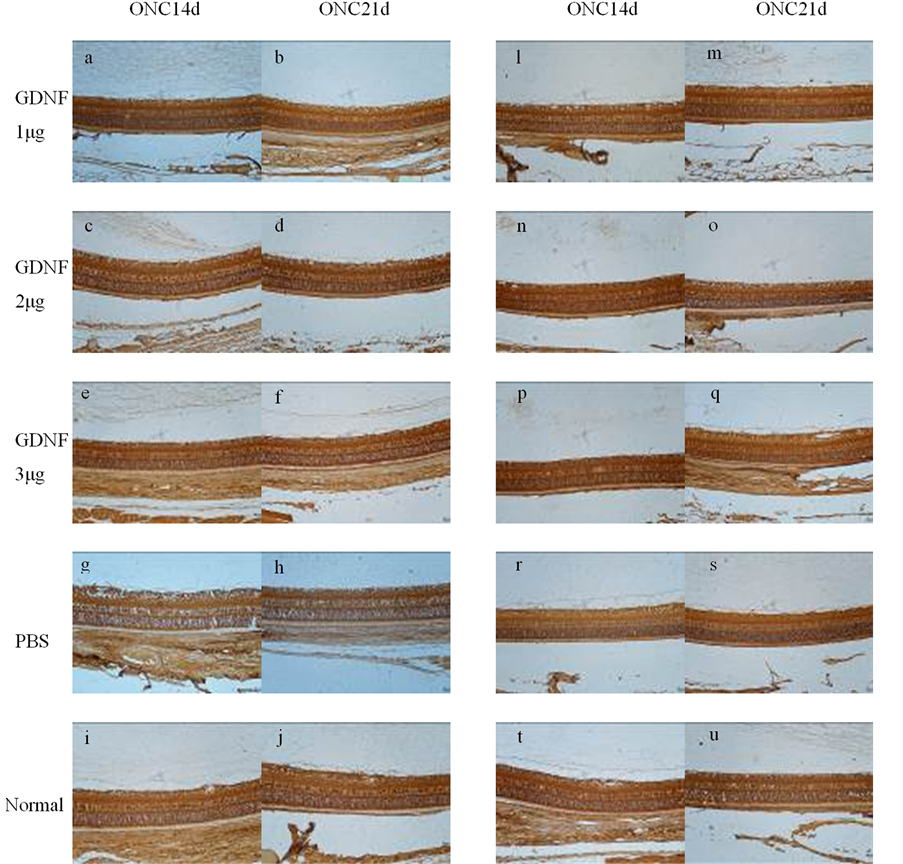
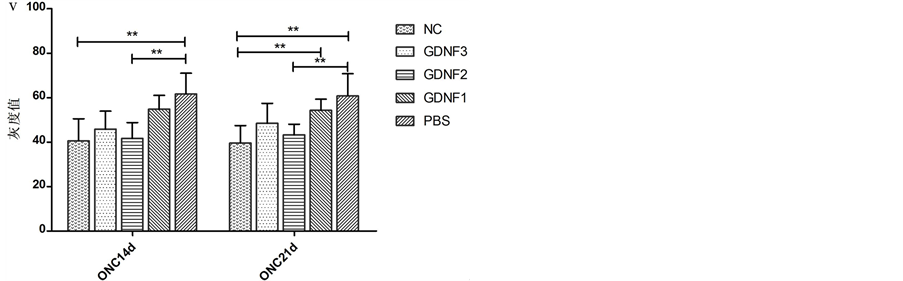
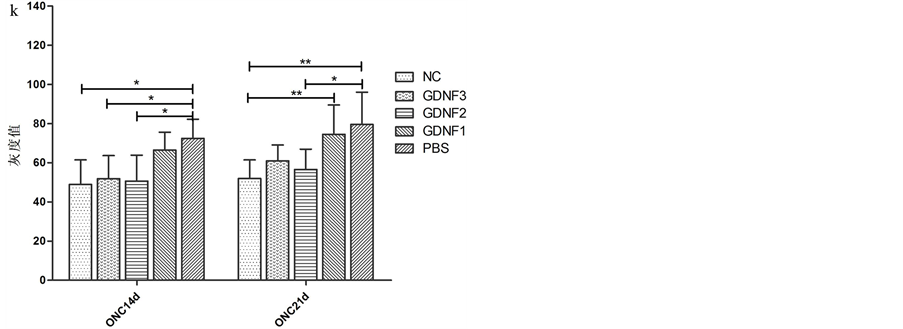 图a-j:各组大鼠视网膜GS的免疫组织化学图像;图l-u:各组大鼠视网膜EAAT-1的免疫组织化学图像;GS、EAAT-1染色均表现为内核层的颗粒状和贯穿内外界膜的垂直走向的丝状棕色染色。图k:各组ONC后不同时间的GS的灰度值统计。图v:各组ONC后不同时间的EAAT-1的灰度值统计。*:P < 0.05,**:P < 0.01
图a-j:各组大鼠视网膜GS的免疫组织化学图像;图l-u:各组大鼠视网膜EAAT-1的免疫组织化学图像;GS、EAAT-1染色均表现为内核层的颗粒状和贯穿内外界膜的垂直走向的丝状棕色染色。图k:各组ONC后不同时间的GS的灰度值统计。图v:各组ONC后不同时间的EAAT-1的灰度值统计。*:P < 0.05,**:P < 0.01
Figure 2. Expression of GS and EAAT-1 of each group
图2. 各组大鼠视网膜GS、EAAT-1的表达
转运蛋白,即EAAT-1、EAAT-2、EAAT-3、EAAT-4、EAAT-5,其中最主要的是表达于Müller细胞的EAAT-1 [11] 。Müller细胞也特异性表达谷氨酰胺合酶(glutamine synthetase, GS),催化细胞内谷氨酸的酰胺化过程 [7] 。Müller细胞通过跨膜蛋白EAAT-1摄取谷氨酸,并通过GS将摄取的谷氨酸酰胺化为谷氨酰胺。因此,Müller细胞在维持视网膜内谷氨酸的动态稳定起着决定性作用 [6] [7] 。
谷氨酸是哺乳动物中枢神经系统,包括视网膜内的神经递质,但过度的刺激谷氨酸受体具有兴奋性毒性作用 [12] [13] 。视神经损伤造成多因素的病理生理改变,谷氨酸的兴奋性毒性作用是其中之一 [12] 。我们既往的研究也发现视神经损伤1 d,EAAT-1的表达就已降低并持续至7 d后 [3] 。本研究进一步发现ONA后14 d、21 d,EAAT-1的表达仍低于正常。视神经损伤后Müller细胞摄取和转化的谷氨酸减少,能导致视网膜细胞外谷氨酸浓度升高至兴奋性毒性水平 [14] 。因而导致更多的谷氨酸被转运入光感受细胞、双极细胞、RGCs,视网膜神经元细胞内谷氨酸的积聚能导致视网膜神经元细胞,尤其是RGCs的变性死亡 [15] - [17] 。
生理情况下内源性GDNF能促进Müller细胞表达EAAT-1 [18] ,因此我们在ONA后即刻和7 d玻璃体腔注射不同剂量的外源性GDNF对EAAT-1表达的影响,结果表明玻璃体腔注射2 µg GDNF能在ONA14 d、21 d时促进EAAT-1的表达,而注射1 µg、3 µg GDNF均不能提高EAAT-1的表达,提示GDNF对ONA后EAAT-1表达的促进作用与其剂量相关,剂量过低时不能促进EAAT-1的表达,而剂量过高时这种促进作用又受到抑制。
Müller细胞摄取的谷氨酸大部分在GS的催化下转化为谷氨酰胺而进入谷氨酸-谷氨酰胺循环,小部分进入线粒体。GS催化谷氨酸转化为谷氨酰胺的过程同时能促进Müller细胞摄取谷氨酸 [19] 。在视网膜缺血、炎症、青光眼状态下,GS的表达和功能均受到抑制 [14] 。视神经外伤也能影响GS的表达。我们既往的研究显示视神经损伤后1 d,GS的表达显著增强,而7 d时又低于正常 [4] ,与急性高眼压后大鼠视网膜GS的表达变化趋势相同 [20] 。本研究发现ONA后14 d、21 d,GS的表达始终低于正常;ONA后14 d,玻璃体腔注射2 µg、3 µg GDNF组的GS表达高于阴性对照组;而ONA后21 d,只有2 µg组的GS表达高于阴性对照组。本研究结果表明ONA后GS持久低表达,而GDNF能上调ONA后的GS表达并存在剂量相关。最新的研究表明在治疗帕金森病时,高剂量的GDNF对大脑浦肯野细胞具有的毒性作用 [21] 。本研究结果表明过高浓度的GDNF反而抑制ONA后EAAT-1、GS的表达。GDNF对EAAT-1、GS表达影响的这种剂量相关效应或许也与其毒性有关。
研究显示GDNF能通过上调EAAT-1的表达而一定程度地抑制视网膜变性模型小鼠的光感受器细胞凋亡 [18] ,对实验性青光眼的RGCs也具有保护作用 [22] 。最近的研究也显示GDNF能通过PI3K/AKT途径上调哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)功能而发挥神经保护作用 [23] [24] 。mTOR在CNS发育过程中调节蛋白合成、轴突生长和生长锥活力,或许是对损伤反应中神经元损害和轴突再生的关键决定因素 [25] 。因此,GDNF可能通过上调mTOR功能而促进ONA后EAAT-1、GS的表达,但玻璃体腔注射外源性GDNF能否有效抑制视神经损伤后的RGCs凋亡并促进视神经纤维再生需进一步研究。
基金项目
江苏省卫生厅医学重点学科开放课题(NT2009-001)。
文章引用
黄正如,陈海英,项晓丽,管怀进. GDNF对视神经轴突切断后大鼠视网膜EAAT-1和GS表达的影响
The Effect of GDNF on the Expression of Retinal EAAT-1 and GS of Rats after Optic Nerve Axotomy[J]. 眼科学, 2016, 05(02): 37-44. http://dx.doi.org/10.12677/HJO.2016.52007
参考文献 (References)
- 1. Park, K.K., Liu, K., Hu, Y., et al. (2008) Promoting Axon Regeneration in the Adult CNS by Modulation of the PTEN/mTOR Pathway. Science, 322, 963-966. http://dx.doi.org/10.1126/science.1161566
- 2. Tan, H.B., Shen, X., Cheng, Y., et al. (2012) Evaluation of a Partial Optic Nerve Crush Model in Rats. Experimental and Therapeutic Medicine, 4, 401-404.
- 3. 陈海英, 黄正如, 叶凯. 视神经损伤对大鼠视网膜兴奋性氨基酸转运蛋白-1表达的影响[J]. 眼科研究, 2009, 27(10): 884-887.
- 4. 黄正如, 陈海英, 徐明, 等. 视神经挫伤对大鼠视网膜谷氨酰胺合酶和兴奋性氨基酸转运蛋白-2表达的影响[J]. 眼科新进展, 2008, 28(9): 657-660.
- 5. Martin, K.R., Levkovitch-Verbin, H., Valenta, D., et al. (2002) Retinal Glutamate Transporter Changes in Experimental Glaucoma and after Optic Nerve Transection in the Rat. Investigative Ophthalmology & Visual Science, 43, 2236- 2243.
- 6. Ola, M.S., Hosoya, K. and LaNoue, K.F. (2011) Regulation of Glutamate Metabolism by Hydrocortisone and Branched Chain Keto Acids in Cultured Rat Retinal Muller Cells (TR-MUL). Neurochemistry International, 59, 656- 663. http://dx.doi.org/10.1016/j.neuint.2011.06.010
- 7. Ola, M.S., Hosoya, K. and LaNoue, K.F. (2011) Influence of Insulin on Glutamine Synthetase in the Muller Glial Cells of Retina. Metabolic Brain Disease, 26, 195-202. http://dx.doi.org/10.1007/s11011-011-9245-y
- 8. Ward, M.S., Khoobehi, A., Lavik, E.B., et al. (2007) Neuroprotection of Retinal Ganglion Cells in DBA/2J Mice with GDNF-Loaded Biodegradable Microspheres. Journal of Pharmaceutical Sciences, 96, 558-568. http://dx.doi.org/10.1002/jps.20629
- 9. Koeberle, P.D. and Ball, A.K. (2002) Neurturin Enhances the Survival of Axotomized Retinal Ganglion Cells in Vivo: Combined Effects with Glial Cell Line-Derived Neurotrophic Factor and Brain-Derived Neurotrophic Factor. Neuroscience, 110, 555-567. http://dx.doi.org/10.1016/S0306-4522(01)00557-7
- 10. Feng, D.F., Chen, E.T., Li, X.Y., et al. (2010) Standardizing Optic Nerve Crushes with an Aneurysm Clip. Neurological Research, 32, 476-481. http://dx.doi.org/10.1179/016164110X12556180206158
- 11. Ishikawa, M. (2013) Abnormalities in Glutamate Metabolism and Excitotoxicity in the Retinal Diseases. Scientifica (Cairo), 2013, 528940. http://dx.doi.org/10.1155/2013/528940
- 12. Schuettauf, F., Naskar, R., Vorwerk, C.K., et al. (2000) Ganglion Cell Loss after Optic Nerve Crush Mediated through AMPA-Kainate and NMDA Receptors. Investigative Ophthalmology & Visual Science, 41, 4313-4316.
- 13. Vorwerk, C.K., Kreutz, M.R., Bockers, T.M., et al. (1999) Susceptibility of Retinal Ganglion Cells to Excitotoxicity Depends on Soma Size and Retinal Eccentricity. Current Eye Research, 19, 59-65. http://dx.doi.org/10.1076/ceyr.19.1.59.5336
- 14. Bringmann, A., Grosche, A., Pannicke, T., et al. (2013) GABA and Glutamate Uptake and Metabolism in Retinal Glial (Muller) Cells. Frontiers in Endocrinology (Lausanne), 4, 48. http://dx.doi.org/10.3389/fendo.2013.00048
- 15. Siliprandi, R., Canella, R., Carmignoto, G., et al. (1992) N-Methyl-D-Aspartate-Induced Neurotoxicity in the Adult Rat Retina. Visual Neuroscience, 8, 567-573. http://dx.doi.org/10.1017/S0952523800005666
- 16. Barnett, N.L., Pow, D.V. and Bull, N.D. (2001) Differential Perturbation of Neuronal and Glial Glutamate Transport Systems in Retinal Ischaemia. Neurochemistry International, 39, 291-299. http://dx.doi.org/10.1016/S0197-0186(01)00033-X
- 17. Holcombe, D.J., Lengefeld, N., Gole, G.A., et al. (2008) The Effects of Acute Intraocular Pressure Elevation on Rat Retinal Glutamate Transport. Acta Ophthalmologica, 86, 408-414. http://dx.doi.org/10.1111/j.1600-0420.2007.01052.x
- 18. Delyfer, M.N., Simonutti, M., Neveux, N., et al. (2005) Does GDNF Exert Its Neuroprotective Effects on Photoreceptors in the rd1 Retina through the Glial Glutamate Transporter GLAST? Molecular Vision, 11, 677-687.
- 19. Shaked, I., Ben-Dror, I. and Vardimon, L. (2002) Glutamine Synthetase Enhances the Clearance of Extra-cellular Glutamate by the Neural Retina. Journal of Neurochemistry, 83, 574-580. http://dx.doi.org/10.1046/j.1471-4159.2002.01168.x
- 20. 罗学港, 熊黄, 潘童, 等. 急性眼高压大鼠视网膜谷氨酸/天冬氨酸转运体和谷氨酰胺合成酶的表达[J]. 解剖学杂志, 2005, 28(3): 308-310.
- 21. Luz, M., Mohr, E. and Fibiger, H.C. (2015) GDNF-Induced Cerebelllar Toxicity: A Brief Review l. Neurotoxicology, 11, 1. http://dx.doi.org/10.1016/j.neuro.2015.10.011
- 22. Jiang, C., Moore, M.J., Zhang, X., Klassen, H., Langer, R. and Young, M. (2007) Intravitreal Injections of GDNF- Loaded Biodegradable Microspheres Are Neuroprotective in a Rat Model of Glaucoma. Molecular Vision, 13, 1783- 1792.
- 23. Gao, K., Wang, G., Wang, Y., et al. (2015) Neuroprotective Effect of Simvastatin via Inducing the Autophagy on Spinal Cord Injury in the Rat Model. BioMed Research International, 2015, 260161. http://dx.doi.org/10.1155/2015/260161
- 24. Cui, W., Zhang, Y., Lu, D., et al. (2015) Upregulation of pAkt by Glial Cell Linederived Neurotrophic Factor Ameliorates Cell Apoptosis in the Hippocampus of Rats with Streptozotocin-Induced Diabetic En-cephalopathy. Molecular Medicine Reports, 11, 5. http://dx.doi.org/10.3892/mmr.2015.4507
- 25. Morgan-Warren, P.J., Berry, M., Ahmed, Z., et al. (2013) Exploiting mTOR Signaling: A Novel Translatable Treatment Strategy for Traumatic Optic Neuropathy? Investigative Ophthalmology & Visual Science, 54, 6903-6916. http://dx.doi.org/10.1167/iovs.13-12803