International Journal of Psychiatry and Neurology
Vol.06 No.04(2017), Article ID:22605,9
pages
10.12677/IJPN.2017.64012
Serotonin Effect on Change between Cardiac Electrophysiology and Growth-Associated Protein-43 in Unpredictable Chronic Mild Stress of Depression in Mice
Zhengjiang Liu1, Hua Liu1, Zhihuan Zeng2
1Department of Cardiology, The Six Affiliated Hospital of Guangzhou Medical University Guangzhou/Qingyuan People’s Hospital, Qingyuan Guangdong
2Department of Cardiology, The First Affiliated Hospital of Guangdong Pharmaceutical University, Guangzhou Guangdong
Received: Oct. 18th, 2017; accepted: Nov. 1st, 2017; published: Nov. 8th, 2017

ABSTRACT
Objective: To explore electrophysiologic characteristics of action potential and serotonin, growth-associated protein-43 (GAP-43) of heart location tissue in chronic stress mice. Methods: Twenty rats were randomly divided into two groups, 10 rats exposed to 21 consecutive days of unpredicted chronic mild stress as depression models, and 10 rats as normal controls. After intraperitioneal injection of choral hydrate (0.3 ml/100 mg), heart rats, atrial and ventricular local tissue field action potential duration (fAPD) were recorded by electrophysiological technology. Immunohistochemical stain, quantitative analysis of 5-HT and GAP-43 in the local heart tissue of depression group and control group were achieved by computerized image system. Results: There was significantly difference in glucose consume, total activity, heart rats between the two groups (p < 0.01, p < 0.05). The atrium and ventricular local tissue APD in depression model group were lower than that in normal group (p < 0.05). the positive index(PI) of 5-HT and GAP-43 increased in the local tissue of heart in depression model group, the PI of depression model group was much higher than in control group (p < 0.01). Conclusions: The increased heart rate, decreased fADP in atrial and ventricular tissue and increased PI of 5-HT and GAP-43 are the typical electrophysiologic characteristics of chronic depressive mice models made by unpredicted chronic mild stress method, stress depression may lead to arrhythmia through abnormal sympathetic nerve tension and serotonin change.
Keywords:Depression, Serotonin, Arrhythmias, Cardiac Electrophysiology
慢性应激抑郁大鼠模型心脏电生理变化 与5-羟色胺、生长相关蛋白-43影响的研究
刘政疆1,刘华1,曾志恒2
1广州医科大学附属第六医院/清远市人民医院心内科,广东 清远
2广州药科大学附属第一医院心内科,广东 广州
收稿日期:2017年10月18日;录用日期:2017年11月1日;发布日期:2017年11月8日

摘 要
目的:探讨慢性应激抑郁大鼠模型5-羟色胺(5-HT)对心脏局部组织生长相关蛋白-43(GAP-43)及动作电位的影响。方法:随机将20只大鼠分为对照组和抑郁组,对抑郁组大鼠进行连续21天的慢性应激。应用电生理仪纪录心率、心房、心室局部组织动作电位时间(APD),对左心室心尖部行5-HT及GAP-43免疫染色。结果:抑郁组大鼠慢性应激后的糖水消耗试验、自主活动得分均明显低于对照组,差异有显著统计学意义(P < 0.01)。抑郁组大鼠心率高于对照组,差异有统计学意义(P < 0.05)。抑郁组大鼠心房、心室组织动作电位时间低于对照组大鼠,差异有统计学意义(P < 0.05)。抑郁组大鼠心室组织5-羟色胺及GAP-43递质含量高于对照组大鼠,差异有统计学意义(P < 0.01)。结论:慢性应激所致的抑郁导致交感神经平衡紊乱及5-羟色胺及GAP-43递质含量增多,明显缩短大鼠心房、心室动作电位时程,破坏了心室电生理一致性,这可能是抑郁导致心律失常的机制之一。
关键词 :抑郁,5-羟色胺,心律失常,心脏电生理学

Copyright © 2017 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
在二十世纪初,不到10%世界死亡率的与心血管疾病(CVD)有关,现在CVD是发达国家死亡的主要原因 [1] 。目前公认心血管疾病和抑郁症之间有关联并且是双向的 [2] 。对于心血管疾病的死亡率和发病率来讲,抑郁情绪与有没有基础心脏病的心血管疾病患者危险因素相关 [3] ,抑郁症是一个独立的危险因素 [4] 。尽管对抑郁和心血管事件之间关系的研究发展很快,但二者之间联系的机制仍不清楚,公认的抑郁症和心血管疾病共享一个共同的生化背景,其中包括主要激素介质的压力 [5] 。抑郁可能表现为自主调节心脏的变化,如交感神经系统的激活,心脏迷走神经张力下降,心率升高、心率变异性下降,压力感受性反射功能改变,自主神经系统紊乱是其中最合乎道理的解释,这些能够降低心血管疾病患者心肌缺血、室速、室颤和心脏猝死的阈值 [6] 。
许多学者认为5-HT能神经元在神经系统的靶区广泛,是调节内脏感觉、运动和植物神经系统功能的结构基础 [7] ,5-HT及其受体在心血管系统广泛分布,并对心血管具有重要的调节作用,5-HT调节异常可导致心血管疾病。目前最广泛接受抑郁症的神经内分泌机制是血浆5-羟色胺(5-HT)功能障碍 [8] 。
不可预知的慢性温和应激(unpredictable chronic mild stress UCMS)模型是一种被广泛采用的大鼠抑郁模型,因为它以社会环境压力角色的自然方式模拟诱发抑郁症病理条件,它不仅模拟了人类抑郁的核心症状,即快感缺乏,同时也模拟了重症抑郁障碍的其他症状表现,如运动能力及社会交往能力下降、探索行为能力下降、侵犯攻击能力缺陷、性行为能力下降等 [9] 。抑郁症的UCMS模型是一个用来研究抑郁和心血管疾病之间关系的强大工具。
因此,本研究通过心脏电生理仪记录、免疫组化等方式记录慢性轻度不可预见性应激抑郁大鼠模型的心房、心室局部组织动作电位时间、5-HT、GAP-43神经递质的数量及分布的影响,探讨慢性应激性抑郁致心律失常发生的原因。
2. 材料和方法
2.1. 动物与分组
成年健康雄性SD大鼠(新疆医科大学实验动物中心提供),体重180~250 g,2~3月龄。在光/暗周期为12 h/12 h (光照时间7:00~19:00)条件下饲养,自由进食、饮水,每日触摸动物以适应实验人员的操作。实验前在本院清洁级动物喂养中心适应性饲养1周。利用随机数字表将大鼠分为抑郁模型组(以下简称抑郁组)和正常对照组(以下简称对照组),每组各10只。抑郁组连续21天给予不可预见性刺激,对照组不进行任何处理。实验设计及实施均经过新疆医科大学第一附属医院动物伦理委员会的审核批准(审批号:20080317002),均在心律失常实验室进行。
参考文献 [10] 的方法,建立慢性轻度不可预见性应激抑郁模型,小笼行为限制2 h (配备呼吸孔),持续通宵照明,鼠笼沿40˚垂直轴倾斜24 h,集群饲养,4℃冰水游泳5 min,污笼期24 h,明暗颠倒24 h,潮湿垫料24 h (200毫升水和100 g锯末混合在一起),噪声刺激(60 Hz, 1 h)等。模型组从第1天开始孤养,且每天上午8:00给予一种刺激,顺序随机,使动物不能预料刺激的发生,应激持续21天。正常对照组群养且不给予任何刺激。
2.2. 糖水偏爱试验
抑郁症的核心特征是快感缺失,定义为蔗糖偏好减少。蔗糖偏好试验采用Muscat Willner等人所描述的测量方法 [11] 。实验前48 h训练大鼠适应的蔗糖溶液(1%)的味道。每笼均放置2个塑料水瓶。第一个24 h两瓶均为1%的蔗糖溶液,随后的24 h一个瓶装1%蔗糖水和一个瓶装纯水。禁食物和水24小时后,预先称重分别是水和1%蔗糖溶液的塑料瓶,放置在鼠笼里,允许大鼠消耗液体1小时。然后瓶取出和称重,以确定的量(克)的每一个液体消耗。进行了测试,在CUMS之前测定体重(基线)和蔗糖偏好试验,此后每2周一次直到8周后。根据以下公式计算:糖水消耗与体重比(糖水消耗与体重比 = 糖水消耗量/体重)和糖水偏爱百分比[糖水偏爱百分比 = 糖水消耗量/(糖水消耗量 + 纯水消耗量) × 100%]。
2.3. 动物行为学评定
开箱试验(open field test)以反映实验大鼠的自发活动行为。因其实验操作简单,所得数据量丰富,一次实验就可以对动物的自发活动、探索行为及焦虑、抑郁状态进行定量评价,在应激前对所有大鼠进行第1次开箱试验检测 [12] 。抑郁组给予连续21 d不可预见性刺激后,对两组大鼠进行第2次开箱试验。箱底面为100 cm × 100 cm的正方形,并被等分为25个等边方格;箱壁为黑色,高50 cm,试验在早10:00~12:00进行。将大鼠置于中心方格内,观察大鼠在5 min内穿越的格数(水平运动得分,大鼠四爪均进入的方格,且爬行10 cm,方可计数为1分)及后肢直立次数(垂直运动得分,两前爪腾空或攀附墙壁)。水平运动得分及垂直运动得分之和为大鼠的自主行为学成绩。自我修饰次数即理毛或者洗脸的次数得分,每次测定时间为5 min。
2.4. 实验方法
1) 实验大鼠称重后,先将大鼠用水合氯醛(剂量0.3 ml/100 mg)腹腔麻醉。麻醉生效后仰卧位固定于木板上,开胸取出心脏,Langendorff法灌流心脏,台式液的成分为NaCl140 mmol/L、KCl4 mmol/L、MgCl21 mmol/L、CaCl23 mmol/L、Hepes3.333 g、葡萄糖1 g,用NaOH/HCL滴定pH至7.36,温度控制在37℃以下,以1.5 ml/min速度灌流心脏,灌流30 min后,使用自制铜丝微电极,分别贴附在大鼠心房、心室表面,利用锦江电子Lead-2000电生理仪记录其心房、心室局部组织动作电位时程。
2) 免疫组化染色,心脏灌流及动作电位记录结束后,从心脏标本心尖部起,垂直左心室长轴切取0.5 cm3组织块,备用石蜡切片常规4℃甲醛、0.01 mol/L,pH7.4的PBS冲洗,固定脱蜡至水,加3%H2O2,室温10分钟灭活,微波抗原修复(将切片置700~800 w微波炉内枸橼酸盐缓冲液(0.01 M枸橼酸盐缓冲液(pH6.0))容器中加热,使容器内液体温度保持在92℃~98℃之间并持续10~15分钟,取出容器,室温冷却10~20分钟后,PBS冲洗),封闭内源性过氧化物酶,滴加1;100的5-羟色胺兔一抗(PB0442,武汉博士德生物工程公司),室温封闭4℃过夜。然后滴加聚合HRP标记抗兔IgG (兔多克隆Ig抗体SV-002,武汉博士德生物工程公司),37℃孵育30分钟,冲洗3次,使用DAB显色试剂盒(AR1022,武汉博士德生物工程公司),取1 ml蒸馏水,加试剂盒中,A、B、C试剂各1滴,混匀后加至切片,室温下放置显色,镜下控制反应时间,流水冲洗终止反应。苏木精衬染,盐酸乙醇透明。常规树脂封片观察。
2.5. 结果分析方法
光镜下每例组织观察3张切片,心脏左心室心肌纤维5-HT均呈棕黄色,在Olympus光学显微镜下用IBAS计算机图像分析系统,在每张切片随机挑选5个视野(×200倍),测量同样面积内阳性反应面积及阳性强度值,并按以下公式计算:阳性指数(PI) = (阳性反应面积 × 阳性强度值)/测量面积 [6] 。
3) 标本切片及激光共聚焦镜观察,心脏灌流及动作电位记录结束后,取出另一块新鲜左心室心尖部组织,立即在−20℃温度下用LEICA-CM3050S冰冻切片机对每个组织块进行连续冰冻切片(厚度5 µm),随后切片放入−20℃冰箱保存,进行免疫荧光实验。实验步骤如下:4℃甲醛固定10 min;0.01 mol/L,pH7.4的PBS漂洗3次,滴加内源性过氧化酶阻断剂,静置30分钟,漂洗3次,用5%~10%正常山羊血清(1:10~1:20倍稀释,AR0009,武汉博士德生物工程公司)封片后将玻片置于37℃恒温箱30分钟,冲洗3次,滴加一抗,为GAP-43 (BA0878,武汉博士德生物工程公司),过夜4℃过夜后,复温。滴加荧光标记的二抗山羊抗兔IgG (BA1039,武汉博士德生物工程公司),湿盒遮光置于37℃,恒温箱30分钟,冲洗3次,捞片、阴干、甘油封片。一标荧光二抗孵育结束后的所有步骤都应避光。样品在激光共聚焦显微镜(MicroTime 200激光共焦扫描显微镜,德国LeiCa 仪器有限公司)下扫描,光源分别用488 nm和561 nm波长的激光器激发绿色和红色荧光,扫描分辨率为1024 × 1024 pixel,计算机采集数据,数字成像。
每张左心室心尖部切片,在光学显微镜20倍目镜视野中,随机计数5个视野,以平均每视野中的神经纤维条数代表交感神经密度。在激光共聚焦显微镜下观察GAP-43的分布,并在200倍视野下选取5个不同视野计算GAP-43的数目。
2.6. 统计学处理
将资料的原始数据输入计算机,建立数据库,采用Spss16.0统计软件包在计算机上进行数据描述和统计处理,计量资料采用均数±标准差表示。
3. 结果
各组大鼠最终完成模型制作及成功进行微电极阵列实验的例数均为10只。
3.1. 各组大鼠蔗糖水消耗指标的比较(表1)
各组大鼠糖水消耗与体重比及糖水偏爱百分比在实验前差异无统计学意义,抑郁组在慢性应激3周后糖水消耗与体重比及糖水偏爱百分比较正常对照组在实验前明显降低(P<0.01)。
3.2. 各组大鼠行为学指标的比较(表2)
各组大鼠水平活动得分及垂直活动得分在实验前差异无统计学意义,抑郁组在慢性应激3周后水平活动得分及垂直活动得分比正常对照组在实验前明显降低(P < 0.01)。
3.3. 各组大鼠心率及心脏局部组织动作电位时间指标的比较(表3)
抑郁组大鼠在慢性应激3周后心房、心室局部组织动作电位时间比正常对照组明显降低,心率比正常对照组高(均P < 0.05)。
3.4. 心脏免疫组化染色结果(表4)
各组大鼠心肌纤维均有5-HT免疫阳性纤维分布,对照组心肌纤维走行整齐,无过多间质,肌间5-HT
阳性神经纤维沿肌束走行的方向投射。如图1所示,抑郁组大鼠心肌纤维走行较弥散,间质较正常组明
Table 1. Comparison of glucose consumption in each group (±s)
表1. 各组大鼠糖水消耗指标的比较(±s)
注:与对照组相比,*P < 0.01。
Table 2. Comparison of behavioral indicators of out-of-box trials in each group
表2. 各组大鼠开箱试验行为学指标的比较
注:与对照组相比,*P < 0.01。
Table 3. Heart rate, atrial and ventricular tissue action potentials in each group
表3. 各组大鼠心率、心房、心室组织动作电位时间表
注:与对照组相比,*P < 0.05。
显增多,心肌细胞阳性面积、阳性强度和PI均明显增加(P < 0.01)如图2所示。
3.5. 大鼠心肌细胞GAP-43对比图
各组大鼠心肌GAP-43在LSCM下,心肌细胞间GAP-43增生(14.10 ± 2.73),与正常对照组(6.30 ± 1.89),有显著差异(t = 7.437, P < 0.01),且形态多不规则,说明抑郁大鼠心肌细胞GAP-43增生显著。如图3、图4。
Table 4. 5-HT immunohistochemical staining of myocardial fibers in each group
表4. 各组大鼠心肌纤维5-HT免疫组化染色结果
注:与对照组相比,*P < 0.01。
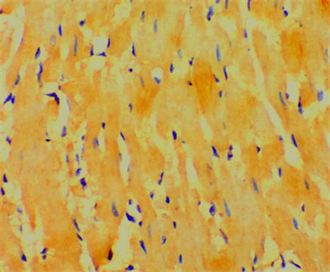
Figure 1. Control group of rat myocardium 5-HT-positive nerve fibers (×200)
图1. 对照组大鼠心肌5-HT染色阳性的神经纤维(×200)
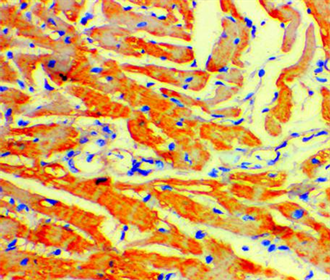
Figure 2. Neurogen fibers (×200) positive for 5-HT staining in the myocardium of the depression group
图2. 抑郁组大鼠心肌5-HT染色阳性的神经纤维(×200)

Figure 3. Normal group GAP-43
图3. 正常组GAP-43
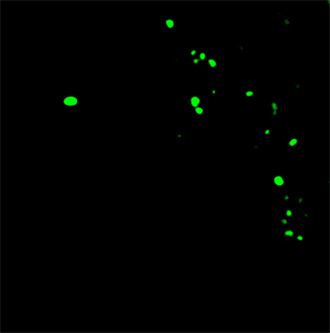
Figure 4. Depression group GAP-43
图4. 抑郁组GAP-43
4. 讨论
本实验采用目前国内外普遍接受的慢性应激抑郁模型,与人类抑郁症中慢性、低水平的应激源促进疾病发生、加速疾病发展的机制更接近 [13] 。该模型采用的应激因子更贴近人在生活当中经常遇到的应激性事件的强度。慢性轻度应激导致脑内奖赏刺激阈值升高和位置偏爱下降,这与抑郁症的核心症状(快感缺乏)非常相似,以此作为症状的指标可信度较高。用糖水偏爱试验检测本抑郁模型均给予肯定评价 [12] 。本研究采用慢性温和应激的方法建立抑郁动物模型,糖水消耗与体重比、糖水偏爱百分比反映动物的奖赏反应程度,水平活动反映动物的活动度,垂直活动反映动物对新鲜环境的好奇程度。本实验中抑郁组糖水消耗与体重比、糖水偏爱百分比、水平活动得分和垂直活动得分较其基础值及正常组明显降低,符合抑郁的特点,表明抑郁动物模型的制作是成功的 [14] 。
心脏交感神经由星状神经节交感神经元延伸,位于双侧胸椎。交感神经纤维从心底部投射到心肌,并主要位于心室的心外膜下,心脏的副交感神经在心脏神经节交感神经元延伸,位于心房的底部。心脏交感神经支配区域差异在哺乳动物中是高度恒定的 [15] 。心脏受大量交感神经和副交感神经传出神经的支配,其性能受二者严格控制,病变心脏神经的支配密度包括感觉神经改变,这可能导致神经激活的不稳定和致命的心律失常 [16] 。
中枢5-羟色胺的神经通路起源于中脑的喙区末端和背部,延髓的5-羟色胺细胞有纤维投射到脊髓,在延髓中缝5-羟色胺能神经元向尾端调节呼吸、心脏等功能 [17] 。5-羟色胺通过5-羟色胺2B受体,调节心脏结构和功能。血浆中5-HT水平的升高可兴奋心房的5-HT4受体,引起窦性心动过速,血浆中5-HT水平变化可诱发房性心律失常,甚至房颤 [18] 。
我们的研究发现抑郁大鼠模型心房、心室动作电位时间和心率均大于正常对照组,这可能是当慢性精神应激导致中脑反应不对称、交感神经张力异常时,在传出–传入反馈回路异常。导致不对称活动与不对称神经冲动传入心脏,使心脏交感神经反应不平衡,穿过心脏表面的交感神经冲动左右不平衡,引起交感神经再分布,破坏了心室电生理一致性,动作电位失衡,表现出心房、心室局部组织动作电位时间快于正常对照组,动作电位时程对交感神经刺激的异质性的响应,倾向于致命性心律失常明显增加,促进了心律失常 [19] 。
另外,生长相关蛋白43 (GAP-43)纳入神经元生长,是内源性神经元生长依赖蛋白,与神经发育、轴突再生以及突触功能的维持等方面起着重要作用,并参与神经递质释放的调节,被认为是神经元发育和再生的一个内在决定因子,是神经元生长的标记 [20] 。
抑郁促使中枢神经系统5-羟色胺功能低下 [21] ,同时自主神经系统张力发生改变,交感神经张力增高,过度的交感神经应激,通过反馈的保护作用,使中脑5-羟色胺的神经通路紊乱,GAP43含量增加,正如本文结果所示抑郁大鼠5-羟色胺递质及GAP43含量在心脏的数量和分布增加,表明神经萌芽生长,突触密度增加,交感产生神经重构,这可能是一个更持久的自适应过程,是内脏感觉传导和调控异常的重要原因。
上述原因破坏了心室电生理一致性,动作电位失衡,表现出心房、心室局部组织动作电位时间快于正常对照组,促进心律失常 [22] 。
总之,慢性应激所致的抑郁可导致交感神经平衡紊乱5-羟色胺神经元增多,破坏了心室电生理一致性,促进了心律失常,这可能是抑郁导致心律失常的机制之一。本文虽对慢性精神应激致心律失常发送机制进行了初步探讨,但在这过程中导致心脏5-羟色胺神经元数量和分布的异常及其和自主神经系统的相互关系、5-HT神经纤维/神经元在其中起多大的作用还需进一步探讨以明确。
基金项目
2015年清远市社会发展领域自筹经费科技计划项目,编号:2015B026。
文章引用
刘政疆,刘 华,曾志恒. 慢性应激抑郁大鼠模型心脏电生理变化与5-羟色胺、生长相关蛋白-43影响的研究
Serotonin Effect on Change between Cardiac Electrophysiology and Growth-Associated Protein-43 in Unpredictable Chronic Mild Stress of Depression in Mice[J]. 国际神经精神科学杂志, 2017, 06(04): 74-82. http://dx.doi.org/10.12677/IJPN.2017.64012
参考文献 (References)
- 1. Murray, C.J.L. and Lopez, A.D. (1997) Mortality by Cause for Eight Regions of the World: Global Burden of Disease Study. The Lancet, 349, 1269-1276. https://doi.org/10.1016/S0140-6736(96)07493-4
- 2. Baune, B.T., Stuart, M., Gilmour, A., Wersching, H., Heindel, W., et al. (2012) The Relationship between Subtypes of Depression and Cardiovascular Disease: A Systematic Review of Biological Models. Translational Psychiatry, 2, 1-19. https://doi.org/10.1038/tp.2012.18
- 3. Wyman, L., Crum, R.M. and Celentano, D. (2012) Depressed Mood and Cause-Specific Mortality: A 40-Year General Community Assessment. Annals of Epidemiology, 22, 638-643. https://doi.org/10.1016/j.annepidem.2012.06.102
- 4. Williams, M.S. (2012) Platelets and Depression in Cardiovascular Disease: A Brief Review of the Current Literature. World Journal of Psychiatry, 2, 114-123. https://doi.org/10.5498/wjp.v2.i6.114
- 5. Thombs, B.D., Bass, E.B., Ford, D.E., Stewart, K.J., Tsilidis, K.K., et al. (2006) Prevalence of Depression in Survivors of Acute Myocardial Infarction. Journal of General Internal Medicine, 21, 30-38. https://doi.org/10.1111/j.1525-1497.2005.00269.x
- 6. Whooley, M.A. (2006) Depression and Cardiovascular Disease. JAMA: The Journal of the American Medical Association, 295, 2874-2881. https://doi.org/10.1001/jama.295.24.2874
- 7. Hausberg, M., Hillebrand, U. and Kisters, K. (2007) Addressing Sympathetic Overactivity in Major Depressive Disorder. Journal of Hypertension, 25, 2004-2005. https://doi.org/10.1097/HJH.0b013e3282ef9819
- 8. Vikenes, K., Farstad, M. and Nordrehaug, J.E. (1999) Serotonin Is Associated with Coronary Artery Disease and Cardiac Events. Circulation, 100, 483-489. https://doi.org/10.1161/01.CIR.100.5.483
- 9. Liu, M.-Y., Ren, Y.-P., Zhang, L.-J., et al. (2016) Pretreatment with Ginseng Fruit Saponins Affects Serotonin Expression in an Experimental Comorbidity Model of Myocardial Infarction and Depression. Aging and Disease, 7, 680-686. https://doi.org/10.14336/AD.2016.0729
- 10. Mineur, Y.S., Belzung, C. and Crusio, W.E. (2007) Functional Implications of Decreases in Neurogenesis Following Chronic Mild Stress in Mice. Neuroscience, 150, 251Y9.
- 11. Xin, X.W., Wei, L., Lei, W., Rui, Z., et al. (2014) A Neuroendocrine Mechanism of Co-Morbidity of Depression-Like Behavior and Myocardial Injury in Rats. PLoS ONE, 9, e8842. https://doi.org/10.1371/journal.pone.0088427
- 12. D’Aquila, P.S., Newton, J. and Willner, P. (1997) Diurnal Variation in the Effect of Chronic Mild Stress on Sucrose Intake and Preference. Physiology & Behavior, 62, 421-426.
- 13. Pechlivanova, D., Tchekalarova, J., Nikolov, R. and Yakimova, K. (2010) Dose-Dependent Effects of Caffeine on Behavior and Thermoregulation in a Chronic Unpredictable Stress Model of Depression in Rats. Behavioural Brain Research, 209, 205-211.
- 14. Morgan, J.K., Olino, T.M., McMakin, D.L., Ryan, N.D. and Forbes, E.E. (2013) Neural Response to Reward as a Predictor of Increases in Depressive Symptoms in Adolescence. Neurobiology of Disease, 52, 66-74.
- 15. Shen, J., Zhang, J., Deng, M., Liu, Y., Hu, Y. and Zhang, L. (2016) The Antidepressant Effect of Angelica sinensis Extracts on Chronic Unpredictable Mild Stress-Induced Depression Is Mediated via the Up-Regulation of the BDNF Signaling Pathway in Rats. Evidence-Based Complementary and Alternative Medicine, 2016, Article ID: 7434692. https://doi.org/10.1155/2016/7434692
- 16. Kimura, K., Ieda, M. and Fukuda, K. (2012) Development, Maturation, and Trans-Differentiation of Cardiac Sympathetic Nerves. Circulation Research, 110, 325-336. https://doi.org/10.1161/CIRCRESAHA.111.257253
- 17. Fukuda, K., Kanazawa, H., Aizawa, Y., Ardell, J.L. and Shivkumar, K. (2015) Cardiac Innervation and Sudden Cardiac Death. Circulation Research, 116, 2005-2019.
- 18. Buchanan, G.F. and Richerson, G.B. (2010) Central Serotonin Neurons Are Required for Arousal to CO2. Proceedings of the National Academy of Sciences, 107, 16354-16359. https://doi.org/10.1073/pnas.1004587107
- 19. Christ, T., Rozmaritsa, N., Engel, A., Berk, E., Knaut, M., Metzner, K., Canteras, M., Ravens, U. and Kaumann, A. (2014) Arrhythmias, Elicited by Catecholamines and Serotonin, Vanish in Human Chronic Atrial Fibrillation. Proceedings of the National Academy of Sciences, 111, 11193-11198.
- 20. Ajijola, O.A., Yagishita, D., Patel, K.J., Vaseghi, M., Zhou, W., Yamakawa, K., So, E., Lux, R.L., Mahajan, A. and Shivkumar, K. (2013) Focal Myocardial Infarction Induces Global Remodeling of Cardiac Sympathetic Innervation: Neural Remodeling in a Spatial Context. American Journal of Physiology. Heart and Circulatory Physiology, 305, H1031-H1040. https://doi.org/10.1152/ajpheart.00434.2013
- 21. Schwartz, P.J., Vanoli, E., Stramba-Badiale, M., DeFerrari, G.M., Billman, G.E. and Foreman, R.D. (1988) Autonomic Mechanisms and Sudden Death. New Insights from Analysis of Baroreceptor Reflexes in Conscious Dogs with and without a Myocardial Infarction. Circulation, 78, 969-979. https://doi.org/10.1161/01.CIR.78.4.969
- 22. Sullivan, G.M., Oquendo, M.A., Milak, M., Miller, J.M., Burke, A., Ogden, R.T., et al. (2014) Positron Emission Tomography Quantification of Serotonin1A Receptor Binding in Suicide Attempters with Major Depressive Disorder. JAMA Psychiatry, 72, 169-178.
