Traditional Chinese Medicine
Vol.
08
No.
02
(
2019
), Article ID:
28975
,
7
pages
10.12677/TCM.2019.82015
Study on the Relationship between the Prevention of Insomnia and the Dopamine Receptor Pathway by Shugan Anshen Method
Xiufeng Wang, Xing Li, Yu Zhang, Xueai Zeng, Yifan Zhang, Junshan Huang*
Fujian Key Laboratory of Sleep Medicine of Traditional Chinese Medicine, Fujian Academy of Traditional Chinese Medicine, Fuzhou Fujian

Received: Feb. 2nd, 2019; accepted: Feb. 15th, 2019; published: Feb. 22nd, 2019

ABSTRACT
Objective: To observe the correlation between shugan anshen traditional Chinese medicine compound songyu anshen prescription and dopamine receptor in preventing insomnia. Methods: Insomnia model of rat was used. After successful modeling, SYF, dopamine receptor agonist pergolide, dopamine receptor antagonist spiperone, and drug combination were given for one week. At the end of the treatment, the contents of the neurotransmitter dopamine (DA) in rat brain tissue and plasma were determined by enzyme-linked immunosorbent assay (Elisa). Western Blotting assay was used to detect the expression level of dopamine receptor D2DR protein in brain tissue. Results: Compared with the control group, DA content in brain tissue and plasma of rats in the model group and pergolide group was significantly increased (P < 0.01), and D2DR protein expression level in brain tissue was also significantly increased (P < 0.01). However, in SYF + spiperone group, DA content and D2DR protein expression level in brain tissue and plasma of rats were significantly reduced (P < 0.01), and the same results were also observed in the combination group. Compared with pergolide group, DA content and D2DR protein expression level in brain tissue and plasma of SYF + pergolide group were significantly down-regulated (P < 0.01). Conclusion: The pathogenesis of liver-depression insomnia is similar to the action of dopamine receptor agonist. Songyu anshen prescription can inhibit the expression of D2DR protein and the release of DA induced by dopamine receptor agonist, and has the similar action with dopamine receptor antagonist, indicating that the action of shugan anshen method in preventing insomnia may be related to the dopamine receptor pathway.
Keywords:Shugan Anshen Method, Insomnia, Dopamine Receptor
疏肝安神法防治失眠与多巴胺受体途径的相关性研究
王秀峰,李星,张瑜,曾雪爱,张一帆,黄俊山*
福建省中医药研究院,福建省中医睡眠医学重点实验室,福建 福州

收稿日期:2019年2月2日;录用日期:2019年2月15日;发布日期:2019年2月22日

摘 要
目的:观察疏肝安神类中药复方松郁安神方防治失眠的作用与多巴胺受体的相关性。方法:利用失眠大鼠模型,造模成功后分别给予松郁安神方(SYF)、多巴胺受体激动剂pergolide、多巴胺受体拮抗剂spiperone以及联合用药1周。治疗结束后通过酶联免疫吸附测定(Elisa)方法检测大鼠脑组织和血浆中神经递质多巴胺(DA)的含量。运用Western Blotting实验检测脑组织多巴胺受体D2DR蛋白表达水平。结果:同对照组相比较,模型组和pergolide组大鼠脑组织和血浆中DA含量显著升高(P < 0.01),脑组织中D2DR蛋白表达水平同样显著上调(P < 0.01)。而SYF组、spiperone组则使得大鼠脑组织和血浆中DA含量以及D2DR蛋白表达水平均被显著性的降低(P < 0.01),联合用药组也呈现了同样的结果。SYF组 + pergolide组同pergolide组比较,大鼠脑组织和血浆中DA含量以及D2DR蛋白表达水平均被显著性的下调(P < 0.01)。结论:肝郁型失眠的发生机制同多巴胺受体激动剂作用相似,松郁安神方能够抑制多巴胺受体激动剂诱导的D2DR蛋白表达和DA的释放,与多巴胺受体拮抗剂作用相似,表明了疏肝安神法防治失眠的作用可能与多巴胺受体途径相关。
关键词 :疏肝安神法,失眠,多巴胺受体

Copyright © 2019 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
随着社会不断发展,人们的生活节奏加快,睡眠问题日益凸显,失眠是最常见的睡眠问题。中医学认为失眠的病机以肝郁为主,故对应的治疗应该是以疏肝解郁为主,兼以镇静安神之法。近几年关于此类方药治疗失眠的报道也在不断增加,临床也收到了不错的疗效 [1] [2]。但是它们的作用机制研究还是很薄弱的。松郁安神方即是
2. 材料与方法
2.1. 实验动物
实验选用雄性SD大鼠,8周龄,体重250 ± 10 g,56只,购于上海斯莱克实验动物有限责任公司,实验动物生产许可证号:SCXK(沪)2007-0005,质量合格证号:2007000525946,于福建省中医药研究院比较医学中心实验动物清洁级饲养室喂养。
2.2. 实验药物
中药复方松郁安神方由甘松10 g,郁金15 g,玫瑰花
2.3. 主要试剂
多巴胺受体抑制剂spiperone (Catalogue Number: S682000),多巴胺受体激动剂pergolide mesylate (Catalogue Number: P287200)均购于TRC公司;D2DR Antibody (B-10) (sc-5303)购于Santa Cruz公司。GAPDH (14C10) Rabbit mAb (CST: #2118S);Anti-mouse IgG,HRP-linked Antibody (CST: #7076S)购于CST公司;Anti-rabbit IgG,HRP-linked Antibody (CST: #7074S)购于CST公司。Anti-rabbit IgG, HRP-linked Antibody (CST: #7074S)购于CST公司。Rat DA ELISA Kit (货号:ml9003201)购于mlbio公司。
2.4. 失眠大鼠模型的建立
参考关于肝郁证失眠模型文献 [5] [6] [7] ,采用夹尾刺激法致大鼠肝郁:用大弯止血钳夹住大鼠的尾巴,令其与其他大鼠撕打,从而激怒全笼大鼠,令全笼大鼠处于对峙状态。每次夹尾刺激30 min,1天2次,持续1周。将形成肝郁的实验大鼠放在改良多平台上进行睡眠剥夺,连续剥夺3天,建立肝郁失眠复合型模型。实验在福建省中医药研究院动物实验室进行,湿度79% RH,室温
2.5. 实验大鼠的分组、给药及取材
造模成功后分成以下几组:对照组、模型组、松郁安神方组(SYF组)、spiperone组、SYF + spiperone组、pergolide组以及SYF + pergolide组,每组8只。SYF组大鼠用量为成人6倍(按体重计算)剂量,按15 ml/kg灌胃给药,1次/天,1周 [4]。spiperone按1 mg/kg剂量,pergolide按1 mg/kg剂量,均腹腔注射给药,1次/天,1周 [8]。对照组和模型组给予同等体积的生理盐水灌胃,1次/天,共7天。实验结束,将实验大鼠用戊巴比妥钠腹腔注射麻醉(40 mg/kg),腹主动脉取血5 mL装到抗凝管中,离心取上清,分装EP管中冻存备用。取血后,断头,剪开头皮,用血管钳揭去颅骨和硬脑膜,剪断双侧视神经后用眼科镊子迅速取出大鼠的整个脑组织。用0.9%氯化钠溶液冲洗干净,置于液氮或−80℃保存备用。
2.6. 神经递质的检测
神经递质的检测方法按照Rat DA ELISA Kit (货号:ml9003201)检测试剂盒说明书进行 [9]。取所需检测的大鼠血浆样本各50 μL,不同浓度标准品各50 μL分别加入96孔酶标板中。标准品孔和样本孔中每孔加入辣根过氧化物酶(HRP)标记的检测抗体100 μL,封板,37℃温育60 min。然后洗板5次。每孔加入底物A、B各50 μL,37℃避光孵育15 min。每孔加入终止液50 μL,15 min内,450 nm测OD值,计算样本的浓度。
2.7. Western blotting蛋白检测
将取材的大鼠脑组织按10 mg/100 μL加入Western细胞裂解液,经匀浆,超声粉碎后12000 r/min低温离心5 min,取上清液。采用BCA法定蛋白浓度,95度变性。配置5%的浓缩胶,10%的分离胶,待PAGE胶凝固后,按照样本顺序上样进行PAGE凝胶电泳,浓缩胶80 V,30 min和分离胶120 V,90 min。电泳结束后,取与凝胶大小一致的PVDF膜和滤纸,PVDF膜先在100%甲醇溶液中浸泡5 s,然后在转移缓冲液中浸泡10 min,按照负极、转印滤纸、凝胶、PVDF膜、转印滤纸、正极的顺序放入电泳槽,接通电源300 mA,120 min转移到PVDF膜上。转膜结束后,5%脱脂奶粉室温封闭PVDF膜60 min。弃去封闭液,加入一抗D2DR (1:200)或GAPDH (1:1000),4℃摇床反应过夜。次日,洗膜后加入HRP标记的二抗(1:2000)室温孵育2 h,洗膜后加入ECL显色,图像分析。应用Image J分析软件分析上述结果,计算每个蛋白印迹的密度与内参蛋白密度的比值,然后用药组再同对照组相比,作为被检测蛋白的相对表达量。
2.8. 统计学方法
实验结果用数据和图表显示,实验数据以X ± S表示,用SPSS16.0统计分析软件进行数据处理,多组间比较用单因素方差分析,组间两两比较用t检验。以P < 0.05为差异存在统计学意义,P < 0.01为差异显著。
3. 结果
3.1. 给予不同药物处理的大鼠脑组织中DA含量的变化情况
为了检测松郁安神方、多巴胺受体激动剂和拮抗剂单独及联合应用对实验大鼠DA含量的影响,运用Rat DA ELISA Kit检测用药处理后各组大鼠脑组织中DA含量,检测结果如图1所示:对照组大鼠脑组织中DA的含量为218.58 pg/mL,模型组为281.43 pg/mL,pergolide组DA的含量为294.06 pg/mL。与对照组相比较,模型组和pergolide组的DA含量显著升高(P < 0.01)。中药复方SPF组DA的含量为178.91 pg/mL,spiperone组DA的含量为149.61 pg/mL,同模型组相比较,这两组DA含量显著下降(P < 0.01)。spiperone组与SPF组之间具有用统计学差异(P < 0.05),药物联合应用组SYF + pergolide组(211.73 pg/mL),SYF + spiperone组(164.87 pg/mL),同样跟模型组具有显著差异(P < 0.01)。SYF + pergolide组与pergolide组相比,差异显著(P < 0.01)。
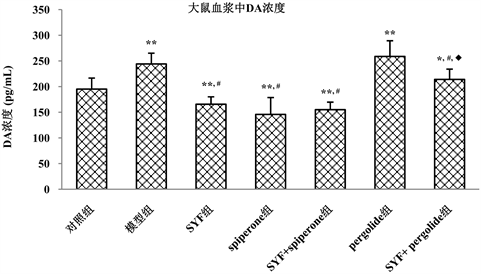
3.2. 不同药物处理对大鼠血浆中DA含量的影响
检测了大鼠脑组织中DA含量变化之后,我们对各组大鼠血浆中DA的含量进行了Elisa检测,结果如图2所示:与对照组大鼠血浆中DA的含量(195.28 pg/mL)相比较,模型组(244.18 ng/mL)和pergolide组(258.84 ng/mL)显著升高,具有显著的统计学差异(P < 0.01)。与模型组相比较,SYF组(165.80 ng/mL)和spiperone组(145.90 ng/mL)的血浆DA含量均显著降低(P < 0.01),药物联用组SYF + pergolide组(213.99 pg/mL),SYF + spiperone组(155.15 pg/mL),同模型组差异显著(P < 0.01)。SYF组与SYF + pergolide组比较具有显著地统计学差异(P < 0.01)。SYF组、spiperone组及SYF + spiperone组三组间无统计学差异。
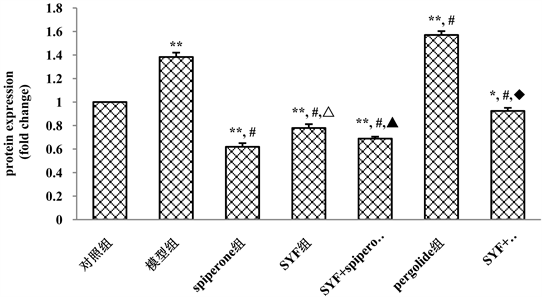
3.3. 松郁安神方药理作用与多巴胺受体的相关性
通过上述对实验大鼠不同用药处理后DA的含量变化的检测结果,我们想进一步证实具有疏肝安神作用的中药复方松郁安神方是否对多巴胺受体具有调节作用。因此,我们运用Western Blotting实验检测各组大鼠的脑组织中D2DR的表达变化,检测结果如图3和图4所示:同对照组相比较,模型组和多巴胺受体激动剂pergolide组的D2DR的表达水平被显著的上调(P < 0.01),多巴胺受体抑制剂spiperone组,中药复方SYF组以及SYF + pergolide组则显著的下调了脑组织中D2DR的蛋白表达水平(P < 0.01)。SYF组与spiperone组间比较具有显著统计学差异(P < 0.01),SYF + pergolide组与spiperone组间比较具有统计差异(P < 0.05)。SYF + pergolide组与pergolide组相比,D2DR的表达水平被显著的下调(P < 0.01)。
 注:与对照组比较,**P < 0.01;与模型组比较,#P < 0.01;与SYF组比较,△P < 0.05;与pergolide组比较,▲P < 0.01。
注:与对照组比较,**P < 0.01;与模型组比较,#P < 0.01;与SYF组比较,△P < 0.05;与pergolide组比较,▲P < 0.01。
Figure 1. Comparison of DA content in brain tissue of experimental rats
图1. 各组实验大鼠脑组织中DA含量比较
 注:与对照组比较,**P < 0.01;与模型组比较,#P < 0.01;与pergolide组比较,◆P < 0.01。
注:与对照组比较,**P < 0.01;与模型组比较,#P < 0.01;与pergolide组比较,◆P < 0.01。
Figure 2. Comparison of plasma DA content in experimental rats
图2. 各组实验大鼠血浆中DA含量比较
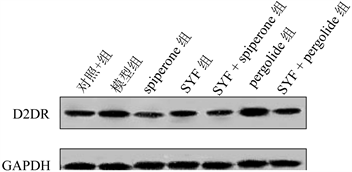
Figure 3. Expression of D2DR protein in brain tissue of rats in each group
图3. 各组大鼠脑组织D2DR蛋白表达情况
 注:与对照组比较,**P < 0.01;与模型组比较,#P < 0.01;与spiperone组比较,△P < 0.01,▲P < 0.05;与pergolide组比较,◆P < 0.01。
注:与对照组比较,**P < 0.01;与模型组比较,#P < 0.01;与spiperone组比较,△P < 0.01,▲P < 0.05;与pergolide组比较,◆P < 0.01。
Figure 4. Semi-quantitative analysis of D2DR protein expression in brain tissue of rats in each group
图4. 各组大鼠脑组织D2DR蛋白表达半定量分析
4. 讨论
睡眠是人类不可缺少的生理过程,失眠会引起一系列不良反应。偶尔的失眠会造成第二天疲倦和动作不协调,长期失眠则会严重影响生活质量。目前,对睡眠调控机制研究还不是很明确,临床上缺乏安全有效的失眠治疗药物 [10]。中医药在治疗失眠上有一定优势,应该加强关于中医药治疗失眠的研究。
DA是最常见的兴奋性神经递质,对维持觉醒起着重要的调节作用。本研究发现:肝郁失眠模型组同对照组比较,大鼠脑组织和血浆中的DA含量均显著的增加(P < 0.01),肝郁失眠模型组跟多巴胺受体激动剂pergolide组的作用相似。同时,我们发现中药复方SYF组效果同多巴胺受体拮抗剂spiperone组的作用一致。中药复方SYF能够显著性的抑制肝郁失眠模型和多巴胺受体激动剂对DA的释放促进作用(P < 0.01)。
大脑中多巴胺受体主要有Dl类和D2类两种受体,并且研究发现D2类多巴胺受体对内源性的多巴胺的亲和力大于Dl类多巴胺受体 [11]。D2类受体包括D2、D3、D4 3种亚型 [12] 多巴胺配体与多巴胺受体结合后活化,改变与其偶联的G蛋白构象,可以激活或抑制AC,引起cAMP生成增加或降低,调控cAMP调节的蛋白激酶A活性,进一步影响核内cAMP的反应元件结合蛋白和fos、jun等早基因的表达,调控生理或病理反应 [13] [14]。多巴胺D2受体是维持觉醒状态的主要受体 [15]。本研究发现:夹尾刺激结合改良水平台睡眠剥夺造成的大鼠肝郁失眠模型同多巴胺受体激动剂pergolide组的作用一致,均能够使大鼠脑组织中的D2DR的蛋白表达水平显著上调,同对照组比较,具有显著的统计学差异(P < 0.01)。而中药复方SYF组效果同多巴胺受体拮抗剂spiperone组的作用一致。中药复方SYF能够显著性的抑制肝郁失眠模型和多巴胺受体激动剂pergolide引起的D2DR的蛋白表达水平上调(P < 0.01)。
以上这些实验结果部分证实了,夹尾刺激结合改良水平台睡眠剥夺造成的大鼠肝郁失眠模型发生机制可能与多巴胺受体激动剂引起的睡眠觉醒作用一致。依照疏肝安神法组方的松郁安神方能够抑制肝郁失眠和多巴胺受体激动剂诱导的大鼠D2DR蛋白表达和DA的释放,与多巴胺受体拮抗剂作用相似,表明了疏肝安神法防治失眠的作用可能与多巴胺受体途径相关。
本研究的新颖性在于利用肝郁失眠大鼠模型,证明了肝郁型失眠的形成和多巴胺受体具有相关性,并通过按照疏肝解郁安神的治法而组方的松郁安神方得到验证,进而丰富了失眠的中医理论基础。但是,失眠的机制目前还没有研究清楚,影响因素很多。我们的中医药组成也是非常的复杂,多成分,多靶点是它们的显著特点。以至于松郁安神方具体有哪些主要成分可以作用于多巴胺受体系统还不是很清楚,另外,这些主要成分可能还会作用于其他影响睡眠的因素。这些问题还需要继续探索。
5. 结论
综上所述,临床上常见的肝郁型失眠的机制可能与多巴胺受体途径相关,疏肝安神的中药复方松郁安神方能够通过调节D2DR受体,进而降低多巴胺的释放,达到治疗失眠的目的。关于中药复方松郁安神方是通过什么信号通路调控D2DR受体的机制以及松郁安神方主要的药效成分是什么还需要更深入的研究去证实。
基金项目
国家自然科学基金项目(81703843);福建省卫计委医药卫生科技创新项目(2015-CX-35);福建省科技厅公益类科研院所基本科研专项(2017R1035-3)。
文章引用
王秀峰,李 星,张 瑜,曾雪爱,张一帆,黄俊山. 疏肝安神法防治失眠与多巴胺受体途径的相关性研究
Study on the Relationship between the Prevention of Insomnia and the Dopamine Receptor Pathway by Shugan Anshen Method[J]. 中医学, 2019, 08(02): 74-80. https://doi.org/10.12677/TCM.2019.82015
参考文献
- 1. 游秋云, 王平, 吴丽丽, 田代志, 孔明望. 舒郁安神方对老年肝郁失眠证候模型大鼠学习记忆及脑组织谷氨酸、γ-氨基丁酸含量的影响[J]. 中国老年学杂志, 2011, 31(6): 1006-1009.
- 2. 欧碧阳, 李艳, 杨志敏, 徐碧云. 柴胡加龙骨牡蛎汤治疗失眠的机理[J]. 时珍国医国药, 2010, 21(8): 1887-1888.
- 3. 黄俊山, 曾雪爱, 黄兆迁, 吴文宝, 王雅丽, 樊书领, 陈铭奇. 松郁安神方对不同中医证型失眠患者血浆中5-羟色胺及多巴胺水平的影响[J]. 中医杂志, 2011, 52(24): 2119-2124.
- 4. 曾雪爱, 黄俊山, 王雅丽. 松郁安神方对REM睡眠剥夺大鼠认知功能及神经递质的影响[J]. 中国中医基础医学杂志, 2012, 18(4): 392-397.
- 5. 陈小野. 实用中医证候动物模型学[M]. 北京: 北京医科大学出版社, 1992: 23.
- 6. 朱洁, 申国明, 汪远金, 胡闻. 肝郁证失眠大鼠模型的建立与评价[J]. 中医杂志, 2011, 52(8): 689-692.
- 7. 游秋云, 王平, 田代志, 张舜波, 黄攀攀. 老年肝郁失眠证候大鼠模型的建立和评价[J]. 中国实验方剂学杂志, 2013, 19(2): 222-225.
- 8. 王健, 彭国光, 郑敏, 罗海彦. 培高利特对帕金森病大鼠保护作用的实验研究[J]. 中国药理学通报, 2004, 20(11): 1273-1276.
- 9. 王秀峰, 曾雪爱, 张瑜, 张一帆, 李星, 黄俊山. 养心安神药和重镇安神药对失眠大鼠神经递质的影响[J]. 中医学, 2018, 7(6): 357-363.
- 10. 赵忠新, 张红菊, 黄流清. 失眠的治疗药物及其使用方法研究进展[J]. 中国新药与临床杂志, 2007, 26(11): 851-856.
- 11. Rye, D.B. and Freeman, A.A.H. (2008) Dopamine in Behavioral State Control. In: Monti, J.M., Pandiperumal, S.R., Sinton, C.M., Pandi-Perumal and Sinton, C.M., Eds., Neurochemistry of Sleep and Wakefulness, Cambridge University Press, New York, 179-223.
- 12. Malvaez, M., Mhillaj, E., Matheos, D.P., Palmery, M. and Wood, M.A. (2011) CBP in the Nucleus Accumbens Regulates Cocaine-Induced Histone Acetylation and Is Critica1 for Cocaine-Associated Behaviors. Journal of Neuroscience, 31, 16941-16948. https://doi.org/10.1523/JNEUROSCI.2747-11.2011
- 13. Bateup, H.S., Svenningsson, P., Kuroiwa, M., Gonq, S., Nishi, A., Heintz, N. and Greengard, P. (2008) Cell Type-Specific Regulation of DARPP-32 Phosphorylation by Psychostimulant and Antipsychotic Drugs. Nature Neuroscience, 11, 932-939. https://doi.org/10.1038/nn.2153
- 14. Chen, J.C., Chen, P.C. and Chiang, Y.C. (2009) Molecular Mechanisms of Psychostimulant Addiction. Chang Gung Medical Journal, 32, 148-154.
- 15. 许奇, 曲卫敏, 黄志力. 多巴胺D2受体调控睡眠-觉醒研究进展[J]. 中国临床药理学与治疗学, 2010, 15(4): 361-366.
NOTES
*通讯作者。