Botanical Research
Vol.
08
No.
04
(
2019
), Article ID:
31176
,
11
pages
10.12677/BR.2019.84043
Advances in Phenylaprapanoid Metabolism and Its Enzyme Genes in Sweet Potato
Kaizhen Xie, Jiaqi Liu, Lei Ren, Tingting Zhang, Aimin Wang*
School of Life Science, Jiangsu Normal University, Xuzhou Jiangsu

Received: Jun. 17th, 2019; accepted: Jul. 1st, 2019; published: Jul. 8th, 2019

ABSTRACT
Sweet potato is an important crop for food, vegetable, feed, industry raw materials and bioenergy source in the world. Phenylpropane metabolism is an important pathway for the synthesis of secondary metabolites in plants. This review provides the advances in phenylaprapanoid metabolism and its enzyme genes in sweet potato.
Keywords:Sweet Potato, Phenylpropane Metabolism, Gene
甘薯苯丙烷类代谢及其酶基因研究进展
谢开珍,刘佳琪,任磊,张婷婷,王爱民*
江苏师范大学生命科学学院,江苏 徐州

收稿日期:2019年6月17日;录用日期:2019年7月1日;发布日期:2019年7月8日

摘 要
甘薯是世界上重要的粮食、蔬菜、饲料、工业原料和生物能源作物。苯丙烷代谢是植物体内次生代谢物合成的重要途径。本文论述了甘薯苯丙烷类代谢物及其酶基因的研究进展。
关键词 :甘薯,苯丙烷代谢物,基因

Copyright © 2019 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
甘薯(Ipomoea batatas (L.) Lam.),是世界上重要的粮食、蔬菜、饲料、工业原料和生物能源作物 [1]。我国的栽培面积和产量均居世界首位,总产量仅次于水稻、小麦和玉米。长期以来,因甘薯具有投入低、产量大、适应性广、抗逆性强等特点,在我国一直充当着抗灾救荒、保命粮的角色,是我国粮食安全的底线作物 [2]。近年来,因富含类黄酮等酚类抗氧化成分,其保健功能也日益引起人们的关注,更成为现代生活中新兴的营养保健食品,具有保健作用的功能性新型甘薯品种已极大地改变了传统食用甘薯的概念。世界卫生组织(WHO)、美国公共利益科学中心(CSPI)研究认为甘薯营养指数最高,推荐其为最佳食品榜首 [3] [4]。
苯丙烷代谢是植物体内次生代谢物合成的重要途径。含苯丙烷骨架的所有物质都是直接或间接由这一途径产生的。以莽草酸途径来源的苯丙氨酸为最初原料 [5] ,进入苯丙烷类代谢途径,经反式肉桂酸、香豆酸、阿魏酸、芥子酸等中间产物,进一步转化为香豆素、绿原酸,也可以形成乙酰CoA,再进一步转化为木质素、酚类物质、异黄酮类、植保素等终产物 [6]。
甘薯中,苯丙烷类代谢途径主要包括花青素、绿原酸、木质素等重要物质的代谢通路。本文主要对甘薯苯丙烷类代谢及其相关酶基因的研究进展做一概述。
2. 甘薯主要的苯丙氨酸代谢产物及其主要功能
2.1. 类黄酮类化合物
两个酚羟基的苯环(A-与B-环)通过一个C3链连接而成的所有化合物统称类黄酮类化合物(flavonoids)。在植物体内类黄酮类化合物常常与糖结合成苷的更加稳定的形式。Winkel-Shirley根据其母核上C环的氧化程度、氧化位置的不同,将类黄酮类化合物分为六大类:黄酮(flavones),黄酮醇(flavonol),黄烷酮(flavanone),黄烷醇(flavan-3-ol),异黄酮(isoflavone)和花青素(anthocyanin) [7]。甘薯富含类黄酮类化合物。Wang等利用UPLC-MS/MS方法检测并鉴定到甘薯中的75种类黄酮类化合物,其中包含有3种查耳酮类化合物,45种黄酮,8种黄烷酮,10种黄酮醇,2种黄烷醇类和7种花青素类 [8]。类黄酮类化合物的结构通式,如图1所示:
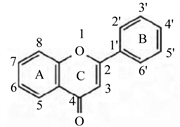
Figure 1. The basic chemical structure of flavonoids [9]
图1. 类黄酮类化合物的结构通式 [9]
2.2. 花青素
花青素是类黄酮类化合物中最丰富的一类水溶性色素,大量存在于植物细胞的液泡中。于植物本身具有抗氧化和呈色等作用 [10]。在生活中还具有调节机体免疫力、抗肿瘤、抗衰老、降血糖、增强记忆力等医疗保健功能 [11] [12]。植物体内花青素亦常与各种单糖结合形成糖苷,所以又被称为花色苷(anthocyains)。甘薯中花青素的含量在不同品种或同一品种的不同器官具有一定的差异,其中紫肉甘薯块根中含量最丰富,白肉甘薯块根中含量很少;而在紫肉甘薯中,其块根中的含量则大于茎、叶中花青素的含量 [13] [14] [15]。
有关花青素的另一个研究热点在于花青素的组分分析。1958年,Haborne等首次鉴定出紫甘薯花青素为经咖啡酸酰基化的矢车菊素3-槐糖苷5-葡糖苷 [16] ;1966年,Shi等鉴定出2种紫甘薯花青素为带三分子阿魏酸和一分子咖啡酸的芍药素以及含两分子阿魏酸和一分子咖啡酸的芍药素 [17] ;1992年,Odake K等鉴定出2种紫甘薯花青素化学结构为被咖啡酸和阿魏酸酰化的矢车菊素和芍药素 [18] ;1999年,日本Terahara等证实了紫甘薯品种“Yamagawamurasaki”含有8种酰化的花色苷,其中6种为双酰化结构,其中3-0-{6-O-(E)-咖啡酰-2-O-[6-O-(E)-咖啡酰-βD-吡喃葡糖基]-β-D-吡喃葡糖苷}-[5-O-(β-D-吡喃葡糖苷)]矢车菊素和芍药素以及3-O-{6-O-(E)-咖啡酰-2-O-[6-O-(E)-对羟基苯甲酰-β-D-吡喃葡糖基]-β-D-吡哺葡糖苷}-[5-O-(β-D-吡哺葡糖苷)]矢车菊素和芍药素4种是首次鉴定出来 [19]。2000年,Terahara等成功从新品种“Ayamurasaki”块根中鉴定出3-O-槐糖苷-5-O-葡糖苷矢车菊色素和3-O-{2-O-[6-O-(E)-ρ-香豆酰-β-D-吡喃葡糖基]-β-D-吡喃葡糖苷}-5-O-β-D-吡喃葡糖苷矢车菊色素2种新的花青素的结构 [20]。国内对紫甘薯花青素化学结构的研究起步较晚,2011年,江连洲等采用HPLC-MS等方法对紫甘薯花色苷结构进行鉴定 [21]。综上,紫甘薯中花青素主要为单酰基和双酰基化的花青素,已经明确在甘薯块根中的27种花青素组分(表1),而在甘薯叶片中也同样存在有花青素,已检测到的花青素组分有15种(表2),并且矢车菊素和芍药色素为两个主要成分。
Table 1. Anthocyanin compositions in the tuber root of sweet potato [22]
表1. 甘薯块根中检测到的花青素组分 [22]
Table 2. Anthocyanin compositions in sweet potato leaves [23]
表2. 甘薯叶中检测到的花青素组分 [23]
2.3. 绿原酸
绿原酸(chlorogenic acid),又名咖啡单宁酸,化学名为3-咖啡酰奎宁酸(3-ocaffeoylquinic acid),由咖啡酸与奎宁酸组成的缩酚酸,为甘薯苯丙烷代谢途径中含量最为丰富的酚类化合物 [24]。甘薯中的绿原酸主要存在于茎、叶、块根中,块根中的含量相对最少,而甘薯叶中绿原酸的含量最高,且存在绿原酸(3-caffeoylquinic acid),新绿原酸(5-caffeoyl-quinic acid)和隐绿原酸(4-caffeoylquinic acid)3种同分异构体 [25] [26] [27] [28]。绿原酸对甘薯本身而言具有抗病、抗虫害等作用外 [29] [30] [31]。闫征等研究还表明,绿原酸对紫甘薯的花色苷具有辅色和增强其热稳定的作用 [32]。此外,绿原酸在人类健康保健方面,具有抑菌、抗氧化、抗炎、抗病毒、抑制血栓形成、保护肝脏、免疫调节、抗肿瘤、致敏性、调节肠道平衡等诸多生物活性 [33]。
2.4. 木质素
木质素(lignin)是植物苯丙烷类代谢的又一类重要产物,为一类复杂、非结晶、三维网状的高分子聚合物。木质素作为纤维素的粘合剂,可以增强植物体的机械强度。木质素是植物细胞壁的主要成分之一,植物的生长分化与细胞壁的活动紧密相关,其功能主要表现在植物抗逆性和抗病性两方面。甘薯块根中的木质素含量一般约为1.5%。王连平等的实验表明乙烯、赤霉素、细胞分裂素、生长素等4种生长调节物质可促进机械损伤的甘薯薯块的木质素的合成,尤其以赤霉素和乙烯作用最为显著(P < 0.01);而5种供试的化学物质中,苯丙氨酸和蔗糖对甘薯切片木质素合成有很强的促进作用,且两者之间呈高度的线性正相关,有机酸(阿魏酸、柠檬酸和香豆酸)等则影响很弱;温度、相对湿度、氧分压是影响木质素合成的三种物理因素,其中温度最重要,其次是氧分压,相对湿度作用最小 [34]。木质素主要提高了宿主细胞抵抗病原菌穿透的能力,从而在抵抗薯瘟病、疮痂病等病原菌侵害时起到了天然屏障的作用 [35]。
3. 甘薯主要的苯丙烷类代谢相关酶基因研究进展
苯丙氨酸解氨酶催化L-苯丙氨酸脱去氨基形成反式肉桂酸,并在肉桂酸-4-羟化酶作用下羟基化形成反式-4-香豆酸,此为苯丙烷类代谢的核心途径。随后分别在香豆酸-3-羟化酶,4-香豆酸辅酶A连接酶、乙酰转移酶、查尔酮合成酶等酶作用下进入木质素、绿原酸以及黄酮类化合物(花青素等)合成的代谢途径。
3.1. 苯丙烷类代谢核心途径相关酶基因的研究
苯丙氨酸解氨酶(Phenylalanin ammonia-lyase, PAL),催化L-苯丙氨酸脱去氨基生成反式肉桂酸,是苯丙烷类公共代谢的第一步关键酶和限速酶,连接初级代谢与苯丙烷代谢。因此,PAL是苯丙烷代谢途径相关酶基因研究中研究最多的酶。Tanaka等克隆了甘薯PAL的cDNA序列,包含一个长为2121 bp的开放阅读框、编码707个氨基酸、22 bp的5′非编码区和207 bp的3′非编码区,并且推测PAL对甘薯受伤做出应答 [36]。研究表明,甘薯PAL功能还体现在抗病性上,青枯病和黑斑病病原菌侵入甘薯体内会导致PAL酶活性明显升高,因此,PAL活性可作为甘薯青枯病和黑斑病的一个检测指标 [37] [38] [39]。
肉桂酸-4-羟化酶(Cinnamate-4-hydroxylase, C4H):苯丙烷类物质公共代谢途径中第二步酶,催化苯丙氨酸代谢途径的第一个氧化反应,即催化肉桂酸羟基化形成反式-4-香豆酸。C4H是第一个被发现并成功克隆鉴定的编码P450单加氧酶的基因。杨春贤等利用RACE技术首次从甘薯中得到编码C4H的基因,命名为IbC4H [40]。经序列分析显示,此甘薯IbC4H长1668 bp,编码505个氨基酸。王爱民等从紫甘薯中成功克隆的IbC4H可响应逆境信号,提高甘薯的抗旱性 [41]。
3.2. 甘薯花青素的合成通路相关酶基因的研究
3.2.1. 甘薯花青素合成途径中相关酶基因的研究
花青素的合成代谢是类黄酮代谢途径中最重要的分支,由4-香豆酰–CoA连接酶催化香豆酸生成丙二酰辅酶A进入花青素合成,经查尔酮、黄酮醇柚皮素、二氢黄烷醇、二氢杨梅酮后合成各种花色素苷。甘薯花青素合成通路中已被克隆的相关酶基因包括查尔酮合成酶、查尔酮异构酶、类黄酮3′-羟化酶、二羟基黄酮醇还原酶、花青素合成酶、花青素还原酶和花青素3-O-糖苷-2″-葡萄糖基转移酶等。植物中花青素生物合成途径,如图2所示:

Figure 2. The biosynthesis pathway of antbocyanins in plants [59]
图2. 植物中花青素生物合成途径 [59]
查尔酮合成酶(Chalcone synthase, CHS)催化丙二酰辅酶A与香豆酰辅酶A生成柚皮素查尔酮,为黄酮类次级代谢提供原料。CHS不仅参与色素的形成,而且还与植物体内多种生理过程密切相关。甘薯中克隆得到的查尔酮合成酶基因,命名为IbCHS1,其cDNA全长1556 bp,其中包含编码388个氨基酸的1167 bp的开放阅读框。研究表明,IbCHS1基因主要在紫甘薯中表达,其表达水平与不同品种的甘薯花青素的含量呈正相关 [42]。
查尔酮异构酶(Chalcone isomerase, CHI)是合成花青素途径的一个上游关键酶,催化查尔酮异构化形成黄酮醇柚皮素。查尔酮异构酶超家族包括四种类型的CHI蛋白,即具有CHI蛋白酶活性的Ⅰ型、Ⅱ型,脂肪酸结合蛋白Ⅲ型和目前尚未具体了解其功能的IV型 [43]。甘薯中已被报道的两种CHI基因都属于Ⅰ型。徐靖等利用RT-PCR技术克隆了IbCHIL1, cDNA全长857 bp,包含编码206个氨基酸残基长621 bp的开放阅读框。IbCHIL1主要在紫肉甘薯中表达,其表达水平与花青素积累呈正相关 [44]。Guo等从紫甘薯中分离克隆的CHI基因全长cDNA序列,并命名为IbCHI,该基因包含一个732 bp的开放阅读框,编码一个243氨基酸多肽,并进一步表明IbCHI是负责甘薯花青素早期阶段合成通路中的关键酶 [45]。
类黄酮3′-羟化酶(Flavonoid 3'-hydroxylase, F3′H)是一个细胞色素P450依赖酶,在花青素合成中的羟基化起着重要作用,催化黄酮醇柚皮素(Naringenin)转化酶为二氢黄烷醇(Dihydrokaempferol)。Zhou等克隆了甘薯IbF3′H,cDNA全长1789 bp,含1554 bp的开放阅读框,编码518个氨基酸。研究表明,在花青素积累较多紫甘薯块根中,IbF3′H具有较高水平的表达,而IbF3′H不表达的白心甘薯块茎中花青素含量远低于紫薯块茎 [46]。
二羟基黄酮醇还原酶(Dihydroflavonol-4-Reductase, DFR)是合成花青素途径的一个下游关键酶,催化二羟基黄烷醇还原成无色花青素,与植物花色的修饰相关。赵宝杰等从紫甘薯块根中克隆的IbDFR基因,其cDNA全长l232 bp,编码398个氨基酸 [47]。有研究表明,甘薯在受冷害、损伤时,IbDFR的表达明显升高。IbDFR不仅在类黄酮代谢中承担角色,还有助于提高花青素在胁迫条件下清除活性氧自由基的能力 [48]。
花青素合成酶(Anthocyanin synthesis, ANS)是合成花青素途径倒数第二步的关键酶,催化无色花青素着色变成有色花青素。zhou等从紫肉甘薯中分离出IbANS全长cDNA序列,该基因包含了一个长1086 bp,编码362个氨基酸的开放阅读框 [49]。Liu等研究还发现,IbANS的表达与花青素的含量呈正相关,且在紫甘薯块根的表达水平远高于茎、叶等器官 [50]。
花青素还原酶(Anthocyanidin reductase, ANR)是原花青素代谢途径上的关键酶,催化矢车菊素转化成表儿茶素(2,3-顺式黄烷-3-醇),进一步向液泡中转运并聚合成原花青素。武传建等从徐薯3号中克隆出了一个编码ANR的IbANR基因,并发现了该基因的内含子多态性较高 [51]。
花青素3-O-糖苷-2″-葡萄糖基转移酶(3-O-glucoside-2″-O-glucosyltransferase, 3GGT)催化花青素3-O-糖苷转化为花青素3-O-槐糖苷。现已从甘薯cDNA库中鉴定出全长为1380 bp,编码459个氨基酸的基因序列。Ib3GGT糖基化发生在细胞质基质,并且受到IbMYB1转录因子基因的调控。Ib3GGT利用尿苷二磷酸葡萄糖(UDP-glucose)作为糖供体催化花青素3-O-糖苷转化为花青素3-O-槐糖苷。Ib3GGT上的138号苏氨酸(Thr-138)残基用以选择性识别糖供体,从而维持花青素的多样性与稳定性 [52]。
类黄酮3-葡萄糖基转移酶(UDP-glucose: flavonoid 3-O-glucosyltransferase, UF3GT)催化葡萄糖基转移到花青素的3-羟基,在花青素生物合成途径中产生第一个稳定的中间体。从甘薯分离鉴定出IbUF3GT的全长cDNA序列1541 bp,包含1359 bp的开放阅读框,编码452个氨基酸。并进一步克隆了IbUF3GT的启动子序列,实验结果表明其转录启动活性的关键元件位于−758至−633 bp的区域,其转录水平可能受转录调控因子MYB、MYC和光、水杨酸及赤霉素的调控 [53]。
3.2.2. 甘薯花青素合成转录调控因子
现已经明确,调控花青素合成的转录因子主要有MYB家族、BHLH家族、WD40家族。Dong等从紫肉甘薯中克隆的IbWD40,全长1427 bp,含1032 bp开放阅读框,编码含343个氨基酸的多肽链。IbWD40主要位于细胞核中参与转录调控,在花青素等类黄酮物质的合成调控中起着至关重要的作用 [54]。从紫甘薯中分离的MYB类转录因子IbMYB1的cDNA序列长1186 bp,该转录因子可以激活花青素合成途径中的结构基因的表达从而调控甘薯块根中花青素的生物合成 [55] [56] [57]。根据甘薯转录组数据,徐靖等采用RT-PCR技术从甘薯中克隆了长度为2120 bp的bHLH转录因子家族的IbGL3基因,该基因包含一个编码625个氨基酸、长度1878 bp的开放阅读框。IbGL3属于Ⅲf亚类成员,其表达水平与花青素积累呈正相关,在紫肉甘薯中的表达量最高,其次是浅紫肉甘薯,在白肉甘薯中的表达量最低 [58]。
3.3. 绿原酸及木质素的合成通路相关酶基因的研究
3.3.1. 甘薯绿原酸合成通路的研究
绿原酸合成过程中主要涉及两个关键酶:一是奎宁酸肉桂酸羟基化转移酶(Quinatehydroxylcinnamoyl transferase, HQT),该酶催化咖啡酰辅酶A与奎宁酸反应生成咖啡酰奎宁酸(绿原酸);二是乙酰转移酶(Hydroxylcinnamoyl transferase, HCT),该酶催化羟基化香豆酰辅酶A与香豆酰莽草酸或香豆酰奎宁酸反应,生成绿原酸。绿原酸生物合成途径研究主要集中在茄科作物中,甘薯中绿原酸的生物合成途径及调控尚未见报道,参与其合成过程中重要的酶、关键基因、调控因子,都有待进行深入研究。
3.3.2. 甘薯木质素合成通路的研究
植物中主要存在三种木质素,即H-木质素、G-木质素、S-木质素,其合成过程中主要有3个关键酶,即4-香豆酸辅酶A连接酶(4-coumarate coenzyme A ligase, 4CL)、肉桂酰辅酶A还原酶(cinnamoyl-CoA reductase, CCR)和肉桂醇脱氢酶(Cinnamyl alcohol dehydrogenase, CAD)。目前没有甘薯木质素合成途径中相关酶的研究报道,而其合成调控因子可以找到相关研究。miR828通过调节下游靶基因IbMYB和IbTLD的表达而增加了木质素的合成 [60]。在甘薯中关于木质素的合成代谢及其调控因子的研究仍需进一步扩充。
4. 展望
我国是甘薯种植大国,随着现代人们生活水平的不断提高,人们对于健康饮食越来重视。甘薯作为重要的粮食作物,富含蛋白质、淀粉、果胶、氨基酸、维生素及多种矿物元素,研究甘薯苯丙烷代谢途径,于甘薯具有提高产量和完善其基因组的意义,此类研究成果可用于农业生产,提高经济效益。紫甘薯富含花青素,而花青素具有抗癌、防衰老、美容养颜等作用,甘薯叶中含较多的绿原酸,绿原酸具有抗氧化、抑菌、免疫调节、抗肿瘤、保护肝脏等作用,因此,此类研究又可运用于医药保健、食品开发等领域。苯丙烷代谢产物花青素、绿原酸等在人们健康保健方面具有重要作用,而木质素对于甘薯在抗病虫害方面具有重要作用。于人类而言,运用基因工程等高科技技术手段的同时,也促进了生物领域的发展,带来巨大的经济效益,进一步满足人们追求绿色健康营养食品的需求。因此,对甘薯苯丙烷代谢途径的研究,具有广阔的前景。
项目基金
江苏省高等学校自然科学研究项目(18KJB180005);徐州市科技计划重点研发计划(社会发展)项目(KC18143),江苏师范大学博士学位教师科研支持项目(18XLRS014);江苏师范大学大学生创新创业团队组建和研究项目;江苏高校优势学科建设工程资助项目。
文章引用
谢开珍,刘佳琪,任 磊,张婷婷,王爱民. 甘薯苯丙烷类代谢及其酶基因研究进展
Advances in Phenylaprapanoid Metabolism and Its Enzyme Genes in Sweet Potato[J]. 植物学研究, 2019, 08(04): 355-365. https://doi.org/10.12677/BR.2019.84043
参考文献
- 1. 杨新笋, 雷剑, 苏文瑾, 王连军, 李明亮, 邓辉. 甘薯新品种鄂薯9号的选育与栽培技术[J]. 湖北农业科学, 2012, 51(17): 3696-3698.
- 2. 马代夫, 李强, 曹清河, 钮福祥, 谢逸萍, 唐君, 李洪民. 中国甘薯产业及产业技术的发展与展望[J]. 江苏农业学报, 2012, 28(5): 969-973.
- 3. 蒋海伟, 杨婷婷, 李红艳, 等. 茄子、紫薯和胡萝卜中植物化学物之间的抗氧化相互作用[J]. 中国食品学报, 2016, 16(7): 17-24.
- 4. 张毅, 钮福祥, 孙健, 等. 不同地区紫薯的花青素含量与体外抗氧化活性比较[J]. 江苏农业科学, 2017, 45(21): 205-207.
- 5. Schadel, W.E. and Jr., W.M.W. (1981) Localization of Phenols and Polyphenol Oxidase in “Jewel” Sweet Potato. Canadian Journal of Botany, 59, 1961-1967. https://doi.org/10.1139/b81-258
- 6. Walter, W.M. and Schadel, W.E. (1981) Distribution of Phenols in “Jewel” Sweet Potato [Ipomoea batatas (L.) Lam.] Roots. Journal of Agricultural and Food Chemistry, 29, 904-906. https://doi.org/10.1021/jf00107a003
- 7. Winkel-Shirley, B. (2001) It Takes a Garden. How Work on Diverse Plant Species Has Contributed to an Understanding of Flavonoid Metabolism. Plant Physiology, 127, 1399-1404. https://doi.org/10.1104/pp.010675
- 8. Wang, A., Li, R., Ren, L., et al. (2018) A Comparative Metabolomics Study of Flavonoids in Sweet Potato with Different Flesh Colors (Ipomoea batatas (L.) Lam). Food Chemistry, 260, 124-134. https://doi.org/10.1016/j.foodchem.2018.03.125
- 9. 方雅静, 何梦影, 潘思轶, 徐晓云. 类黄酮构效关系研究进展[J]. 华中农业大学学报, 2015, 34(6): 146-154.
- 10. 钟兰兰, 屠迪, 杨亚, 刘进辉. 花青素生理功能研究进展及其应用前景[J]. 生物技术进展, 2013, 3(5): 346-352.
- 11. 祝志欣, 鲁迎青. 花青素代谢途径与植物颜色变异[J]. 植物学报, 2016, 51(1): 107-119.
- 12. Lu, J., Wu, D.M., Zheng, Y., Hu, B. and Zhang, Z.F. (2010) Purple Sweet Potato Color Alleviates D-Galactose-Induced Brain Aging in Old Mice by Promoting Survival of Neurons viaPI3k Pathway and Inhibiting Cytochrome C-Mediated Apoptsis. Brain Pathology, 20, 598-612. https://doi.org/10.1111/j.1750-3639.2009.00339.x
- 13. 李霞, 王欣, 刘亚菊, 后猛, 闫会, 李强, 马代夫. 甘薯花青苷生物合成调控研究进展[J]. 分子植物育种, 2014, 12(3): 567-576.
- 14. 王浩亮, 斯啸寅, 程凯, 张益峰, 何敏, 罗昔松, 陆国权. 我国甘薯花青素开发现状与展望[J]. 安徽农业科学, 2009, 37(12): 5433-5435.
- 15. 王洪云, 张毅, 钮福祥, 孙健, 徐飞, 朱红, 岳瑞雪. 紫甘薯花青素研究进展[J]. 中国食物与营养, 2015, 21(5): 24-27.
- 16. Harborne, J.B. (1958) Spectral Methods of Characterizing Anthocyanins. Biochemical Journal, 70, 2228. https://doi.org/10.1042/bj0700022
- 17. Shi, Z., Bassa, I.A., Gabriel, S.L., et al. (1992) Anthocyanin Pigments of Sweet Potatoes (Ipomoea Batatas). Journal of Food Science, 57, 755-757. https://doi.org/10.1111/j.1365-2621.1992.tb08088.x
- 18. Odake, K., Terahara, N., Saito, N., et al. (1992) Chemical Structures of Two Anthocyanins from Purple Sweet Potato, Ipomoea batatas. Phytochemistry, 31, 2127-2130. https://doi.org/10.1016/0031-9422(92)80378-R
- 19. Terahara, N., Shimizu, T., Takashige, K., et al. (1999) Diaeylated Anthocyanins from the Storage Root of Purple Sweet Potato. Bioscience, Biotechnology, and Biochemistry, 63, 1420-1424. https://doi.org/10.1271/bbb.63.1420
- 20. Terahara, N., Konczak Islam, I., Nakatani, M., et al. (2000) Anthocyanins in Callus Induced from Purple Storage Root of Ipomoea batatas. Phytochemistry, 54, 919-922. https://doi.org/10.1016/S0031-9422(00)00099-6
- 21. 江连洲, 王晰锐, 张超, 等. HPLC-MS法鉴定不同品种紫甘薯中花色苷组成[J]. 中国食品学报, 2011, 11(5): 176-181.
- 22. Lee, M.J., Park, J.S., Choi, D.S., et al. (2013) Characterization and Quantitation of Anthocyanins in Purple-Fleshed Sweet Potatoes Cultivated in Korea by HPLC-DAD and HPLC-ESI-QTOF-MS/MS. Journal of Agricultural and Food Chemistry, 61, 3148-3158. https://doi.org/10.1021/jf3055455
- 23. Islam, M.S., Yoshimoto, M., Terahara, N., et al. (2002) Anthocyanin Compositions in Sweetpotato (Ipomoea batatas L.) Leaves. Journal of the Agricultural Chemical Society of Japan, 66, 2483-2486. https://doi.org/10.1271/bbb.66.2483
- 24. 刘颖, 郭明晔, 自根本, 等. 绿原酸的研究进展[J]. 中药材, 2012, 36(7): 1180.
- 25. 李悦丰, 尹婷, 钱金萍, 等. 红薯叶中绿原酸的提取纯化工艺研究[J]. 四川食品与发酵, 2006, 42(4): 27.
- 26. Zheng, W. and Clifford, M.N. (2008) Profiling the Chlorogenic Acids of Sweet Potato (Ipomoea batatas) from China. Food Chemistry, 106, 147-152. https://doi.org/10.1016/j.foodchem.2007.05.053
- 27. 尹永芹, 沈志滨, 孔令义. 巴西甘薯叶化学成分研究[J]. 中药材, 2008, 10(31): 1501-1503.
- 28. 石伯阳, 李佳银, 周桥, 朱丽娜, 陆英. 紫甘薯中绿原酸及异绿原酸的高速逆流色谱分离[J]. 食品科学, 2013, 34(13): 87-90.
- 29. 王伟, 阮妙鸿, 邱永祥, 等. 甘薯抗薯瘟病的苯丙烷类代谢研究[J]. 中国生态农业学报, 2009, 17(5): 944.
- 30. 刘海晶, 段立清, 李海平, 等. 绿原酸提高舞毒蛾核型多角体病毒(LdNPV)的致病力[J]. 昆虫学报, 2016, 59(5): 568.
- 31. 陈建新, 吴雅琴. 甘薯块根内绿原酸、酚含量与抗象甲关系初探[J]. 北京农业大学学报, 1994, 20(2): 178.
- 32. 闫征, 李春阳. 绿原酸对紫薯花色苷的辅色作用研究[J]. 西南农业学报, 2012, 25(6): 2218-2221.
- 33. 王珍, 李宗芸. 绿原酸的生物活性及甘薯绿原酸研究进展[J]. 江苏师范大学学报(自然科学版), 2017, 35(3): 30-34+48.
- 34. 王连平, 席与芳, 王汉荣, 郜海燕, 余舰斌. 外源处理对机械损伤甘薯块根木质素合成的影响[J]. 江西农业学报, 2004(1): 20-24.
- 35. Rhodes, J.C. (1976) Activity of Enzymes Involved in Lignin Biosynthesis in Sweet Root Disk. Phytochemistry, 15, 707-710. https://doi.org/10.1016/S0031-9422(00)94426-1
- 36. Tanaka, Y., Matsuoka, M., Yamanoto, N., et al. (1989) Structure and Characterization of a cDNA Clone for Phenylalanine Ammonia-Lyase from Cut-Injured Roots of Sweet Potato. Plant Physiology, 90, 1403-1407. https://doi.org/10.1104/pp.90.4.1403
- 37. 谢世勇, 卢同, 李本金, 等. 苯丙氨酸解氨酶、过氧化物酶与甘薯抗青枯病的关系[J]. 福建农业学报, 2003, 18(4): 236-238.
- 38. 刘美艳, 孙厚俊, 王景景, 等. 甘薯块根抗黑斑病酚类物质代谢的研究[J]. 中国农学通报, 2012, 28(24): 226-230.
- 39. 王星, 罗双霞, 于萍, 罗蕾, 赵建军, 王彦华, 申书兴, 陈雪平. 茄科蔬菜苯丙烷类代谢及相关酶基因研究进展[J]. 园艺学报, 2017, 44(9): 1738-1748.
- 40. 张华玲, 刘绪, 杨春贤, 黄元射, 傅玉凡, 张启堂. 甘薯肉桂酸-4-羟化酶基因克隆及序列分析[J]. 广西植物, 2018, 38(4): 501-508.
- 41. Wang, A., Zhu, M., Luo, Y., et al. (2017) A Sweet Potato Cinnamate 4-Hydroxylase Gene, IbC4H, Increases Phenolics Content and Enhances Drought Tolerance in Tobacco. Acta Physiologiae Plantarum, 39, 276. https://doi.org/10.1007/s11738-017-2551-1
- 42. 徐靖, 朱家红, 王效宁, 韩义胜, 唐力琼, 朱红林. 甘薯查尔酮合成酶基因IbCHS1的克隆和表达分析[J]. 分子植物育种, 2018, 16(6): 1752-1757.
- 43. 海南省农业科学院粮食作物研究所. 一种甘薯查尔酮异构酶IbCHIL1及其编码基因和应用[P]. 中国. CN201810053230.2. 2018-07-03.
- 44. 徐靖, 朱家红, 韩义胜, 白翠云, 朱红林. 一个新的甘薯查尔酮异构酶基因的克隆和表达分析[J]. 基因组学与应用生物学, 2018, 37(2): 845-849.
- 45. Guo, J., Zhou, W., Lu, Z., et al. (2015) Isolation and Functional Analysis of Chalcone Isomerase Gene from Purple-Fleshed Sweet Potato. Plant Molecular Biology Reporter, 33, 1451-1463. https://doi.org/10.1007/s11105-014-0842-x
- 46. Zhou, W., Gong, Y., Lu, X., et al. (2012) Molecular Cloning and Characterization of a Flavonoid 3’-Hydroxylase Gene from Purple-Fleshed Sweet Potato (Ipomoea batatas). Molecular Biology Reports, 39, 295-302.
- 47. 赵宝杰, 侯夫云, 王庆美, 李爱贤, 张立明. 甘薯二羟基黄酮醇还原酶基因的克隆及在大肠杆菌中的表达[J]. 分子植物育种, 2008(3): 583-586.
- 48. Wang, H., Fan, W., Li, H., Yang, J., Huang, J., et al. (2013) Functional Characterization of Dihydroflavonol-4-Reductase in Anthocyanin Biosynthesis of Purple Sweet Potato Underlies the Direct Evidence of Anthocyanins Function against Abiotic Stresses. PLoS ONE, 8, e78484. https://doi.org/10.1371/journal.pone.0078484
- 49. Zhou, W., Huang, C., Gong, Y., et al. (2010) Molecular Cloning and Expression Analysis of an ANS Gene Encoding Anthocyanidin Synthase from Purple-Fleshed Sweet Potato [Ipomoea batatas (L.) Lam]. Plant Molecular Biology Reporter, 28, 112-121. https://doi.org/10.1007/s11105-009-0133-0
- 50. Liu, X., Chen, M., Li, M., et al. (2010) The Anthocyanidin Synthase Gene from Sweetpotato [Ipomoea batatas (L.) Lam]: Cloning, Characterization and Tissue Expression Analysis. African Journal of Biotechnology, 925, 3748-3752.
- 51. 武传建, 戚骁, 李仁赛, 封功成, 苏静静, 葛海军, 马代夫, 王爱民. 甘薯IbANR基因的多态性分析[J]. 江苏师范大学学报(自然科学版), 2017, 35(1): 30-33+45.
- 52. Wang, H., Wang, C., Fan, W., Yang, J., Appelhagen, I., Wu, Y. and Zhang, P. (2018) A Novel Glycosyltransferase Catalyses the Transfer of Glucose to Glucosylated Anthocyanins in Purple Sweet Potato. Journal of Experimental Botany, 69, 5445–5459. https://doi.org/10.1093/jxb/ery305
- 53. Hu, M., Lu, Z., Guo, J., Luo, Y., Li, H., Li, L. and Gao, F. (2016) Cloning and Characterization of the cDNA and Promoter of UDP-Glucose: Flavonoid 3-O-Glucosyltransferase Gene from a Purple-Fleshed Sweet Potato. South African Journal of Botany, 106, 211-220. https://doi.org/10.1016/j.sajb.2016.07.018
- 54. Dong, W., Niu, L., Gu, J., et al. (2014) Isolation of a WD40-Repeat Gene Regulating Anthocyanin Biosynthesis in Storage Roots of Purple-Fleshed Sweet Potato. Acta Physiologiae Plantarum, 36, 1123-1132. https://doi.org/10.1007/s11738-014-1487-y
- 55. Park, S.C., Kim, Y.H., Kim, S.H., et al. (2015) Overexpression of the IbMYB1 Gene in an Orange-Fleshed Sweet Potato Cultivar Produces a Dual-Pigmented Transgenic Sweet Potato with Improved Antioxidant Activity. Physiologia Plantarum, 153, 525-537. https://doi.org/10.1111/ppl.12281
- 56. Dong, W., Niu, L., Li, H., et al. (2015) Isolation and Analysis of the Promoter of IbMYB1 Gene from Storage Roots of Purple-Fleshed Sweet Potato. Journal of Plant Biochemistry and Biotechnology, 25, 278-284. https://doi.org/10.1007/s13562-015-0339-1
- 57. Kim, C.Y., Ahn, Y.O., Kim, S.H., et al. (2010) The Sweet Potato IbMYB1 Gene as a Potential Visible Marker for Sweet Potato Intragenic Vector System. Physiologia Plantarum, 139, 229-240. https://doi.org/10.1111/j.1399-3054.2010.01365.x
- 58. 徐靖, 朱红林, 朱家红, 等. 甘薯IbGL3的克隆和表达分析[J]. 广西植物, 2018, 38(10): 1356-1362.
- 59. 肖伟, 张铭芳, 张秀海, 王倩, 董然. 百合花青素合成调控的研究进展[J]. 北方园艺, 2018(20): 154-162.
- 60. Lin, J.S., Lin, C.C., Lin, H.H., Chen, Y.C. and Jeng, S.T. (2012) MicroR828 Regulates Lignin and H2O2 Accumulation in Sweet Potato on Wounding. The New Phytologist, 196, 427-440. https://doi.org/10.1111/j.1469-8137.2012.04277.x
NOTES
*通讯作者。
