Journal of Advances in Physical Chemistry
Vol.07 No.03(2018), Article ID:26571,8
pages
10.12677/JAPC.2018.73016
Study on Thermodynamic Properties of Copper Sulfide Surface by Solubility Method
Fanghong Qin, Yong Lv, Biyuan Xiao, Zijun He, Jiangyuan Qiu, Zaiyin Huang*
College of Chemistry and Chemical Engineering, Guangxi University for Nationalities, Nanning Guangxi

Received: Aug. 5th, 2018; accepted: Aug. 17th, 2018; published: Aug. 24th, 2018

ABSTRACT
Nanocrystalline copper sulphide particles were prepared by coprecipitation method. The solution equilibrium constants of nanometer copper sulfide and corresponding bulk copper sulfide at 288.15 K, 298.15 K, 308.15 K, 318.15 K, 328.15 K were determined by solubility method. Based on the theory of dissolution thermodynamics, the dissolution thermodynamic function of copper sulfide was further calculated, and the surface thermodynamic function of copper sulfide was obtained by comparison with bulk.
Keywords:Solubility Method, Copper Sulphide, Thermodynamic Function
溶解度法研究硫化铜表面热力学性质
覃方红,吕勇,肖碧源,贺子君,邱江源,黄在银*
广西民族大学化学化工学院,广西 南宁

收稿日期:2018年8月5日;录用日期:2018年8月17日;发布日期:2018年8月24日

摘 要
采用共沉淀法制备了纳米硫化铜颗粒,采用溶解度法分别测定了纳米硫化铜和对应块体硫化铜在288.15 K、298.15 K、308.15 K、318.15 K、328.15 K时的溶液平衡常数,依据溶解热力学理论进一步计算了硫化铜的溶解热力学函数,通过与块体对比进一步获取了硫化铜的表面热力学函数。
关键词 :溶解度法,硫化铜,热力学函数

Copyright © 2018 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
纳米科技的出现为传统材料不能解决的问题提供了机遇与广阔的空间。纳米硫化铜因其具有多种化学计量比、形貌结构丰富且无毒无害在非线性光学材料 [1] 、光催化材料 [2] 、锂电子阴极材料 [3] 、光热转换 [4] 、光电传感器 [5] 等领域具有广泛的应用。如李岳彬等 [6] 制备了超小尺寸CuS半导体表面等离子激元光热纳米颗粒,组装复合获得一种新型的基于硫化铜纳米盘聚集体的CuS-PTX/SiO2复合纳米胶囊,在肝癌细胞HepG2的体内/外杀伤实验中表现出了显著的光热–化学联合治疗效果。俞书宏教授课题组 [7] 设计出了一种独特的同质异相硫化铜半导体纳米异质结,促进了体系中光生电子和空穴的分离和传输,显著提升了其在光电转换应用中的性能。Wang等 [8] 制备的质量比是1%的CuS/TiO2光催化剂具有优异的光催化产氢性能和稳定性。
纳米材料的热力学性质是纳米材料原子排布结构的综合体现,与其吸附 [9] 、传感 [10] 、催化 [11] 性能密切相关。长期以来硫化铜的光学性质、化学性质的研究取得了长足的发展,但由于技术方法的局限纳米硫化铜的热力学性质研究仍不深入 [12] [13] 。主要原因如下:1) 纳米材料具有极高的表面能不可避免的吸附空气中杂质,用传统的热熔法获取纳米材料的热力性质无法代表真实体系;2) 当前采用的接触角法,该技术对纳米材料的表面光滑度要求极高,使其表面能的测定极其困难;3) 采用理论计算方法也因体系存在诸多假设,无法代表真实体系。因此发展科学的技术方法获取纳米材料的热力学函数,是材料科学、表面科学领域亟待解决的科学难题。
本研究组自2009年起致力于纳米材料的热力学函数的测定,已经提出了电化学法 [14] 、微量热法 [15] 、溶解法 [16] 研究纳米材料的规定热力学函数及表面热力学函数。其中溶解度法因具有操作简单、高精度、高灵敏度的特点,测定难溶盐类纳米材料具有独特的优势。因此本工作基于溶解度法结合溶解热力学理论,获取了纳米硫化铜的溶解热力学函数、表面热力学函数。
2. 实验部分
2.1. 试剂与仪器
试剂:五水硫代硫酸钠、五水硫酸铜购于国药集团化学试剂有限公司;聚乙烯醇(PVA)购于成都市科龙化工试剂厂;无水乙醇购于汕头西陇化工股份有限公司,所有药品均为分析纯,使用前未经过进一步纯化。
仪器:场发射扫描电子显微镜(德国卡尔蔡司公司,SUPRA 55 Sapphire)、X射线粉末衍射仪(日本理学株式会社,MiniFlex600)、磁力加热搅拌器(德国ika公司,RT 10)、恒温水浴槽(德国Julabo公司,ED-19M)、真空干燥箱(上海精宏实验设备有限公司,DZF-6050)、电导率仪(上海佑刻,DDS-308型)。
2.2. 制备纳米CuS
先将0.012 g PVA通过超声振荡溶解在去离子水中。静置后将和0.78 g溶解在PVA溶液中得到绿色胶状溶液。接下来将混合液转移到25 mL聚四氟乙烯水热反应釜中,密封反应釜放入烘箱中在120℃加热5 h。反应结束以后让反应釜自然冷却到室温。将产品取出后离心分离,无水乙醇冲洗三次,去离子水冲洗三次。然后将产物放在烘箱里60℃干燥3 h得到黑色纳米硫化铜颗粒。
2.3. 制备块体CuS
将1.5 g 和0.78 g 溶解在PVA溶液中得到绿色胶状溶液。接下来将混合液转移到25 mL聚四氟乙烯水热反应釜中,密封反应釜放入烘箱中在120℃加热5 h。反应结束以后让反应釜自然冷却到室温。将产品取出后离心分离,无水乙醇冲洗三次,去离子水冲洗三次。然后将产物放在烘箱里60℃干燥3 h得到黑色硫化铜大颗粒。
2.4. 电导率的测定
打开电导率仪预热30 min,用0.01 mol−1的KCl溶液测定电导率仪的电极常数;测定纯水的电导率;称取0.1000 g左右的CuS微晶体,超声,加热溶解,制得CuS饱和溶液,离心分离,取上清液,之后用超高精度低温恒温恒槽恒温,当测定的温度达到预设温度后,将铂黑电极插入溶液中测其电导率,记录数值,搅拌,再记录数值,重复三次;在288.15 K、293.15 K、298.15 K、303.15 K、308.15 K下,重复上述实验。
3. 结果与讨论
图1中(a)为纳米硫化铜的扫描电镜图,由图发现其形貌较为规整。图1(b)是硫化铜的XRD图谱,各衍射峰强度较强,峰宽较窄表明它们具有良好的结晶度。未见出现Cu (0)和Cu (II)的杂质峰表明所制备的CuS纳米晶较纯。
3.1. 溶解热力学函数
在难溶电解质硫酸钙的饱和溶液中存在下列平衡:
其溶解积为:
(1)
 (a) 立方体Cu2O的SEM图
(a) 立方体Cu2O的SEM图
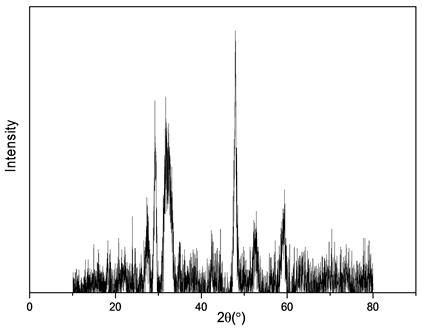 (b) 立方体Cu2O的XRD谱
(b) 立方体Cu2O的XRD谱
Figure 1. SEM images and XRD spectrum of CuS
图1. 纳米CuS的SEM图和XRD谱
摩尔电导率与电导率的关系:
(2)
式中c为溶液的浓度,其单位mol∙m−3微溶盐的溶解度很小,饱和溶液和的浓度值很低,所以式中 可认为就是 。
c为饱和溶液中微溶盐的溶解度,即:
(3)
根据科尔劳施离子独立运动定律:
(4)
查表可以得知:
故:
因为硫化铜在水中的溶解度非常小,可以按照无限稀释来处理,即:
对于难溶盐硫化铜的溶解反应,可以认为完全电离生成 和 的过程,因此有:
由于硫化铜属于难溶盐,其在水中的溶解度可以根据(3)式可得:
(4)
注:在试验中所测定的饱和溶液的电导率值为盐与水的电导率之和:
k (溶液) = k (水) + k (盐),k (盐) = k (溶液) − k (水),式中k (盐)是纯微溶盐的电导率。
由表1可知不同温度下水和样品溶液的平均电导率,计算可得
将表2中的数据代入公式即:
计算出不同温度块体和纳米硫化铜的浓度,结果如表3。
将表3中的数据代入公式即:
计算出同温度不下硫化铜的溶解平衡常数,结果如表4。
根据计算得到的溶解标准平衡常数,可以得到标准溶解Gibbs自由能:
式中: 为溶解的Gibbs自由能,单位为KJ∙mol−1;R为气体常数,单位为J∙mol−1∙K−1;T为反应温度,单位为K。
Table 1. Conductivity of pure water and copper sulfide solution at different temperatures
表1. 不同温度下纯水和硫化铜溶液的电导率
Table 2. Conductivity of copper sulfide at different temperatures
表2. 不同温度下硫化铜的电导率
Table 3. Concentration of copper sulfide at different temperatures
表3. 不同温度下硫化铜的浓度
将表4中的数据代入公式即:
计算出不同温度不下硫化铜的Gibbs自由能,结果如表5。
在恒温恒压下,当 与温度T的线性关系较好时,可以根据下式计算标准溶解焓和熵:
将 对温度T作图,并进行线性拟合,得到的直线截距即为溶液标准溶解焓 ,单位为KJ∙mol−1;直线斜率的相反数即为纳米颗粒的标准溶解熵 ,单位为J∙mol−1∙K−1。
从图2可知块体硫化铜的标准溶解焓 和标准溶解熵 分别为:28.81 kJ∙mol−l和−20.90 J∙mol−1∙K−1。
从图3可知纳米硫化铜的标准溶解焓 和标准溶解熵 分别为:31.14 kJ∙mol−l和−50.80 J∙mol−1∙K−1。
3.2. 表面热力学函数
纳米体系的Gibbs自由能由体相和表面相两部分组成,忽略块体材料的表相,并且假设块体材料与与其对应的纳米材料体相相同,因此两者摩尔Gibbs自由能的差值即为纳米反应体系的摩尔表面Gibbs自由能,表达式如下 , 。
根据热力学基本方程 ,可得纳米反应体系的摩尔表面熵的表达式为 则计算得纳米氧化亚铜在标况下的各表面热力学函数结果如表6。
Table 4. Dissolution equilibrium constants of copper sulfide at the same temperature
表4. 同温度不下硫化铜的溶解平衡常数
Table 5. Gibbs free energy of copper sulfide at different temperatures
表5. 不同温度不下硫化铜的Gibbs自由能
Table 6. Nano-CuS surface thermodynamic functions
表6. 纳米CuS在的表面热力学函数

Figure 2. The standard dissolved Gibss free energy of bulk copper sulfide varies with temperature
图2. 块体硫化铜的标准溶解Gibss自由能随温度变化

Figure 3. The standard dissolved Gibss free energy of nano-copper sulphide varying with temperature
图3. 纳米硫化铜的标准溶解Gibss自由能随温度变化
4. 结论
溶解度法因具有操作简单、高精度、高灵敏度的特点,测定难溶盐类纳米材料具有独特的优势。本文采用溶解度法分别测定了纳米硫化铜和对应块体硫化铜在288.15 K、293.15 K、298.15 K、303.15 K、308.15 K时的溶液平衡常数,依据溶解热力学理论进一步计算了硫化铜的溶解热力学函数,通过与块体对比进一步获取了硫化铜的表面热力学函数 分别为2.33 kJ/mol,−6.59 kJ/mol,29.9 J/(mol∙K)。
基金项目
国家自然科学基金项目(21273050,21573048);广西研究生教育创新计划项目(gxun-chxzs2018062)。
文章引用
覃方红,吕 勇,肖碧源,贺子君,邱江源,黄在银. 溶解度法研究硫化铜表面热力学性质
Study on Thermodynamic Properties of Copper Sulfide Surface by Solubility Method[J]. 物理化学进展, 2018, 07(03): 131-138. https://doi.org/10.12677/JAPC.2018.73016
参考文献
- 1. Yu, X.L., Cao, C.B., Zhu, H.S., et al. (2010) Nanometer-Sized Copper Sulfide Hollow Spheres with Strong Optical-Limiting Proper-ties. Advanced Functional Materials, 17, 1397-1401. https://doi.org/10.1002/adfm.200600245
- 2. Liu, X.L., Zhu, Y.J., Yang, B., et al. (2012) CuS Nanotubes: Microwave-Solvothermal Synthesis and Photocatalytic Property. Advanced Materials Research, 554-556, 605-609.
- 3. Chung, J.S. and Sohn, H.J. (2002) Electrochemical Behaviors of CuS as a Cathode Material for Lithium Secondary Batteries. Journal of Power Sources, 108, 226-231. https://doi.org/10.1016/S0378-7753(02)00024-1
- 4. Liu, X., Li, B., Fu, F., et al. (2014) Facile Synthesis of Biocompatible Cysteine-Coated CuS Nanoparticles with High Photothermal Conversion Efficiency for Cancer Therapy. Dalton Transactions, 43, 11709-11715. https://doi.org/10.1039/C4DT00424H
- 5. Huse, N.P., Dive, A.S. Gattu, K.P., et al. (2017) An Experimental and Theoretical Study on Soft Chemically Grown CuS Thin Film for Photosensor Application. Materials Science in Semiconductor Processing, 67, 62-68. https://doi.org/10.1016/j.mssp.2017.05.010
- 6. He, J., Ai, L., Liu, X., et al. (2018) Plasmonic CuS Nanodisk Assemblies Based Composite Nanocapsules for NIR-Laser-Driven Synergistic Chemo-Photothermal Cancer Therapy. Journal of Materials Chemistry B, 6, 1035-1043. https://doi.org/10.1039/C7TB02772A
- 7. Han, S.K., Gu, C., Zhao, S., et al. (2016) Precursor Triggering Synthesis of Self-Coupled Sulfide Polymorphs with Enhanced Photoelectrochemical Properties. Journal of the American Chemical Society, 138, 12913-12919. https://doi.org/10.1021/jacs.6b06609
- 8. Wang, Q., An, N., Bai, Y., et al. (2013) High Photocatalytic Hydrogen Production from Methanol Aqueous Solution Using the Photocatalysts CuS/TiO2. International Journal of Hydrogen Energy, 38, 10739-10745. https://doi.org/10.1016/j.ijhydene.2013.02.131
- 9. Lin, R., Huang, P., Ségalini, J., et al. (2009) Solvent Effect on the Ion Ad-sorption from Ionic Liquid Electrolyte into Sub-Nanometer Carbon Pores. Electrochimica Acta, 54, 7025-7032. https://doi.org/10.1016/j.electacta.2009.07.015
- 10. Li, X., Wan, T., Qiu, J., et al. (2017) In-Situ, Photocalorimetry-Fluorescence Spectroscopy Studies of RhBphotocatalysis over Z-Scheme g-C3N4@Ag@Ag3PO4, Nanocomposites: A Pseudo-Zero-Order Rather Than a First-Order Process. Applied Catalysis B Environmental, 15, 591-602.
- 11. Khairy, M., Ayoub, H.A. and Banks, C.E. (2018) Non-Enzymatic Electrochemical Platform for Parathion Pesticide Sensing Based on Nanometer-Sized Nickel Oxide Modified Screen-Printed Electrodes. Food Chemistry, 255, 104-111. https://doi.org/10.1016/j.foodchem.2018.02.004
- 12. Xiang, M. (2015) Young Measure Solutions for a Fourth-Order Wave Equation with Variable Growth. Boundary Value Problems, 2015, 123. https://doi.org/10.1186/s13661-015-0386-5
- 13. Navrotsky, A. (1977) Progress and New Directions in High Temperature Calo-rimetry. Physics & Chemistry of Minerals, 2, 89-104. https://doi.org/10.1007/BF00307526
- 14. 王路得, 黄在银, 范高超, 等. 电化学方法测定纳米材料的热力学函数[J]. 中国科学:化学, 2012, 42(1): 47-51.
- 15. 刘晓林, 王路得, 黄在银, 等. 纳米氧化锌热力学函数的微量热法及电化学法测量[J]. 高等学校化学学报, 2015, 36(3): 539-543.
- 16. 肖明, 黄在银, 汤焕丰, 等. Ag3PO4表面热力学性质及光催化原位过程热动力学的晶面效应[J]. 物理化学学报, 2017, 33(2): 399-406.
NOTES
*通讯作者。
