Journal of Advances in Physical Chemistry
Vol.
11
No.
03
(
2022
), Article ID:
54247
,
10
pages
10.12677/JAPC.2022.113012
1-丁基-3-甲基咪唑氯盐/尿素低共熔溶剂的 制备及结构与性能研究
袁朝圣1,2*,汪健1
1河南省磁电信息功能材料重点实验室,河南 郑州
2郑州轻工业大学,物理与电子工程学院,河南 郑州
收稿日期:2022年7月2日;录用日期:2022年7月22日;发布日期:2022年7月29日

摘要
以1-丁基-3-甲基咪唑氯盐(BMIMCl)和尿素(Urea)为氢键“受体”和“给体”,通过热混合的方法对BMIMCl/Urea低共熔溶剂(DES)进行了制备。研究了摩尔分数对BMIMCl/Urea体系结构的演化及低共熔溶剂形成的影响。通过表观形态、差示扫描量热分析(DSC)、二维广角X射线衍射(WAXD)和傅里叶红外(FT-IR)对制备的BMIMCl/Urea样品进行了结构表征。结果表明,随着BMIMCl摩尔分数的增加,BMIMCl/Urea体系经历了固–固相变、非晶化和溶剂化过程;BMIMCl摩尔分数为80 mol%和90 mol%时形成了BMIMCl/Urea DES。通过对BMIMCl/Urea DES样品的交流阻抗分析,发现离子液体基低共熔溶剂具有与离子液体一样的导电性。从氢键和离子液体对称性角度分析了离子液体低共熔溶剂形成机制,为开发和利用新型离子液体低共熔溶剂提供了新的参考。
关键词
离子液体,低共熔溶剂,相变,氢键,溶剂化

Study on Preparation, Structure and Properties of 1-Butyl-3-Methylimidazolium Chloride/Urea Deep Eutectic Solvent
Chaosheng Yuan1,2*, Jian Wang1
1Henan Provincial Key Laboratory of Magnetoelectric Information Functional Materials, Zhengzhou Henan
2College of Physics and Electronic Engineering, Zhengzhou University of Light Industry, Zhengzhou Henan
Received: Jul. 2nd, 2022; accepted: Jul. 22nd, 2022; published: Jul. 29th, 2022

ABSTRACT
1-Butyl-3-methylimidazolium chloride (BMIMCl) and urea (Urea), used as hydrogen bond “acceptors” and “donors” were mixed, stirred, heated to prepare BMIMCl/Urea DES (deep eutectic solvent). The influence of molar fraction of BMIMCl on the structure evolution of Urea and formation mechanism of ionic liquid-based DES was analyzed. Apparent morphology, differential scanning calorimetry (DSC), two-dimensional wide-angle X-ray diffraction (WAXD) and Fourier transform infrared (FT-IR) were respectively employed to characterize the structure of prepared BMIMCl/Urea samples. The results showed that the BMIMCl/Urea system underwent solid-solid phase transition, amorphization and solvation with the increasing of molar fracyion of BMIMCl. The BMIMCl/Urea DESs were formed when the mole fractions of BMIMCl were between 80 mol% and 90 mol%. The AC impedance analysis was employed to characterize the electrical property of BMIMCl/Urea DESs. It was found that the ionic liquid-based deep eutectic solvent has the same conductivity as the ionic liquid. The formation mechanism of ionic liquid-based DESs was explained by intermolecular hydrogen bonding and asymmetry structure of ionic liquid. This work provided a reference for the development and utilization of new ionic liquid deep eutectic solvents.
Keywords:Ionic Liquid, Deep Eutectic Solvent, Phase Transition, Hydrogen Bonding, Solvation

Copyright © 2022 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
低共熔溶剂(DESs, deep eutectic solvents)是一类由氢键受体和氢键给体按一定化学计量比形成的液体,且其熔点都明显低于原组分 [1]。低共熔溶剂具有与离子液体类似的物理化学性质,如较宽的液程、较低的蒸汽压、良好的热稳定性和溶解性等性质,使其有望成为工业上常用的600多种挥发性有机溶剂的替代品 [2]。此外,与离子液体相比,低共熔溶剂的制备工艺简单、制造成本低,且无毒、生物相容性好,具有更宽的应用范围和前景 [3] [4] [5]。
Abbott等 [6] 根据组成低共熔溶剂配体类型的不同,将低共熔溶剂大致分为四类,即以无水金属氯化物和季铵盐组成的第I类,以含结晶水的金属氯化物和季铵盐组成的第II类,以金属卤化物和有机配体组成的第III类和以季铵盐和羧酸、醇、酰胺等组成的第IV类。基于低共熔溶剂可设计性的特点,研究者们根据实际需要设计了一系列功能化的低共熔溶剂,并在一些新兴领域进行了应用,如冶金电镀 [7]、气体分离 [8]、生物催化 [9] 和储能电池 [10] 等。特别是高电导率、低可燃性和宽的液相范围,低共熔溶剂也被认为是锂离子电池潜在的电解质材料。Boisset等 [11] 发现多数低共熔溶剂具有较宽的电化学稳定窗口,而且还获得以LiNO3基低共熔溶剂为电解质,LiFePO4为阴极的电池容量高达160 mAh/g,效率高达99%。Jhong等 [12] 研究了丙三醇/碘化胆碱低共熔溶剂作为电解质在敏化太阳能电池中的应用,发现I3−的扩散系数和电导率都明显优于含I3−的离子液体。但是,低共熔溶剂的电导率偏低,还达不到电池电解质的应用标准。尝试不同配体类型,获取高性能低共熔溶剂,是解决这一关键问题的有效办法。
考虑到离子液体本身的电化学性能,能否制备出一种以离子液体为母体的低共熔溶剂,拓展其在电池电解质方面的应用,是一个值得探索的研究方向。近年来,围绕离子液体的应用,研究者们尝试了离子液体基低共熔溶剂的制备及应用,并发现其在电解质 [13]、气体吸收 [14] [15]、催化 [16] [17]、反应溶剂 [18] [19] 方面具有一些特定的物理化学性能。然而,离子液体基低共熔溶剂的形成机制还不清楚。基于此,本文以1-丁基-3-甲基咪唑氯盐(BMIMCl)为氢键受体,以尿素(Urea)为氢键给体,按照不同化学计量比对BMIMCl/Urea进行制备,并对制备样品进行了结构和性能的表征,分析了化学计量比对离子液体基低共熔溶剂形成机制的影响,以期为离子液体基低共熔溶剂的开发和应用提供理论依据。
2. 材料与方法
2.1. 材料与试剂
1-丁基-3-甲基咪唑氯盐(BMIMCl),分子式为C8H15ClN2,纯度大于99%,熔点温度为65℃,常温下为白色晶体,购于兰州应用化学物理研究所。尿素(Urea),分子式为CH4N2O,纯度大于98%,熔点温度为132.7℃,购于上海阿拉丁生化科技股份有限公司。使用前样品在50℃下真空干燥处理48小时。
2.2. 主要仪器与设备
TA Q250型差示扫描量热仪,美国TA分析仪器公司产;VERTEX 70型真空红外光谱仪,德国布鲁克光谱仪器公司产;Bruker D8 Discover二维广角X射线衍射仪,德国布鲁克光谱仪器公司产;CHI660型电化学分析仪,上海辰华仪器有限公司产;ZNCL-TS型恒温加热磁力搅拌设备,河南爱博特科技发展有限公司。
2.3. 实验方法
2.3.1. BMIMCl/Urea DES的制备
首先称取一定量的BMIMCl和Urea,按照BMIMCl的摩尔分数(MF: Molar Fraction),以10 mol%为梯度制备了10~90 mol%的9组样品,分别放入玻璃瓶中,然后将混合物置于恒温磁力搅拌器上进行100℃搅拌处理,直至混合物为澄清透明的液体,最后停止加热和搅拌,自然冷却至室温。
2.3.2. 结构与性能表征
采用DSC测量样品的熔点:称取一定量的BMIMCl/Urea DES置于铝坩埚中,并用坩埚盖进行封闭放入测量室。为了获得准确的相变温度,首先将样品以10℃/min的速率从室温降至−80℃,并保持5 min,然后以10℃/min的速率从−80℃升至140℃。实验中,样品腔内通氮气进行保护,流速为40 mL/min。
采用FT-IR分析样品的结构:将固体样品采用KBr压片法进行制样,液体样品则直接涂在压好的纯KBr窗口上,分辨率为4 cm−1,扫描次数为50次,测量范围:400~4000 cm−1。
采用WAXD分析样品的晶体结构:在制备样品置于薄玻璃片的20 mm × 20 mm凹槽内,采用CuKα (0.154 nm)辐射进行测量,激发电压为40 kV,激发电流40 mA,扫描衍射角(2θ)范围为5˚~30˚。
采用CHI660测量液体样品的导电性:选用“不锈钢/电解质/不锈钢”三明治结构,频率范围:100 mHz-100 KHz,电极电势振幅:5 mV。
3. 结果与分析
3.1. BMIMCl/Urea DES表象结构
室温下澄清、透明、可流动的状态是低共熔溶剂的一个重要的特征 [1]。室温下不同摩尔分数BMIMCl/Urea混合物的照片如图1所示。

Figure 1. Photographs of BMIMCL/Urea mixtures with different molar fraction at room temperature (MFBMIMCl = 10%~90%)
图1. 室温下不同摩尔分数BMIMCl/Urea混合物照片(MFBMIMCl = 10%~90%)
由图1可以看出,MFBMIMCl为80 mol%和90 mol%的样品为透明、澄清、可流动的液体,说明此两种摩尔配比时形成了BMIMCl/Urea DES。而MFBMIMCl从10 mol%到70 mol%的样品虽然在加热(100℃)的条件下形成了透明、澄清的液体,但降温后又重新固化。这些结果说明:MFBMIMCl为80 mol%和90 mol%的BMIMCl/Urea经加热搅拌处理后形成了较低共晶温度的BMIMCl/Urea DES。MFBMIMCl小于80 mol%时,样品的共晶温度高于室温而未形成室温液体。
3.2. DSC分析
不同摩尔分数BMIMCl/Urea的DSC图谱如图2所示。从图2可以看出,随着温度从−80℃升至140℃,样品出现了不同程度的吸热峰,其峰值对应着不同摩尔分数样品的共晶温度点。由于BMIMCl/Urea之间存在多种相互作用,不同摩尔分数时存在两个吸热峰,这里我们依据最强的吸热峰对应的温度为共晶温度点。MFBMIMCl从10 mol%增加到70 mol%,共晶温度从91.74℃下降到32.51℃,且吸热峰的熔限变宽、面积变小,说明BMIMCl/Urea样品中的结晶度降低;当MFBMIMCl增加到80~90 mol%时,DSC曲线上未发现明显的吸热或放热峰,说明在−80℃升至140℃测量范围内,该摩尔分数的样品没有明显的共晶温度点。为了验证MFBMIMCl为80~90 mol%样品的共晶温度低于室温,我们还将两个样品放在−25℃的冰箱中静置24小时,取出后发现样品仍然为流动、透明的液体。这些结果说明MFBMIMCl为80~90 mol%样品的共晶温度应远低于室温,也充分证明了该浓度下BMIMCl/Urea形成了低共熔溶剂。
根据DSC曲线中的吸热峰信息,可找出不同摩尔分数样品的共晶温度,绘制BMIMCl/Urea二元相图共晶温度点图,如图3所示。很明显,随着MFBMIMCl的增加,BMIMCl/Urea的共晶温度降低;当MFBMIMCl增加到80 mol%和90 mol%时,共晶温度明显下降,BMIMCl/Urea形成了低温低共熔溶剂。这一现象可能与离子液体和尿素之间形成强的氢键作用有关。
3.3. FT-IR分析
为了进一步表征不同摩尔分数BMIMCl/Urea样品的结构演化,对制备的样品进行FTIR分析,如图4所示。为了便于比较,这里将纯BMIMCl和Urea的FTIR结果也列在图中。从图4可以看出,3446,3346和3264 cm−1的吸收峰对应-NH2伸缩振动,而1679和1628 cm−1吸收峰对应-NH2弯曲振动 [13]。当MFBMIMCl为10 mol%时,Urea的-NH2伸缩振动峰和弯曲振动峰均发生了不同程度的红移,这说明BMIMCl与Urea分子间相互作用形成了“氢键”。随着MFBMIMCl的增加,BMIMCl的特征吸收峰越来越明显。如:
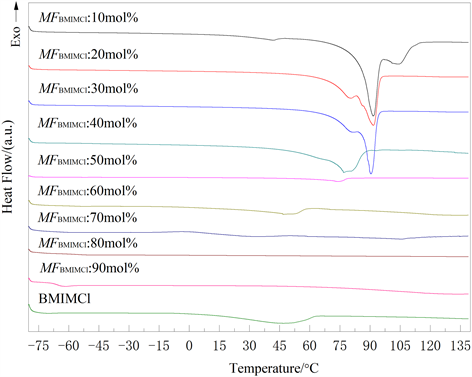
Figure 2. DSC curves of BMIMCl/Urea with different molar fraction
图2. 不同摩尔分数BMIMCl/Urea的DSC曲线

Figure 3. Eutectic temperature points of BMIMCl/Urea on phase diagram
图3. BMIMCl/Urea组分相图上的共晶温度点
2800~3200 cm−1对应离子液体咪唑环上-CH3的对称和反对称伸缩振动;1581~1464 cm−1对应咪唑环的伸缩振动;1168 cm−1对应咪唑环上H-C-C的弯曲振动;620~655 cm−1对应咪唑环上C-N-C的弯曲振动 [14]。但是,离子液体咪唑环的吸收峰位置并未随着MFBMIMCl发生明显的红移或蓝移,咪唑环的振动未受到氢键作用的影响。以上分析结果表明,BMIMCl/Urea共混处理后,体系中分子间存在氢键作用,且主要氢键形式可能是Cl...HN作用。当MFBMIMCl高于50 mol%时,1571,1618和1668 cm−1出现了三个耦合吸收峰,Urea分子间的NH…HN氢键被Cl−破坏,Urea与BMIMCl之间的氢键作用增强 [20]。对于MFBMIMCl为80 mol%和90 mol%的BMIMCl/Urea,虽然二者在常温下均为液体,但是体系内的分子振动模式有所不同,MFBMIMCl为90 mol%的BMIMCl/Urea DES基本与母体BMIMCl相同。
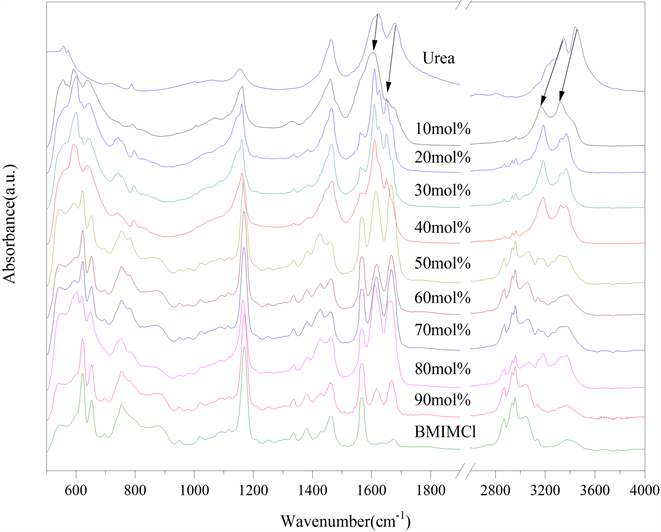
Figure 4. Infrared absorption spectra of BMIMCl/Urea samples with different fraction
图4. 不同摩尔分数BMIMCl/Urea样品的红外吸收光谱图
3.4. 广角X射线衍射(WAXD)分析
图5为不同摩尔分数BMIMCl/Urea的二维广角图。随着MFBMIMCl的增加,衍射环逐渐变宽,在超过50 mol%以后,衍射环变得更加的弥散,不可分辨。除此之外,随着MFBMIMCl的增加,衍射环的位置和相对强度也有明显改变。结果表明,随着MFBMIMCl的增加,BMIMCl对Urea的晶体结构进行“插层”,破坏了Urea原有的晶型结构。对二维广角图进行强度的积分,可得不同摩尔分数BMIMCl/Urea样品的一维广角X射线衍射曲线(图6)。对于Urea,在2θ = 22.22˚和26.94˚存在明显的衍射峰,由于Urea样品较厚和颗粒度不均匀的原因,衍射峰与PDF-2004的结果稍有不同。对MFBMIMCl为10 mol%的样品,衍射角转到了低角度2θ = 21.79˚和25.49˚,同时在2θ = 6.08˚和8.03˚处也出现了衍射峰,这些结果表明:离子液体的加入改变了Urea原来的晶型结构,衍射角2θ的减小预示着Urea晶胞间距增大。当MFBMIMCl为30 mol%时,衍射峰2θ = 21.79˚消失,而在2θ = 9.42˚,14.22˚和20.34˚处出现了新的衍射峰,这表明在该摩尔分数下Urea的晶型结构崩塌,继而在BMIMCl的参与下重建了新的晶型结构。当MFBMIMCl大于50 mol%,衍射曲线变得平滑,衍射峰难以分辨,为典型的非晶化结构。以上结果表明:随着BMIMCl的掺入,BMIMCl/Urea样品在MFBMIMCl为30 mol%时经历了一次固–固相变,在MFBMIMCl大于50 mol%时样品结构趋于非晶化。

Figure 5. Two-dimensional wide-angle X-ray diffraction patterns of BMIMCl/Urea samples with different molar fraction
图5. 不同摩尔分数BMIMCl/Urea样品的二维广角X射线衍射图
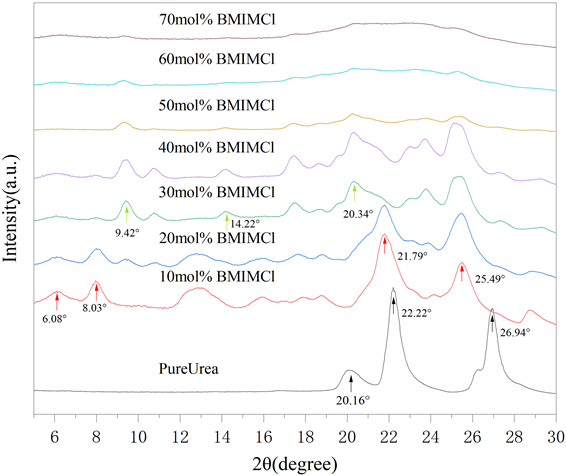
Figure 6. One-dimensional wide-angle X-ray diffraction curves of BMIMCl/Urea samples with different molar fraction
图6. 不同摩尔分数BMIMCl/Urea样品的一维广角X射线衍射曲线
3.5. 电化学性质分析
对MFBMIMCl为80 mol%和90 mol%的液体样品以及纯BMIMCl进行了交流阻抗分析,图7为样品的交流阻抗谱。谱图中的一个半圆(高频区)和一个斜线(低频区)是典型的电容器特征的交流阻抗谱,图谱体现电解质在电极表面的电荷传递过程。由图7中高频区半圆起点与Z'轴的截距,可得80 mol%、90 mol%和纯BMIMCl的溶液内阻分别为709 Ω,601 Ω,617 Ω。由此可见,少量Urea的掺入,没有显著改变BMIMCl/Urea样品的内阻,相反,适量Urea的加入还能够降低粘度,提高BMIMCl/Urea DES的导电性 [21]。另外,图中半圆直径为电极与电解质之间的界面电阻,经分析可得MFBMIMCl为80 mol%和90 mol%及纯BMIMCl与不锈钢电极之间的界面电阻分别为11,241 Ω,13,569 Ω,10,713 Ω。很明显,BMIMCl/Urea DES的界面电阻大于纯BMIMCl,这可能是由于BMIMCl/Urea DES中Urea分子与Cl−之间存在较强的氢键作用,降低了体系中离子的迁移率,阻碍了离子在电极表面的扩散。
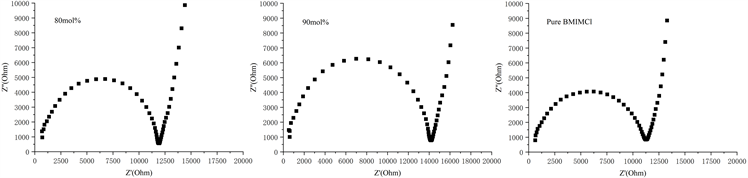
Figure 7. AC impedance spectra of BMIMCl/Urea liquid samples with molar fraction of 80 mol% and 90 mol% and pure BMIMCl
图7. 摩尔分数为80 mol%和90 mol%的BMIMCl/Urea液体样品及纯BMIMCl的交流阻抗谱
3.6. 摩尔分数对BMIMCl/Urea DES形成机制的影响
对于BMIMCl/Urea体系,随着BMIMCl的掺入,Cl−与-NH间可形成氢键作用,BMIMCl浸入到Urea的晶格中,使Urea的晶胞结构膨胀;当Urea的晶胞增大到一定程度后,晶格能不能维持原有结构,晶型发生转变,即BMIMCl和Urea协同作用下形成了新的晶型(WAXD的结果印证了这一结论)。当MFBMIMCl超过50 mol%时,BMIMCl/Urea体系中BMIMCl起主导作用,维持晶体结构的稳定。但是由于BMIMCl阳离子结构对称性不好,不利于结晶,BMIMCl的非晶性与Urea的结晶性相互竞争而使体系结构趋于非晶化。当MFBMIMCl为80 mol%和90 mol%时,Urea分子主要以氢键方式与Cl−结合,“溶解”在BMIMCl中,使BMIMCl的结构不对成性变得更差,离子键减弱,形成了以氢键作用为主的低共熔溶剂。离子液体自身结构的不对称性和氢键作用的共同影响,使得离子液体基低共熔溶剂形成并不严格按照传统低共熔溶剂中氢键给体和受体摩尔比(如:1:2氯化胆碱/尿素和1:3.5氯化锌/尿素等),而是比传统配比低,这有助于开发新型低温低共熔溶剂。
4. 总结
以BMIMCl和Urea为原料,通过热混合的方法研究了摩尔分数对离子液体基低共熔溶剂形成的影响。表观照片和DSC结果显示:BMIMCl摩尔分数为80 mol%和90 mol%时,形成了BMIMCl/Urea低共熔溶剂;WAXD和FT-IR的结果表明:随着BMIMCl摩尔分数的增加,BMIMCl/Urea的晶格常数增加,并经历了固–固相变、非晶化和溶剂化过程;制备的BMIMCl/Urea DES (MFBMIMCl为80 mol%和90 mol%)的导电性接近液态时的BMIMCl,但离子扩散性有所降低。基于实验结果,绘制出BMIMCl/Urea的组分–共晶温度点相图,并从离子液体自身结构的不对称性和分子间氢键的角度分析了离子液体基低共熔溶剂的形成机制,解释了其形成的摩尔比低于传统低共熔溶剂的原因。这些结果为充分理解低共熔溶剂的形成机制、开发新型离子液体低共熔溶剂以及拓展低共熔溶剂的应用领域提供了理论依据和参考。
致谢
作者感谢郑州轻工业大学高压科学与技术研究中心在样品检测方面提供的支持和帮助。
基金项目
本工作得到了河南省科技攻关项目“No. No.212102210129”和北京计算物理重点实验室项目“No. 6142A05210101”的资助。
文章引用
袁朝圣,汪 健. 1-丁基-3-甲基咪唑氯盐/尿素低共熔溶剂的制备及结构与性能研究
Study on Preparation, Structure and Properties of 1-Butyl-3-Methylimidazolium Chloride/Urea Deep Eutectic Solvent[J]. 物理化学进展, 2022, 11(03): 88-97. https://doi.org/10.12677/JAPC.2022.113012
参考文献
- 1. Abbott, A.P., Capper, G., Davies, D.L., Rasheed, R.K. and Tambyrajah, V. (2003) Novel Solvent Properties of Choline Chloride Urea Mixtures. Chemical Communications, 9, 70-71. https://doi.org/10.1039/b210714g
- 2. Pollet, P., Davey, E.A., Ureña-Benavides, E.E., Eckert, C.A. and Liotta, C.L. (2014) Solvents for Sustainable Chemical Processes. Green Chemistry, 16, 1034-1055. https://doi.org/10.1039/C3GC42302F
- 3. Xu, P., Zheng, G.-W., Zong, M.-H., Li, N. and Lou, W.-Y. (2017) Recent Progress on Deep Eutectic Solvents in Biocatalysis. Bioresources and Bioprocessing, 4, Article No. 34 https://doi.org/10.1186/s40643-017-0165-5
- 4. Khandelwal, S., Tailor, Y.K. and Kumar, M. (2016) Deep Eutectic Solvents (DESs) as Eco-friendly and Sustainable Solvent/Catalyst Systems in Organic Transformations. Journal of Molecular Liquids, 215, 345-386. https://doi.org/10.1016/j.molliq.2015.12.015
- 5. Radošević, K., Bubalo, M.C., Srček, V.G., Grgas, D., Dragičević, T.L. and Redovniković, I.R. (2015) Evaluation of Toxicity and Biodegradability of Choline Chloride Based Deep Eutectic Solvents. Ecotoxicology and Environmental Safety, 112, 46-53. https://doi.org/10.1016/j.ecoenv.2014.09.034
- 6. Abbott, A., Barron, J., Ryder, K. and Wilson, D. (2010) Eutectic-Based Ionic Liquids with Metal-Containing Anions and Cations. Chemistry, 13, 6495-6501. https://doi.org/10.1002/chem.200601738
- 7. Di Marino, D., Shalaby, M., Kriescher, S. and Wessling, M. (2018) Corrosion of Metal Electrodes in Deep Eutectic Solvents. Electrochemistry Communications, 90, 101-105. https://doi.org/10.1016/j.elecom.2018.04.011
- 8. Oliveira, F.S., Pereiro, A.B., Rebelo, L.P. and Marrucho, I.M. (2013) Deep Eutectic Solvents as Extraction Media for Azeotropic Mixtures. Green Chemistry, 15, 1326-1330. https://doi.org/10.1039/c3gc37030e
- 9. El Abedin, S.Z. and Endres, F. (2007) Ionic Liquids: The Link to High-Temperature Molten Salts? Accounts of Chemical Research, 40, 1106-1113. https://doi.org/10.1021/ar700049w
- 10. Lloyd, D., Vainikka, T. and Kontturi, K. (2013) The Development of an All Copper Hybrid Redox Flow Battery Using Deep Eutectic Solvents. Electrochimica Acta, 100, 18-23. https://doi.org/10.1016/j.electacta.2013.03.130
- 11. Boisset, A., Menne, S., Jacquemin, J., Balducci, A. and Anouti, M. (2013) Deep Eutectic Solvents Based on N-methylacetamide and a Lithium Salt as Suitable Electrolytes for Lithium-ion Batteries. Physical Chemistry Chemical Physics, 15, 20054-20063. https://doi.org/10.1039/c3cp53406e
- 12. Jhong, H.-R., Wong, D.S.-H., Wan, C.-C., Wang, Y.-Y. and Wei, T.-C. (2009) A Novel Deep Eutectic Solvent-based Ionic Liquid Used as Electrolyte for Dye-sensitized Solar Cells. Electrochemistry Communications, 11, 209-211. https://doi.org/10.1016/j.elecom.2008.11.001
- 13. Mahanta, U., Choudhury, S., Prasanna Venkatesh, R., SarojiniAmma, S., Ilangovan, S.A. and Banerjee, T. (2019) Ionic-Liquid-Based Deep Eutectic Solvents as Novel Electrolytes for Supercapacitors: COSMO-SAC Predictions, Synthesis, and Characterization. ACS Sustainable Chemistry & Engineering, 8, 372-381. https://doi.org/10.1021/acssuschemeng.9b05596
- 14. Yan, H., Zhao, L., Bai, Y., Li, F., Dong, H., Wang, H., et al. (2020) Superbase Ionic Liquid-Based Deep Eutectic Solvents for Improving CO2 Absorption. ACS Sustainable Chemistry & Engineering, 8, 2523-2530. https://doi.org/10.1021/acssuschemeng.9b07128
- 15. Cao, Y., Zhang, X., Zeng, S., Liu, Y., Dong, H. and Deng, C. (2020) Protic Ionic Liquid-Based Deep Eutectic Solvents with Multiple Hydrogen Bonding Sites for Efficient Absorption of NH3. AIChE Journal, 66, Article ID: e16253. https://doi.org/10.1002/aic.16253
- 16. Mishra, D.K., Gopal, P. and Tamal, B. (2020) Ionic Liquid-Based Deep Eutectic Solvent as Reaction Media for the Thermal Dehydrogenation of Ethylene Diamine-bis-Borane. ACS Sustainable Chemistry & Engineering, 8, 4910-4919. https://doi.org/10.1021/acssuschemeng.0c00220
- 17. 阮佳纬, 叶香珠, 陈立芳, 漆志文. 离子液体和低共熔溶剂催化二氧化碳合成有机碳酸酯的研究进展[J]. 化工进展, 2022, 41(3): 1176-1186.
- 18. Sheng, K., Li, D. and Kang, Y. (2021) Unexpectedly Promoted SO2 Capture in Novel Ionic Liquid-Based Eutectic Solvents: The Synergistic Interactions. Journal of Molecular Liquids, 337, Article ID: 116432. https://doi.org/10.1016/j.molliq.2021.116432
- 19. 易兰, 李文英, 冯杰. 离子液体/低共熔溶剂在煤基液体分离中的应用[J]. 化工进展, 2020, 39(6): 2066-2078.
- 20. Yuan, C., Zhang, X., Ren, Y., Feng, S., Liu, J., Wang, J., et al. (2019) Temperature- and Pressure-Induced Phase Transitions of Choline Chloride-Urea Deep Eutectic Solvent. Journal of Molecular Liquids. 291, Article ID: 111343. https://doi.org/10.1016/j.molliq.2019.111343
- 21. Ammam, M. and Fransaer, J. (2011) Synthesis and Characterization of Hybrid Materials Based on 1-butyl-3-methy- limidazolium Tetrafluoroborate Ionic Liquid and Dawson-Type Tungstophosphate K7[H4PW18O62]·18H2O and K6[P2W18O62]·13H2O. Journal of Solid State Chemistry, 184, 818-824. https://doi.org/10.1016/j.jssc.2011.02.002