Asian Case Reports in Veterinary Medicine
Vol.
08
No.
04
(
2019
), Article ID:
32293
,
6
pages
10.12677/ACRPVM.2019.84008
Investigation and Study on Disease Situation of a Scale Goose Farm in Xinjiang
Rizwagu·Nuerdong1, Shukui Miao2, Yurong Wei2, Ting Zhao1, Jun Xia2, Wenge Ma2, Jie Wei2, Ping Wang2, Jiong Huang2, Xiaoyun Mi2*
1College of Animal Medicine, Xinjiang Agricultural University, Urumqi Xinjiang
2Veterinary Research Institute, Xinjiang Academy of Animal Science, Animal Clinical Medicine Research Center, Urumqi Xinjiang
Received: Sep. 6th, 2019; accepted: Sep. 17th, 2019; published: Sep. 24th, 2019

ABSTRACT
In recent years, the development of goose industry in China is rapid, and the scale of goose farm is expanding, which leads to the trend of complexity and diversification of goose disease in goose farm, and the incidence of goose disease is increasing year by year. In particular, goose plague (goose parvovirus disease), Escherichia coli disease, Pasteurella multocida disease, reovirus infection, duck plague and so on occur from time to time. Their single infection or co-infection results in the incidence of goose disease, death or degradation of production performance, which seriously hits the economic interests of farmers. In this experiment, anal swabs samples were collected from different ages, different health conditions and species of geese in a goose factory. According to the conserved sequence of published genes in Gen Bank, eight pairs of specific primers were designed by using primer premier 5 software for PCR detection of Pasteurella multocida, Shiga toxin Escherichia coli, duck plague, goose parvovirus and goose reovirus. The results showed that Pasteurella multocida and Shigella toxin colibacillosis were not detected in this sample, the negative rate was 100% (60/60), 6 cases of duck plague virus, 5 cases of goose parvovirus and 14 cases of reovirus were detected, the positive rates were 10% (6/60), 8.3% (5/60) and 23.3% (14/60), respectively, which would provide a reference for the prevention and control of goose disease in this goose farm and Xinjiang.
Keywords:Large-Scale Goose Farm, Epidemic Disease Control, PCR
新疆某规模化鹅场养殖疾病情况调查研究
日孜瓦古·努尔东1,苗书魁2,魏玉荣2,赵婷1,夏俊2,马文戈2,魏婕2, 汪萍2,黄炯2,米晓云2*
1新疆农业大学动物医学学院,新疆 乌鲁木齐
2新疆畜牧科学院兽医研究所(新疆畜牧科学院动物临床医学研究中心),新疆 乌鲁木齐

收稿日期:2019年9月6日;录用日期:2019年9月17日;发布日期:2019年9月24日

摘 要
近年来我国养鹅行业的发展速度较快,养鹅场的规模不断扩大,导致养鹅场内的鹅病呈复杂化和多样化的趋势,发病率逐年增多;特别是小鹅瘟(鹅细小病毒病)、大肠杆菌病、巴氏杆菌病、呼肠孤病、鸭瘟病毒等时有发生,它们单一感染或共感染,造成鹅的发病、死亡或生产性能降低,使养殖者的经济利益受到严重打击。本实验通过对某鹅厂不同日龄、不同健康状况和种类的鹅抽样收集肛拭子样品,并根据Gen Bank中已发表基因的保守序列,利用primer premier 5软件设计了8对特异性检测引物,对巴氏杆菌、志贺氏毒素大肠杆菌、鸭瘟病毒、鹅细小病毒、呼肠孤病毒进行PCR检测,结果显示本次抽测样品中未检测到巴氏杆菌和志贺氏毒素大肠杆菌,阴性率均为100% (60/60),检测出6例鸭瘟病毒、5例鹅细小病毒和14例呼肠孤病毒,阳性率分别为10% (6/60)、8.3% (5/60)、23.3% (14/60),这将对该鹅场及新疆地区鹅病的防治和预防工作提供参考依据。
关键词 :规模化养鹅场,疫病防治,PCR

Copyright © 2019 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
我国是养鹅大国,作为鹅种质遗传资源最为丰富的国家,养鹅产业占世界的85%以上 [1] 。鹅是一种草食性水禽类,很适合农户进行饲养,而且它的耗粮量很低,投入少产出多,为农民带来较高的经济效益。近年来,我国的养鹅业进步非常快,个人散养者为主的饲养方式逐渐向规模化养鹅场的综合养殖模式转变。但是,由于很多养鹅场管理者对于鹅的生长发育、饲养方式及鹅场的环境卫生等缺少管理经验,使得饲养方式不当,从而引发鹅的疫病爆发,造成巨大经济损失。因此,规模化养鹅场应针对常出现的鹅疫病——大肠杆菌病、巴氏杆菌病、鹅细小病毒病、鸭瘟病毒病及呼肠孤病等进行综合防控 [2] 。
2. 材料和方法
2.1. 被检肛拭子
根据新疆某鹅场鹅的种类、年龄及群体数量分别采集成年亚健康状态伊犁鹅、成年健康伊犁鹅鹅、成年亚健康白鹅、成年健康白鹅、30日龄雏鹅等共随机抽测60份肛拭子样品。
2.2. 主要试剂
TIANamp Virus DNA/RNA Kit病毒基因组DNA/RNA提取试剂盒,购自TIANGEN生物公司(中国北京);PrimeScriptTMOne Step RT-PCR Kit Ver.2,Kodaq 2xPCR MasterMix with dye,2000 bp和5000 bp DNA Marker (购自大连宝生物)。
2.3. 引物
根据Gen Bank中已发表的巴氏杆菌、志贺氏毒素大肠杆菌、鸭瘟病毒、鹅细小病毒、鹅呼肠孤病毒基因的保守序列,利用primer premier 5软件设计了8对特异性检测引物,巴氏杆菌特异性引物(B1和B2),预期扩增片段大小为460 bp、志贺氏毒素大肠杆菌特异性引物(S1和S2),预期扩增片段大小为614 bp、鸭瘟病毒特异性引物(D1和D2),预期扩增片段大小为563 bp、鹅细小病毒特异性引物(G1和G2),预期扩增片段大小为1146 bp、呼肠孤病毒特异性引物(R1和R2),预期扩增片段大小为380 bp;均由上海生工基因科技股份有限公司合成(表1)。
Table 1. Primer sequence
表1. 引物序列
2.4. 检测方法
根据TIANamp Virus DNA/RNA Kit说明书提取样品RNA和DNA,用一步法RT-PCR方法 [3] 扩增呼肠孤病毒基因片段,Kodaq 2xPCR MasterMix with dye扩增巴氏杆菌、志贺氏毒素大肠杆菌、鸭瘟病毒、鹅细小病毒基因,PCR扩增体系(总体积为25 μL):1) 模版RNA:2 μL,PrimeScript 1 step Enzyme Mix: 1 μL,2X1 step Buffer (Dye plus):12.5 μL,上下引物:各0.5 μL,RNase Free dH2O:8.5 μL。2) 模板DNA:2 μL,Kodaq 2xPCR MasterMix: 12.5 μL,上下引物:各0.5 μL,RNase Free dH2O:9.5 μL。PCR扩增程序:呼肠孤病毒:50℃,反转录30 min;94℃预变性5 min;94℃变性40 s,55℃退火40 s,72℃延伸45 s,共33个循环;72℃延伸10 min;4℃保存。巴氏杆菌:94℃预变性5 min;94℃变性30 s,55℃退火45 s,72℃延伸1 min,共30个循环;72℃延伸10 min;4℃保存。志贺氏毒素大肠杆菌:95℃预变性5 min;94℃变性30 s,58℃退火50 s,72℃延伸90 s,共35个循环;72℃延伸10 min;4℃保存。鸭瘟病毒:94℃预变性5 min;94℃变性40 s,56℃退火40 s,72℃延伸 40 s,共30个循环;72℃延伸7 min;4℃保存。鹅细小病毒:94℃预变性5 min;94℃变性1 min,59.5℃退火1 min,72℃延伸90 s,共30个循环;72℃延伸7 min;4℃保存。PCR扩增产物用1.0%琼脂糖凝胶电泳检测。
3. 结果
3.1. 鹅场养殖疾病检测结果
对60份肛拭子样品分别提取RNA和DNA,采用特异性引物对巴氏杆菌、志贺氏毒素大肠杆菌、鸭瘟病毒、鹅细小病毒和呼肠孤病毒基因进行PCR扩增,PCR产物经1%琼脂糖凝胶电泳检测,如表1所示,巴氏杆菌和志贺氏毒素大肠杆菌抽样采集样品产物都为阴性,阴性率为100% (60/60),鸭瘟病毒阳性率为10% (6/60),鹅细小病毒阳性率8.3% (5/60),呼肠孤病毒阳性率为23.3% (14/60)。
Table 2. Results of detection of diseases in goose farms
表2. 鹅场养殖疾病检测结果
由表2可得:该鹅场中的鹅无巴氏杆菌和志贺氏毒素大肠杆菌感染,但存在鸭瘟病毒、鹅细小病毒及呼肠孤病毒的感染。
3.2. PCR电泳结果
特异性引物对鸭瘟病毒、鹅细小病毒、呼肠孤病毒基因进行PCR扩增,并将PCR产物经1%琼脂糖凝胶电泳检测,结果显示,鸭瘟病毒基因扩增的部分样品产物可见约563 bp的特异性片段(图1),与预期大小相符;细小病毒基因扩增的部分样品产物可见约1146 bp的特异性片段(图2),与预期大小相符;呼肠孤病毒基因扩增的部分样品产物可见约380 bp的特异性片段(图3),与预期大小相符。结果分析表明该鹅场存在鸭瘟病毒、鹅细小病毒及呼肠孤病毒的感染。以下电泳图为部分样品检测结果。
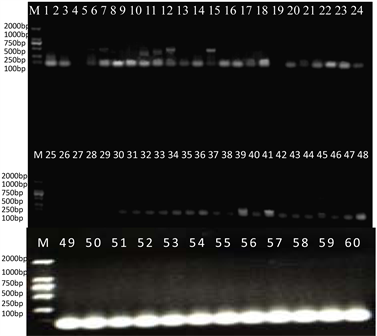
Figure 1. Identification of duck plague virus with specific primers. M: DL2000 DNA Marker; 1~60: Anal swab sample
图1. 鸭瘟病毒特异性引物鉴定。M:DL2000 DNA Marker;1~60:肛拭子样品

Figure 2. Identification of goose parvovirus specific primers. M: DL5000 DNA Marker; 1~60: Anal swab sample
图2. 鹅细小病毒特异性引物鉴定。M:DL5000 DNA Marker;1~60:肛拭子样品

Figure 3. Identification of reovirus specific primers. M: DL5000 DNA Marker, 1~60: Anal swab sample
图3. 呼肠孤病毒特异性引物鉴定。M:DL5000 DNA Marker;1~60:肛拭子样品
4. 讨论
随着鹅养殖规模的发展与扩大,规模化养鹅场可能因引种不当或管理不力等原因出现疫病,疫病出现后可危及雏鹅与成鹅的健康与生命,为了减少疫病流行给养鹅场经济利益带来的损害,管理者应加强对养鹅场的管理,做好免疫、引种、饲养、隔离等工作,以实现对鹅疫病的综合防控 [4] ,本实验通过对我区某规模化鹅场不同日龄和种类的鹅抽样收集的拭子样品进行巴氏杆菌、志贺氏毒素大肠杆菌、鸭瘟病毒、鹅细小病毒、呼肠孤病毒进行PCR检测来诊断该鹅场存在的鹅疫病,经过检测结果以及数据统计分析,初步了解到该鹅场发生疾病的情况以及存在的问题,这将为鹅养殖业疫病的预防控制等提供合理科学的参考。
本次检测针对鹅厂较为常发的巴氏杆菌、志贺氏毒素大肠杆菌、鸭瘟病毒、鹅细小病毒、呼肠孤病毒对鹅场抽样采集的60份肛拭子样品进行PCR检测,结果显示本次抽测样品中未检测到巴氏杆菌和志贺氏毒素大肠杆菌,阴性率均为100% (60/60),检测出6例鸭瘟病毒感染样品、5例鹅细小病毒和14例呼肠孤病毒感染样品,阳性率分别为10% (6/60)、8.3% (5/60)、23.3% (14/60)。鸭瘟病毒主要从成年的伊犁鹅和亚健康白鹅中检测到,雏鹅中也检测到2例;鹅细小病毒主要从成年的伊犁鹅和亚健康白鹅中检测到,雏鹅中1例;呼肠孤病毒主要从成年的伊犁鹅和亚健康白鹅中检测到,雏鹅检测到3例。在检测到的成年病鹅中有表象病态的和健康的,表象病态的鹅常常出现鸭瘟病毒、鹅细小病毒和呼肠孤病毒三种病毒同时感染的情况,这种鹅的状况很差,身形消瘦、走路跛行还伴有拉白痢的情况,其中一个批次的健康鹅几乎未检测到任何疾病,说明在养殖过程中购进的雏鹅品质与养殖效益直接相关,雏鹅品质好,鹅的存活率高,产肉量高效益就好,而像此类的小型鹅厂没有自己的孵化部门,在购买雏鹅时往往购买几日龄的雏鹅,虽在购买后进行常规免疫,而一些垂直传染的疾病,在购进雏鹅后才渐渐发病,无法自行从源头预防。经了解该鹅厂几月前爆发过大规模鹅病,数万只雏鹅在一个月之内最后只存活了几千只,给厂主造成巨大损失,这种情况发生后鹅厂进行了全面消毒却未休养,使疾病未能彻底消除,在鹅群中一直传播。该鹅厂地处水库边缘,除雏鹅圈养外其他年龄段的鹅都是半放养状态,白天放养在水库边缘的湿地草甸上,晚上赶回圈舍,据厂主介绍该鹅厂的鹅只要成长到半放养阶段死亡率就大大降低,该现象表明当鹅的运动场所宽阔、空气流通好、饲草质量高、水源丰沛可以时时进行洗浴的环境可以大大增强鹅的体质,降低疾病的感染与爆发。
通过对该养殖场鹅疾病的调查研究,发现该鹅厂存在的很多问题,也是现在很多类似的鹅厂所共有的。随着养鹅规模加大,养鹅场的疫病防控工作没能及时跟进,使疾病种类更加复杂从而增大了防控的难度,而且在鹅生长发育的各个阶段的饲养的过程中,鹅场的环境卫生不达标、鹅的饲养方法不科学、饲养密度过大等。规模化养鹅场内一旦爆发疫病,其控制难度大大增加。因此规模化养鹅场的疫病防控工作应该以预防工作为主,与治疗相结合进行有效防控。对各种鹅疫病的产生原因要做全面了解 [5] ,掌握每种鹅疫病的影响与带来的危害,还要加强养鹅场的管理工作,及时采取措施进行预防,保证鹅舍清洁,合理饮食,及时接种疫苗,提高鹅群免疫力,预防好鹅病,保证从根本上杜绝鹅疫病的发生,促进养鹅场的经济发展 [6] 。
基金项目
国家自然基金项目(U1703117);自治区创新环境(人才、基地)建设专项,新疆兽医微生物资源共享平台建设(PT1809)。
文章引用
日孜瓦古•努尔东,苗书魁,魏玉荣,赵 婷,夏 俊,马文戈,魏 婕,汪 萍,黄 炯,米晓云. 新疆某规模化鹅场养殖疾病情况调查研究
Investigation and Study on Disease Situation of a Scale Goose Farm in Xinjiang[J]. 亚洲兽医病例研究, 2019, 08(04): 55-60. https://doi.org/10.12677/ACRPVM.2019.84008
参考文献
- 1. 刘雅丽, 何世山. 我国部分地方及引进鹅种特性与利用现状[J]. 浙江农业科学, 2016, 57(9): 1515-1517.
- 2. 王华冰. 浅谈大鹅饲养管理及疾病预防[J]. 山东畜牧兽医, 2018(2): 49-50.
- 3. 于新友, 李天芝, 莫玲, 等. 一步法RT-PCR快速检测禽呼肠孤病毒方法的建立及应用[J]. 养禽与禽病防治, 2015(9): 2-4.
- 4. 范勇. 浅析常见鹅病的防治[J]. 吉林畜牧兽医, 2015, 36(12): 40-41.
- 5. 周立军. 浅析常见鹅病防治[J]. 中国畜禽种业, 2018(1): 148.
- 6. 罗成杰. 规模化养鹅场疫病防控的综合措施[J]. 兽医导刊, 2016(10): 122.
NOTES
*通讯作者。
