International Journal of Ecology
Vol.05 No.01(2016), Article ID:17037,9
pages
10.12677/IJE.2016.51002
Evolution of Physico-Chemical Properties and Enzymatic Activity during Composting
Yaoling Lv*, Min Wu, Yulei Jia, Huirong Ma, Xiaolin Jiang
Department of Environmental Science and Engineering, Tongji University, Shanghai

Received: Feb. 5th, 2016; accepted: Feb. 26th, 2016; published: Feb. 29th, 2016
Copyright © 2016 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
Composting is increasingly considered a good way for recycling the surplus of manure as a stabilised and sanitised end-product for agriculture, whose quality is much dependent on microbial enzyme activity. In order to comprehensively grasp the composting process and quality, the paper firstly explored the changes of some physic-chemical characters such as C/N ratio and E4/E6 and analyzed how these factors affected its performance. Next, a special attention had been paid to the changes of catalase, invertase and cellulase activities and their important influence on the degradation of organic matter. Then, the correlation between these physic-chemical characteristics and enzymatic activities was discussed whilst interpreted their mutual impact on the mineralization and humification of organic matter.
Keywords:Manure Composting, Enzyme Activity, Mineralization, Humification, Composting Quality

堆肥过程中理化性质和酶活性的演变
吕药灵*,吴敏,贾玉蕾,马慧荣,姜晓琳
同济大学环境科学与工程学院,上海

收稿日期:2016年2月5日;录用日期:2016年2月26日;发布日期:2016年2月29日

摘 要
堆肥逐渐被认为是将禽畜粪便残渣再生为稳定清洁的农产品的好方法。堆肥的质量与堆体微生物酶的活性密切相关。为了更全面的了解堆肥过程及堆肥质量,本文首先研究了堆肥过程中某些理化特性,如总有机碳与总有机氮的比值(C/N),E4/E6 (胡明酸水溶液中光学密度或吸光度分别在465 nm和665 nm处的比值,反应了堆肥物质的芳构化程度)的变化,并分析了这些因素如何影响堆肥的质量;其次重点研究了过氧化氢酶、蔗糖酶酶和纤维素酶活性变化及其对有机物降解作用的重要影响;最后,讨论了这些理化性质和酶活性之间的相关性,从而解释这两者对有机物矿化和腐殖化的相互影响。
关键词 :粪便堆肥,酶活性,矿化,腐殖化,堆肥质量

1. 引言
随着新型化、集约化畜牧业的迅速发展,养殖场产生大量的粪便残渣,却没有足够的用地将这些排泄物直接转化为肥料而利用[1] 。动物粪便中含有大量的有机物、病原体和重金属等,对环境和人体健康造成潜在威胁 [2] 。堆肥是一种氧化过程,伴随着各种微生物酶的参与,涉及有机物的矿化和部分有机物腐殖化,可形成一种无毒无害并具有一定腐殖质特性的稳定的终产物[3] ,正成为解决这一问题的普遍和合适的选择之一 [4] 。随着堆肥的不断进行,堆体的各种理化性质是连续变化的,如堆肥温度,pH值和电导率(EC),总有机碳与总有机氮比值(C/N),E4/E6和有机物含量等。这些因素不但彼此之间相互作用,影响堆体性能和堆肥质量 [1] ;而且这些其物化特性的变化与酶的活性密切相关。更好地理解微生物酶的活动变化,有助于进一步探索微生物的降解作用,了解堆肥进程,并提高堆肥效率。因此,基于对牛粪和芦笋秸秆混合物的研究,本文详细探究了其理化性质及酶活性的变化,并对这两者之间的相关性进行分析,以获得更多的信息并更好地理解堆肥过程。
2. 材料和方法
2.1. 堆肥原料与性质
堆肥原料由新鲜牛粪和秸秆芦笋混合物组成,材料均来自于上海市崇明县某生态养殖厂。堆肥原料及实验所用腐殖土初始特征见表1和表2。
Table 1. Physico-chemical properties of raw materials used for composting
表1. 堆肥原料的物化性质分析
注:TOC:总有机碳;TON:总有机氮;C/N:总有机碳与总有机氮的比值。
Table 2. Physico-chemical indicators of humus soil
表2. 腐殖土理化指标
2.2. 试验设计
整个堆肥过程从2013年4月20日到2013年6月10日,共持续50天。首先,把芦笋秸秆粉碎成约2厘米长,并与新鲜牛粪充分混合,将堆体的C/N比调整到25~30:1之后,将材料放入40厘米(直径) × 50厘米(高)、底部装有强制通风扇的圆筒反应器中,通气量控制在40~80毫升/(分.每千克初始挥发性物质),按气体流量计,风扇的运转由时间继电器来调节。具体来说,前4天内,风扇每开1分钟后关闭25分钟;第5到15天内,风扇每运行1分钟后停止15分钟;16~50,风扇每开1分钟后关闭35分钟。每周翻一次堆体以保持物料均匀。通过空调将环境温度控制在20℃~21℃。
2.3. 样品采集与分析方法
取样时间为第1,4,7,12,17,22,27,32,37,42和第50天。为了更具代表性,样品从每个堆的顶部,中部和底部等不同区域收集,然后把来自三个位置的样本完全混合,并将每个样本分为两个部分:一部分存放在4℃环境中用来进行化学分析,另一部分用来即时检测三种酶的活性。
堆肥温度每天测量两次(8:00和16:00),取平均值。每10 g的样品溶解在100倍体积的蒸馏水中,并以150转/分的速度摇动一个小时。完成离心过滤后,需要进行pH和电导率(EC)测定;同时,将50 ml浸出溶液和去离子水(作为对照试验)加入到含有10颗卷心菜种子的培养皿中进行观察。每个培养皿分别覆盖两片滤纸,然后在25℃温度下进行48小时温育。每个样品的种子根长度和发芽率测量三次,其种子发芽指数(GI值)计算公式如下:
 。
。
有机物含量的测定过程如下:首先将瓷坩埚(恒重)与20 g样品放入马弗焙烧炉中,在600℃温度下燃烧6~8小时;然后将瓷坩埚转移到干燥器中,冷却后称量;之后,瓷坩埚被放置到马弗焙烧炉中,在相同的温度下燃烧10分钟,冷却称重。重复上述步骤,直到得到恒定重量。有机物含量通过测定煅烧前和煅烧后样品的净重得到。使用200目尼龙筛将样品研磨,充分干燥,并使用有机元素分析仪测定有机碳和有机氮的总含量,即可得到样品的C/N比。样品E4/E6的测定过程如下:将0.5 g样品进行空气干燥,然后放入20倍体积的氢氧化钠溶液(0.5 mol/L)中处理2小时,最后将上清液进行465 nm和665 nm指标测定。
对于过氧化氢酶的活性测定,首先将0.5 g样品进行空气干燥,放入含有40 ml蒸馏水和50 ml 3%过氧化氢溶液的150 ml锥形烧瓶中,振荡半小时后,使用5 ml硫酸(1.5 mol/L)来终止反应;最后使用滤纸过滤悬浮液,将25 ml滤液与0.02 mol/L的KMnO4溶液进行滴定,直至观察到溶液颜色偏红。空白组实验的操作方法与上述过程相同,但是其烧瓶中不加入堆肥样品。过氧化氢酶的活性定量公式如下 [5] :
 。
。
对于蔗糖酶活性的测定,首先将0.5 g样品进行空气干燥,放入含有15 ml 8%蔗糖溶液,5 ml磷酸盐缓冲液和5滴甲苯的150 ml锥形烧瓶中,在38℃温度下培养24小时;然后使用滤纸过滤悬浮液,将1 ml滤液和3 ml水杨酸放入50 ml比色管中,在沸水中加热5分钟。最后等待溶液冷却,将溶液的体积稀释至50 ml,进行485 nm吸光度测定。空白组实验(不加入堆肥样品)的操作方法与上述过程相同,可得
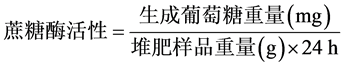 。
。
对于纤维素酶的活性测定,首先将0.5 g样品进行空气干燥,放入含有20 ml 1%羧甲基纤维素钠溶液,5 ml pH为5.5的磷酸盐缓冲液和1.5 ml甲苯的150 ml锥形烧瓶中,在38℃温度下培养24小时;然后使用滤纸过滤悬浮液,将滤液调整至25 ml,并取出1 ml滤液进行540 nm吸光度测定。空白组实验(不加入堆肥样品)的操作方法与上述过程相同,可得
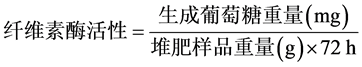 。
。
3. 试验结果
3.1. 物化变化
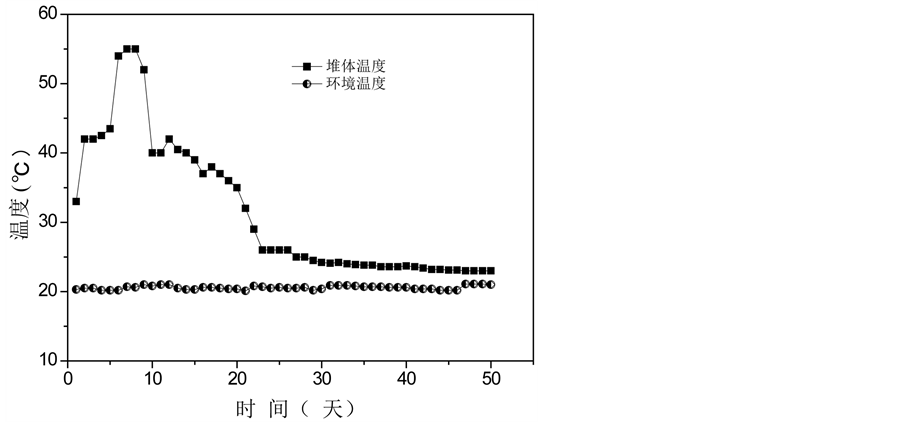
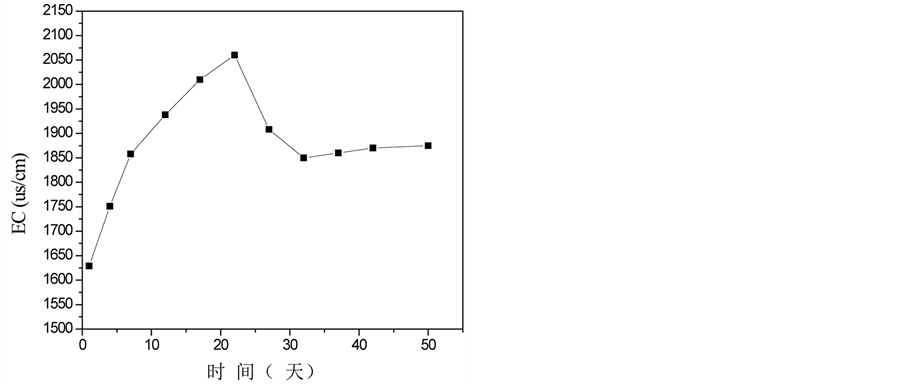
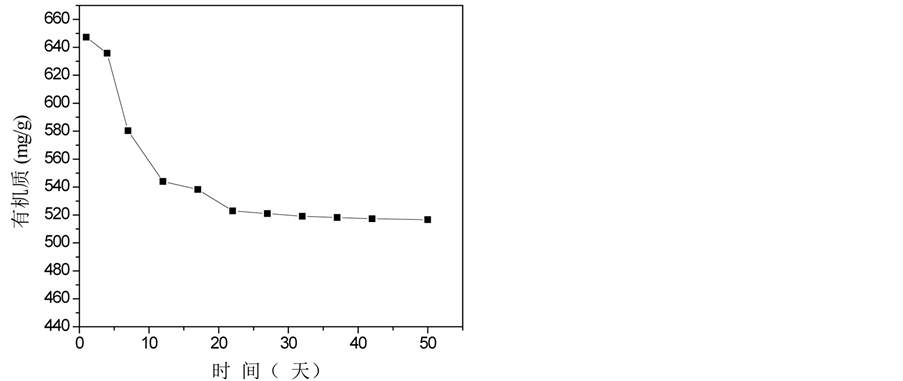
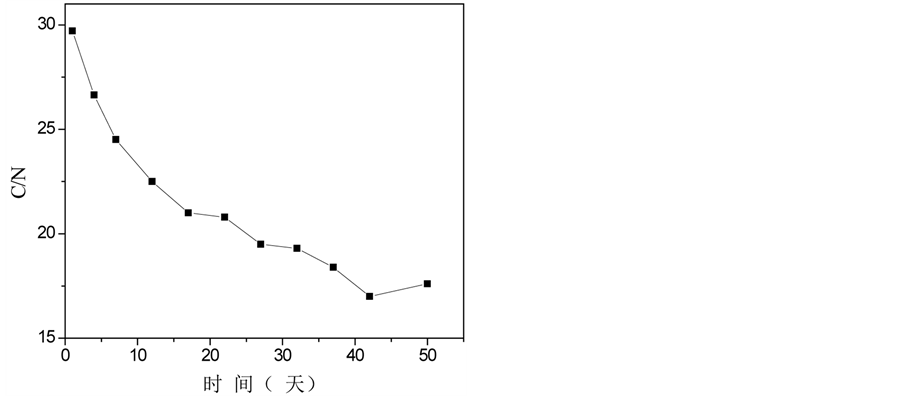
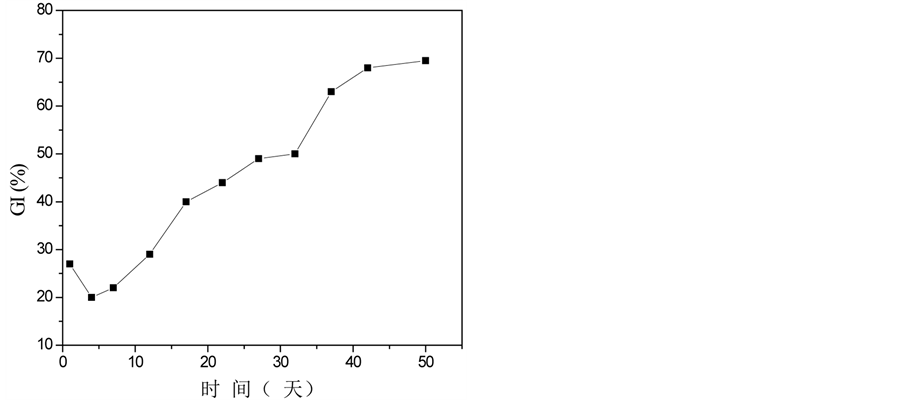
温度图显示了微生物活动和堆肥过程的发生 [1] 。堆体温度的变化经历了三个阶段,如图1(a)所示。第一阶段:升温阶段。温度在第6天升至45℃;第二阶段:高温阶段。堆体高温期持续4天,最高温度达55.2℃,在此期间,大多数病原微生物被杀死;第三阶段:稳定期。堆体温度最终稳定保持在23℃左右。pH值的变化趋势与EC值的变化趋势相似,从第一阶段到第二阶段,两者都迅速增加,这很可能是由于脂肪、碳水化合物、氮有机物等的分解,产生相关产物,例如氨,导致pH值升高(图1(c));类似的结果也可以从杨的实验中推断出 [6] 。一些无机离子(磷酸根和铵离子等),促进EC值的上升;随着堆肥的进行,EC值降低至1900 μs/cm2 (图1(b));pH值稳定在8.0左右,符合堆肥产品要求 [7] 。C/N比是评估堆肥腐熟度最常用参数之一。整个堆肥过程中,C/N比持续下降,并在堆肥末期降至18.6,低于堆肥成熟度的指标20 [8] (图1(e)),这表明堆肥已处于稳定腐熟状态。较高的GI值通常意味着堆肥对作物的毒性较低;在堆肥的早起阶段,由于植物生长抑制物质,例如低分子量有机酸和多酚类物质的产生,堆体的GI值略有降低(图1(g));然后随着这些有害物质的蒸发或转换成无害的物质,GI值再次增加,在堆肥末期,它到达69.5% (>50%)。图1(f)显示堆体的E4/E6随着温度的升高而增长,达到峰值3.98后逐渐降低,最终稳定在2.79。E4/E6是反映腐殖酸成型和特性的重要指标,E4/E6越低,堆肥的缩合与芳构化程度越高。因此,实验结果清晰地反映了堆肥过程中的矿化和有机物腐殖化现象。
3.2. 酶活性
在堆肥过程中,三种酶(过氧化氢酶,蔗糖酶和纤维素酶)的活性变化趋势类似,即他们都在堆肥初期时上升,然后下降(图2)。具体而言,从升温期到高温期,过氧化氢酶,纤维素酶和蔗糖酶的活性迅速增加,在第17天时分别达到峰值70.21 mL KMnO4/g,170.3 mg glucose/(g∙72h)和85.7 mg glucose/(g∙72h),随后下降。因为在堆肥的早期阶段,中温微生物和耐高温微生物数量和代谢强度在高温环境中迅速增长,因此有机物转化率较高。而在堆肥的后期,由于能被微生物利用的可降解有机化合物减少,因此酶的活性也随之降低 [9] ;此外,这一时期的温度降低对微生物生物量产生负面影响,而酶的产生依赖于微生物生物量,这意味着当该生物量下降,酶的活性降低 [10] 。因此,酶活性逐渐减少,并且在堆肥末期保持在较低的水平。纤维素酶和转化酶活性的结果与其他学者的研究结果一致 [11] ;然而,过氧化氢酶活动的数据与其他研究结果有一些差异 [12] 。这种差异可能是由于使用不同的堆肥原料和堆肥条件引起的 [13] 。
4. 讨论
堆肥是有机质在有氧环境中自发生物分解的过程,这一过程受多种物化条件和微生物活性的影响。本文通过为期50天的堆肥实验来解释堆肥过程中的物化状态和酶活性变化。第一周温度急剧上升,并保持在较高值;高温阶段能够有效地促使有机物(OM)含量迅速下降;然而,由于结构简单的小分子碳源的减少和新的复杂聚合有机化合物的增加,有机物的降解率逐渐较少;随着有机物的分解,氮有机物的分解而产生的副产物氨导致堆体的pH值相较于最初有所上升。然后,随着NH3挥发,硝化和有机酸中和,
 (a)
(a)
 (b)(c)
(b)(c)
 (d) (e)
(d) (e)
 (f)(g)
(f)(g)
Figure 1. Physico-chemical changes in compost samples over time. (a) Temperature, (b) EC, (c) pH, (d) Organic matter, (e) C/N ratio, (f) E4/E6, (g) GI value
图1. 堆肥过程中物化性质随时间的变化。(a)温度,(b) EC,(c) pH值,(d)有机质,(e) C/N比,(f) E4/E6,(g) GI值


 (a) (b) (c)
(a) (b) (c)
Figure 2. Enzymatic activities in compost. (a) Catalase, (b) Cellulase, (c) Sucrase
图2. 堆体中酶活性随时间的变化。(a)过氧化氢酶,(b)纤维素酶,(c)蔗糖酶
堆肥的pH值再次下降;事实上,pH值不是堆肥的关键因素,但它将影响到氨的挥发程度,从而影响到N损失程度 [14] 。报告显示,当pH值超过7.5,N损失可能特别高,从而降低营养浓度和堆肥质量。C/N比是反映堆肥成熟度的常用评估参数,有机碳和氮的含量与C/N显著相关(表3),堆肥末期,堆肥的C/N比是18.6 (20以下),达到了作为植物肥料的标准。此外,评估堆肥产物毒害性高低(高达70%的可视为无毒)的GI值,比其在堆肥之前的数值增加两倍以上,这表明堆肥后对植物生长不再存有不良影响 [15] ;从光谱学角度来评估腐殖性和堆肥过程的E4/E6,与GI值有显著的相关性(表3),秦莉等人 [16] 对城市生活垃圾堆肥过程的研究中也发现了两者之间有极显著相关性,这两者均与堆肥的腐熟度相关 [17] 。
堆肥原料的降解与不同种类的酶有着直接密切的联系,例如过氧化氢酶,纤维素酶和蔗糖酶。过氧化氢酶主要反映堆肥有机物(主要是木质素)的降解强度 [18] ,较高的酶活性表示有机物的转化率较高;纤维素酶主要涉及纤维素的水解,反映了纤维素分解强度;与其他酶作用相比,纤维素的分解对堆肥的影
Table 3. Correlation coefficients of major physico-chemical properties and relevant enzymatic activities in compost samples
表3. 堆肥过程中主要物化性质与酶活性的相关系数
注:*表示显著性水平为0.05,即P < 0.05水平;**表示显著性水平为0.01,即p < 0.01水平。其中,OM:有机质;C/N:堆体中总有机碳与总有机氮的比值;E4/E6:胡明酸水溶液中光学密度或吸光度分别在465 nm和665 nm处的比值;GI:种子发芽指数。
响较大 [19] ;此外,蔗糖酶可促进蔗糖降解为葡萄糖和果糖,从而加速有机物的分解,为微生物的活动提供碳源和能源,并促进堆肥的腐殖化程度 [11] 。堆肥过程中的酶活性研究,不仅有利于理解有机物的降解转化和碳氮腐循环过程,而且也有助于了解微生物的活动;微生物活动通常反映堆肥的稳定性 [1] 。
有机物含量和C/N比与纤维素酶和蔗糖酶活性高度相关(表3)。这说明蔗糖酶和纤维素酶活性大小可以反映出有机物含量是否充足 [20] ;另外,有机氮含量和纤维素酶的活性之间很强的相关性表明,堆肥过程中相当一部分的含氮物质来源于堆体纤维素的分解;此外,反映堆肥无害化程度的GI值和堆肥质量的EC,都表现出与过氧化氢酶、纤维素酶和蔗糖酶活性的显著相关性,这表明,有机物的不完全转化而产生的一些水溶性无机盐和硝酸盐,可能导致潜在的堆肥毒性;同时也观察到了E4/E6值和过氧化氢酶活性之间的相关性。据称,过氧化氢酶可能在腐殖质的形成中发挥着重要的作用 [21] ,其活性大小能够为堆肥物质的芳构化和腐熟度之间的关系提供间接证据,过氧化氢酶活性越高,说明堆肥物质的芳构化程度和腐熟度越高,堆肥品质越好 [3] ,由表3可知,过氧化氢酶活性与有机质没有显著相关性,由此说明该实验中过氧化氢酶活性不能表征有机质的状况,这与张莹等人 [22] 对污泥堆肥过程中酶活性的研究一致。此外,所涉及的三种酶活性彼此相关,相互影响。这可能是由于微生物物种之间的相互作用,尚待进一步研究。
5. 结论
首先,本文基于牛粪和芦笋秸秆的混合堆肥实验,讨论了若干关键的物化性质和酶活性变化,以及对它们之间的相关性进行观察;证明了过氧化氢酶、纤维素酶和蔗糖酶的活性对一些有机物如蔗糖和纤维素降解的重要性。此外,这三种酶的活性与有机物含量、EC和其他性能也具有一定的相关性。这些数据有助于更好地理解堆肥,也就是说,堆肥原料中的有机物,在微生物酶的催化作用下,经历一系列的物理化学反应,转化为结构更稳定、芳构化和缩合度更高的有机物。
致谢
感谢崇明生态养殖场和上海美容生物技术公司,感谢前者提供的牛粪和芦笋秸秆原料,以及后者提供的化学分析和帮助,本人也十分感谢贾玉蕾和马慧荣等对实验的贡献,以及导师吴敏的学术指导。
文章引用
吕药灵,吴 敏,贾玉蕾,马慧荣,姜晓琳. 堆肥过程中理化性质和酶活性的演变
Evolution of Physico-Chemical Properties and Enzymatic Activity during Composting[J]. 世界生态学, 2016, 05(01): 8-16. http://dx.doi.org/10.12677/IJE.2016.51002
参考文献 (References)
- 1. Bernal, M.P., Alburquerque, J.A. and Moral, R. (2009) Composting of Animal Manures and Chemical Criteria for Compost Maturity Assessment. A Review. Bioresource Technology, 100, 5444-5453. http://dx.doi.org/10.1016/j.biortech.2008.11.027
- 2. Domingo, J.L. and Nadal, M. (2009) Domestic Waste Composting Facilities: A Review of Human Health Risks. Environment International, 35, 382-389. http://dx.doi.org/10.1016/j.envint.2008.07.004
- 3. Zucconi, F., Monaco, A., Forte, M. and Bertoldi, M.D. (1985) Phytotoxins during the Stabilization of Organic Matter. In: Gasser, J.K.R., Ed., Composting of Agricultural and other Wastes, Elsevier Applied Science Publication, New York, 73-86.
- 4. He, Y.M., Xie, K.Z., Xu, P. Z., Huang, X., Gu, W.J., Zhang, F.B. and Tang, S.H. (2013) Evolution of Microbial Community Diversity and Enzymatic Activity during Composting. Research in Microbiology, 164, 189-198. http://dx.doi.org/10.1016/j.resmic.2012.11.001
- 5. Guan, S., Zhang, D. and Zhang, Z. (1986) Soil Enzyme and Its Research Methods. Agriculture Press, Beijing, 274-297.
- 6. Jang, J.-C., Shin, P.-K., Yoon, J.-S., Lee, I.-M., Lee, H.-S. and Kim, M.-N. (2002) Glucose Effect on the Biodegradation of Plastics by Compost from Food Garbage. Polymer Degradation and Stability, 76, 155-159. http://dx.doi.org/10.1016/S0141-3910(02)00011-3
- 7. Miller, F. and Metting Jr., F. (1992) Composting as a Process Based on the Control of Ecologically Selective Factors. In: Metting Jr., F.B., Ed., Soil Microbial Ecology: Applications in Agricultural and Environmental Management, Marcel Dekker, Inc., New York, 515-544.
- 8. Raut, M., William, S.P., Bhattacharyya, J., Chakrabarti, T. and Devotta, S. (2008) Microbial Dynamics and Enzyme Activities during Rapid Composting of Municipal Solid Waste—A Compost Maturity Analysis Perspective. Biore-source Technology, 99, 6512-6519. http://dx.doi.org/10.1016/j.biortech.2007.11.030
- 9. Castaldi, P., Garau, G. and Melis, P. (2008) Maturity Assessment of Compost from Municipal Solid Waste through the Study of Enzyme Activities and Water-Soluble Fractions. Waste Management, 28, 534-540. http://dx.doi.org/10.1016/j.wasman.2007.02.002
- 10. Ayuso, M., Hernandez, T., Garcia, C. and Pascual, J. (1996) Biochemical and Chemical-Structural Characterization of Different Organic Materials Used as Manures. Bioresource Technology, 57, 201-207. http://dx.doi.org/10.1016/0960-8524(96)00070-3
- 11. Liang, D.L., Gu, J., Gao, H., Qin, Q.J. and Li, S.X. (2009) Changes of Sucrase Activities and Temperature in Static State Composting Processes of Different Livestock and Fowl Excrement. Journal of Agro-Environment Science, 28, 1535-1540.
- 12. Li, M.Q., Yuan, Y.Y., Yang, J.Z., Zhang, J., Meng, Y.G. and Li, H.X. (2010) The Change of Enzyme Activity and Microbial Quantity in the Livestock Manure Composting Process. Journal of Chinese Biotechnology, 30, 56-60.
- 13. Queda, A.C., Vallini, G., Agnolucci, M., Coelho, C., Campos, L. and de Sousa, R.B. (2002) Microbiological and Chemical Characterisation of Composts at Different Levels of Maturity, with Evaluation of Phytotoxicity and Enzymatic Activities. Springer, Berlin. http://dx.doi.org/10.1007/978-3-662-08724-4_29
- 14. Paillat, J.-M., Robin, P., Hassouna, M. and Leterme, P. (2005) Predicting Ammonia and Carbon Dioxide Emissions from Carbon and Nitrogen Biodegradability during Animal Waste Composting. Atmospheric Environment, 39, 6833- 6842. http://dx.doi.org/10.1016/j.atmosenv.2005.07.045
- 15. Tiquia, S. (2005) Microbiological Parameters as Indicators of Compost Maturity. Journal of Applied Microbiology, 99, 816-828. http://dx.doi.org/10.1111/j.1365-2672.2005.02673.x
- 16. 秦莉, 李玉春, 李国学, 尹莉, 丁湘荣, 胡菊. 城市生活垃圾堆肥过程中腐熟度指标及控制参数[J]. 农业工程学报, 2006, 22(12): 189-194.
- 17. Iannotti, D.A., Pang, T., Toth, B., Elwell, D., Keener, H. and Hoitink, H. (1993) A Quantitative Respirometric Method for Monitoring Compost Stability. Compost Science & Utilization, 1, 52-65. http://dx.doi.org/10.1080/1065657X.1993.10757890
- 18. Hammel, K.E. (1996) Extracellular Free Radical Biochemistry of Ligninolytic Fungi. New Journal of Chemistry, 20, 195-198.
- 19. Poincelot, R. and Day, P. (1973) Rates of Cellulose Decomposition during the Composting of Leaves Combined with Several Municipal and Industrial Wastes and Other Additives. Compost Science, 14, 23-25.
- 20. Souza, A.C., Pease, T.K. and Gardner, W.S. (2012) Vertical Profiles of Major Organic Geochemical Constituents and Extracellular Enzymatic Activities in Sandy Sediments of Aransas and Copano Bays, TX. Estuaries and Coasts, 35, 308-323. http://dx.doi.org/10.1007/s12237-011-9438-y
- 21. Gu, W., Bao, F., Xu, P., Xie, K., Tang, S., Chen, J. and Yang, S. (2010) The Surfactant APG’s Influence on the Cow Dung Compost Enzyme Activity in a Composting Reactor. Journal of Chinese Ecological Agriculture, 18, 637-642. http://dx.doi.org/10.3724/SP.J.1011.2010.00637
- 22. 张莹, 许修宏, 李洪涛. 污泥堆肥过程中生物酶活性与理化因子关系分析[J]. 农业环境科学学报, 2012, 31(11): 2290-2295.
*通讯作者。
