Advances in Microbiology
Vol.05 No.04(2016), Article ID:19151,11
pages
10.12677/AMB.2016.54006
Biodegradation of Polybrominated Diphenyl Ethers in Mesophilic Anaerobic Digestion of Sewage Sludge
Gang Niu1, Dachao Sheng1, Hong Wang1, Zhigang Liu2, Ling Chen1, Xiaohu Dai2, Xiangzhou Meng1*
1State Key Laboratory of Pollution Control and Resources Reuse, College of Environmental Science and Engineering, Tongji University, Shanghai
2National Engineering Research Center for Urban Pollution Control, College of Environmental Science and Engineering, Tongji University, Shanghai

Received: Nov. 17th, 2016; accepted: Dec. 3rd, 2016; published: Dec. 6th, 2016
Copyright © 2016 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
As persistent organic pollutants, polybrominateddiphenyl ethers (PBDEs) were frequently detected in sewage sludge worldwide. The occurrence of PBDEs as well as the irpotential environmental risk was widely concerned in recent years. However, few studies were conducted on the fate of PBDEs during the disposal of sewage sludge. The present study developed a small-scale anaerobic digestion reactor to explore the degradation of PBDEs in sewage sludge in 60 days. Meanwhile, the microbial structure in sludge was analyzed, aiming to further identify the responsible species for the degradation. Results showed that the mesophilic anaerobic digestion reaction reached to equilibrium after two sludge age running (40 days). The mass of BDE-209, a main component of PBDEs in sewage sludge, increased in the first sludge age and then decreased in the following two ages with a degradation rate of 67.5%. For all other PBDE congeners, the mass increased dramatically in the third sludge age, especially for three nona-brominated congeners BDE-206, 207, and 208. Based on mass changes and chemical structures of three nona-brominated congeners, the debromination of BDE-209 is more likely to occur in meta- and ortho-position of bromine rather than para-position. Other degradation products containing bromine are also expected. High-throughput sequencing results indicated that the microbialspecies in anaerobic sewage sludge is diverse, of which dehalococcoidaceae could be contributed more to the degradation of PBDEs. The findings could provide help in the isolation and culture of strains for degradation of PBDEs in sludge.
Keywords:Sewage Sludge, Polybrominated Diphenyl Ethers, Anaerobic Digestion, Microbial Degradation, High-Throughput Sequencing

污泥中温厌氧消化过程中多溴联苯醚的 生物降解研究
牛刚1,盛大超1,王虹1,刘志刚2,陈玲1,戴晓虎2,孟祥周1*
1同济大学环境科学与工程学院,污染控制与资源化研究国家重点实验室,上海
2同济大学环境科学与工程学院,城市污染控制国家工程研究中心,上海

收稿日期:2016年11月17日;录用日期:2016年12月3日;发布日期:2016年12月6日

摘 要
多溴联苯醚(PBDEs)是城市污泥中普遍存在的一种持久性有机污染物,其残留浓度与生态风险近年来受到广泛关注,但关于污泥处置过程中PBDEs归宿的研究相对较少。本文通过建立小型规模实验装置,连续运行60天,考察了典型城市污泥中温厌氧消化过程中PBDEs的生物降解过程,并初步分析了导致PBDEs降解的微生物群落组成。结果表明:经过两个泥龄阶段(40天)的运行,厌氧消化反应达到稳定状态。污泥中主要的PBDEs同系物BDE-209的质量呈现先增加后减少的趋势,在整个厌氧消化过程中,降解率达67.5%。其它PBDEs同系物则在第III泥龄阶段均表现出增加的趋势,特别是三种九溴化合物BDE-206、207和208。根据九溴化合物的增加量及其化合物分子结构,发现BDE-209脱溴降解主要发生在邻位和间位溴原子上,同时也有其它含溴化合物的生成。通过16S rDNA高通量测序技术测定表明,污泥厌氧消化过程中微生物群落组成丰度较高,多样性较大,其中脱卤球菌科(Dehalococcoidaceae)有可能在PBDEs的降解中起到一定作用。这为进一步分离筛选和培养污泥中厌氧降解PBDEs的优势菌种提供了依据。
关键词 :污泥,多溴联苯醚,厌氧消化,微生物降解,高通量测序

1. 引言
多溴联苯醚(polybrominated diphenyl ethers,简称PBDEs)是一种添加型溴代阻燃剂,曾广泛应用于塑料、纺织品和泡沫等产品中。根据Br取代数目及取代位置的不同,PBDEs共有209种同系物 [1] 。PBDEs在环境中难以自然降解,可在生物体内产生累积,并可通过食物链进行富集。PBDEs的大量生产和使用导致其广泛存在于各种环境介质中 [2] [3] [4] 。研究表明,1981~2000年间加拿大北极环斑海豹(Phoca hispida)体内PBDEs浓度一直处于增长趋势,科学家预计在2050年PBDEs将成为该生物体内最主要的有机卤素化合物 [5] 。
高溴代联苯醚可以微生物降解生成毒性更强的低溴代联苯醚。Rayne等 [6] 对PBDEs的厌氧微生物降解进行了研究,结果表明BDE-15可以在污水厌氧处理过程中脱溴生成BDE-3和联苯醚。Gerecke等 [7] 以城市污水处理厂消化污泥为接种物,对BDE-209进行降解,在培养基质中检测到了2种九溴联苯醚和6种八溴联苯醚同系物,证明BDE-209发生了脱溴降解。He等 [8] 研究了厌氧菌Sulfurospirillum multivorans和Dehalococcoides sp.对十溴联苯醚(deca-BDE)和八溴联苯醚(octa-BDE)的降解情况。Sulfurospirillum multivorans可降解deca-BDE,但不能降解octa-BDE;相反,Dehalococcoides sp.可以降解octa-BDE,但不能降解deca-BDE。Lee等 [9] 采集不同区域的土壤和沉积物用于octa-BDE的降解研究,发现octa-BDE在大部分样品中可发生微生物脱溴过程。Tokarz等 [10] 和Huang等 [11] 对PBDEs的厌氧降解途径进行了较为详细的研究,高溴代联苯醚在还原脱溴作用下,可脱去邻位、间位或对位的溴原子,生成相应的低溴代产物。
城市污泥中普遍含有PBDEs [12] ,随着污泥的排放,这些持久性有机污染物将可能会再次进入环境中,对生态系统和人类形成潜在危害。目前对污泥中PBDEs厌氧生物降解的研究多集中在采用序批式实验培养方法,但是对于工程实际中的污泥厌氧消化厂,由于在一定的工艺参数下连续运行,与序批式的培养方式有很大不同。本论文拟通过建立和运行实验室规模的污泥厌氧消化反应器,来探讨污泥厌氧消化过程中PBDEs的降解过程。
2. 材料与方法
2.1. 实验材料
多溴联苯醚标准物质:BDE-17、28、33、47、49、66、99、100、138、153、154、183、190、196、203、206、207、208和209购自美国Accustandard公司。回收率指示物标样:BDE-50和BDE-172及内标BDE-118和BDE-128均购自美国Accustandard公司。丙酮、正己烷和二氯甲烷均为色谱纯级,购自德国CNW公司。
2.2. 实验装置
实验所用污泥厌氧消化实验装置由钢材制成,设有内外两腔,外腔中注满水,通过连接的加热和温控装置使内腔保持恒定的温度(35℃ ± 1℃)。内腔容积为6 L,是污泥进行厌氧消化反应的场所,在外腔的保护下,可以在运行中维持良好的厌氧状态。该厌氧消化反应器连有搅拌装置,可设定搅拌速率,实现反应物不同程度的混匀。进出料口采用密封设计,可以防止进出污泥的过程中有气体进入或泄露。内腔设有一个气体出口,与湿式气体流量计相连,用来测量反应器运行过程中气体的产量。
2.3. 实验方法
污泥厌氧硝化反应装置运行经历驯化和反应两个阶段,驯化阶段所用污泥来自上海安亭污水处理厂。首先在反应器中加入6 kg安亭污泥,然后每天进出安亭污泥300 g,反应器转速设为60 rmp,每10 min搅拌1 min,使反应物充分混合。实验过程中每天记录气体产生量,直到反应器厌氧消化达到稳定状态。反应阶段每天向反应器加入300 g实验污泥(取自上海白龙港污水处理厂),运行条件和驯化阶段污泥相同,反应阶段持续3个污泥龄,共60 d。在反应阶段,每天记录气体产量,每3 d测定pH、总固体含量(TS)、挥发性固体含量(VS)、总氨氮(TAN)和总碱度(TA,以CaCO3计)等指标。同时,每天采集反应器出污泥样品,用于后续PBDEs测定和16S rDNA高通量测序分析。实验污泥样品每隔15 d采集一次,共采集5次。接种污泥在驯化阶段结束时,平行采集3次,用于监控储存期间污泥中PBDEs的变化。在反应阶段,每天记录气体产量,同时采集反应器内污泥样品,用于后续PBDEs测定和16S rDNA高通量测序分析。
2.4. 污泥基本指标分析
污泥pH由Mettler Toledo FE20型pH计直接测得,TS、VS和TAN的测定方法参照美国公共卫生协会(APHA)发布的《水和废水标准检验法》(第19版)。为了减少色度和浊度的影响,TA通过自动碱度滴定仪测定,滴定终点pH设为4.3。
2.5. 多溴联苯醚的分析
污泥中PBDEs的分析参考文献 [12] 中报道的方法,即污泥样品经冷冻干燥48 h后研磨,过60目筛。取约0.2 g污泥样品,加入100 uL回标(BDE-52, 172),用110 mL二氯甲烷索氏提取48 h。向提取液中加入2 mL浓H2SO4以去除污泥中的有机质组份,静止分层后,将有机层再次通过凝胶色谱柱净化。之后,向提取液中加入Cu片以去除其中的硫。样品浓缩后,加入内标(BDE-118, 128),用于后续的仪器分析。PBDEs的测定使用气相色谱质谱联用仪(Agilent 7890A/5975C),色谱柱为DB-5(30 m × 0.25 mm × 0.25 µm, J & W Scientific)。低溴联苯醚(三至七溴联苯醚,BDE-17、28、33、47、49、66、99、100、138、153、154、183和190)的色谱柱升温程序为:初始温度80℃ (保持2 min);之后12℃/min升温到140℃,然后5℃/min升温到280℃(保持5 min);后运行300℃(保持15 min)。高溴联苯醚(八至十溴联苯醚,BDE-196、203、206、207、208和209)的色谱柱升温程序为:初始温度110℃(保持1 min);然后10℃/min升温到290℃ (保持11 min);后运行300℃ (保持15 min)。载气为高纯氦气,色谱柱流速为1.36 mL/min,进样口温度为280℃,进样量1 µL,进样方式为不分流进样。电离方式选择负化学电离模式,反应气为甲烷,离子源温度200℃。采用选择性离子检测模式,除BDE-209外,所有化合物的扫描离子为79、81;BDE-209的扫描离子为79、81、486.70和488.70。
2.6. 16S rDNA测序
以5-50 ng DNA为模板,PCR扩增细菌16S rDNA上包括V3、V4和V5的3个高度可变区。通过PCR向16S rDNA的PCR产物末端加上带有Index的接头。其中,V3和V4高度可变区进行扩增的正向引物包含序列“CCTACGGRRBGCASCAGKVRVGAAT”,进行扩增的反相引物包含序列“GGACTAC NVGGGTWTCTAATCC”。V4和V5高度可变区进行扩增的正向引物包含序列“GTGYCAGCMGCCGC GGTAA”,进行扩增的反相引物包含序列“CTTGTGCGGKCCCCCGYCAATTC”。然后,使用生物分析仪(Agilent 2100)检测文库质量,并且通过Qubit和实时定量PCR (Applied Biosystems)检测文库浓度。DNA文库混合后,进行2 × 250 bp双端测序,并读取序列信息,最后在Illumina basespace云端计算平台进行初始分类分析。
2.7. 质量控制与保障
污泥样品分析过程中,同时分析方法空白、加标空白及其平行样来进行质量控制和质量保证。每个样品中均加入回收率指示物(BDE-50和BDE-172),其回收率为分别为99.29% ± %8.54%和87.02% ± %6.48%。以干重计,目标物BDE-17、28 + 33、47、49、66、99、100、138、153、154、183、190、196、203、206、207、208和209的方法检出限依次为0.15、0.37、0.17、0.07、0.17、0.15、0.11、0.20、0.10、0.09、0.15、0.09、0.50、0.20、0.54、1.3、0.90和0.59 ng/g。样品中PBDEs同系物通读低于其检测限时,以1/2检测限计。样品浓度均扣除空白值,且不经回收率校正。
2.8. 数据分析
实验所用污泥厌氧消化实验装置由钢材制成,设有内外两腔,外腔中注满水,通过连接的加热和温控装置使内腔保持恒定的温度(35℃ ± 1℃)。内腔容积为6 L,是污泥进行厌氧消化反应的场所,在外腔的保护下,可以在运行中维持良好的厌氧状态。该厌氧消化反应器连有搅拌装置,可设定搅拌速率,实现反应物不同程度的混匀。进出料口采用密封设计,可以防止进出污泥的过程中有气体进入或泄露。内腔设有一个气体出口,与湿式气体流量计相连,用来测量反应器运行过程中气体的产量。
2.8.1. 污泥中PBDEs质量的变化
厌氧消化反应中污泥所含PBDEs质量的变化由其浓度计算得到,如公式(1)所示。
 (1)
(1)
其中,∆M表示污泥中PBDEs质量的日变化量(μg),∆C表示污泥中PBDEs浓度的日变化量(ng/g dw),V表示厌氧消化反应器体积(L,此值恒定为6 L),θ表示污泥的含水率(测定值为18.6%,假定反应过程中该值恒定),k表示单位转换系数。
污泥中PBDEs浓度的变化可由公式(2)计算得到。
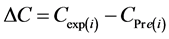 (2)
(2)
其中,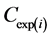 表示反应第i天污泥中PBDEs的测定值(ng/g dw),
表示反应第i天污泥中PBDEs的测定值(ng/g dw),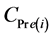 表示反应第i天污泥中PBDEs的预测值(ng/g dw),可由公式(3)计算得到。
表示反应第i天污泥中PBDEs的预测值(ng/g dw),可由公式(3)计算得到。
 (3)
(3)
其中, 表示反应第
表示反应第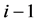 天污泥中PBDEs的测定值(ng/g dw),ν表示每天加入的污泥量(L,此值恒定为0.3 L,假定300 g污泥的体积为0.3 L)。
天污泥中PBDEs的测定值(ng/g dw),ν表示每天加入的污泥量(L,此值恒定为0.3 L,假定300 g污泥的体积为0.3 L)。
2.8.2. 污泥中PBDEs所含溴元素摩尔数(物质的量)
厌氧消化污泥中PBDEs所含溴元素摩尔数可由公式(4)计算得到。
 (4)
(4)
其中,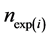 表示反应第i天污泥中PBDEs所含Br摩尔数的测定值(μmol),m表示PBDEs各同系物所含的溴原子个数,MW表示PBDEs各同系物的分子量(g/mol)。
表示反应第i天污泥中PBDEs所含Br摩尔数的测定值(μmol),m表示PBDEs各同系物所含的溴原子个数,MW表示PBDEs各同系物的分子量(g/mol)。
另外,我们假定污泥中的PBDEs在厌氧消化反应中未发生降解,此时可以根据公式(5)计算得到PBDEs所含Br摩尔数的预测值
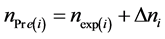 (5)
(5)
其中,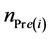 表示反应第i天污泥中PBDEs所含Br摩尔数的预测值(μmol),∆ni表示反应第i天污泥中PBDEs所含Br摩尔数的变化值(μmol),可由公式(6)计算得到。
表示反应第i天污泥中PBDEs所含Br摩尔数的预测值(μmol),∆ni表示反应第i天污泥中PBDEs所含Br摩尔数的变化值(μmol),可由公式(6)计算得到。
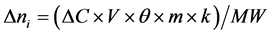 (6)
(6)
3. 结果与讨论
3.1. 污泥的基本性质
接种污泥(即驯化后污泥)和实验污泥(即厌氧消化反应所用污泥)的基本性质如表1所示。接种污泥和实验污泥的pH初始值分别为8.0和7.5,适于进行厌氧消化反应 [13] 。两种污泥的TS含量均大于15%,属于高含固率污泥,VS的含量范围为7.7%~11.8%。接种污泥中TAN和TA分别为3530 mg/L和11,200 mg/L,相应地,实验污泥中TAN和TA分别为2690 mg/L和9010 mg/L。
厌氧消化过程中污泥pH [14] 、VS/TS [15] 、TAN [16] 、TA [17] 的变化情况可用来判断反应的稳定性。
通常,在反应的初始阶段(0~20 d,第I泥龄),这些指标的变化范围较大,而在反应后期(如40~60 d,第III泥龄)变化较小。例如,初始阶段污泥的pH值在8.0~8.4之间;反应后期pH值相对稳定,在8.0左右。同样,初始阶段VS/TS变化幅度较大(39.2%~51.3%),反应后期趋于稳定,其平均值为48.8%,标准偏差仅为0.2%。这说明在初始阶段随着实验污泥的加入,改变了由接种污泥形成的厌氧消化反应平衡,导致系统处于不稳定状态。经过两个泥龄(40天)的运行,系统达到稳定状态。在反应稳定阶段(40~60 d,第III泥龄),反应器每天产气量的平均值为7.2 L。
3.2. 污泥中多溴联苯醚的含量
接种污泥和实验污泥中19种PBDEs同系物(BDE-17、28、33、47、49、66、99、100、138、153、154、183、190、196、203、206、207、208和209)的含量如表2所示。每种目标物均可以在污泥样品中检测到,表明PBDEs已广泛存在于上海市政污泥中,这与先前的研究结果相似 [12] 。以干重计,接种污
泥中19种PBDEs的总浓度(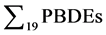 )为357 ng/g dw,远远低于实验污泥中PBDEs的总含量(19,000 ng/g
)为357 ng/g dw,远远低于实验污泥中PBDEs的总含量(19,000 ng/g
dw),这可能与两个污水处理厂的污水来源有关。两种污泥样品中,十溴联苯醚(BDE-209)都占绝对比例,分别为92.1% (接种污泥)和99.9% (实验污泥),然后依次是BDE-207、208、206、203、193、99和47等。污泥中PBDEs同系物分布特征主要与我国大量生产和使用十溴联苯醚工业品有关,其主要成份是BDE-209。在我国其它环境介质如土壤 [18] 、沉积物 [19] 和室内灰尘 [20] 等样品中,也发现了类似的分布特征。
Table 1. Basic characteristics of inoculated and experimental sludge
表1. 接种污泥和实验污泥的基本性质
Table 2. The concentrations of polybrominated diphenyl ethers (PBDEs) in inoculated and experimental sludge
表2. 接种污泥和实验污泥中多溴联苯醚的含量
3.3. 污泥厌氧消化过程中多溴联苯醚的变化
根据污泥中PBDEs同系物的分布特征,该部分选择主要目标物(BDE-209、208、207、206、203、196、183、153、138、99、47和28)作为对象,研究其在污泥厌氧消化过程中PBDEs的变化规律。
对于厌氧消化反应器内污泥中的BDE-209,存在两种来源。其一是实验污泥的添加导致其不断增加,其二是微生物的降解导致其逐渐减少,二者在不同反应阶段对BDE-209质量变化的贡献不同,致使BDE-209质量呈现上升或下降的趋势(图1)。在第I泥龄和第II泥龄阶段初期,BDE-209质量呈现增加现象,主要是因为该物质在实验污泥中的浓度(18300 ng/g dw)远远高于接种污泥含量(329 ng/g dw),会迅速增加反应器内BDE-209的质量,而此时厌氧反应尚未稳定,微生物的降解程度可能相对较低。在第III泥龄阶段,厌氧反应已经稳定,微生物酶活性增强,BDE-209的质量则呈现下降趋势,平均减少7820 μg。若考虑整个厌氧反应过程中(0~60 d)BDE-209质量的减少情况,则减少量约为19,600 μg,约占总质量的67.5%,表明在60天的厌氧消化过程中,污泥含有的BDE-209有67.5%发生了降解。
导致其它PBDEs同系物质量发生变化的有三部分作用,即实验污泥的添加、BDE-209的脱溴生成、微生物的降解。总体上,这些同系物呈现出不同的变化规律(图1)。BDE-208和207在第I泥龄阶段均出现了减少趋势,表明微生物产生的降解作用要大于实验污泥的添加和高溴代PBDEs的脱溴生成作用之和。在第I和III泥龄阶段,BDE-208和207的质量处于增加状态。对于BDE-203和196,在第I和II泥龄阶段均呈现减少现象,但绝对质量变化不大,平均值分别为1.6 μg和2.9 μg,在第III泥龄阶段开始增加。其余的PBDEs,包括BDE-206、183、153、138、99、47、28,其质量在整个消化反应过程中一直处于增加状态,平均增加量分别为0.55、0.34、0.12、0.38、0.68和0.33 μg。接种污泥(即驯化后污泥)和实验污泥(即厌氧消化反应所用污泥)的基本性质如表1所示。接种污泥和实验污泥的pH初始值分别为8.0。
3.4. 污泥中BDE-209的降解产物
低溴代PBDEs质量的增加表明了BDE-209在厌氧消化反应过程中发生了脱溴降解。前人研究表明,含卤化合物可以在厌氧条件下可以进行还原脱卤降解 [10] [21] 。在这些反应中,含卤化合物通常作为微生物呼吸和共代谢过程的电子受体。在本研究中,三种九溴代同系物BDE-208、207和206质量的增加幅度较大,平均值分别为11.8、106和179 μg,说明BDE-209首先脱溴生成九溴化合物。另外,BDE-206和207质量的增加量约为BDE-208的十倍,根据化合物分子结构,推断出BDE-209脱溴降解主要发生在邻位和间位溴原子上。Lee等在共培养菌GY2(由Dehalococcoides和Desulfovibrio组成)快速降解BDE-47、99和100过程中,也发现邻位上的溴原子会被优先脱去 [22] 。然后,Tokarz等以沉积物为培养基质对BDE-209进行厌氧降解,观察到三种九溴同系物(BDE-206、207和208)均有明显增加,脱溴程度与溴原子位置无明显关系 [10] 。也有研究发现,厌氧条件下BDE-209的降解主要发生在对位和间位,生成BDE-208和BDE-207,而邻位脱溴产物BDE-206没有明显增加 [23] 。厌氧降解过程中PBDEs脱溴位置的差别可能与微生物种类有关,其具体机理有待于进一步研究 [24] 。
此外,我们还分析了污泥厌氧消化过程中PBDEs所含溴元素的变化规律,如图2所示。在反应初始,反应器中仅有接种污泥,此时溴元素含量为4.1 μmol (以物质的量计)。随着实验污泥的加入,溴元素的含量逐渐增多。在第I泥龄阶段结束时,溴元素含量达到102 μmol,增加超过20倍;然而在第II泥龄阶段,溴元素含量变化不大,在100~201 μmol之间(平均值为152 μmol),并随反应时间延长有减少趋势。在第III泥龄阶段,厌氧消化反应进入稳定阶段,溴元素含量也相对稳定,在64.5~166 μmol之间,平均值为123 μmol,略低于第II泥龄阶段的平均值。同时,假定污泥中PBDEs在未发生生物降解情况下,我们计算了所含溴元素的物质的量,可以发现其随着实验污泥的加入,一直处于增加状态。在第I泥龄和第II泥龄阶段前半段(30 d),溴元素的理论值和实测值基本相同,表明PBDEs从高溴代同系物全部脱

Figure 1. The mass variation of PBDEs during anaerobic digestion of sewage sludge
图1. 污泥厌氧消化过程中多溴联苯醚同系物总质量变化率
溴生成低溴代同系物,即污泥中PBDEs主要组份BDE-209,全部脱溴生成了BDE-206、207和208,而无其它含溴化合物的产生。从第II泥龄阶段后半段(31 d)开始,溴元素含量的实测值一直小于理论值,在第60 d,该差值达到197 μmol,占理论值的64.6%。此差值说明PBDEs厌氧降解生成了其它溴代化合物,可能是目标物以外的低溴代PBDEs同系物,也可能是非PBDEs的含溴化合物。对于这些潜在的降解产物,则需要利用同位素示踪技术和质谱技术、并结合可能降解途径进一步确定其结构。
3.5. 污泥中降解PBDEs厌氧菌的初步分析
为进一步确定厌氧消化过程中对PBDEs产生降解作用的细菌种类,我们分别采集不同反应阶段的污泥样品进行了微生物群落分析。样品共有四组,包括第0天污泥(接种污泥)、第20 d污泥(代表第I泥龄阶段)、第40 d污泥(代表第II泥龄阶段)和第60 d污泥(代表第III泥龄阶段)。
污泥样品中测定的物种有细菌和古细菌,共覆盖46门,其中厚壁菌门(Firmicutes)是最主要的门,在0 d、20 d、40 d和60 d污泥样品中的相对丰度分别为62.9%、61.7%、57.4%和59.3%。其次是变形菌门

Figure 2. The variation of Br derived from PBDEs during anaerobic digestion of sewage sludge
图2. 污泥厌氧消化过程中多溴联苯醚所含溴元素的变化
(Proteobacteria),在四个污泥样品中所占比例分别为20.6%、18.4%、22.1%和17.3%,也处于优势地位。然后依次是放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)、WS6门、浮霉菌门(Planctomycetes)、互养菌门(Synergistetes)、TM7门、拟杆菌门(Bacteroidetes)、OP9门、装甲菌门(Armatimonadetes)和广古菌门(Euryarchaeota),相对丰度在0.1%到10%之间,余下各门相对丰度大都在0.1%以下。这与前期的研究结果类似 [25] [26] [27] 。例如:Chouari等 [25] 发现Firmicutes和Actinobacteria是厌氧消化污泥中主要的细菌门类,相对丰度为21.8%,其次为Chloroflexi (20.2%)、Bacteroidete (14.5%)和Proteobacteria (14.4%)。另外,OP10、WS3、OP8、TM6、OD1和C2等这些未培养的类群,也常在厌氧污泥中被检测到,且可作为潜在的门或纲 [27] 。
Chloroflexi门的厌氧绳菌纲(Anaerolineae)包含一些嗜热菌和中温菌,在厌氧污泥中常被检出 [28] 。前期研究表明,Chloroflexi中的脱卤球菌属(Dehalococcoides)具有还原脱卤作用,可以脱去PBDEs中的溴原子 [9] 。本研究中未检测到Dehalococcoides,但在60 d污泥样品中检测到了脱卤球菌科(Dehalococcoidaceae),相对丰度为0.008%,其很有可能在PBDEs的降解中起到一定作用。且在厌氧消化过程中,Chloroflexi的相对丰度随时间不断增加,这可能加快污泥中PBDEs的降解。
本研究仅对污泥中可能降解PBDEs的菌种进行了探讨,未来的研究需要对单一菌种的脱溴机理展开研究,从实际污泥样品中分离、筛选和优化出有利于PBDEs降解的微生物优势菌种。
4. 结论
1) 中温污泥厌氧消化反应系统经过两个泥龄的运行,达到平衡状态。在整个反应过程中,BDE-209的质量呈现先上升后下降趋势,减少量约为19,600 μg,约占总质量的67.5%,表明在60天的厌氧消化过程中,污泥含有的BDE-209有67.5%发生了降解。其它PBDEs同系物呈现出不同的变化规律。在第I和III泥龄阶段,BDE-208和207的质量处于增加状态。对于BDE-203和196,在第I和II泥龄阶段均呈现减少现象,但绝对质量变化不大,在第III泥龄阶段开始增加。其余的PBDEs,包括BDE-206、183、153、138、99、47、28,其质量在整个消化反应过程中一直处于增加状态。
2) 三种九溴代同系物BDE-208、207和206质量的增加幅度较大,说明BDE-209首先脱溴生成九溴化合物。另外,BDE-206和207质量的增加量约为BDE-208的十倍,结合化合物分子结构,推断出BDE-209脱溴降解主要发生在邻位和间位溴原子上。
3) 通过16S rDNA高通量测序技术测定表明,污泥厌氧消化过程中微生物群落组成丰度较高,多样性较大。污泥样品中的细菌和古细菌共覆盖46门,其中厚壁菌门(Firmicutes)是最主要的门,其次是变形菌门(Proteobacteria)。Chloroflexi门的脱卤球菌科(Dehalococcoidaceae),相对丰度虽然较低,但可能是降解PBDEs的重要菌种。
基金项目
本课题获国家自然科学基金(41172318);国家水体污染控制与治理科技重大专项(2012ZX07313001);新世纪优秀人才计划项目(NCET-12-0417)资助。
文章引用
牛 刚,盛大超,王 虹,刘志刚,陈 玲,戴晓虎,孟祥周. 污泥中温厌氧消化过程中多溴联苯醚的生物降解研究
Biodegradation of Polybrominated Diphenyl Ethers in Mesophilic Anaerobic Digestion of Sewage Sludge[J]. 微生物前沿, 2016, 05(04): 55-65. http://dx.doi.org/10.12677/AMB.2016.54006
参考文献 (References)
- 1. La Guardia, M.J., Hale, R.C. and Harvey, E. (2006) Detailed Polybrominated Diphenyl Ether (PBDE) Congener Composition of the Widely Used Penta-, Octa-, and Deca-PBDE Technical Flame-Retardant Mixtures. Environmental Science & Technology, 40, 6247-6254. https://doi.org/10.1021/es060630m
- 2. Darnerud, P.O., Eriksen, G.S., Jóhannesson, T., et al. (2001) Polybrominated Diphenyl Ethers: Occurrence, Dietary Exposure, and Toxicology. Environmental Health Perspectives, 109, 49-68. https://doi.org/10.1289/ehp.01109s149
- 3. Hites, R.A. (2004) Polybrominated Diphenyl Ethers in the Environment and in People: A Meta-Analysis of Concentrations. Environmental Science & Technology, 38, 945-956. https://doi.org/10.1021/es035082g
- 4. Law, R.J., Covaci, A., Harrad, S., et al. (2014) Levels and Trends of PBDEs and HBCDs in the Global Environment: Status at the End of 2012. Environment International, 65, 147-158. https://doi.org/10.1016/j.envint.2014.01.006
- 5. Ikonomou, M.G., Rayne, S. and Addison, R.F. (2002) Exponential Increases of the Brominated Flame Retardants, Polybrominated Diphenyl Ethers, in the Canadian Arctic from 1981 to 2000. Environmental Science & Technology, 36, 1886-1892. https://doi.org/10.1021/es011401x
- 6. Rayne, S., Ikonomou, M.G. and Whale, M.D. (2003) Anaerobic Microbial and Photochemical Degradation of 4,4’-Dibromodiphenyl Ether. Water Research, 37, 551-560. https://doi.org/10.1016/S0043-1354(02)00311-1
- 7. Gerecke, A.C., Hartmann, P.C., Heeb, N.V., et al. (2005) Anaerobic Degradation of Decabromodiphenyl Ether. Environmental Science & Technology, 39, 1078-1083. https://doi.org/10.1021/es048634j
- 8. He, J.Z., Robrock, K.R. and Alvarez-Cohen, L. (2006) Microbial Reductive Debromination of Polybrominated Diphenyl Ethers (PBDEs). Environmental Science & Technology, 40, 4429-4434. https://doi.org/10.1021/es052508d
- 9. Lee, L.K. and He, J. (2010) Reductive Debromination of Polybrominated Diphenyl Ethers by Anaerobic Bacteria from Soils and Sediments. Applied and Environmental Microbiology, 76, 794-802. https://doi.org/10.1128/AEM.01872-09
- 10. Tokarz, J.A., Ahn, M.Y., Leng, J., et al. (2008) Reductive Debromination of Polybrominated Diphenyl Ethers in Anaerobic Sediment and a Biomimetic System. Environmental Science & Technology, 42, 1157-1164. https://doi.org/10.1021/es071989t
- 11. Huang, H.W., Chang, B.V. and Lee, C.C. (2014) Reductive Debromination of Decabromodiphenyl Ether by Anaerobic Microbes from River Sediment. International Biodeterioration and Biodegradation, 87, 60-65. https://doi.org/10.1016/j.ibiod.2013.10.011
- 12. Yang, C., Meng, X.-Z., Chen, L. and Xia, S. (2011) Polybrominated Diphenyl Ethers in Sewage Sludge from Shanghai, China: Possible Ecological Risk Applied to Agricultural Land. Chemosphere, 85, 418-423. https://doi.org/10.1016/j.chemosphere.2011.07.068
- 13. Lay, J.J., Li, Y.Y. and Noike, T. (1997) Influences of pH and Moisture Content on the Methane Production in High- Solids Sludge Digestion. Water Research, 31, 1518-1524. https://doi.org/10.1016/S0043-1354(96)00413-7
- 14. Dai, X.H., Duan, N.N., Dong, B. and Dai, L. (2013) High-Solids Anaerobic Co-Digestion of Sewage Sludge and Food Waste in Comparison with Mono Digestions: Stability and Performance. Waste Management, 33, 308-316. https://doi.org/10.1016/j.wasman.2012.10.018
- 15. 段妮娜, 董滨, 李江华. 污泥和餐厨垃圾联合干法中温厌氧消化性能研究[J]. 环境科学, 2013, 34(1): 321-327.
- 16. Rajagopal, R., Masse, D.I. and Singh, G. (2013) A Critical Review on Inhibition of Anaerobic Digestion Process by Excess Ammonia. Bioresource Technology, 143, 632-641. https://doi.org/10.1016/j.biortech.2013.06.030
- 17. 付胜涛, 于水利, 严晓菊. 剩余活性污泥和厨余垃圾的混合中温厌氧消化[J]. 环境科学, 2006, 27(7): 1459-1463.
- 18. Duan, Y.P., Meng, X.Z., Yang, C., et al. (2010) Polybrominated Diphenyl Ethers in Background Surface Soils from the Yangtze River Delta (YRD), China: Occurrence, Sources, and Inventory. Environmental Science and Pollution Research, 17, 948-956. https://doi.org/10.1007/s11356-010-0295-1
- 19. Mai, B.X., Chen, S.J., Luo, X.J., et al. (2005) Distribution of Polybrominated Diphenyl Ethers in Sediments of the Pearl River Delta and Adjacent South China Sea. Environmental Science & Technology, 39, 3521-3527. https://doi.org/10.1021/es048083x
- 20. Li, Y., Chen, L., Wen, Z.H., et al. (2015) Characterizing Distribution, Sources, and Potential Health Risk of Polybrominated Diphenyl Ethers (PBDEs) in Office Environment. Environmental Pollution, 198, 25-31. https://doi.org/10.1016/j.envpol.2014.12.024
- 21. Schmidt, S., Fortnagel, P. and Wittich, R.M. (1993) Biodegradation and Transformation of 4,4’-and 2,4-Dihalodi- phenyl Ethers by Sphingomonas sp. Strain SS33. Applied and Environmental Microbiology, 59, 3931-3933.
- 22. Lee, L.K., Ding, C., Yang, K.L. and He, J. (2011) Complete Debromination of Tetra- and Penta-Brominated Diphenyl Ethers by a Coculture Consisting of Dehalococcoides and Desulfovibrio Species. Environmental Science & Technology, 45, 8475-8482. https://doi.org/10.1021/es201559g
- 23. Gerecke, A.C., Giger, W. and Hartmann, P.C. (2006) Anaerobic Degradation of Brominated Flame Retardants in Sewage Sludge. Chemosphere, 64, 311-317. https://doi.org/10.1016/j.chemosphere.2005.12.016
- 24. Robrock, K.R., Korytar, P. and Alvarez-Cohen, L. (2008) Pathways for the Anaerobic Microbial Debromination of Polybrominated Diphenyl Ethers. Environmental Science & Technology, 42, 2845-2852. https://doi.org/10.1021/es0720917
- 25. Chouari, R., Le Paslier, D., Daegelen, P., et al. (2005) Novel Predominant Archaeal and Bacterial Groups Revealed by Molecular Analysis of an Anaerobic Sludge Digester. Environmental Microbiology, 7, 1104-1115. https://doi.org/10.1111/j.1462-2920.2005.00795.x
- 26. Ariesyady, H.D., Ito, T. and Okabe, S. (2007) Functional Bacterial and Archaeal Community Structures of Major Trophic Groups in a Full-Scale Anaerobic Sludge Digester. Water Research, 41, 1554-1568. https://doi.org/10.1016/j.watres.2006.12.036
- 27. 刘君寒, 胡光荣, 李福利. 厌氧消化系统微生物菌群的研究进展[J]. 工业水处理, 2011, 31(10): 10-14.
- 28. Yamada, T., Sekiguchi, Y., Imachi, H., et al. (2005)Diversity, Localization, and Physiological Properties of Filamentous Microbes Belonging to Chloroflexi Subphylum I in Mesophilic and Thermophilic Methanogenic Sludge Granules. Applied and Environmental Microbiology, 71, 7493-7503. https://doi.org/10.1128/AEM.71.11.7493-7503.2005
