Advances in Microbiology
Vol.
12
No.
04
(
2023
), Article ID:
77340
,
17
pages
10.12677/AMB.2023.124015
海南鹦哥岭不同海拔热带山地雨林土壤 微生物群落多样性差异
吴红萍1,刘季2,刘磊3,李蕾1*
1海南师范大学生命科学学院热带岛屿生态学教育部重点实验室,海南 海口
2海南热带雨林国家公园管理局鹦哥岭分局,海南 白沙
3海南热带雨林国家公园管理局五指山分局,海南 五指山
收稿日期:2023年11月8日;录用日期:2023年12月6日;发布日期:2023年12月15日

摘要
土壤微生物作为土壤生态系统的重要组成部分,是自然生态系统重要的分解者,在生态系统的物质循环和能量转化中占有重要的地位,同时在维持陆地生态系统的结构和稳定其功能等诸多方面都发挥十分重要的作用。本研究以鹦哥岭不同海拔热带山地雨林的8个固定样地为实验样地,采用Biolog-ECO法,探讨了不同海拔梯度下的土壤微生物群落多样性变化特征。结果表明:部分海拔样地的土壤和凋落物的理化性质、土壤酶活性差异显著,且南坡和北坡不同。反映土壤微生物活性的AWCD值的大小顺序为:YGL22 (591 m) > YGL32 (550 m) > YGL23 (458 m) > YGL21 (745 m) > YGL18 (1025 m) > YGL24 (800 m) > YGL16 (1355 m) > YGL34 (406 m);南坡745 m海拔处样地土壤微生物群落对碳源的利用模式为理论模式I,南坡1025 m、1355 m与北坡458 m、800 m海拔处样地土壤微生物群落对碳源的利用模式为理论模式II,南坡406 m、550 m和北坡591 m海拔处样地土壤微生物群落对碳源的利用模式为理论模式III。土壤微生物群落功能多样性指数随海拔的升高先增加后减少,符合“中峰分布”格局。土壤微生物碳源代谢多样性的垂直地带性差异主要体现在碳水化合物、多聚物类和羧酸类碳源的利用,土壤微生物群落功能多样性与土壤有效磷含量显著正相关(p < 0.05),与土壤酸性磷酸酶、凋落物有机碳含量显著负相关(p < 0.05),与土壤过氧化氢酶显著负相关(p < 0.05)。土壤有效磷、酸性磷酸酶、过氧化氢酶和凋落物有机碳含量可能是导致鹦哥岭热带山地雨林土壤微生物群落功能多样性的海拔分布异质性的重要影响因子,研究结果为进一步探讨热带山地雨林与土壤微生物之间的关系奠定了基础。
关键词
热带山地雨林,海拔梯度,Biolog,土壤微生物,土壤微生物群落及多样性

Soil Microbial Community Diversity under Different Altitudes in the Tropical Mountain Rainforests of Yinggeling National Nature Reserve in Hainan Island
Hongping Wu1, Ji Liu2, Lei Liu3, Lei Li1*
1Key Laboratory of Ministry of Education for Ecology of Tropical Islands, College of Life Sciences, Hainan Normal University, Haikou Hainan
2Yinggeling Branch of Hainan Tropical Rainforest National Park Administration Bureau, Baisha Hainan
3Wuzhishan Branch of Hainan Tropical Rainforest National Park Administration Bureau, Wuzhishan Hainan
Received: Nov. 8th, 2023; accepted: Dec. 6th, 2023; published: Dec. 15th, 2023

ABSTRACT
Soil microbes are an important component of soil ecosystem and playing a key role in nutrient and energy cycling. At the same time, it plays a very important role in maintaining the structure and stabilizing the functions of terrestrial ecosystems. This study used 8 fixed plots of tropical mountain rainforests at different altitudes in Yinggeling as experimental plots, and used the BIOLOG- ECO method to explore the variation of soil microbial community diversity under different altitude gradients. The results showed that three were significant differences in the physicochemical properties and soil enzyme activities of soil and litter in some altitude plots, and the south and north slopes were different. The order of AWCD values reflecting soil microbial activity was YGL22 (591 m) > YGL32 (550 m) > YGL23 (458 m) > YGL21 (745 m) > YGL18 (1025 m) > YGL24 (800 m) > YGL16 (1355 m) > YGL34 (406 m); the utilization mode of soil microbial communities on carbon sources at elevations of 745 m on the south slope was the theoretical mode I, 1025 m and 1355 m on the south slope, 458 m and 800 m on the north slope were the theoretical mode II, 406 m and 550 m on the south slope and 591 m on the north slope were the theoretical mode III. The functional diversity index of soil microbial community increased first and then decreased with the increase of altitude, which conformed to the pattern of “Middle Peak Distribution”, and the vertical zonal differences in the metabolic diversity of soil microbial carbon sources were mainly reflected in the utilization of carbohydrates, polymers and carboxylic acids. The functional diversity of soil microbial community was significantly positively correlated with soil available phosphorus content (p < 0.05), negatively correlated with soil acid phosphatase and litter organic carbon content (p < 0.05), and highly negatively correlated with soil catalase (p < 0.01). The soil available phosphorus, acid phosphatase, catalase and organic carbon content of litter may be the important influencing factors for the altitude distribution heterogeneity of soil microbial community functional diversity in the Yinggeling tropical mountain rainforest. The results of this study suggested a basis for further investigation of the relationships between tropical mountain rainforests and soil microbial community diversity.
Keywords:Tropical Mountain Rainforest, Altitude Gradient, Biolog, Soil Microorganism, Soil Microbial Community and Diversity

Copyright © 2023 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
土壤微生物作为地球化学循环过程的重要参与者,参与土壤的有机质分解、元素循环和土壤矿化等化学活动,积极促进土壤物质循环、稳定与保持土壤的生产力和健康 [1] [2] 。近年来,土壤微生物多样性已成为土壤微生物学、土壤生态学和全球变化生物学等研究领域的热点问题,国内外众多学者对其开展了大量的研究 [3] [4] [5] 。
BIOLOG微平板法(BIOLOG-ECO Plate)是基于微生物利用碳源的表征特性来反映不同土壤或水体中的微生物区系差异,该方法能定量的评价生境来源微生物群落的功能多样性,具有方便快捷、灵敏度高、分辨率强、重现性好的优势 [6] [7] [8] 。虽然BIOLOG方法有一定的局限性,但其弥补了传统培养法、生物标记法和分子生物学方法无法获得的有关微生物群落总体活性和代谢功能信息的不足 [9] [10] 。目前被广泛应用于评价不同土壤类型、土地利用方式、土地经营管理模式、植被类型和植被恢复方式、海拔高度等的土壤微生物群落功能多样性 [11] - [16] 。因此,开展微生物群落研究具有非常重要的理论和应用价值。
鹦哥岭自然保护区位于海南岛中南部黎母山脉中段,属海洋性热带季风气候,区内保存着华南原生性最强、连片面积最大的雨林,是我国热带雨林生态系统保存最完整的区域之一 [17] 。鹦哥岭自然保护区具有海拔高、垂直带谱完整、生态类型丰富、原始性强等特点,目前的研究多集中于优势动植物的组成分布特征、多样性及其对环境变化的响应,以及土壤碳储量、凋落物现存量、养分循环动态以及森林生态系统服务价值评估等 [18] - [23] 。较少关注具有完整垂直谱带的热带山地雨林土壤微生物物种丰富度、群落组成结构、群落构建机制,以及与地上植被群落关系、与环境因子间关系的研究。为此,本文采用BIOLOG-ECO技术,通过沿鹦哥岭热带山地雨林海拔梯度的8个固定样地开展土壤微生物多样性研究,以期揭示其底物代谢多样性的变化特征及其土壤微生物适应海拔变化的生理代谢特征,为探索土壤微生物在热带山地雨林生态系统中的物质循环和能量流动中的作用和地位提供基础数据,为鹦哥岭自然保护区的管理提供理论依据。
2. 材料与方法
2.1. 研究区域概况
海南鹦哥岭国家级自然保护区(以下简称“保护区”),是以热带雨林及其生态系统为主要保护对象的森林生态类型保护区。保护区位于海南岛中南部黎母山脉中段,与霸王岭国家级自然保护区、佳西省级自然保护区交界,总面积50,464 hm2。保护区属热带海洋性季风气候;年均气温23~35℃,年降水量在1500~2000 mm之间,雨季旱季分明 [24] 。保护区土壤类型以赤红壤、砖红壤、山地黄壤土为主;地势中间高四周低,海拔从200~1812 m,最高峰为鹦哥岭 [25] 。“中高周低”的地貌特征形成了与海拔变化相应的土壤和植被类型,主要包括热带低地雨林、热带季雨林、热带山地雨林、热带山地常绿林、热带针叶林和热带山顶矮林等类型,整个区域的植被构成体现了完整的热带–亚热带植被垂直带 [26] 。
2.2. 样地设置与取样方法
2020年6月,选取保护区内不同海拔热带山地雨林的8个固定样地(50 × 50 m),其具体信息见表1。在每个固定样地内随机选取3个小样格(10 m × 10 m),即3个重复。在每个小样区内以五点采样法随机采样,先收集采样点30 cm × 30 cm范围内的凋落物装入自封袋,再采集新鲜表层土壤(0~10 cm),去除植物根系和石块等,将5个采样点的土壤充分混匀合并为一份样,装入无菌自封袋置于4℃保温箱里带回实验室,24 h内完成Biolog测定。
Table 1. Descriptions of the fixed sample plots at different altitudes in the tropical mountain rainforest of Yinggeling
表1. 鹦哥岭热带山地雨林不同海拔固定样方情况
注:1、YGL34表示34号固定样地;2、经、纬度数值系公里网格,采用北京54坐标系统。
2.3. 土壤、凋落物理化性质及酶活性测定
土壤理化指标的测定主要参照《土壤农业化学分析》和《森林土壤分析方法》 [27] [28] 。其中:土壤pH采用2.5:1水土比玻璃电极法测定,土壤含水量采用烘干称重法,土壤有机质采用高温外热重铬酸钾氧化–容量法,土壤全氮采用凯氏–蒸馏滴定法,土壤全磷采用氢氧化钠熔融–钼锑抗比色法,土壤全钾采用氢氧化钠熔融–火焰原子吸收分光光度法,土壤碱解氮采用碱解扩散法,土壤有效磷采用盐酸–氟化铵提取–钼锑抗比色法,土壤速效钾采用乙酸铵提取–火焰原子吸收分光光度法;土壤铵态氮采用硝态氮,氯化钾提取–氧化镁–代氏合净金蒸馏法,土壤硝态氮采用紫外分光光度校正因数法。
土壤酶活性的测定参照《土壤酶及其研究方法》 [29] 。其中:土壤脲酶采用靛酚蓝比色法,土壤酸性磷酸酶采用磷酸苯二钠比色法,土壤过氧化氢酶采用容量法。
凋落物于85℃烘箱烘干至恒重,以干物质计算凋落物生物量,并计算含水量。凋落物烘干后粉碎,按照LY/T 1271-1999《森林植物与森林枯枝落叶层全氮、磷、钾、钠、钙、镁的测定》测定凋落物的全氮、全磷和全钾养分指标。其中:凋落物有机碳采用高温外热重铬酸钾氧化–容量法;凋落物全氮采用硫酸–双氧水消煮–蒸馏滴定法;凋落物全磷采用硫酸–双氧水消煮–钒钼黄比色法;凋落物全钾采用硫酸–双氧水消煮–火焰原子吸收分光光度法。
2.4. 土壤微生物活性测定
参考章家恩等人的方法并加以改进,具体方法如下:称取鲜土10 g加入到装有90 mL 0.85% NaCl灭菌生理盐水的250 mL三角烧瓶中(瓶内加5~10粒玻璃珠),120 r/min振荡培养30 min,确保细菌、真菌及其孢子混合均匀。冰浴中静置5 min后,取5 mL土壤悬浊液加入到装入45 mL无菌水的100 mL三角烧瓶中,充分摇匀,重复稀释2次,得到1:100的土壤悬浊液用于ELSIA反应。用排枪吸取150 μl土壤悬浮液至已预热的Biolog-ECO平板的96孔中,28℃恒温条件下连续培养9 d,每24 h用Biolog自动读数仪读取590 nm和750 nm处的吸光值,记录数据并保存,用于后续分析 [30] 。
平均颜色变化率(Average Well Color Development, AWCD),也称平均吸光值,用来评估土壤微生物群落对碳源利用的整体情况及利用活性 [31] 。Shananon-Wiener指数(H’值),用来评估微生物物种的丰富度,指被利用的碳源的总数,为每孔中(C-R)值大于0.25的孔个数。对于稀疏种敏感,是研究群落微生物物种及其个体数与分布均匀程度的综合指标 [32] 。Simpson指数(D值),又称优势度指数。用来评估物种的优势度,该指数对富集中相对敏感,是对微生物多样性方面的集中性的度量。Pielou指数(E值),又称均匀度指数,是微生物群落实测多样性与最大多样性的比率,通过Shananon-Wiener指数计算出的精度。McIntosh指数(U值),是基于群落物种的多维空间上的Euclidian距离的多样性指数 [33] 。
(1) AWCD = [∑(Ci − R)]/n,式中:Ci为所测定的31种碳源孔的吸光值,R为对照孔的吸光值,n为培养基的碳源种类(ECO板为31种);
(2) H’ = −∑(Pi.lnPi),式中:Pi为第i孔相对吸光值与整个平板相对吸光值总和的比值,Pi = (Ci − R)/∑(Ci − R),表示有培养基(碳源)的孔和对照孔(A1)的光密度值差与整板总差的比值;
(3) D = 1 − ∑Pi2;
(4) E = H’/lnS,式中:S为被利用的碳源总数,log选用e为底;
(5) U = ∑ni2,式中:ni = Ci − R,是第i孔的相对吸光值,丰富度指数R指被利用的碳源总数目。
2.5. 数据处理与分析
所有数据均为平均值 ± 标准误,利用SPSS22.0 (IBM Corp., Chicago IL, USA)对各类碳源的利用及多样性数据进行单因素方差分析(one-way ANOVA)和主成分分析。Pearson相关系数来分析土壤及凋落物理化性质及酶活性与土壤微生物群落多样性指数之间的关系。
3. 结果与分析
3.1. 不同海拔土壤理化性质及酶活性特征
Table 2. Soil physical-chemical properties at different altitudes
表2. 不同海拔样地土壤理化性质
注:同列不同小写字母代表在各海拔梯度之间差异显著(p < 0.05)。
从表2可以看出,不同海拔样地土壤pH介于3.85~4.92之间,属于酸性土壤。南坡样地土壤pH随海拔的升高先升高后降低,1355 m海拔处样地的pH显著最低;北坡样地土壤pH随海拔的升高持续降低,458 m海拔处样地的pH显著最高(p < 0.05)。不同海拔样地土壤有机质含量29.43~116.80g.kg−1之间,整体随海拔的升高而升高,仅部分海拔样地间差异显著(p < 0.05)。不同海拔样地土壤全氮含量在1.02~4.15 g∙kg−1之间,整体随海拔的升高而升高,部分海拔样地间差异显著(p < 0.05);不同海拔样地土壤碱解氮、铵态氮和硝态氮含量随海拔的升高呈现不规则变化,仅部分海拔样地间差异显著(p < 0.05),碱解氮和硝态氮含量分别在550 m和1355 m海拔处显著最高(p < 0.05),而铵态氮含量在591 m海拔处显著最低(p < 0.05)。不同海拔样地土壤全磷和有效磷含量分别在0.12~0.40 g∙kg−1和1.31~4.44g∙kg−1之间,均随海拔的升高呈现不规则变化,且均在745 m海拔处显著最高(p < 0.05),部分海拔样地间差异显著(p < 0.05)。不同海拔样地土壤全钾和速效钾含量分别在6.38~32.19 g∙kg−1和81.16~168.37 g∙kg−1之间,均随海拔的升高呈现不规则变化,仅在部分海拔样地间差异显著(p < 0.05),全钾含量和速效钾含量分别在550 m和1025 m海拔处最高。
从表3可以看出,不同海拔样地土壤过氧化氢酶、酸性磷酸酶以及脲酶含量分别在2.50~3.64 mL∙g−1∙20min−1、1176.47~3067.77 mg∙g−1∙2h−1和460.79~858.86 mg∙g−1∙24h−1之间,均随海拔的升高呈现不规则变化,且仅在部分海拔样地间差异显著,其中土壤过氧化氢酶含量在1355 m海拔处显著最高(p < 0.05),在591 m海拔处显著最低(p < 0.05);土壤酸性磷酸酶和脲酶含量均在1025 m海拔处最高。
Table 3. Enzyme activities of soils at different altitudes
表3. 不同海拔样地土壤酶活性
注:同列不同小写字母代表在各海拔梯度之间差异显著(p < 0.05)。
从表4可以看出,不同海拔样地处的凋落物重量差异均不显著,凋落物其他理化性质均随海拔的升高呈现不规则变化,591 m海拔处样地凋落物有机碳含量显著最低(p < 0.05),其他理化性质仅在部分海拔样地间差异显著(p < 0.05)。
Table 4. Litter material physical-chemical properties at different altitudes
表4. 不同海拔样地凋落物理化性质
注:同列不同小写字母代表在各海拔梯度之间差异显著(p < 0.05)。
3.2. 不同海拔土壤微生物的平均颜色变化率的动态特征
由图1可知,24 h内土壤微生物活性较低,微生物培养24 h后,微生物对底物利用快速增加,各海拔样地AWCD值呈相似的趋势。整体来看,591 m海拔处的AWCD值最高,406 m海拔处的AWCD值最低,其他海拔处的AWCD值相当。由于不同类型的土壤微生物群落利用碳源能力的不同,因此不同的碳源利用模式即可表征微生物群落的差异。根据AWCD值曲线的变化情况(图1)还可以看出,南坡745 m海拔处样地土壤微生物个体生物量多且种群丰富,属于土壤微生物利用碳源的理论模式I;北坡800 m和南坡1025 m、1355 m海拔处样地土壤微生物个体数量少但种群丰富,属于土壤微生物利用碳源的理论模式II;南坡406 m、550 m和北坡591 m海拔处样地土壤微生物土壤某些种类的微生物数量多但种群丰富度低,属于土壤微生物利用碳源的理论模式III。由此可见,在“低”(406 m、550 m和591m)、“中”(745 m)、“高”(800 m、1025 m和1355 m)海拔处呈现了不同的碳源利用模式,据此推测鹦哥岭热带山地雨林不同海拔处土壤微生物群落结构不同。

Figure 1. AWCD dynamics change with incubation time at different altitudes
图1. 不同海拔下的土壤微生物群落平均颜色变化率随时间的变化
3.3. 不同海拔土壤微生物利用不同碳源的强度特征
不同海拔热带雨林样地土壤微生物群落对碳水化合物类、羧酸类、氨基酸类、多聚物类、酚酸类和胺类六大类碳源的利用结果表明(图2-A,图2-B),鹦哥岭热带山地雨林各海拔点样地土壤微生物群落对碳源的利用情况不同,不同海拔样地土壤微生物群落对碳源的利用程度不同,且南坡和北坡存在差异。海拔和坡向共同影响土壤微生物利用碳源的强度。
从图2-A可知,南坡不同海拔土壤微生物群落利用胺类和羧酸类碳源差异不显著(p > 0.05),对胺类碳源的利用在550 m海拔处最高,对羧酸类碳源的利用在1025 m海拔处最高。550 m、745 m、1025 m和1355 m四个海拔样地土壤微生物群落对多聚物类碳源的利用差异不显著(p > 0.05),但均显著高于406 m海拔处(p < 0.05),且在1355 m海拔处最高。土壤微生物群落对碳水化合物、氨基酸类、酚酸类碳源的利用随海拔的升高先升高后降低,1025 m海拔处的样地土壤微生物群落对酚酸类碳源的利用最高,1025 m和1355 m两个“高”海拔处的样地土壤微生物群落对酚酸类碳源的利用显著高于406 m的“低”海拔处(p < 0.05),745 m的“中”海拔处样地土壤微生物群落对酚酸类碳源的利用与406 m和550 m 两个“低”海拔处差异不显著(p > 0.05)。550 m海拔处土壤微生物群落对碳水化合物类和氨基酸类碳源的利用最高,其中:对碳水化合物类碳源利用,550 m海拔处显著高于1355 m海拔处(p < 0.05),与406 m、745 m和1025 m海拔处差异不显著(p > 0.05);对氨基酸类碳源的利用,550 m海拔处显著高于406 m海拔处和1355 m海拔处(p < 0.05),与745 m和1025 m海拔处差异不显著(p > 0.05)。南坡不同海拔土壤微生物群落利用不同碳源(胺类和羧酸类除外)的不同,同样也说明了南坡不同海拔土壤微生物群落结构不同。
从图2-B可知,北坡不同海拔土壤微生物群落对碳水化合物、氨基酸类、多聚物类、酚酸类、胺类和羧酸类六大类碳源的利用均随海拔的升高先升高后降低,其中:利用氨基酸类、酚酸类和胺类碳源差异不显著(p > 0.05),且在591 m海拔处最高;对碳水化合物类碳源的利用,591 m的“中”海拔处显著高于458 m的“低”海拔和800 m的“高”海拔处(p < 0.05),“低”海拔处和“高”海拔处差异不显著(p > 0.05);对多聚物类碳源的利用,591 m的“中”海拔处显著高于800 m的“高”海拔处(p < 0.05),“低”海拔处和“高”海拔处差异不显著(p > 0.05);对羧酸类碳源的利用,591 m的“中”海拔处显著高于458 m的“低”海拔处(p < 0.05),“低”海拔处和“高”海拔处差异不显著(p > 0.05)。北坡不同海拔处土壤微生物群落利用不同碳源(氨基酸类、酚酸类和胺类除外)的不同同样也说明了北坡不同海拔土壤微生物群落结构不同。
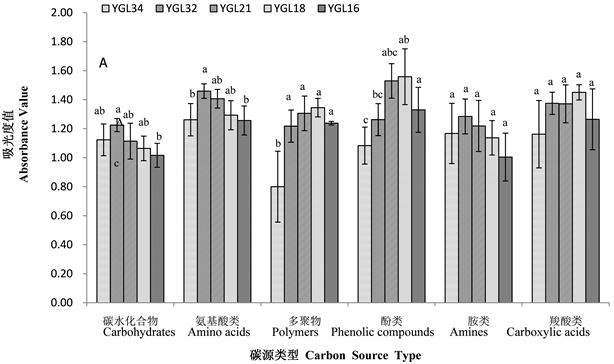
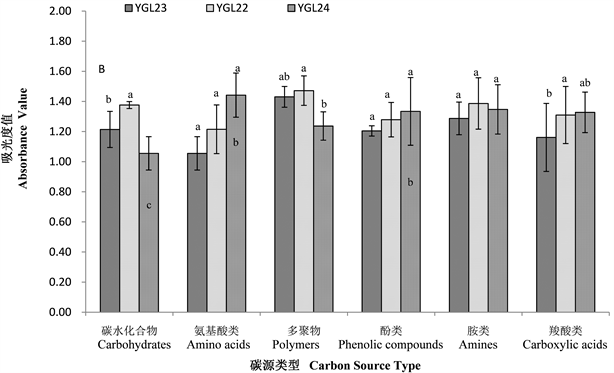
Figure 2. Different carbon source utilization by soil microbial community in different slope directions (A: Southern slope, B: northern slope) at different altitudes
图2. 不同坡向(A:南坡,B:北坡)不同海拔土壤微生物群落对不同碳源的利用
3.4. 不同海拔土壤微生物群落功能多样性指数特征
从表5可知,鹦哥岭热带山地雨林土壤微生物群落McIntosh指数和Shannon指数整体随海拔的升高先升高后降低,McIntosh指数在591 m海拔处显著最高,部分海拔样地间差异显著(p < 0.05);Shannon指数在591 m海拔处最高,各海拔样地间差异均不显著(p > 0.05);Simpson指数和Pielou指数在各海拔样地间差异均不显著(p > 0.05)。结合图1,可知591 m海拔处(YGL22)热带山地雨林土壤微生物活性最强。
Table 5. Functional diversity index of soil microbial communities at different altitudes
表5. 不同海拔的土壤微生物群落功能多样性指数
注:表中同一列字母不同,表示差异显著(p < 0.05)。
3.5. 不同海拔土壤微生物群落代谢功能主成分分析
提取Biolog-ECO微平板上144 h的31种碳源底物利用情况进行主成分分析,结果表明,不同海拔土壤微生物第一主成分(PC1)和第2主成分(PC2)贡献率分别为32.38%和28.47%,累计贡献率达60.75%,是微生物群落碳源利用变异的主要来源,其他主成分存在一定的贡献率(图3)。YGL34位于PC1的负端得分系数分别为−1.9228;YGL32、YGL21、YGL22和YGL23均位于位于PC1轴“基点”附近,得分系数在−0.2119~0.94139之间,四样点基本聚集为一簇;YGL18、YGL16、YGL24均位于PC2的正端,得分系数在0.6108~1.3135之间,三样点基本聚集为一簇。另外,YGL34位于PC2的正端,得分系数为0.3245,为单独的一簇。由此可见,PC1和PC2基本能区分鹦哥岭不同海拔土壤微生物的群落特征,“低”(406 m)、“中”(458 m, 550 m, 591 m, 745 m)、“高”(800 m, 1025 m, 1355 m)海拔显著影响土壤微生物的碳源利用。
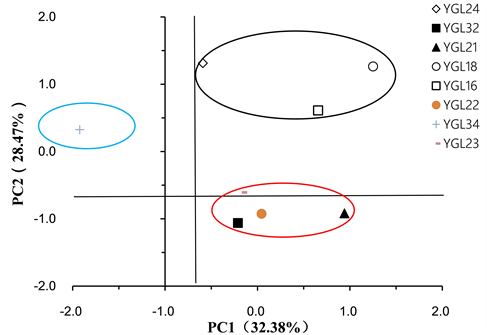
Figure 3. Principle component (PC) analysis for carbon utilization of soil microbial communities at different altitudes
图3. 不同海拔土壤微生物群落碳源利用主成分分析
进一步将主成分得分系数与单一碳源AWCD值做相关分析,即获得31种碳源在2个主成分上的载荷值,载荷因子越高,表示该碳源对主成分的影响越大,两者之间的相关性越高。从表6可知,鹦哥岭不同海拔热带山地雨林土壤微生物,在31种碳源中与PC1高度相关(主成分相关系数 > 0.7)的碳源有7种,其中5种正相关,2种负相关,分别属于碳水化合物类3种,多聚物类2种,羧酸类和酚酸类各1种;与PC2高度相关的碳源有8种,其中5种正相关,3种负相关,分别属于碳水化合物类4种,氨基酸酸类2种,羧酸类和多聚物类各1种。综合与PC1和PC2高度相关的碳源类型可见,在主成分分离中起主要贡献作用的是碳水化合物类、多聚物类和羧酸类的碳源。
Table 6. Loading factors of carbon sources utilization of soil microbial in tropical mountain rain forest of Yinggeling
表6. 鹦哥岭热带山地雨林土壤微生物主要利用碳源的载荷因子
3.6. 不同海拔土壤微生物群落碳代谢与土壤理化性质的相关性分析
从表7可知,鹦哥岭热带山地雨林土壤微生物群落功能多样性McIntosh指数与土壤理化性质相关性程度大小依次为过氧化氢酶 > 有效磷 > 酸性磷酸酶 > 有机质 > 全氮 > 铵态氮 > 全磷 > 脲酶> pH > 硝态氮 > 速效钾 > 碱解氮 > 全钾。其中:与pH、全钾、有效磷、速效钾正相关,与其他理化因子之间负相关;与有效磷显著正相关(p < 0.05),与过氧化氢酶、酸性磷酸酶显著负相关(p < 0.05)。土壤微生物群落功能多样性Shannon指数、Simpson指数和Pielou指数与土壤理化性质相关性绝对值均较小(r < 0.2),极弱相关或不相关。
Table 7. Correlation analysis of physical-chemical properties and microbial community functional diversity in the tropical montane rainforest of Yinggeling
表7. 鹦哥岭热带山地雨林土壤理化及酶活性与微生物群落功能多样性的相关性
注:n = 24,*表示显著相关(p < 0.05),**表示极显著相关(p < 0.01)。
3.7. 不同海拔土壤微生物群落碳代谢与凋落物理化性质的相关性分析
Table 8. Correlation between physical—chemical properties of litter and functional diversity of microbial community
表8. 凋落物理化性质与微生物群落功能多样性的相关性
注:n = 24,*表示显著相关(p < 0.05)。
凋落物是联系植被与土壤两个系统的纽带,凋落物分解是森林生态系统尤为关键的生态过程之一,对森林的生物地球化学循环起着十分重要的作用,是土壤有机质的主要来源。凋落物的化学组成影响土壤微生物学性状,为了解凋落物与土壤微生物群落功能多样性之间的关系,对土壤微生物群落功能多样性与凋落物理化性质进行相关性分析。从表8可以看出,鹦哥岭热带山地雨林土壤微生物群落功能多样性McIntosh指数与凋落物有机碳含量显著负相关(p < 0.05),与凋落物其他理化性质之间弱相关或极弱相关,甚至不相关;土壤微生物群落功能多样性Shannon指数、Pielou指数和Simpson指数与凋落物理化性质弱相关或极弱相关,甚至不相关。
4. 讨论
4.1. 海拔变化对土壤微生物利用碳源的影响
海拔梯度的上升会引起气候、植被和土壤养分等环境因子的变化,尤其是引起直接作用于生境的光照、湿度、温度等气候生态因子的变化,最终影响土壤微生物群落活性和多样性特征。本研究中不同海拔梯度下土壤微生物群落的AWCD值均随时间的延长而上升,整体上随海拔上升呈现先上升后下降的单峰变化趋势,该研究结果与王颖、朱平、孟苗婧等的研究结果基本一致 [10] [34] [35] ,与吴则焰、韩冬雪、宋贤冲的研究结果不一致 [36] [37] [38] [39] 。由此推测,本研究中鹦哥岭热带山地雨林不同海拔土壤微生物群落的AWCD值的变化特征可能是土壤理化性质和土壤酶活性综合作用的结果,土壤有效磷、过氧化氢酶和酸性磷酸酶活性是最重要的影响因子。
4.2. 海拔变化对土壤微生物群落功能多样性指数的影响
土壤中微生物物种数量及其分布的均匀度决定土壤微生物群落中的物种多样性,物种多样性指数的差异侧面反映了土壤微生物多样性,群落多样性指数可用来指示土壤微生物群落利用碳源的程度 [40] 。山地生态学中的“中部膨胀”理论认为植物和动物在垂直地带上的多样性分布具有明显的中峰优势,这一现象已被以往的研究证实,微生物在垂直地带上的多样性分布同样存在类似的中锋优势分布规律 [36] [41] 。本研究中鹦哥岭热带山地雨林生态系统的土壤微生物群落功能多样性指数整体随海拔的升高先增加后减少,土壤微生物群落功能多样性在垂直地带上的分布具有明显的中锋优势;同时发现Shannon、Simpson和Pielou指数在各海拔间差异均不显著,McIntosh指数仅在部分海拔间差异显著;591 m海拔处样地的Shannon指数和McIntosh指数均最高,406 m海拔处样地的Shannon指数最低。由此可见,鹦哥岭热带山地雨林“中”海拔处样地微生物种类多且分布均匀,利用碳源多且强度大;鹦哥岭热带山地雨林“低”海拔处样地微生物种类相对较少且分布不均匀。结合土壤及凋落物理化性质及酶活性与微生物群落功能多样性的相关性结果(表7~8),推测鹦哥岭热带山地雨林土壤微生物群落功能多样性的垂直地带性差异可能与植被类型的改变及其伴随的土壤养分的改变有关。
4.3. 海拔变化对土壤微生物群落利用碳源强度和利用模式的影响
海拔高度变化影响植被组成、结构,土壤温湿度、水分、养分,土壤有机质和微生物活性,进而影响土壤微生物群落功能和结构 [42] [43] [44] [45] 。本研究发现鹦哥岭热带山地雨林南坡的“低”海拔处,土壤微生物群落对氨基酸类和羧酸类碳源的利用程度相对较高,对多聚物类碳源的利用程度相对较低;南坡的“中、高”海拔处,土壤微生物群落对酚类和羧酸类碳源的利用程度相对较高,对碳水化合物类的利用程度相对较低。北坡各海拔处的土壤微生物群落对氨基酸类碳源的利用程度相对较高,对碳水化合物类碳源的利用程度相对较低。上述研究结果与宋贤冲、吴则焰、金裕华等的研究结果不同 [38] [39] [40] 。土壤输入性碳源的种类影响土壤微生物群落对碳源的利用强度和利用模式 [46] 。本研究中南坡745 m海拔处样地土壤微生物群落对碳源的利用模式为理论模式I,南坡1025 m、1355 m与北坡458 m、800 m海拔处样地土壤微生物群落对碳源的利用模式为理论模式II,南坡406 m、550 m和北坡591 m海拔处样地土壤微生物群落对碳源的利用模式为理论模式III。植物群落组成和结构可能通过影响其根际土壤的理化性质,进而影响土壤微生物群落组成和结构,最终导致不同海拔处土壤微生物功能多样性的差异化 [47] 。结合不同海拔样地植被及土壤理化性质特点,推测在诸多环境因子的多重及交互作用的复杂关系中,植被和土壤要素对不同海拔热带山地雨林土壤微生物的碳源利用模式和强度产生重要的影响。
4.4. 海拔变化对土壤微生物群落碳源代谢多样性的影响
主成分分析可以直观的展示土壤微生物群落功能的相似状况和综合差异,碳源底物的初始载荷因子体现了主成分与碳源利用的相关性,初始载荷因子的高低反映了该碳源对主成分的影响程度 [35] 。本研究发现海拔梯度显著影响鹦哥岭热带山地雨林土壤微生物的碳源利用,土壤微生物群落碳源代谢多样性的垂直地带性差异主要体现在对碳水化合物类、多聚物类和羧酸类碳源的利用,该结果与以往大多数的研究结果不一致 [36] [37] [38] 。众所周知,碳水化合物类的碳源既是自然界矿化过程的主要物质,也为大多数异养微生物提供有机营养物;植物根系分泌物羧酸和小分子的氨基酸等碳源类物质 [48] 。鹦哥岭热带山地雨林特殊生境提供的高温、高湿环境为土壤微生物的生命活动提供了良好的条件,可能有利于土壤微生物对多聚物类等难氧化碳源的利用。据此推测,鹦哥岭热带山地雨林土壤微生物碳源代谢多样性的垂直地带性差异可能与热带山地雨林高温、高湿的特殊生境以及土壤养分的改变有关。
4.5. 环境因子对土壤微生物群落功能多样性的影响
气候条件、土壤理化性质及植物群落等环境因子影响土壤微生物群落结构和组成,由于气候、土壤和植物因子的多重或交互作用导致土壤微生物多样性呈现相应的时空变化。众多的研究发现有机碳、pH、全氮、全磷和有效磷等土壤理化性质的变化影响土壤微生物功能多样性的空间变化 [10] [35] 。本研究中土壤微生物群落功能多样McIntosh指数与有效磷显著正相关,与过氧化氢酶和酸性磷酸酶活性显著负相关;土壤微生物群落功能多样性Shannon指数、Simpson指数和Pielou指数(E)与土壤理化性质极弱相关,甚至不相关。据此推测,土壤有效磷、过氧化氢酶和酸性磷酸酶活性是鹦哥岭热带山地雨林土壤微生物群落功能多样性随海拔梯度变化最主要的影响因子。
4.6. 凋落物对土壤微生物群落功能多样性的影响
凋落物是热带山地雨林森林生态系统生产力构成中的重要组成成分,是热带山地雨林生态系统物质和能量的主要来源,也是土壤与微生物间的物质循环枢纽 [49] 。土壤微生物以分解者角色,积极参与森林生态系统中的物质循环和能量流动,是凋落物分解、土壤呼吸以及生物化学循环等过程的主要驱动因子之一 [50] 。本研究发现鹦哥岭热带山地雨林土壤微生物群落功能多样性McIntosh指数与凋落物有机碳含量显著负相关,与凋落物其他指标相关性极弱;Shannon指数、Pielou指数和Simpson指数与凋落物各项理化指标极弱相关。据此推测鹦哥岭热带山地雨林生态系统中凋落物的输入或去除显著影响土壤微生物群落功能多样性的McIntosh指数,但对土壤微生物群落的Shannon多样性指数、Pielou均匀度指数和Simpson指数影响不大,该结果与以往的研究结果存在一定的相似性 [47] 。另外,本研究还发现各海拔样地凋落物干重差异不显著,但是凋落物的有机碳含量仅在部分海拔间差异显著,据此推测凋落物对热带山地雨林土壤微生物群落碳代谢多样性的影响在于凋落物碳的可利用性,即凋落物碳的质量,尤其是有机碳是影响土壤微生物群落功能多样性的重要环境因子。
5. 结论
鹦哥岭热带山地雨林土壤和凋落物理化性质、土壤酶活性的海拔分布具有异质性,部分海拔样地间差异显著,且南坡和北坡不同。不同海拔样地土壤微生物群落的AWCD值不同,pH是重要的影响因子。不同海拔样地土壤微生物对碳源的利用模式和利用程度不同,土壤微生物碳源代谢多样性的垂直地带性差异主要体现在碳水化合物、多聚物类和羧酸类碳源的利用上,且在部分海拔间差异显著。土壤微生物群落功能多样性指数随海拔的升高先增加后减少,符合“中峰分布”格局。土壤微生物群落功能McIntosh指数在部分海拔间差异显著,与土壤有效磷含量显著正相关,与土壤过氧化氢酶、酸性磷酸酶、凋落物有机碳含量显著负相关,且南坡和北坡不同;各海拔样地土壤微生物群落功能Shannon指数、Simpson指数和Pielou指数差异不显著,与土壤和凋落物理化性质以及土壤酶活性弱相关,甚至不相关。土壤有效磷、酸性磷酸酶、过氧化氢酶和凋落物有机碳含量是导致鹦哥岭热带山地雨林土壤微生物群落功能多样性的海拔分布异质性的重要影响因子。
基金项目
海南省自然科学基金面上项目(320MS040):鹦哥岭热带雨林土壤微生物多样性及其影响因子的研究。
文章引用
吴红萍,刘 季,刘 磊,李 蕾. 海南鹦哥岭不同海拔热带山地雨林土壤微生物群落多样性差异
Soil Microbial Community Diversity under Different Altitudes in the Tropical Mountain Rainforests of Yinggeling National Nature Reserve in Hainan Island[J]. 微生物前沿, 2023, 12(04): 130-146. https://doi.org/10.12677/AMB.2023.124015
参考文献
- 1. Rutigliano, F.A., Ascoli, R.D. and Virzo De Santo, A. (2004) Soil Microbial Metabolism and Nutrient Status in a Mediterranean Area as Affected by Plant Cover. Soil Biology & Biochemistry, 36, 1719-1729. https://doi.org/10.1016/j.soilbio.2004.04.029
- 2. Falkowski, P.G., Fenchel, T. and Delong E.F. (2008) The Microbial Engines That Drive Earth’s Bio-Geochemical Cycles. Science, 320, 1034-1039. https://doi.org/10.1126/science.1153213
- 3. 张地, 张育新, 曲来叶, 等. 海拔对辽东栎林地土壤微生物群落的影响应[J]. 应用生态学报, 2012, 23(8): 2041-2048.
- 4. Fierer, N., Mccain, C.M., Meir, P., et al. (2011) Microbes Do Not Follow the Elevational Diversity Patterns of Plants and Animals. Ecology, 92, 797-804. https://doi.org/10.1890/10-1170.1
- 5. Waldrop, M.P. and Firestone, M.K. (2006) Seasonal Dynamics of Microbial Community Composition and Function in Oak Canopy and Open Grassland Soils. Microbial Ecology, 52, 470-479. https://doi.org/10.1007/s00248-006-9100-6
- 6. Garland, J.L. and Mills, A.L. (1991) Classification and Characterization of Heterotrophic Microbial Communities on the Basis of Patterns of Community-Level Sole-Carbon-Source Utilization. Applied and Environmental Microbiology, 57, 2351-2359. https://doi.org/10.1128/aem.57.8.2351-2359.1991
- 7. Hacck, S.K., Garchow, H., Klyg, J.M. and Forney, L.J. (1995) Analysis of Factors Affecting the Accuracy, Reproducibility, and Interpretation of Microbial Community Carbon Source Utilization Patterns. Applied Environmental Microbiology, 61, 1258-1268. https://doi.org/10.1128/aem.61.4.1458-1468.1995
- 8. Zak, D.R., Tilman, D., Parmenter, R.R., et al. (1994) Plant Production and Soil Microorganisms in Late-Successional Ecosystems a Continental-Scale Study. Ecology, 75, 2333-2347. https://doi.org/10.2307/1940888
- 9. Zheng, H., Ouyang, Z.Y., Fang, Z.G., et al. (2004) Application of Biology to Study on Soil Microbial Community Functional Diversity. Acta Pedologica Sinica, 41, 456-461.
- 10. 朱平, 陈仁升, 宋耀选, 刘光琇, 陈拓, 张威. 祁连山不同植被类型土壤微生物群落多样性差异[J]. 草业科学, 2015, 24(6): 75-84
- 11. 蔡进军, 董立国, 李生宝, 等. 黄土丘陵区不同土地利用方式土壤微生物功能多样性特征[J]. 生态环境学报, 2016, 25(4): 555-562.
- 12. 范垚城, 覃林, 王雅菲, 等. 东北天然次生林不同经营模式下土壤微生物碳源利用与功能多样性[J]. 林业科学, 2016, 52(7): 68-77.
- 13. 李小容, 韦金玉, 陈云, 等. 海南岛不同林龄的木麻黄林地土壤微生物的功能多样性[J]. 植物生态学报, 2014, 38(6): 608-618.
- 14. 厉桂香, 马克明. 土壤微生物多样性海拔格局研究进展[J]. 生态学报, 2018, 38(5): 1521-1529.
- 15. 孙雪, 隋心, 韩冬雪, 等. 原始红松林退化演替后土壤微生物功能多样性的变化[J]. 环境科学研究, 2017, 30(6): 911-919.
- 16. 徐琳, 张雪娇, 田忠赛, 等. 秭归张家冲坡耕地作物类型对土壤微生物功能多样性的影响[J]. 生态学杂志, 2017, 36(6): 1555-1563.
- 17. 刘磊. 海南鹦哥岭自然保护区国家自然保护区林地管理研究[D]: [硕士学位论文]. 长沙: 中南林业科技大学, 2017.
- 18. 廖常乐, 王合升, 黄娟, 王慧颖. 鹦哥岭自然保护区鹦哥岭自然保护区树蛙种群分布及数量调查[J]. 动物学杂志, 2013, 48(3): 377-381.
- 19. 王慧颖, 廖常乐, 王合升, 王云鹏, 许碧果, 蔡金山. 鹦哥岭自然保护区保护区海南疣螈分布、种群与栖息地生境特征研究[J]. 四川动物, 2013, 32(3): 434-437.
- 20. 吴庭天, 张凯, 杨小波, 龙成, 岑举人, 李东海. 海南鹦哥岭自然保护区广东松(Pinus kwangtungensis)群落优势种群的生态位[J], 热带生物学报, 2017, 8(4): 444-452.
- 21. 徐碧果. 鹦哥岭自然保护区与社区经济协调发展对策研究[D]: [硕士学位论文]. 长沙: 中南林业科技大学, 2017.
- 22. 张荣京, 陈红锋, 叶育石, 吴世捷, 邢福武, 王发国. 海南鹦哥岭自然保护区的种子植物资源[J]. 华南农业大学学报, 2010, 31(3): 116-118.
- 23. 周婷. 鹦哥岭自然保护区森林资源现状及可持续经营分析[D]: [硕士学位论文]. 长沙: 中南林业科技大学, 2015.
- 24. 王发国, 张荣京, 邢福武, 等. 海南鹦哥岭自然保护区的珍稀濒危植物与保育[J]. 武汉植物学研究, 2007, 25(3): 303-309.
- 25. 姜祖扬, 王伟峰, 刘磊, 林帅, 许碧果. 海南鹦哥岭省级自然保护区森林现状与发展初步分析[J]. 热带林业, 2012, 40(3): 16-19
- 26. 刘磊, 王合升, 王云鹏, 等. 海南鹦哥岭自然保护区SWOT分析[J]. 热带林业, 2008, 36(1): 8-11.
- 27. 鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000.
- 28. 中华人民共和国林业行业标准. 森林土壤分析方法[M]. 北京: 中国标准出版社, 1999.
- 29. 关松荫, 等, 主编. 土壤酶及其研究法[M]. 北京: 农业出版社, 1986.
- 30. 章家恩, 蔡燕飞, 高爱霞, 朱丽霞. 土壤微生物多样性实验研究方法概述[J], 土壤, 2004, 36(4): 346-350.
- 31. Galieva, G.S., Gilmutdinova, I.M., Fomin, V.P., et al. (2018) Monitoring Soil Bacteria with Community-Level Physiological Profiles Using Biolog™ ECO-Plates in the Republic of Tatarstan (Russia). IOP Conference Series: Earth and Environmental Science, 107, Article ID: 012057. https://doi.org/10.1088/1755-1315/107/1/012057
- 32. Rogers, B.F. and Tate III, R.L. (2001) Temporal Analysis of the Soilmicrobial Community Along a Top Sequence in Pineland Soils. Soil Biology and Biochemistry, 33, 1389-1401. https://doi.org/10.1016/S0038-0717(01)00044-X
- 33. 王强, 戴九兰, 吴大千, 等. 微生物生态研究中基于BIOLOG方法的数据分析[J]. 生态学报, 2010, 30(3): 817-823.
- 34. 孟苗婧, 张金池, 郭晓平, 等. 海拔对黄山松阔叶混交林土壤微生物功能多样性的影响[J]. 南京林业大学学报(自然科学版), 2017, 41(4): 209-214.
- 35. 王颖, 宗宁, 何念鹏, 等. 青藏高原高寒草甸不同海拔梯度下土壤微生物群落碳代谢多样性[J]. 生态学报, 2018, 38(16): 5837-5845.
- 36. 韩冬雪, 王宁, 王楠楠, 等. 不同海拔红松林土壤微生物功能多样性[J]. 应用生态学报, 2015, 26(12): 3649-3656.
- 37. 宋贤冲, 郭丽梅, 田红灯, 等. 猫儿山不同海拔植被带土壤微生物群落功能多样性[J]. 生态学报, 2017, 37(16): 5428-5435.
- 38. 吴则焰, 林文雄, 陈志芳, 等. 中亚热带森林土壤微生物群落多样性随海拔梯度的变化[J]. 植物生态学报, 2013, 37(5): 397-406.
- 39. 吴则焰, 林文雄, 陈志芳, 等. 武夷山国家自然保护区不同植被类型土壤微生物群落特征[J]. 应用生态学报, 2013, 24(8): 2301-2309.
- 40. 邵元元, 王志英, 邹莉, 吴韶平. 百菌清对落叶松人工防护林土壤微生物群落的影响[J]. 生态学报, 2011, 31(3), 819-829.
- 41. 斯贵才, 王建, 夏燕青, 等. 念青唐古拉山沼泽土壤微生物群落和酶活性随海拔变化特征[J]. 湿地科学, 2014, 12(3): 340-348.
- 42. Klose, S., Acosta-Martínez, V. and Ajwa, H.A. (2006) Microbial Community Composition and Enzyme Activities in a Sandy Loam Soil after Fumigation with Methyl Bromide or Alternative Biocides. Soil Biology and Biochemistry, 38, 1243-1254. https://doi.org/10.1016/j.soilbio.2005.09.025
- 43. 褚海燕, 冯毛毛, 柳旭, 时玉, 杨腾, 高贵峰. 土壤微生物生物地理学: 国内进展与国际前沿[J]. 土壤学报, 2020, 57(3): 515-529.
- 44. 厉桂香, 马克明. 土壤微生物多样性海拔格局研究进展[J]. 生态学报, 2018, 38(5): 1521-1529.
- 45. Yang, T., Tedersoo, L., Soltis, P.S., Soltis, D.E., Gilbert, J.A., Sun, M., Shi, Y., Wang, H., Li, Y., Zhang, J. and Chen, Z. (2019) Phylogenetic Imprint of Woody Plants on the Soil Mycobiome in Natural Mountain Forests of Eastern China. The ISME Journal, 13, 686-697. https://doi.org/10.1038/s41396-018-0303-x
- 46. Ushio, M., Wagai, R., Balser, T.C. and Kitayama, K. (2008) Variations in the Soil Microbial Community Composition of a Tropicalmontane Forest Ecosystem: Does Tree Species Matter? Soil Biology & Biochemistry, 40, 2699-2702. https://doi.org/10.1016/j.soilbio.2008.06.023
- 47. 张磊, 贾淑娴, 李啸灵, 陆宇明, 林伟盛, 刘小飞, 郭剑芬. 改变凋落物和根系输入对米槠天然林土壤微生物群落的影响[J]. 水土保持学报, 2021, 35(6): 270-277.
- 48. Liu, X.F., Lin, T.C., Vadeboncoeur, M.A., et al. (2019) Root Litter Inputs Exert Greater Influence over Soil C than Does Aboveground Litter in a Subtropical Natural Forest. Plant and Soil, 444, 489-499. https://doi.org/10.1007/s11104-019-04294-5
- 49. 王小平, 杨雪, 杨楠, 辛晓静, 曲耀冰, 赵念席, 高玉葆. 凋落物多样性及组成对凋落物分解和土壤微生物群落的影响[J]. 生态学报, 2019, 39(17): 6264-6272.
- 50. Gryta, A., Frac, M. and Oszust, K. (2014) The Application of the Biolog EcoPlate Approach in Ecotoxicological Evaluation of Dairy Sewage Sludge. Applied Biochemistry and Biotechnology, 174, 1434-1443. https://doi.org/10.1007/s12010-014-1131-8
NOTES
*通讯作者。
