Journal of Organic Chemistry Research
Vol.04 No.01(2016), Article ID:17107,7
pages
10.12677/JOCR.2016.41002
Silver-Promoted Cyclization of α-Aminoacetophenone with NH4PF6: Synthesis of 2-Arylformylimidazole Derivatives
Zuohui Wang, Xiaoxue Cheng, Hao Wang, Xinru Ling, Chenchen Zhao, Maolin Hu*
College of Chemistry and Materials Engineering, Wenzhou University, Wenzhou Zhejiang

Received: Feb. 15th, 2016; accepted: Mar. 7th, 2016; published: Mar. 10th, 2016
Copyright © 2016 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
A new method for AgOAc-oxidative cyclization of α-aminoacetophenones with NH4PF6 leading to 2-arylformylimidazoles derivatives has been developed. Under the optimal reaction conditions, a wide range of 2-arylformylimidazoles derivatives were synthesized in moderate to good yields ranging from 52% to 93%. These products were confirmed by IR, NMR and MS. The results show that this method has advantages such as the availability for raw materials and simple chemical operations.
Keywords:α-Aminoacetophenone, Imidazole, Condensation, Cyclization, Oxidative Deamination

银促进的α-氨基芳乙酮与NH4PF6的缩合环化反应:2-芳甲酰基咪唑衍生物的合成研究
王祚辉,程晓雪,王浩,凌心茹,赵晨晨,胡茂林*
温州大学化学与材料工程学院,浙江 温州

收稿日期:2016年2月15日;录用日期:2016年3月7日;发布日期:2016年3月10日

摘 要
本文发展了一种由六氟磷酸铵提供铵源,与两分子α-氨基芳乙酮在醋酸银的氧化作用下,经过缩合、脱胺、环化等串联反应合成2-芳甲酰基咪唑衍生物的新方法。在最优条件下,合成了8种2-芳甲酰基咪唑衍生物,收率为52%~93%。所有的产物结构通过IR、NMR和MS等手段表征。该方法具有原料简单易得、操作简便等优点。
关键词 :α-氨基芳乙酮,咪唑,缩合反应,环化反应,氧化脱胺

1. 引言
咪唑作为一种重要的氮杂五元骨架,不仅是生物体内肌肽、组氨酸、组胺、嘌呤等重要生命物质的基本单元,而且存在于多种农药、医药化合物中,如杀虫剂、除草剂、灭菌剂等[1] ,以及降压药氯沙坦[2] 、抗消化性溃疡药甲氰咪胺[3] 、抗肿瘤药物4H-吡咯并[1,2-a]苯并咪唑(PBIS)衍生物[4] -[6] 等。此外,咪唑化合物还具有良好的配位性能,不仅易与金属离子配位形成金属配合物 [7] ,还可作为多种酶的活性中心功能基[7] [8] 。由于咪唑化合物具有众多优良的性能,被广泛应用于生物、工业和有机合成领域中。因此,百余年来咪唑及其衍生物的合成及应用研究从未间断,至今仍十分活跃[9] 。咪唑环的合成方法众多,据文献报道主要有如下一些方法:乙二醛(1,2-二酮)-醛-氨法[10] -[12] 、α-氨基缩醛法[13] 、直接缩聚法[14] [15] 、异腈法[16] 、α-氨基氰法[17] 、α-酰氨基希夫碱法[18] 、Claisen重排反应法[19] 、钯催化环化合成法[20] 等。2-芳甲酰基咪唑衍生物最初从海鞘类动物体内分离出,近年来,该类化合物在生物学研究领域中备受关注[21] [22] 。但有关2-苯甲酰基-5-苯基咪唑及其衍生物的合成鲜有报道。已报道的该类化合物的合成方法主要有以下两种:1) 以芳基乙二醛为原料制备2-苯甲酰基-5-苯基咪唑[23] [24] 。但是该方法中使用的原料芳基乙二醛不易获取,需要复杂的制备过程;2) 以α-叠氮基芳乙酮为原料制备2-苯甲酰基-5-苯基咪唑[25] [26] 。但是叠氮化合物有毒、易爆炸,而且反应后处理复杂,限制了其应用范围。
本文以α-氨基芳乙酮和六氟磷酸铵为原料,通过反应条件的优化,建立了一种合成2-芳甲酰基咪唑衍生物的反应新方法。在醋酸银的作用下,α-氨基芳乙酮发生碳氮键断裂,与铵离子缩合环化,最终生成2-芳甲酰基咪唑衍生物。本文合成2-芳甲酰基咪唑衍生物的技术方法具有原料简单易得、反应后处理简单等特点。采用红外光谱(IR)、核磁共振波谱(1H NMR, 13C NMR)和质谱(MS)对产物进行了结构表征。
2. 实验部分
2.1. 试剂与仪器
WRS-1B型数字熔点仪(上海申光仪器仪表有限公司);Bruker EQUINOX55型红外分光光度计(瑞士布鲁克公司);Avance-III AV500 核磁共振仪(瑞士布鲁克公司,TMS为内标,DMSO-d6为溶剂);GC(7890A)-MS(5975C)型气相色谱–质谱联用仪(美国安捷伦公司);Bruker micrOTOF-Q II高分辨率质谱仪(美国布鲁克–道尔顿公司);薄层层析硅胶用GF254硅胶和HF254型柱层析硅胶(烟台江友硅胶开发有限公司)。石油醚和乙酸乙酯经过重蒸纯化,其它试剂均为进口或国产市售分析纯。原料α-氨基芳乙酮根据文献[27] 的方法合成。
2.2. 化合物4a~4i(5a~5i) (4,5互为同分异构体)的合成及产物表征:
化合物4a~4i (5a~5i)的合成反应如图1所示。向15 mL反应管(SYNTHWARE)中依次加入磁力搅拌子、α-(N-甲基-N-苯基)-苯乙酮(3)(0.20 mmol)、AgOAc (66.8 mg,0.40 mmol,2.0 equiv)、NH4PF6 (65.2 mg,0.40 mmol,2.0 equiv)、HFIP(六氟异丙醇)与CH3CN (v:v = 1:5) 的混合溶液(2 mL),于130℃下搅拌回流反应。用薄层色谱(TLC)监测反应进程,反应完成后冷却至室温,用25 mL乙酸乙酯稀释,过滤分离出固体物质,减压蒸除溶剂,粗产物经柱层析[v(石油醚)/v(乙酸乙酯) = 10:1~5:1]分离得到化合物4与5。化合物4与5互为同分异构体,我们尝试分离这两种化合物,然而由于4与5之间相互快速转化[24] ,因此未能分离出它们。目标化合物的表征结果见表1和表2。
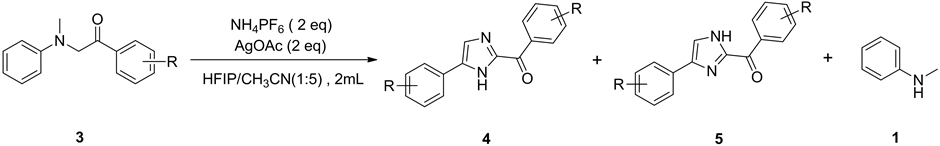 3a: R = H; 3b: R = CH3; 3c: R = p-OCH3; 3d: R = F; 3e: R = Cl; 3f: R = Br; 3g: R = CN; 3h: R = CF3.
3a: R = H; 3b: R = CH3; 3c: R = p-OCH3; 3d: R = F; 3e: R = Cl; 3f: R = Br; 3g: R = CN; 3h: R = CF3.
Figure 1. Synthesis of compounds 4a-4h and 5a-5h
图1. 化合物4a~4h与5a~5h的合成
Table 1. Feature, yields, MS, HRMS and IR data for compounds 4a-4h and 5a-5h
表1. 化合物4a~4h与5a~5h的特征、产率、低分辨质谱、高分辨质谱及红外光谱表征
*Yield after purification by column chromatography on silica gel.
Table 2. 1H NMR, 13C NMR data of compounds 4a—4h (5a—5h)
表2. 化合物4a—4h (5a—5h)的1H NMR,13C NMR结构表征
3. 结果与讨论
3.1. 反应条件的优化
以α-(N-甲基-N-苯基)-苯乙酮(3a, 0.20 mmol)合成2-苯甲酰基-4(或5)-苯基咪唑(4a, 5a)的反应作为合成2-芳甲酰基咪唑衍生物的反应的模型,分别对氧化剂、铵源、反应温度和反应溶剂等条件进行优化,结果见表3。
首先将原料α-(N-甲基-N-苯基)-苯乙酮3a、醋酸银、六氟磷酸铵、六氟异丙醇与乙腈(v:v = 1:5)的混合溶剂加入反应管,于130℃反应12 h,发现生成痕量的产物4a与5a (表3,Entry 1)。对反应溶剂进行筛选,结果表明,选用体积比为1:5的六氟异丙醇(HFIP)与乙腈(CH3CN)的混合溶剂,收率达到93% (Entries 1~7)。选用醋酸铵(NH4OAc)作为铵源,反应的收率明显下降(Entry 8)。当反应温度为110℃时,反应收率为84% (Entry 9)。继续降低反应温度至90℃,或者缩短反应时间,原料α-(N-甲基-N-苯基)-苯乙酮没有反应完,导致收率降低(Entries 10 and 11)。在确定了合适的溶剂和反应温度等条件后,对氧化剂进行了考察,对比分别加入氧化银(Ag2O)、碳酸银(Ag2CO3)、硝酸银(AgNO3),以及双氧水、过硫酸钾(K2S2O8)等氧化剂,均能促进反应的进行,但都不如醋酸银的反应效果明显(Entries 12~18)。增加或减少醋酸银的量,均不能继续提高收率(Entry 19, 20)。通过对实验条件的筛选和优化,最终确定了130℃下以两当量的醋酸银作氧化剂,两当量的六氟磷酸铵为铵源,体积比为1:5的六氟异丙醇与乙腈的混合溶剂作为反应溶剂
Table 3. Optimization of reaction conditionsa
表3. 反应条件的优化a
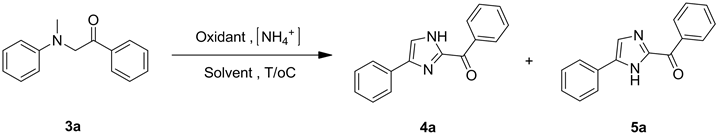
aReaction conditions: 0.2 mmol compound 3a, oxidantand 0.2 mmol [NH4+] (2 eq) in 2 mL solvent; bisolated yield aftercolumn chromatographic purification.
的最优反应条件。在此条件下,α-(N-甲基-N-苯基)-苯乙酮(3a)合成2-苯甲酰基-4-苯基咪唑(4a)与2-苯甲酰基-5-苯基咪唑(5a)的反应可以获得最高的收率。
3.2. 反应底物的扩展
对反应底物的拓展研究结果(表4)表明,苯环上对位存在供电子基团的2-芳甲酰基咪唑衍生物的反应收率相对较高(表4,Entries 2~4,收率为73%~83%)。苯环上对位存在吸电子基团的2-芳甲酰基咪唑衍生物,其反应收率相对较低(表4,Entries 6~9,收率为52%~69%)。当苯环上不含取代基时,反应的收率最高(表4,Entry 1,收率为93%)。实验结果表明,α-(N-甲基-N-苯基)-苯乙酮合成2-芳甲酰基咪唑衍生物的反应活性与苯环上取代基的类型、位置密切相关,苯环上对位取代基的给电子作用越强,α-(N-甲基-N-苯基)-芳乙酮合成2-芳甲酰基咪唑衍生物的反应活性越高。我们合成的产物核磁共振谱图出现两组峰,1H NMR谱图显
Table 4. Substrate scopea
表4. 底物拓展a
aReaction conditions: 0.2 mmol compound 3, 0.4 mmol AgOAc (2 eq), 0.4 mmol NH4PF6 (2 eq) in 2 mL HFIP/CH3CN (v:v= 1:5) at 130℃ for 12 h;
bisolated yield after column chromatographic purification.
示化合物4比5的NH化学位移值小,根据两种同分异构体在1H NMR谱图中的NH峰面积,我们计算出4、5两种化合物的比例(a/b Ratio),结果如表4所示。
4. 结论
我们研究了以α-氨基芳乙酮为原料,通过碳氮键的断裂,串联环化合成2-芳甲酰基咪唑衍生物的反应。通过条件筛选,确定了130℃下,以两当量的醋酸银作催化剂,两当量的六氟磷酸铵为铵源,六氟异丙醇与乙腈(体积比:1:5)的混合溶剂作为反应溶剂的最佳反应条件。在此反应条件下,α-(N-甲基-N-苯基)-苯乙酮合成2-苯甲酰基-4(或5)-苯基咪唑(4a, 5a)的反应产率可达93%。该反应具有操作简便、原料简单易得等特点,通过α-氨基芳乙酮与六氟磷酸铵的串联环化反应,提供了一条有效制备2-芳甲酰基咪唑衍生物的反应新方法。
文章引用
王祚辉,程晓雪,王 浩,凌心茹,赵晨晨,胡茂林. 银促进的α-氨基芳乙酮与NH4PF6的缩合环化反应:2-芳甲酰基咪唑衍生物的合成研究
Silver-Promoted Cyclization of α-Aminoacetophenone with NH4PF6: Synthesis of 2-Arylformylimidazole Derivatives[J]. 有机化学研究, 2016, 04(01): 6-12. http://dx.doi.org/10.12677/JOCR.2016.41002
参考文献 (References)
- 1. 伍晓春. 咪唑类化合物的合成与应用研究[J]. 精细与专用化学品, 2010, 18(7): 51-55.
- 2. 刘凤珍, 吴炎, 赵智斌, 谢淑英, 张锐, 高嵩. 氯沙坦降压疗效及对血管活性物质的影响[J]. 高血压杂志, 2000, 8(1): 43-44.
- 3. Brogden, R.N., Heel, R.C., Speight, T.M. and Avery, G.S. (1978) Cimetidine: A Review of Its Pharmacological Properities and Therapeutic Efficacy in Peptic Ulcer Disease. Drugs, 15, 93-131. http://dx.doi.org/10.2165/00003495-197815020-00002
- 4. Zhou, R. and Skibo, E.B. (1996) Chemistry of the Pyrrolo[1,2-a]benzimidazole Antitumor Agents: Influence of the 7- su-bstituent on the Ability to Alkylate DNA and Inhibit Topoisomerase II. Journal of Medicinal Chemistry, 39, 4321- 4331. http://dx.doi.org/10.1021/jm960064d
- 5. Skibo, E.B., Gordon, S., Bess, L., Boruah, R. and Heileman, M.J. (1997) Studies of Pyrrolo[1,2-a]benzimidazolequi- None DT-Diaphorase Substrate Activity, Topoisomerase II Inhibition Activity, and DNA Reductive Alkylation. Journal of Medicinal Chemistry, 40, 1327-1339. http://dx.doi.org/10.1021/jm960546p
- 6. Craigo, W.A., Le Sueur, B.W. and Skibo, E.B. (1999) Design of Highly Active Analogues of Thepyrrolo[1,2-a]ben- zimidazole Antitumor Agents. Journal of Medicinal Chemistry, 42, 3324-3333. http://dx.doi.org/10.1021/jm990029h
- 7. Kirchner, C. and Krebs, B. (1987) Pentacoordinate Zinc Complexes of Imidazole Nitrogen Donors as Structural Models for the Active Site in Enzymes: Preparation and Crystal Structures of (μ-2,2'-Biimidazolet)tetrakis(2,2'-biimidazole) dizinc(II) Tetraperchlorate Trihydrate and Bis(2,2'-biimidazole)(formato)zinc(II) perchlorate. Inorganic Chemistry, 26, 3569-3576. http://dx.doi.org/10.1021/ic00268a030
- 8. 李云中, 侯自杰. 具有生物活性的咪唑类化合物的合成研究[J]. 有机化学, 2003(23): 426.
- 9. 马文展, 刘少文, 胡建. 咪唑及其衍生物的合成[J]. 化学试剂, 1997, 19(5): 281-285.
- 10. Gridnev, A.A. and Mihaltseva, I.M. (1994) Synthesis of 1-Alkylimidazoles. Synthetic Communications, 24, 1547-1555. http://dx.doi.org/10.1080/00397919408010155
- 11. Sharma, S.D., Hazarika, P. and Konwar, D. (2008) An Effi-cient and One-Pot Synthesis of 2,4,5-trisubstituted and 1,2,4,5-tetrasubstituted Imidazoles Catalyzed by InCl3•3H2O. Tetrahedron Letters, 49, 2216-2220. http://dx.doi.org/10.1016/j.tetlet.2008.02.053
- 12. Maleki, B. and Ashrafi, S.S. (2014) N-Bromosuccinimide Catalyzed Three Component One-Pot Efficient Synthesis of 2,4,5-triaryl-1H-imidazoles from Aldehyde, Ammonium Acetate, and 1,2-diketone or α-Hydroxyketone. Journal of the Mexican Chemical Society, 58, 76-81.
- 13. Mulliez, E. (1989) Synthesis of Polyimidazolesas Biomimetic Ligands Formetalloprotein Activesite Modeling. Tetrahedron Letters, 30, 6169-6172. http://dx.doi.org/10.1016/S0040-4039(01)93333-7
- 14. Uno, K., Niume, K., Iwata, Y., Toda, F. and Iwakura, Y. (1977) Synthesis of Polybenzimidazoles with Sulfonic Acid Groups. Journal of Polymer Science—Polymer Chemistry Edition, 15, 1309-1318. http://dx.doi.org/10.1002/pol.1977.170150602
- 15. 赵晶, 盛丽, 徐宏杰, 房建华, 印杰. 新型磺化聚苯并咪唑的合成及性能[J]. 高等学校化学学报, 2012, 33(3): 645-648.
- 16. Nunami, K., Yamada, M., Fukui, T. and Matsumoto, K. (1994) A Novel Synthesis of Methyl 1,5-disubstitutedimida- zole-4-carboxylates Using 3-bromo-2-isocyanoacrylates. The Journal of Organic Chemistry, 59, 7635-7642. http://dx.doi.org/10.1021/jo00104a018
- 17. Pawar, V.G., De Borggraeve W.M., Robeyns, K., Meervelt, L.V., Compernollea, F. and Hoornaerta, G. (2006) Synthesis of 1,5-disubstituted 4-haloimidazoles from α-Aminonitriles. Tetrahedron Letters, 47, 5451-5453. http://dx.doi.org/10.1016/j.tetlet.2006.05.181
- 18. Bleicher, K.H., Gerber, F., Wüthrich, Y., Alanine, A. and Caprettab, A. (2002) Parallel Synthesis of Substituted Imidazoles from 1,2-aminoalcohols. Tetrahedron Letters, 43, 7687-7690. http://dx.doi.org/10.1016/S0040-4039(02)01839-7
- 19. Lantos, I., Zhang, W.Y., Shui, S.Q. and Eggleston, D.S. (1993) Synthesis of Imidazoles via Hetero-Cope Rearran- gements. The Journal of Organic Chemistry, 58, 7092-7095. http://dx.doi.org/10.1021/jo00077a033
- 20. Zaman, S., Mitsuru, K. and Abell, A.D. (2005) Synthesis of Trisubs-tituted Imidazoles by Palladium-Catalyzed Cyclization of O-Pentafluorobenzoylamidoximes: Application to Amino Acid Mimetics with a C-Terminal Imidazole. Organic Letters, 7, 609-611. http://dx.doi.org/10.1021/ol047628p
- 21. Durán, R., Zubía, E., Ortega, M.J., Naranjo, S. and Salyá, J. (1999) Novel Alkaloids from the Red Ascidian Botryllus Leachi. Tetrahedron, 55, 13225-13232. http://dx.doi.org/10.1016/S0040-4020(99)00803-0
- 22. Sonia, M., Javier, S. and Jesus Angel, D. (2006) Phenolic Marine Natural Products as Aldose Reductase Inhibitors. Journal of Natural Products, 69, 1485-1487. http://dx.doi.org/10.1021/np0503698
- 23. Zuliani, V., Cocconcelli, G., Fantini, M., Ghiron, C. and Rivara, M. (2007) A Practical Synthesis of 2,4(5)- diarylimidazoles from Simple Building Blocks. The Journal of Organic Chemi-stry, 72, 4551-4553.
- 24. Khalili, B., Tondro, T. and Hashemi, M.M. (2009) Novel One-Pot Synthesis of (4 or 5)-aryl-2-aryloyl-(1H)-imidazoles in Water and Tauto-Isomerization Study Using NMR. Tetrahedron, 65, 6882-6887. http://dx.doi.org/10.1016/j.tet.2009.06.082
- 25. Batanero, B., Escudero, J. and Barba, F. (1999) Cathodic Reduction of Phenacyl Azides. Organic Letters, 1, 1521-1522. http://dx.doi.org/10.1021/ol990200j
- 26. Chen, J., Chen, W., Yu, Y.P. and Zhang, G.L. (2013) One-Pot Synthesis of Disubstitutedimidazole Derivatives from α-Azido Ketones Catalyzed by Potassium Ethylxanthate. Tetrahedron Letters, 54, 1572-1575. http://dx.doi.org/10.1016/j.tetlet.2013.01.042
- 27. Srinivasan, M., Perumal, S. and Selvaraj, S. (2006) A Facile Stereoselective Synthesis of (Z)-1,3-diaryl-2-(N- methylanilin-o)-2-propen-1-ones. ARKIVOC, 2006, 21-27.
NOTES
*通讯作者。
