Journal of Organic Chemistry Research
Vol.04 No.03(2016), Article ID:18589,8
pages
10.12677/JOCR.2016.43010
Chemical Constituents Pre-Analysis and Antioxidant Activity of the Puffball Calvatia candida from Foshan
Jingshu Wu1, Feng Zhu2*
1Department of Material Science and Engineering, Foshan University, Foshan Guangdong
2Department of Chemical Engineering, Foshan University, Foshan Guangdong

Received: Sep. 1st, 2016; accepted: Sep. 18th, 2016; published: Sep. 22nd, 2016
Copyright © 2016 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
Based on review of chemical composition of the genus of Calvatia sp., the chemical constituents of the puffball Calvatia candida from Foshan were analyzed by pre-test tube method, and its antioxidant activities were evaluated by the biochemical assay of hydroxyl and DPPH radicals scavenging activity in vitro. The results show that, the puffball Calvatia candida from Foshan contain alkaloids, steroids and terpenoids, and have potent antioxidant activities with IC50 values of 241.55 (for ·OH) and 418.63 (for DPPH) μg/mL, respectively.
Keywords:Calvatia candida, Higher Fungus, Chemical Constituent, Pre-Test Tube Method, Antioxidant Activity

佛山白秃马勃化学成分预分析与抗氧化活性
吴静姝1,朱峰2*
1佛山科学技术学院材料科学与工程系,广东 佛山
2佛山科学技术学院化学工程系,广东 佛山

收稿日期:2016年9月1日;录用日期:2016年9月18日;发布日期:2016年9月22日

摘 要
在综述秃马勃属真菌化学成分研究的基础上,通过多种指示剂和显色剂的显色反应或沉淀反应对佛山白秃马勃化学成分进行了预分析,并通过羟自由基(·OH)和1,1-二苯基-2-苦肼基(DPPH)清除试验评价了其甲醇提取物的体外抗氧化活性。结果表明,佛山白秃马勃含有生物碱、甾体和萜类化合物,具有有效的抗氧化活性,对·OH和DPPH自由基的半数清除浓度(IC50)分别为241.55和418.63 μg/mL。
关键词 :白秃马勃,高等真菌,化学成分,试管预试法,抗氧化活性

1. 引言
氧化还原反应是机体的一个重要代谢过程,但该反应也产生活性氧簇(reactive oxygen species, ROS),比如羟自由基(·OH)。·OH和其它活性氧常常攻击体内的其它细胞和组织,引起细胞凋亡、组织损伤或基因突变。自由基引发的氧化损伤与衰老和许多疾病有关,比如动脉粥样硬化、糖尿病、癌症、肝硬化等等。正常人虽然拥有抗氧化防御修复系统以保护其不被氧化损伤,但是该系统自身产生的抗氧化物不足以完全避免氧化损伤,还需要从饮食中摄取。抗氧化物可以抑制或延缓组织损伤中活性氧的作用。因此,合成抗氧化剂广泛用于食品工业。然而,由于它们的毒性和致癌作用,使得它们的使用受到限制。这大大增加了人们寻找无毒副作用的天然抗氧化剂的兴趣。
高等真菌能产生多种多样的次生代谢产物,包括酚类、聚酮类、生物碱、萜类和甾体化合物等等,许多表现出有效的抗氧化活性 [1] ,比如薄树芝Ganoderma capense [2] 、奥氏蜜环菌Armillaria ostoyae [3] 、合生香菇Lentinus conatus [4] 、美味牛肝菌Boletus edulis [5] 、双孢蘑菇Agaricus Bisporus [6] 等等。
白秃马勃(Calvatia candida)是一种药食两用真菌 [7] [8] ,属于马勃目(Lycoperdales)马勃科(Lycoperdaceae)中的秃马勃属(Calvatia sp.),具有止血、消炎、解热、利咽的功效。本文通过多种指示剂和显色剂的显色反应或沉淀反应对采自佛山的白秃马勃C. candida化学成分进行预分析,并通过·OH和DPPH自由基清除试验评价其甲醇提取物的体外抗氧化活性。
2. 材料与方法
2.1. 仪器与试剂
UV-2501 PC型紫外–可见吸收光谱仪(日本岛津公司)。试剂均为市售分析纯试剂。
2.2. 材料
野生马勃子实体(见图1)于2015年7月26日采自于广东省佛山市南海区桂城街道南一路人工草坪,经与多种图谱 [9] [10] 对比鉴定为白秃马勃C. candida (Rostk.) Hollós。
2.3. 样品制备
白秃马勃C. candida子实体风干,剪碎,称取碎末20 g,用甲醇连续回流渗漉提取24 h,甲醇提取液通过真空旋转蒸发回收甲醇得浸膏4.36 g,提取率21.8%。浸膏用甲醇配制成质量浓度为5 mg/mL的

Figure 1. The fruiting body of the puff ball C. candida from Foshan
图1. 佛山白秃马勃C. candida子实体
样品溶液待用。
2.4. 化学成分预分析
采用试管预试法 [11] [12] 检测甲醇粗提物化学成分。采用三氯化铁试剂检查酚性成分。采用Dragendorff试剂检查生物碱成分。采用盐酸-锌粉试验检查黄酮类成分。采用Bornträger反应和醋酸镁试验检查蒽醌类成分。采用Kedde试剂检查强心甙。采用异羟肟酸铁试验检查内酯和香豆精成分。采用Liebermann-Burchard反应和Salkowski反应检查甾醇和三萜成分。
2.5. 羟自由基清除活性
采用“水杨酸-FeSO4-H2O2”体系 [13] 。运用分光光度法法测定不同浓度样品溶液体外清除·OH的能力。分别精密移取0~1.2 mL样品溶液加入干净的具塞试管中,加甲醇补足至5 mL,然后加入1 mL 6 mmol/L的水杨酸甲醇溶液,摇匀后,再加入1 mL 2 mmol/L的硫酸亚铁水溶液,再加入1 mL 1.5%的双氧水水溶液,以蒸馏水代替1.5%双氧水水溶液为空白对照,摇匀,用甲醇定容至10 mL,置于37℃水浴恒温60 min。于510 nm处测其吸光度,分别记为A0和As。根据公式(1)计算·OH清除率(%RSA)。重复实验三次。以·OH自由基清除活性(%RSA)对样品浓度作图,从图中计算出%RSA为50%时的样品浓度,即为自由基半数清除浓度(IC50)。标准抗氧化剂抗坏血酸为阳性对照。
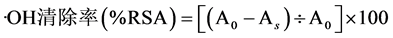 (1)
(1)
其中:A0为“水杨酸-FeSO4-H2O2”生色体系的吸光度,As为“待测样液-水杨酸-FeSO4-H2O2”反应体系的吸光度。
2.6. DPPH自由基清除活性
根据Seephonkai等 [14] 所述方法。采用分光光度法测定不同浓度样品溶液体外清除DPPH自由基的能力。分别精密移取0~1.0 mL样品溶液加入干净的具塞试管中,加甲醇补足至1 mL,然后加入0.2 mmol/L的DPPH溶液2 mL,摇匀,避光反应30 min,以甲醇为空白对照,于517 nm处测其吸光度。根据公式(2)计算DPPH自由基清除率(%RSA)。重复实验三次。以DPPH自由基清除活性(%RSA)对样品浓度作图,从图中计算出%RSA为50%时的样品浓度,即为自由基半数清除浓度(IC50)。标准抗氧化剂抗坏血酸为阳性对照。
 (2)
(2)
其中:As是加入样品溶液后的吸光度,ADPPH是DPPH溶液的吸光度。
3. 结果与讨论
3.1. 白秃马勃化学成分预分析
从秃马勃属(Calvatia sp.)真菌 [15] 已发现了许多新颖活性化合物。Lam等 [16] 和Ng等 [17] 从粟粒皮秃马勃C. boninensis分离到一个新蛋白calcaelin,具有转译抑制、抗增值、抗有丝分裂的活性。Takaishi等 [18] 从头状秃马勃C. craniiformis发现了6个对羟基苯基重氮甲酰胺衍生物:4-hydroxyphenyl-1-azofor- mamide(1)、4-methoxyphenyl-1-azoformamide(2)、4-hydroxyphenyl-1-ONN-azoformamide(3)、4-methoxyphenyl- 1-ONN-azoformamide(4)、2-methylsulfinyl-4-hydroxyl-6-methylthiophenyl-1-azoformamide (5)和craniformin(6),以及3个甾体化合物ergosta-4, 6, 8(14), 22-tetraene-3-one(7)、ergosta-7, 22-diene-3-ol(8)和ergosterol peroxide(9)。Kamo等 [19] 从头状秃马勃C. craniiformis子实体也分离到化合物(1-3)。Kawahara等 [20] - [22] 对杯形秃马勃C. cyathiformis化学成分进行了研究,从中分离获得1个新颖的二聚甾体calvasterone(10),4个新的甾类化合物cyathisterone(11)、cyathisterol(12)、calvasterols A(13)和B(14),以及2个已知甾类化合物ergosta-4, 7, 22-triene-3, 6-dione(15)和ergosta-4, 6, 8(14), 22-tetraen-3-one(7)。早在1960年Roland 等 [23] 研究表明大秃马勃C. gigantea孢子在一定条件下培养产生的抗肿瘤物质马勃菌素calvacin是一个碱性黏蛋白。Bentley等 [24] 研究则表明野生大秃马勃C. gigantea含有丰富的辅酶Q,并鉴定其为CoQ9,其脂肪酸成分主要是棕榈酸、油酸和亚油酸。最近研究 [25] [26] 表明大秃马勃C. gigantea中游离氨基酸含量特别高,这可能是该菌长得巨大的原因。Gasco等 [27] 从紫色秃马勃C. lilacina中分离到抗细菌和抗真菌化学成分,随后通过X–射线衍射分析 [28] 确定其结构为para-carboxyphenylazoxycyanide (16,又名calvatic acid和calvatinic acid)。Umezawa等 [29] - [31] 不仅从紫色秃马勃C. lilacina中分离到新抗生素calvatic acid(16),而且发现该抗生素也能由头状秃马勃C. craniiformis产生。Fugmann等 [32] 从红黄秃马勃C. rubro- flava干燥子实体分离获得橙色组分rubroflavin(17)、oxyrubroflavin(18)和deoxyrubroflavin(19),其中rubroflavin在新鲜子实体中以酚型结构leucorubroflavin(5)的形式存在,并很容易被氧化成酮型结构rubroflavin(17)。综上所述,已有研究表明,秃马勃属真菌主要含有脂肪酸、生物碱(见图2)、甾体(见图3)、脂类、多糖、氨基酸和蛋白质。然而白秃马勃C. candida化学成分研究还未见相关报道。
本试验中,白秃马勃C. candida样品溶液遇三氯化铁不发生显色反应,提示不含有酚性成分。样品

Figure 2. 4-hydroxyphenyl-1-azoformamide derivatives from Calvatia sp.
图2. 秃马勃属真菌中的4-羟基苯基-1-重氮甲酰胺衍生物

Figure 3. Ergosterol derivatives from Calvatia sp.
图3. 秃马勃属真菌中的甾类化合物
溶液水浴蒸干,加5%硫酸溶解残渣,过滤,滤液遇Dragendorff试剂产生红色沉淀,说明含有生物碱。样品溶液在盐酸-锌粉试验中不发生显色反应,说明不含有黄酮类成分。样品溶液在Bornträger试验中遇10%氢氧化钠不发生显色反应,遇1%醋酸镁也不发生显色反应,提示不存在蒽醌类成分。样品溶液遇Kedde试剂不发生显色反应,说明不含强心甙。在异羟肟酸铁试验中,样品溶液不发生显色反应,说明不含有内酯和香豆精成分。样品溶液在Liebermann-Burchard反应和Salkowski反应中产生显著的显色反应,说明含有甾醇和三萜成分。
化学成分预分析表明,白秃马勃C. candida含有生物碱、甾醇和三萜成分。由于多种秃马勃属真菌均含有对羟基苯基重氮甲酰胺衍生物和麦角甾醇衍生物,因而可以推断,对羟基苯基重氮甲酰胺衍生物和麦角甾醇衍生物很可能是该属真菌化学分类学的标志化合物。白秃马勃C. candida中的甾醇和三萜成分很可能是麦角甾醇衍生物,而其生物碱很可能是对羟基苯基重氮甲酰胺衍生物。Fugmann等 [32] 认为酚型结构主要存在于新鲜子实体中,很容易被氧化生成酮型结构。由于本实验样品不是新鲜白秃马勃C. candida子实体,而是风干样品,加上本实验中白秃马勃C. candida样品溶液遇三氯化铁不发生显色反应,因而可以进一步推断其所含对羟基苯基重氮甲酰胺衍生物应该不是酚型结构,可能是酮型结构。
3.2. 白秃马勃抗氧化活性
迄今为止,秃马勃属真菌中只有大秃马勃C. gigantea抗氧化活性得到过研究。Badshah等 [33] 的研究表明,大秃马勃C. gigantea子实体甲醇提取物的总酚含量很高,具有很强的抗氧化活性,其清除DPPH自由基的IC50值为22.2 ± 0.3 μg/mL。
通过·OH和DPPH自由基清除试验评价了佛山白秃马勃C. candida子实体甲醇提取物的抗氧化活性,结果见图4和图5。从图4和图5可以看出,随着样品浓度增加,白秃马勃C. candida对自由基的清除活性也增强。当体系中样品浓度为0.5 mg/mL时,·OH自由基清除率达到93.68%;当体系中样品浓度为1.0 mg/mL时,DPPH自由基清除率达到95.53%,但其抗氧化活性比抗坏血酸更弱。经非线性曲线拟合,从图4和图5计算得到白秃马勃C. candida甲醇提取物对·OH和DPPH自由基的半数清除浓度(IC50)分别为241.55和418.63 μg/mL。
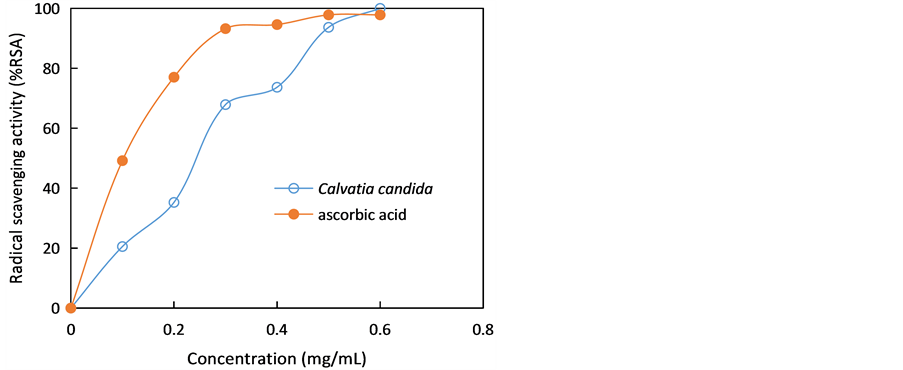
Figure 4. Hydroxyl radicals scavenging activity of Calvatia candida
图4. 白秃马勃羟自由基清除活性

Figure 5. DPPH radicals scavenging activity of Calvatia candida
图5. 白秃马勃DPPH自由基清除活性
4. 结论
化学成分预分析表明,佛山白秃马勃C. candida含有生物碱、甾醇和三萜成分,不含酚类、黄酮类、蒽醌类、强心甙类、内酯和香豆精类化合物。其生物碱可能是对羟基苯基重氮甲酰胺衍生物,而其甾类和三萜类可能为麦角甾醇衍生物。
·OH和DPPH自由基清除试验结果显示,佛山白秃马勃C. Candida甲醇提取物具有一定的抗氧化活性,对·OH和DPPH自由基的半数清除浓度(IC50)分别为241.55和418.63 μg/mL。
因此,作为一种药食两用的蕈菌,进一步对白秃马勃C. Candida化学成分进行研究,分离并鉴定其抗氧化活性成分,揭示其抗氧化活性规律,有可能开发出有意义的天然抗氧化剂。
文章引用
吴静姝,朱 峰. 佛山白秃马勃化学成分预分析与抗氧化活性
Chemical Constituents Pre-Analysis and Antioxidant Activity of the Puffball Calvatia candida from Foshan[J]. 有机化学研究, 2016, 04(03): 69-76. http://dx.doi.org/10.12677/JOCR.2016.43010
参考文献 (References)
- 1. Kozarski, M., Klaus, A., Jakovljevic, D., Todorovic, N., Vunduk, J., Petrovic, P., Niksic, M., Vrvic, M.M. and van Griensven, L. (2015) Antioxidants of Edible Mushrooms. Molecules, 20, 19489-19525. http://dx.doi.org/10.3390/molecules201019489
- 2. Huang, Y.T., Li, N.S., Wan, J.B., Zhang, D.Z. and Yan, C.Y. (2015) Structural Characterization and Antioxidant Activity of a Novel Heteropolysaccharide from the Submerged Fermentation Mycelia of Ganoderma capense. Carbohydrate Polymers, 134, 752-760. http://dx.doi.org/10.1016/j.carbpol.2015.08.067
- 3. Siu, K.C., Xu, L.J., Chen, X. and Wu, J.Y. (2016) Molecular Properties and Antioxidant Activities of Polysaccharides Isolated from Alkaline Extract of Wild Armillaria ostoyae Mushrooms. Carbohydrate polymers, 137, 739-746. http://dx.doi.org/10.1016/j.carbpol.2015.05.061
- 4. Sharma, V.P., Upadhyay, R.C., Kamal, S., Kumar, S., Mohapatra, K.B. and Sharma, M. (2015) Characterization, Cultivation, Nutritional and Antioxidant Properties of the Culinary Edible Mushroom Lentinus conatus. Sydowia, 67, 167-174.
- 5. Jaworska, G., Pogon, K., Skrzypczak, A. and Bernas, E. (2015) Composition and Antioxidant Properties of Wild Mushrooms Boletus edulis and Xerocomus badius Prepared for Consumption. Journal of Food Science and Technology-Mysore, 52, 7944-7953. http://dx.doi.org/10.1007/s13197-015-1933-x
- 6. Li, H.J., Chen, H.Y., Fan, L.L., Jiao, Z.H., Chen, Q.H. and Jiao, Y.C. (2015) In Vitro Antioxidant Activities and in Vivo Anti-Hypoxic Activity of the Edible Mushroom Agaricus bisporus (Lange) Sing. Chaidam. Molecules, 20, 17775- 17788. http://dx.doi.org/10.3390/molecules201017775
- 7. 戴玉成, 周丽伟, 杨祝良, 文华安, 图力古尔, 李泰辉. 中国食用菌名录[J]. 菌物学报, 2010, 29(1): 1-21.
- 8. 戴玉成, 杨祝良. 中国药用真菌名录及部分名称的修订[J]. 菌物学报, 2008, 27(6): 801-824.
- 9. 戴玉成, 图力古尔, 崔宝凯, 秦国夫, 编. 中国药用真菌图志[M]. 哈尔滨: 东北林业大学出版社, 2013: 88-89.
- 10. 吴兴亮, 戴玉成, 李泰辉, 杨祝良, 宋斌编. 中国热带真菌[M]. 北京: 科学出版社, 2014: 60-61.
- 11. 王润梅, 岳志劲, 张永芳. 北芪菇化学成分的初步研究[J]. 山西大同大学学报(自然科学版), 2012, 28(4): 32-34.
- 12. 徐绍业, 金美华, 赵灵颖, 李晶晶, 韦玉, 蒋祯凤, 罗琴, 陈新华. 广东梅县一野生红菇化学成分及急性毒性研究[J]. 食品研究与开发, 2014, 35(15): 24-26.
- 13. 卢卫红, 陈忻, 朱峰. 两种海洋贝类多糖的提取及其生物活性评价[J]. 南方农业学报, 2014, 45(10): 1846-1850.
- 14. Seephonkai, P., Samchai, S., Thongsom, A., Sunaart, S., Kiem-sanmuang, B. and Chakuton, K. (2011) DPPH Radical Scavenging Activity and Total Phenolics of Phellinus Mushroom Extracts Collected from Northeast of Thailand. Chinese Journal of Natural Medicines, 9, 441-445.
- 15. Coetzee, J.C. and van Wyk, A.E. (2009) The Genus Calvatia (“Gasteromycetes”, Lycoperdaceae): A Review of Its Ethnomycology and Biotechnological Potential. African Journal of Biotechnology, 8, 6007-6015. http://dx.doi.org/10.5897/AJB09.360
- 16. Lam, Y.W., Ng, T.B. and Wang, H.X. (2001) Antiproliferative and Antimitogenic Activities in a Peptide from Puffball Mushroom Calvatia caelata. Biochemical and Biophysical Research Communications, 289, 744-749. http://dx.doi.org/10.1006/bbrc.2001.6036
- 17. Ng, T.B., Lam, Y.W. and Wang, H.X. (2003) Calcaelin, a New Protein with Translation-Inhibiting, Antiproliferative and Antimitogenic Activities from the Mosaic Puffball Mushroom Calvatia caelata. Planta Medica, 69, 212-217. http://dx.doi.org/10.1055/s-2003-38492
- 18. Takaishi, Y., Murakami, Y., Uda, M., Ohashi, T., Hamamura, N., Kido, M. and Kadota, S. (1997) Hydroxyphenylazo- formamide Derivatives from Calvatia craniformis. Phytochemistry, 45, 997-1001. http://dx.doi.org/10.1016/S0031-9422(97)00066-6
- 19. Kamo, T., Kashiwabara, M., Tanaka, K., ando, S., Shibata, H. and Hirota, M. (2006) Plant Growth Inhibitory Activity of Azo- and Azoxyformamides from Calvatia craniiformis and Lycoperdon hiemale. Natural Product Research, 20, 507-510. http://dx.doi.org/10.1080/14786410600649596
- 20. Kawahara, N., Sekita, S. and Satake, M. (1993) A Novel Dimeric Steroid, Calvasterone from the Fungus Calvatia cyathiformis. Chemical & Pharmaceutical Bulletin, 41, 1318-1320. http://dx.doi.org/10.1248/cpb.41.1318
- 21. Kawahara, N., Sekita, S. and Satake, M. (1994) Steroids from Calvatia cyathiformis. Phytochemistry, 37, 231-215. http://dx.doi.org/10.1016/0031-9422(94)85028-3
- 22. Kawahara, N., Sekita, S. and Satake, M. (1995) Two Steroids from Cal-vatia cyathiformis. Phytochemistry, 38, 947- 950. http://dx.doi.org/10.1016/0031-9422(94)00740-K
- 23. Roland, J.F., Chmielewicz, Z.F., Weiner, B.A., Gross, A.M., Boening, O.P., Luck, J.V., Bardos, T.J., Christine Reilly, H., Sugiura, K., Chester Stock, C., Lucas, E.H., Byerrum, R.U. and Stevens, J.A. (1960) Calvacin: A New Antitumor Agent. Science, 132, 1897. http://dx.doi.org/10.1126/science.132.3443.1897
- 24. Bentley, R., Lavate, W.V. and Sweeley, C.C. (1964) Lipid Components of 2 Basidiomycetes—Calvatia Gigantea and Clitocybe Illudens. Comparative Biochemistry and Physiology, 11, 263-264. http://dx.doi.org/10.1016/0010-406X(64)90107-0
- 25. Wang, L., Li, Y.Y. and Yan, X.X. (1990) Analysis of Amino Acid Con-tent of 30 Varieties of Edible Fungi. Mushroom Journal of the Tropics, 10, 74-78.
- 26. Kivrak, I., Kivrak, S. and Harmandar, M. (2015) Free Amino Acid Profiling in the Giant Puffball Mushroom (Calvatia gigantea) Using UPLC-MS/MS. Food Chemistry, 158, 88-92. http://dx.doi.org/10.1016/j.foodchem.2014.02.108
- 27. Gasco, A., Serafino, A., Mortarin, V., Menziani, E., Bianco, M.A. and Scurti, J.C. (1974) Antibacterial and Antifungal Compound from Calvatia-Lilacina. Tetrahedron Letters, 15, 3431-3432. http://dx.doi.org/10.1016/S0040-4039(01)91928-8
- 28. Viterbo, D., Gasco, A., Serafino, A. and Mortarini, V. (1975) P-Carboxyphenylazoxycyanide-Dimethyl Sulfoxide- Antibacterial and Antifungal Compound from Calvatia lilacina. Acta Crys-tallographica Section B, 31, 2151-2153. http://dx.doi.org/10.1107/S0567740875007091
- 29. Umezawa, H., Takeuchi, T., Iinuma, H., Ito, M., Ishizuka, M., Kurakata, Y., Umeda, Y., Nakanishi, Y. and Nakamura, T. (1975) New Antibiotic, Calvatic Acid. Journal of Antibiotics, 28, 87-90. http://dx.doi.org/10.7164/antibiotics.28.87
- 30. Umezawa, H., Takeuchi, T., Iinuma, H. and Tanabe, O. (1975) Calvatic Acid. Jpn. Kokai Tokkyo Koho, JP 50052290.
- 31. Umezawa, H., Takeuchi, T., Sekizawa, Y., Kikuchi, T. and Fukunaga, T. (1975) Antibiotic Calvatinic Acid for Fish. Jpn. Kokai Tokkyo Koho, JP 50082215.
- 32. Fugmann, B., Arnold, S., Steglich, W., Fleischhauer, J., Repges, C., Koslowski, A. and Raabe, G. (2001) Pigments from the Puffball Calvatia rubro-flava—Isolation, Structural Elucidation and Synthesis. European Journal of Organic Chemistry, 2001, 3097-3104. http://dx.doi.org/10.1002/1099-0690(200108)2001:16<3097::AID-EJOC3097>3.0.CO;2-V
- 33. Badshah, H., Ullah, F., Khan, M.U., Mumtaz, A.S. and Malik, R.N. (2015) Pharmacological Activities of Selected Wild Mushrooms in South Waziristan (FATA), Pakistan. South African Journal of Botany, 97, 107-110. http://dx.doi.org/10.1016/j.sajb.2014.12.002
*通讯作者。