Advances in Material Chemistry
Vol.03 No.03(2015), Article ID:15696,6
pages
10.12677/AMC.2015.33006
Preparation of MgH2 by Gas-Solid Synthesis and Thermodynamics Analysis
Menglei Tan, Zhejun Tan, Gaofeng Quan*
Key Laboratory of Advanced Technologies of Materials, Ministry of Education, School of Materials Science & Engineering, Southwest Jiaotong University, Chengdu Sichuan
Email: *quangf@sejtu.cn
Received: Jun. 28th, 2015; accepted: Jul. 10th, 2015; published: Jul. 17th, 2015
Copyright © 2015 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
With the rapid development of hydrogen energy, hydrogen production, storage and transport become key issues of engineering technology. MgH2, as an Mg-based hydrogen storage material, has become the center of attention in hydrogen fuel-cell area because it has a high hydrogen capacity with less dense and easy control in hydrogen releasing. In this paper, gas-solid reaction is adopted to prepare MgH2. And a feasibility study in industry is analyzed about reactions between hydrogen with magnesium vapor and powder, respectively, by considering their thermodynamics calculation. The thermodynamics analysis and experimental results show that the temperature and pressure conditions of the reaction between hydrogen and magnesium powder are more easily fulfilled (673 K, 7 MPa, 72 h) than that between hydrogen and magnesium vapor, and that this method can be used in industry.
Keywords:Magnesium Hydride, Hydrogen Storage Materials, Thermodynamics Calculation, Explosive Reaction

气–固法合成制备氢化镁及热力学分析
谭梦蕾,谈哲君,权高峰*
西南交通大学材料科学与工程学院材料先进技术教育部重点实验室,四川 成都
Email: *quangf@sejtu.cn
收稿日期:2015年6月28日;录用日期:2015年7月10日;发布日期:2015年7月17日

摘 要
氢能发展日益壮大,制氢、储氢、运氢成为关键的工程技术问题。氢化镁作为镁基储氢材料,因其储氢量大,密度小,氢气释放易于控制而成为氢燃料电池领域关注的焦点之一。本文采用气–固反应法制备氢化镁,并通过对不同状态的镁(镁蒸汽与固体镁粉)与氢气的在高温高压下的合成反应进行热力学计算和实验,从而论证其大规模生产的工业可行性。热力学分析和试验验证结果表明:相比于镁在蒸汽状态下与氢气反应制备氢化镁而言,工业高纯镁固体粉末与氢气反应制备氢化镁的温度和压强条件要求较低(673 K, 7 MPa, 72 h),可工业化制备氢化镁。
关键词 :氢化镁,储氢材料,热力学计算,爆发式反应

1. 引言
近期我国104个城市频频出现雾霾,多个城市被严重污染的空气所笼罩,治理污染已经到了刻不容缓的地步。绿色发展、可持续发展、低碳发展,是时代潮流,也是各国积极追求的目标。氢能是一种绿色、可再生二次能源,具有来源多样、洁净环保、可储存和可再生等特点,可以同时满足资源、环境和可持续发展的要求[1] 。氢能燃料电池技术,一直被认为是利用氢能,解决未来人类能源危机的途径之一,甚至被某些专家视为终极方案,是氢能经济中的核心技术。制氢是氢能应用的基础,然而高效、安全可靠、低成本的储氢、输氢技术是氢能规模应用的瓶颈。随着储氢材料和技术的研究进展,镁基储氢材料渐渐成为热点。镁基储氢材料可直接应用于燃料电池,是未来改变能源结构的有力武器[2] 。镁金属在地面和盐湖、海水中的储量非常大,而且镁基储氢材料储氢量较高,其中,MgH2拥有高达7.6 wt.%的储氢密度,成为最有潜力的储氢材料之一[3] 。但是,目前MgH2的实用化进程缓慢,这主要是由于MgH2在吸放氢反应过程中的热力学特性不甚理想,包括吸氢过程缓慢、效率低等。针对这一问题,许多研究者尝试了一些不同的方法,如镁稀土合金储氢材料、镁基储氢复合材料等[4] -[9] 。Hanada等[10] 研究了纳米颗粒Fe、Co、Ni和Cu对MgH2储氢性能的影响机制,认为添加2% (摩尔分数) Ni的MgH2组分表现出较好的储氢性能,放氢量达到6.5% (质量分数)。与此同时,有关金属镁在蒸汽状态下与氢气反应及相关氢存储方面的研究鲜有报道。本文从金属镁与氢气在高温高压下制备MgH2的热力学计算出发,通过实验室试制MgH2,讨论不同形态金属镁与氢气在高温高压条件下直接工业制备氢化镁的可行性。
2. 气–气反应的热力学分析
镁蒸汽与氢气的反应式如下:
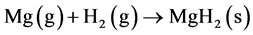 (1)
(1)
假设该反应可以正向进行,其吉布斯自由能表达式如下:
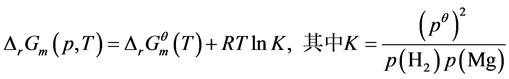 (2)
(2)
而注意到:
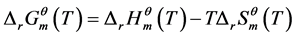 (3)
(3)
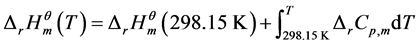 (4)
(4)
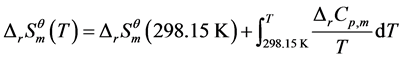 (5)
(5)
而对于某一物质B,它的恒压热容为:
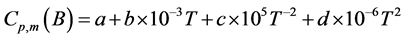 (6)
(6)
针对镁、氢及氢化镁公式中各参数选择如表1所示[11] 。
就某一反应有:
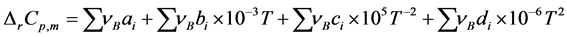 (7)
(7)
其中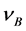 表示该反应的化学计量数,
表示该反应的化学计量数,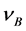 对反应物取负,产物取正。将表中数据带入公式(7),可得:
对反应物取负,产物取正。将表中数据带入公式(7),可得:
 (8)
(8)
设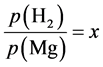 ,并根据
,并根据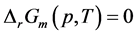 ,化简得到:
,化简得到:
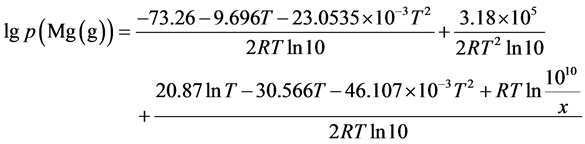 (9)
(9)
其中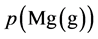 的单位是Pa,给定x值,作
的单位是Pa,给定x值,作 曲线。如图1所示,其中曲线族为x取值
曲线。如图1所示,其中曲线族为x取值 的十条
的十条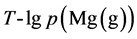 曲线,与蒸汽压曲线有一系列的交点,曲线的右上方是反应可以进行的区域。
曲线,与蒸汽压曲线有一系列的交点,曲线的右上方是反应可以进行的区域。
由图1可知,交点温度很高,达到5000 K,对于生产或实验设备要求苛刻,难度很大,可行性差。
3. 气–固反应的热力学分析
固态的镁粉与氢气的反应式如下
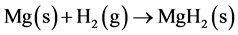 (10)
(10)
计算方式与气态反应类似,但是热容系数取值不同,如表2所示 [11] 。
同样考查该反应自发进行的临界情况,即有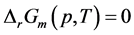 ,化简得到
,化简得到
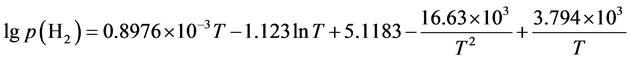 (11)
(11)
做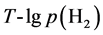 曲线如图2所示
曲线如图2所示
如图2所示,在曲线右侧反应可以自发进行。而且,由图中数据与式(9)表达的气–气反应相关参数对比可见,该种固–气合成的方式制备氢化镁具有更高的可行性。从反应温度而言,气–气反应需要在数千度以上,甚至4000 K、5000 K,比气–固反应要高出一个量级;就反应压强而言,气–固反应所需压强虽然要比气–气反应高,但仍在工业操作范围内。
故而得出:镁蒸汽与氢气反应,计算发现其条件苛刻,需要在非常高的温度和压力下才可以反应,而固态镁(粉末)与氢气在一般高温高压条件下即可合成氢化镁,条件易于实现和便于操作与控制。
Table 1. Constant pressure thermal capacity in gas-gas reaction
表1. 气–气反应各物质恒压热熔系数
Table 2. Constant pressure thermal capacity in gas-solid reaction
表2. 气–固反应各物质恒压热熔系数
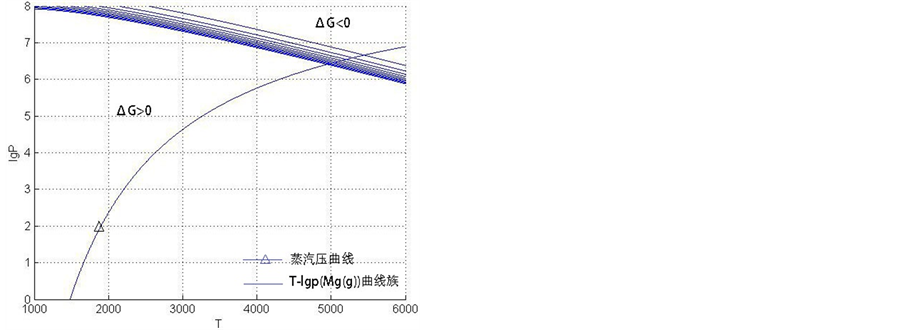
Figure 1. Gas-gas reaction T-lgp(Mg(g)) curve
图1. 气–气反应T-lgp(Mg(g))曲线
Figure 2. Vapor-solid reaction T-lgp(H2(g)) curve
图2. 气–固反应T-lgp(H2(g))曲线
4. 气–固法制备氢化镁实验研究
4.1. 实验材料
超高纯度工业镁粉,纯度99.995%,颗粒度250目,氩气包装,表面处于自然钝化状态,呈亮银白色,未见氧化情形;高纯氢气,纯度99.999%,供应压力30MPa。
4.2. 实验设备
高温高压反应釜,有效容积3.5 L,设计压力12.5 MPa,设计温度723 K,采用电加热法,加热功率2.5 KW,自动恒温控制。
4.3. 试验方法
将镁粉放在镁合金盒内(无盖),整体置于反应釜内,而后缓慢通入氢气,并缓慢放出进行氢气清洗,持续清洗足够长时间后关闭出气阀,开始升压、升温。保持温度和压强分别为673 K、7 MPa,如图3所示。持续时间72 h。随后,采用XRD对反应产物进行物相分析。
5. 结果分析
经过氢化镁制备试验后,发现存在两种不同色泽、形态的物质,如图4所示。通过表观分析可知:浮于表面的纯白色粉末推测为氢化镁,分别收集白色粉末(样品1)与盒底稍深色粉末(样品2)进行X射线衍射图谱分析,如图5所示。
氢化镁在常温常压下为金红石晶体结构,其特征峰出现在2θ = 27.947,35.744,54.617,晶面指数分别为(110),(101),(211),如图5。其中除氢化镁外,还可以标定出纯镁与极少量氧化镁。其中纯镁的特征峰出现在2θ = 32.173,34.385,36.604。而氧化镁特征峰角度较大,只标出了其中两个特征峰2θ = 42.909,62.306。由此可以确定:样品1是由氢化镁与少量未反应的纯镁颗粒组成;样品2中包含氢化镁、纯镁与少量氧化镁,氧化镁的存在是由于在转移纯镁的过程中,难免与空气接触,因此产生少量氧化镁。
仔细观察样品1发现,这些雪白色的粉末状MgH2成团絮状堆聚在一起,或以团聚状贴附在反应釜器壁上,且团聚内的实际的颗粒尺寸远小于反应前镁颗粒尺寸,有文献报道为8~100 nm [12] 。同时,尚
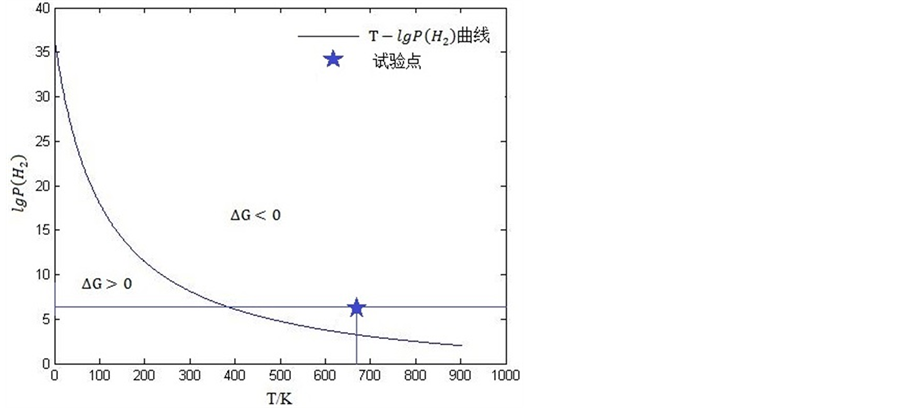
Figure 3. Experiment parameter point in vapor-solid reaction
图3. 气–固实验参数点

Figure 4. Macroscopic appearance of resultant
图4. 反应产物宏观形貌
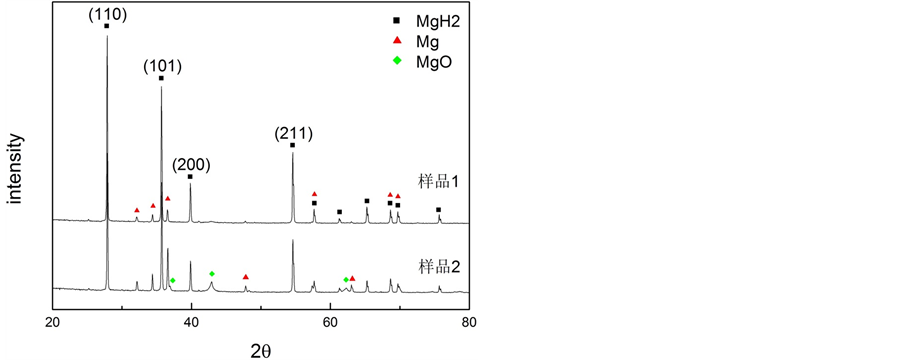
Figure 5. XRD of resultant
图5. XRD分析图谱
未反应的纯镁颗粒是完整的。这种反应产物能跳离原位贴附在容器壁上的现象,证明在反应过程中有产生了一种推动力,将粉末推向了容器壁。作者分析认为,最可能一种原因是:在反应初期,纯镁颗粒的表面随温度升高和氢气压强的增加而逐渐活化,其活化比表面积逐渐增大,当达到临界活化比表面积时,该活化部分的颗粒表面与氢气发生了快速气–固反应,在极短的时间里整个颗粒的镁原子全部转化成为氢化镁。文献分析认为氢化镁由于晶格常数大,快速转变时表现为爆发式转变,即在极短的时间内完成了一个纯镁颗粒到一团氢化镁的转变,所以反应产物很蓬松,成团絮状浮于镁粉表面,个别由镁粉粒转化成的氢化镁团聚体,更由于临近粉粒的几乎同时发生的爆发式转变而被冲击弹射到合成釜侧壁,贴附于器壁上。而未发生反应的则全部是整个颗粒的镁粉粒;形成爆发式转变的另一种原因是:反应产物氢化镁在冷却和降压的过程中,因为发生晶格转变而发生快速膨胀产生推动力,因而互相分散开了。在高压下氢化镁为六方β-MgH2相和斜方γ-MgH2相结构[13] ,随反应釜内压强的降低,氢化镁转变为常压下的α-MgH2金红石型四方晶体结构。由于转变过程中伴随着的体积膨胀,且转变速度足够快,就产生了爆炸式转变,氢化镁团聚互相分散开了。综合考虑,作者认为这两种过程先后发生有更大的可能性。
为了初步验证反应产物就是氢化镁,将收集到的混合物与水反应,采用量气法进行放氢实验,用量瓶收集氢气。通过量气法计算,得到氢化镁转化率达到了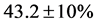 。由于该组反应的时间为72 h,而在铁盒内尚未反应的纯镁由于活化时间仍然不够,并没有达到临界活化比表面积,预测活化时间越长,纯镁制备氢化镁的转化率将越高。镁粉的粒度分布,尺寸,都影响着它的活化时间与转化率,虽然氢化镁有很高的储氢能力,但它的反应速率并不理想,这影响了它在储氢方面的应用,这个问题已经超过了热力学范围,成为了动力学问题。要达到能够满足汽车用储氢材料的指标[14] ,更需要改善制备氢化镁和储氢器件吸–放氢的动力学障碍。
。由于该组反应的时间为72 h,而在铁盒内尚未反应的纯镁由于活化时间仍然不够,并没有达到临界活化比表面积,预测活化时间越长,纯镁制备氢化镁的转化率将越高。镁粉的粒度分布,尺寸,都影响着它的活化时间与转化率,虽然氢化镁有很高的储氢能力,但它的反应速率并不理想,这影响了它在储氢方面的应用,这个问题已经超过了热力学范围,成为了动力学问题。要达到能够满足汽车用储氢材料的指标[14] ,更需要改善制备氢化镁和储氢器件吸–放氢的动力学障碍。
6. 结论
1) 热力学平衡计算表明,相比于镁固体粉末与氢气反应制备氢化镁,镁蒸汽状态下与氢气反应制备氢化镁的方案,需要更高的温度,条件过于苛刻,工业上难以实现。
2) 镁固体粉末状态下与氢气反应生成氢化镁是可行的,温度要求较低(673 K),压强在可控范围内(7 MPa),一般的转化率就达到 ,可以进行工业转化应用。
,可以进行工业转化应用。
3) 纯镁粉在高温高压状态下与氢气发生了爆发式反应,生成氢化镁,该反应特点是:每个纯镁颗粒在高温高压氢气中活化后与氢气在短时间内迅速反应,像爆炸一样跳离原位,形成更细小纳米粉末团聚,堆聚在一起呈团絮状,或贴附在容器壁上。
致谢
感谢为本研究提供支持的成都天智轻量化科技有限公司。
文章引用
谭梦蕾,谈哲君,权高峰, (2015) 气–固法合成制备氢化镁及热力学分析
Preparation of MgH2 by Gas-Solid Synthesis and Thermodynamics Analysis. 材料化学前沿,03,53-59. doi: 10.12677/AMC.2015.33006
参考文献 (References)
- 1. 夏丽洪 (2005) 专家谈我国能源行业的协调发展. 国际石油经济, 2, 10-14.
- 2. 闫惠忠 (2012) 储氢材料产业现状及发展. 高科技与产业化, 195, 68-71.
- 3. 刘新波, 刘子利 (2007) 镁基储氢合金的研究进展. 金属功能材料, 3, 32-36.
- 4. Li, F.B., et al. (2006) Synthesis and hydrogenation properties of Mg-Li-H system by reactive Mechanical alloying. International Journal of Hydrogen Energy, 31, 581-585. http://dx.doi.org /10.1016/j.ijhydene.2005.06.007
- 5. Porcu, M., Petford-Long, A.K. and Sykes, J.M. (2008) TEM studies of Nb2O5 catalyst in ball-milled MgH2 for hydrogen storage. Journal of Alloys and Compounds, 453, 341-346. http://dx.doi.org /10.1016/j.jallcom.2006.11.147
- 6. Kim, J.W., Ahn, J.P. and Jin, S.A. (2008) Microstructural evolution of NBF5-doped MgH2exhibiting fast hydrogen sorption kinetics. Journal of Power Sources, 178, 373-378. http://dx.doi.org /10.1016/j.jpowsour.2007.12.005
- 7. Li, Q., Liu, J. and Liu, Y. (2010) Comparative study on the controlled hydriding combustion synthesis and the microwave synthesis to prepare Mg2Ni from micro-particles. International Journal of Hydrogen Energy, 35, 3129-3135. http://dx.doi.org /10.1016/j.ijhydene.2009.07.121
- 8. CHourashiya, M.G. and Yang, D.-C. (2012) Comparison of commercial and hydriding-combustion-synthesized Mg- hydride. Materials Letters, 66, 42-45. http://dx.doi.org /10.1016/j.matlet.2011.08.008
- 9. Zhong, H.C., Wang, H. and Liu, J.W. (2011) Altered desorption enthalpy of MgH2 by the reversible formation of Mg (In) solid solution. Scripta Materialia, 65, 285-287. http://dx.doi.org /10.1016/j.scriptamat.2011.04.024
- 10. Hanada, N., Ichikawa, T. and Fujii, H. (2005) Catalytic effect of nanoparticle 3d-transition metals on hydrogen storage properties in magnesium hydride MgH2 prepared by mechanical milling. The Journal of Physical Chemistry B, 109, 7188-7194. http://dx.doi.org /10.1021/jp044576c
- 11. Dean, J.A., 著 (2003) 魏俊发, 等, 译. 兰氏化学手册. 第二版, 科学出版社, 北京.
- 12. 李志宝, 孙志贤, 张莹洁 (2014) MgH2储氢热力学研究进展. 中国科学, 6, 964-972.
- 13. Jain, I.P., Lal, C. and Jain, A. (2010) Hydrogen storage in Mg: A most promising material. International Journal of Hydrogen Energy, 35, 5133-5144. http://dx.doi.org /10.1016/j.ijhydene.2009.08.088
- 14. Schlapbaah, L. (2001) Hydrogen storage materials for mobile application. Nature, 414, 353-358. http://dx.doi.org /10.1038/35104634
