Hans Journal of Medicinal Chemistry
Vol.05 No.03(2017), Article ID:21592,7
pages
10.12677/HJMCe.2017.53007
Intervention of Chinese Herbal Medicine on Biofilm of Mycobacterium Tuberculosis
Shanmin Song, Min Tang, Xin Yin, Zonghui Xie, Yuwei Shang, Zaichang Yang*
School of Pharmacy, Guizhou University, Guiyang Guizhou
*通讯作者。

Received: Jul. 14th, 2017; accepted: Jul. 31st, 2017; published: Aug. 3rd, 2017

ABSTRACT
Tuberculosis (TB) is an infectious disease caused by Mycobacterium tuberculosis (MTB). Long treatment time is the main problem for TB prevention and control. Mycobacterium tuberculosis can form biofilm, which could decrease bactericidal activity of anti-tuberculosis drugs. Therefore, the intervention of Mycobacterium tuberculosis biofilm is a new idea for the treatment of tuberculosis. Eleven Chinese herbs were randomly selected to evaluate their interventional effect on the formation of Mycobacterium tuberculosis biofilm. The results showed that Sophora flavescens (0.4 mg/ml) could inhibit the formation of Mycobacterium tuberculosis biofilm, and Cornus officinalis (0.4, 0.8, 1.6, 3.2, 6.4 mg/ml) could promote the formation of Mycobacterium tuberculosis biofilm and showed a dose-effect relationship. The results showed that different Chinese herbal medicine had different effect on the formation of Mycobacterium tuberculosis biofilm. Further study by bioassay guided isolation will lay the foundation for the discovery of the molecular skeleton with the interventional effect on formation of Mycobacterium tuberculosis biofilm.
Keywords:Traditional Chinese Medicine, Mycobacterium Tuberculosis Biofilm, Intervention
中草药对结核分枝杆菌生物膜 的干预
宋善敏,汤敏,尹欣,谢宗会,尚玉维,杨再昌*
贵州大学药学院,贵州 贵阳

收稿日期:2017年7月14日;录用日期:2017年7月31日;发布日期:2017年8月3日

摘 要
结核病(TB)是由结核分枝杆菌(MTB)引起的传染性疾病,治疗时间长是结核防控面临的主要问题。结核杆菌能形成生物膜后,对抗结核药物的敏感性下降,因此,干预结核杆菌生物膜是治疗结核的新思路。本试验随机选择了11种中草药,评价其对结核杆菌生物膜的干预作用,结果表明,苦参(0.4 mg/ml)能抑制结核杆菌生物膜的形成,山茱萸(0.4、0.8、1.6、3.2、6.4 mg/ml)能促进结核杆菌生物膜的形成,并呈明显的量效关系。研究结果提示,不同中草药对结核杆菌生物膜的形成存在不同的干预结果。进一步开展活性跟踪研究,将为发现干预结核杆菌生物膜的分子骨架奠定基础。
关键词 :中草药,结核分枝杆菌生物膜,干预

Copyright © 2017 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
结核病( tuberculosis, TB)是由结核分枝杆菌(mycobacterium tuberculosis, MTB)引起的一种慢性消耗性疾病,是危害人类健康和导致人类死亡的重大传染性疾病。据世界卫生组织(WHO)调查,2016年共1040万人(590万男人,350万妇女,100万儿童)患有结核病,其中有140万人死于结核病,表明结核病仍是全球发病率和死亡率的主要传染病 [1] [2] [3] [4] 。
1944年第一个用于治疗结核病的药物链霉素问世,随后异烟肼、利福平、乙胺丁醇和吡嗪酰胺相继出现,人类已经能够有效治疗结核病。但是,结核的治疗需要长期用药,现有的治疗方案至少要求病人服药6个月,服药时间长有下列危害:1) 一些病人忘记服药,导致治疗失败,病人成为新的传染源;2) 服药时间长,药物对结核杆菌的选择压力加大,容易出现耐药菌株;3) 抗结核药物具有肝毒性,一些病人长期服药可能导致肝功能障碍或其它副作用。因此,缩短结核治疗时间是有效控制结核的关键措施 [5] 。
一般的细菌感染,治疗周期在7~15天左右,为什么结核杆菌引起的感染需要用药至少180天?临床研究表明,结核病人用药3天,痰中的结核杆菌就已经大大下降,但是,仍然有一部分细菌难以被清除,这部分难以被清除的细菌被称为持留菌,这类细菌亚群复制很慢甚至停止复制,代谢水平低或者具有特殊代谢途径,因此又被称为休眠型结核杆菌。当停药后,病人抵抗力下降时,休眠型结核杆菌复苏,开始大量分裂,引起结核复发。长期的临床观察发现,如果用药达到180天,病人复发的概率大大下降,这就是WHO推荐至少用药6个月的依据 [6] [7] 。为什么休眠型结核杆菌难以杀死?有证据表明,休眠型结核杆菌隐藏在生物膜内,抗结核药物分子被生物膜屏蔽,无法接触休眠型结核杆菌,因此必须长期给药,待生物膜自行降解后,药物才能杀死结核杆菌。目前对结核杆菌生物膜的研究处于起步阶段,研究中草药对结核杆菌生物膜的干预作用具有重要意义,本试验探讨了11种中草药对结核杆菌体外生物膜形成的影响,报道如下。
2. 材料与方法
2.1. 材料
2.1.1. 菌株来源
结核分支杆菌H37Rv、牛分枝杆菌BCG(购自ATCC)。
2.1.2. 试剂与药品
异烟肼(INH)、利福平(RFP)购自Sigma公司。
2.1.3. 中草药样本
秦皮、大蓟、远志、山茱萸、杜仲、玉竹、苦参、白术、半夏、金银花和蒲公英购自贵阳和平药房。
2.2. 中草药提取物的制备
称取中药材100 g,加入甲醇约600 ml浸泡7天,滤过,滤液回收甲醇,蒸干后得到甲醇提取物,备用。
2.3. 培养基及制备方法
改良罗氏培养基:准确称取改良罗氏培养基基础40.84 g,并吸取甘油12 ml,加蒸馏水600 ml,煮沸5~10 min,115℃灭菌20 min,待冷却至55℃左右,以无菌操作加入无菌搅匀的全蛋液1 L,混匀,分装15 mm × 150 mm的试管,每管5 ml,置成长斜面,用85℃流动蒸汽加热50 min,备用。
7H9-ADC肉汤培养基:准确称取Middlebrook 7H9肉汤培养基4.7 g,加入去离子水900 ml,加入2 ml甘油,混匀,置于121℃高压蒸汽灭菌30 min,冷却至45℃左右后加入100 ml无菌ADC (Middle brook)营养液,分装15 mm × 150 mm的试管,每管5 ml,备用。
2.4. 中草药提取物对结核杆菌生物膜的干预试验
中药材提取物直接溶解在7H9培养基中,浓度分别为0.4、0.8、1.6、3.2、6.4 mg/ml,每个浓度3管,阴性对照为7H9培养基(3管),每管总体积5 ml。灭菌后加入OADC营养液,每管接种结核分枝杆菌悬液(108 CFU/ml) 100 μl,置于37℃恒温培养箱中静置培养,分别在10、20、30 d观察结核分枝杆菌生物膜在气液交界处成膜情况。如果样本在0.4 mg/ml的浓度下仍然具有较强的活性,则再设0.025、0.05、0.1、0.2、0.4 mg/ml五个浓度,观察是否存在量效关系。生物膜形成的计分标准如下:1) 生物膜长满液面,厚而致密,计4分;2) 生物膜长满液面,薄而稀疏,计3分;3) 生物膜长至液面的一半,计2分;4) 生物膜长至液面的四分之一,计1分;5) 不长生物膜,计0分。
凡能抑制结核分枝杆菌生物膜的提取物,还应将其膜下的菌液接种于改良罗氏培养基2每样本接种3管,置37℃恒温培养箱中静置培养30 d,记录每管菌落数,用于判断样本对结核杆菌本身是否有抑制或杀灭作用。
3. 结果
通过对11种中草药提取物干预结核分枝杆菌生物膜的筛选,结果显示(表1),苦参的甲醇提取物能明显抑制结核杆菌H37Rv生物膜的形成,在低浓度(0.4 mg/ml)时,计分为0分,不能形成生物膜(图1),将该浓度下得菌液接种在改良罗氏培养基上,可见明显的结核杆菌菌落,表明结核杆菌并未被杀死,但是生物膜被抑制,而提高浓度后,结核杆菌被杀死,可见苦参在低浓度时能抑制结核杆菌生物膜形成,高浓度时能杀死结核杆菌(图2)。将苦参的浓度降低为0.025、0.05、0.1、0.2、0.4 mg/ml,生物膜计分值分别为4.0、3.2、2.6、2.2、0,呈现明显的量效关系。
Table 1. The intervention results of 11 medicinal plants extracts on mycobacterium tuberculosis biofilm
表1. 11种中草药提取物对结核杆菌生物膜的干预试验结果

Figure 1. Drug susceptibility assay of Sophora flavescens extract on M. Tuberculosis H37Rv biofilm in vitro
图1. 苦参提取物对结核分枝杆菌H37Rv生物膜体外药敏试验
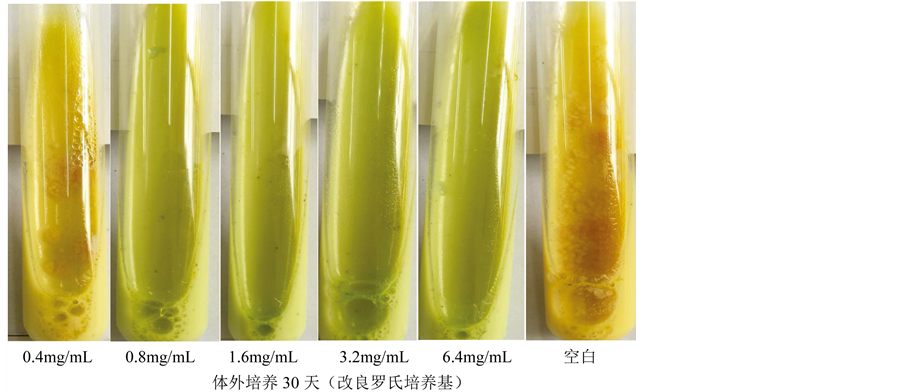
Figure 2. Effects of different concentrations of Sophora flavescens extract on the growth of mycobacterium tuberculosis
图2. 不同浓度的苦参提取物对结核杆菌生长的影响
山茱萸的甲醇提取物能促进结核杆菌H37Rv形成生物膜,呈现明显的量效关系,在6.4 mg/ml的浓度下,生物膜计分为4分(表1),形成的生物膜厚而致密(图3)。
白术、半夏也具有抑制结核杆菌生物膜的作用(表1),但作用稍弱。其余样本对结核杆菌生物膜缺乏明显的干预作用。
4. 讨论
研究表明约80%的细菌感染与存在生物膜相关 [8] 。近年来研究发现,结核分枝杆菌生物膜与持留性和耐药性存在相关性。结核分枝杆菌形成生物膜后,包埋在生物膜内的结核分枝杆菌不能被抗痨药物杀死,成为持留菌(persister),生物膜还能抵抗免疫系统的攻击 [9] [10] 。由于生物膜的存在,治疗时必须增大给药剂量和加长给药时间,才能杀死膜内菌,但这往往会导致耐药菌的出现并且带来肝损伤等严重不良反应 [11] 。本研究旨在从中国传统药用植物中发现能干扰结核杆菌生物膜的药物,为治疗结核提供新的思路。
如何对气液界面的生物膜进行定量?我们曾经采用称重法进行评价,但是操作麻烦,钓取生物膜时,总有部分生物膜留在液面,误差反而较大。经过十几次的反复试验,我们认为计分法更能客观反映生物膜的成膜结果。本研究发现,苦参的甲醇提取物能抑制结核杆菌H37Rv形成生物膜。李洪敏等对苦参中的苦参碱进行了抗结核分枝杆菌试验 [12] ,实验结果显示苦参碱有抑制结核杆菌生长的作用。本试验结果显示,苦参甲醇提取物在0.4 mg/ml浓度时,能抑制结核杆菌生物膜,但是不能抑制或杀死结核杆菌,浓度提高到0.8 mg/ml时,结核杆菌可被苦参杀死。提示结核杆菌形成生物膜不是维持该物种生命存在的基本生物学行为。苦参碱是否是抑制结核杆菌生物膜的有效成分有待进一步证实。
山茱萸的甲醇提取物具有促进结核杆菌H37Rv生物膜生长的作用,这一发现具有重要理论意义。目前对结核杆菌生物膜的研究尚处于起步阶段,生物膜形成的信号通路并不完全清楚,急需获得外源性小分子探针作为工具,从化学生物学的角度,进一步了解生物膜的形成机制。对山茱萸促进结核杆菌生物膜形成的深入探索,将对结核杆菌生物学研究奠定基础。
我国具有丰富的中药资源,中药在防治慢性感染中显示了独特的优势。如果中草药能破坏结核杆菌生物膜,那么抗痨药物就容易接近并杀死生物膜内的持留菌,缩短治疗时间。因此,发现能够干预生物

Figure 3. Drug susceptibility assay of Cornus officinale extract on mycobacterium tuberculosis H37Rv biofilm in vitro
图3. 山茱萸提取物对结核分枝杆菌H37Rv生物膜体外药敏试验
膜成膜的中草药可能缩短结核治疗时间,具有重要的学术价值和实际意义。
基金项目
国家自然科学基金(81460531),贵州省社会发展科技攻关项目(SY字[2013]3058号),贵大SRT字(2015)075号。
文章引用
宋善敏,汤敏,尹欣,谢宗会,尚玉维,杨再昌. 中草药对结核分枝杆菌生物膜的干预
Intervention of Chinese Herbal Medicine on Biofilm of Mycobacterium Tuberculosis[J]. 药物化学, 2017, 05(03): 45-51. http://dx.doi.org/10.12677/HJMCe.2017.53007
参考文献 (References)
- 1. 龚立康, 肖春玲. 抗结核药物靶点研究最新进展[J]. 国外医药抗生素分册, 2006, 27(2): 49-53.
- 2. Meghna A. and Bhasker, V. (2011) Drug-Resistant Tuberculosis: Emerging Treatment Options. Clinical Pharmacology: Advances and Applications, 3, 51-67.
- 3. 汪静, 张惠斌, 周金培. 抗结核新靶点及相关药物的研究进展[J]. 中国药科大学学报, 2012, 43(1): 1-8.
- 4. World Health Or-ganization (2016) Global Tuberculosis Report. World Health Organization, Geneva.
- 5. Ojha, A.K., Trivelli, X., Guerardel, Y., Kre-mer, L. and Hatfull, G.F. (2010) Enzymatic Hydrolysis of Trehalose Dimycolate Releases Free Mycolic Acids during Mycobacterial Growth in Biofilms. Journal of Biological Chemistry, 285, 17380-17389. https://doi.org/10.1074/jbc.M110.112813
- 6. Ojha, A.K. and Hatfull, G.F. (2012) Biofilms of Mycobacterium Tuberculosis: New Perspectives of an Old Pathogen. Understanding Tu-berculosis-Deciphering the Secret Life of the Bacilli, 283, 182-191.
- 7. Ojha, A.K., Anand, M., Bhatt, A., et al. (2005) GroEL1: A Dedicated Chaperone Involved in Mycolic Acid Biosynthesis during Biofilm Formation in Mycobacteria. Cell, 123, 861-873. https://doi.org/10.1016/j.cell.2005.09.012
- 8. 李建华, 宋丰贵. 细菌生物膜形成与细菌耐药机制研究进展[J]. 中国新药与临床杂志, 2008, 27(1): 70-73.
- 9. 刘霞, 郭庆龙, 王若珺, 王洪海, 裴秀英, 张雪莲. 结核分枝杆菌生物膜形成相关基因的筛选与鉴定[J]. 中国生物工程杂志, 2013, 33(4): 15-21.
- 10. Pang, J.M., Layre, E., Sweet, L. et al. (2011) The Polyketide Pks1 Con-tributes to Biofilm Formation in Mycobacterium Tuberculosis. Journal of Bacteriology, 194, 715-721. https://doi.org/10.1128/JB.06304-11
- 11. Parsek, M.R. and Singh, P.K. (2003) Bacterial Biofilms: An Emerging Link to Disease Pathogenesis. Journal of Microbiology, 57, 677-701. https://doi.org/10.1146/annurev.micro.57.030502.090720
- 12. 李洪敏, 冯端浩, 曹晶, 郑忠国, 王小燕, 刘蔚, 付春华. 中药苦参碱对结核杆菌的抑制作用[J]. 解放军药学学报, 2002, 18(6): 383-384.
