Hans Journal of Medicinal Chemistry
Vol.
08
No.
02
(
2020
), Article ID:
34942
,
7
pages
10.12677/HJMCe.2020.82003
Study on the Relationship between the Purity of Horseradish Peroxidase and Efficacy on the Degradation of Benzaldehyde
Xiaowen Yan1, Shengsheng Chen2, Rajendran Satheeshkumar1, Xianghui Liu2, Wenlong Wang1
1School of Pharmaceutical Sciences, Jiangnan University, Wuxi Jiangsu
2Suzhou Kangheshun Medical Co., Ltd., Suzhou Jiangsu

Received: Mar. 13th, 2020; accepted: Apr. 2nd, 2020; published: Apr. 9th, 2020

ABSTRACT
In this paper, the effects of horseradish peroxidase (HRP) with different purities on the catalytic degradation of benzaldehyde were evaluated. Products A (RZ > 0.8, enzyme activity > 80 U/mg), B (RZ > 1.5, enzyme activity > 150 U/mg) and C (RZ > 3.0, enzyme activity > 300 U/mg) were prepared in our lab. The parameters including time, temperature, pH, reactant concentration and enzyme amount were optimized. Using the optimal parameters, the effects of products A and C were evaluated. The results indicated that products B was significantly different from A but similar with product C. Considering the economic issue, these results indicated that Product B (RZ > 1.5, enzyme activity> 150 U/mg) might be the best choice to degrade benzaldehyde for industry.
Keywords:Horseradish Peroxidase, Benzaldehyde, Catalytic Oxidation, Economic Applicability

辣根过氧化物酶的纯度与降解苯甲醛效果关系的研究
严筱文1,陈胜胜2,Rajendran Satheeshkumar1,刘向晖2,王文龙1
1江南大学药学院,江苏 无锡
2苏州康和顺医疗技术有限公司,江苏 苏州

收稿日期:2020年3月13日;录用日期:2020年4月2日;发布日期:2020年4月9日

摘 要
本文研究不同纯度的辣根过氧化物酶(horseradish peroxidase, HRP)催化降解苯甲醛的效果。实验室制备商业级产品A (RZ > 0.8,酶活 > 80 U/mg),B (RZ > 1.5,酶活 > 150 U/mg),C (RZ > 3.0,酶活 > 300 U/mg)三种不同纯度的辣根过氧化物酶。通过改变时间、温度、pH、反应物浓度和酶量等变量探究产品B催化转化苯甲醛的最佳反应条件。利用获得的最佳反应条件,确认产品A和C催化降解苯甲醛的效果,发现产品B与A有明显差别,与C没有显著性差别。考虑到不同纯度HRP产品存在显著的价格差异,本研究认为,产品B (RZ > 1.5,酶活 > 150 U/mg)对于降解苯甲醛而言具有最佳经济适用性。
关键词 :辣根过氧化物酶,苯甲醛,催化氧化,经济适用性

Copyright © 2020 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
辣根过氧化物酶(horseradish peroxidase,HRP)是一种来源于辣根根部的血红素蛋白酶 [1] [2],被广泛运用于生物医疗 [3] [4] [5] [6] 、日用化工 [7] [9] 、以及环境保护 [10] [11] 等领域。商品化的HRP,由于纯度不同,价格存在显著差异(以BBI公司产品为例,RZ > 1.5的HRP价格为136.8元/100 mg,RZ > 3.0的HRP价格为320.0元/100 mg)。实现HPR使用目的与成本的最优平衡,获得最佳性价比的方案是工业界的持续关切。苯甲醛作为一种简单的芳香醛广泛用于食品、香料及制药等行业 [12] [13],产生的苯甲醛污染一直以来用HRP催化过氧化氢降解来治理 [14] - [18]。然而,罕有文献报道HPR降解苯甲醛的效率与成本之间关系的研究。
本文首先根据Barnard [19] 、Mohamed [20] 等人以及Mejri [21] 等人的相关研究确定从辣根中提取纯化HRP的实验方法,根据孙海霞的超滤提取HRP法 [22] 以及Carpenter等人的冻干蛋白制剂法 [23],得到产品A (RZ > 0.8,酶活 > 80 U/mg),产品B (RZ > 1.5,酶活 > 150 U/mg),产品C (RZ > 3.0,酶活 > 300 U/mg)三种不同纯度的辣根过氧化物酶。之后,选用产品B催化氧化苯甲醛,依次从反应时间、温度、pH值、反应物浓度和酶量等方面探索最佳反应条件。最后,在最佳条件下,比较产品A、B以及C的催化降解能力。发现产品B的降解效果与产品C和BBI产品(RZ > 3.0,320.0元/100 mg)没有显著性差异,但与产品A存在明显差异。对于催化氧化苯甲醛而言,产品B具有最佳性价比。本研究可以为合理使用不同纯度HRP,降低使用成本提供思路。
2. 仪器与试剂
2.1. 仪器
BT600-2J蠕动泵,保定兰格恒流泵有限公司;752型紫外可见分光光度计,舜宇恒平有限公司;KQ-700E型超声波清洗器,昆山市超声仪器有限公司;5810R型离心机,Eppendorf仪器有限公司;pH酸度计,梅特勒–托利多仪器有限公司;玻璃层析柱,上海煊盛生化科技有限公司;BSM电子天平,上海卓精电子科技有限公司;成套超滤装置,美国Spectrum仕必纯有限公司。
2.2. 试剂
99.5%三羟基氨基甲烷,北京百灵威科技有限公司;柱蛋白纯化填料,武汉汇研生物技术股份有限公司;无水乙酸钠,上海泰坦科技股份有限公司;冰乙酸,国药集团化学试剂有限公司;盐酸,国药集团化学试剂有限公司;分析纯硫酸铵,上海泰坦科技股份有限公司;氢氧化钠,上海泰坦科技股份有限公司。30%过氧化氢,国药集团化学试剂有限公司;苯甲醛,国药集团化学试剂有限公司。HRP RZ > 1.5、HRP RZ > 3.0,BBI生命科学公司。
3. 实验方法
3.1. 辣根过氧化物酶的分离纯化
分离纯化步骤如图1。将辣根冷冻、切碎、硫酸铵萃取后用硅藻土吸附,10 kD水性微孔滤膜滤去固相,超滤浓缩液相后,通过硫酸铵分级分离,再次收集液相超滤浓缩。将浓缩液载入CM琼脂糖凝胶色谱柱,碱性洗脱,超滤浓缩,冻干后得到产品A。酸性洗脱CM琼脂糖凝胶色谱柱,超滤浓缩洗脱液并载入DEAE琼脂糖凝胶色谱柱,酸性洗脱液超滤浓缩后冻干,得到产品B。碱性洗脱DEAE琼脂糖凝胶色谱柱,超滤浓缩洗脱液后载入Phenyl琼脂糖凝胶色谱柱,酸性洗脱,超滤浓缩洗脱液,冻干后得到产品C。三种不同纯度的HRP产品分别为A (RZ > 0.8,酶活 > 80 U/mg),B (RZ > 1.5,酶活 > 150 U/mg),C (RZ > 3.0,酶活 > 300 U/mg)。根据酶活计算总收率产品A为96%,产品B为62%,产品C为39%。(U的定义:在20℃,pH值为6.0的条件下,前20秒内催化产生1毫克红棓酚的酶数量)。

Figure 1. Purification process
图1. 纯化流程
3.2. 影响苯甲醛去除率的单因素实验
当用紫外分光光度法同时测定苯甲醛和苯甲酸混合液含量时,溶液在250 nm处的吸光度值与苯甲醛浓度成正比 [24] [25]。配制空白样与测试样(表1),在250 nm下用空白样调零后读取测试样的吸光度值,记为A1,反应后的吸光度值记为A2,按照下列公式计算出去除率(α),从而确定处理效果:
α = (A1 − A2)/A1 × 100%。
Table 1. Compositions of the reaction solution
表1. 反应液组成
a) 反应时间对苯甲醛降解率的影响
在反应温度40℃,磷酸缓冲液pH为7,苯甲醛溶液浓度为5 mmol/L,30%氧化氢溶液浓度为0.5 mol/L,HRP浓度为20 ug/mL的条件下,分别读取反应0、20、40、60、80、100 min时的吸光度值,求得降解率。
b) 反应温度对苯甲醛降解率的影响
在最佳反应时间下,在磷酸缓冲液pH为7,苯甲醛溶液浓度为5 mmol/L,30%氧化氢溶液浓度为0.5 mol/L,HRP浓度为20 ug/mL的条件下,分别读取反应温度为10、20、30、40、50、60℃时苯甲醛的降解率。
c) 缓冲液pH对苯甲醛降解率的影响
在最佳反应时间和最佳反应温度下,保持苯甲醛溶液浓度为5 mmol/L,30%氧化氢溶液浓度为0.5 mol/L,HRP浓度为20 ug/mL不变,考查磷酸缓冲液pH为4,5,6,7,8,9时苯甲醛的降解率,得到该反应的最适pH。
d) 探索苯甲醛起始浓度对苯甲醛降解率的影响
在最佳反应时间、最佳反应温度、最适pH下,控制30%氧化氢溶液浓度为0.5 mol/L以及HRP浓度为20 ug/mL的条件不变,改变苯甲醛起始浓度1,2,3,4,5,6,7 mmol/L时,根据苯甲醛降解率的变化探究苯甲醛起始浓度对反应的影响。
e) 探索过氧化氢浓度对苯甲醛降解率的影响
在最佳反应时间、最佳反应温度、最适pH,最适苯甲醛起始浓度下,探究过氧化氢浓度分别为0.1,0.2,0.3,0.4,0.5,0.6 mol/L时的降解率。
f) 探索辣根过氧化物酶浓度对苯甲醛降解率的影响
分别配制辣根过氧化物酶浓度为10,20,30,40,50 ug/mL的酶溶液,在最佳反应时间、最佳反应温度、最适pH,最适苯甲醛起始浓度,最适过氧化氢浓度下,测算降解率。
3.3. 不同纯度酶对苯甲醛去除率的影响实验
使用产品B (RZ > 1.5,酶活 > 150 U/mg),设计单因素实验,依次确定了最佳反应时间、最佳反应温度、最适pH,最适苯甲醛起始浓度,最适过氧化氢浓度和最适HRP浓度。之后,在最优条件下检测产品A (RZ > 0.8,酶活 > 80 U/mg)和产品C (RZ > 3.0,酶活 > 300 U/mg)对苯甲醛去除率的影响。
4. 结果与讨论
4.1. 影响苯甲醛去除率的单因素实验结果






Figure 2. Results of single factor experiments
图2. 单因素实验结果
使用产品B在考查时间变量的实验中发现,前60 min降解率随着时间延长而增加,60 min时降解率达到57.4%。之后的40 min内,降解率维持在57.4%左右并不再随时间延长而变化,说明反应在60 min到达终点(图2a)。因此,我们选用60 min作为后续研究的终点时刻。接下来我们考查了反应温度对降解率的影响情况,当反应温度在10℃至40℃时,苯甲醛的降解率随温度的升高而升高,40℃时降解率出现峰值。若反应温度大于40℃,降解率随着温度的升高反而呈下降趋势(图2b)。这一结果显示,温度较低时,酶活较低,导致降解率低,随温度升高反应加剧,降解率升高,但超过40℃后,酶蛋白变形失活,导致苯甲醛的降解率反而出现下降。相关文献也有类似的结论 [26]。固定反应时间60 min,反应温度40℃,调节缓冲液pH值,发现在pH 4~6之间,酶的降解活性随着pH值的增大而增强,当pH值到达6时,酶的活性达到峰值59.4%,略高于pH为7时的情况,说明弱酸环境更利于此反应(图2c)。对于不同浓度的苯甲醛,在酶浓度为20 ug/mL时,降解率依旧维持在59.4%左右,该结果表明,苯甲醛初始浓度对该反应的影响不大(图2d)固定反应时间60 min、温度40℃、pH值6、苯甲醛的浓度5 mmol/L,酶浓度20 ug/mL,改变过氧化氢的浓度(0.1~0.8 mol/L)后发现,苯甲醛的降解率在0.5 mol/L之前随着浓度的增大而增大,在0.5 mol/L之后维持在峰值59.4%左右,过氧化氢浓度的增加对降解率的增加没有显著提高(图2e)。使用产品B在表1所配的反应体系中,设置反应时间60 min,反应温度为40℃,磷酸缓冲溶液pH为6,苯甲醛溶液浓度为5 mmol/L,过氧化氢溶液浓度为0.5 mol/L,HRP浓度为20 ug/mL时,苯甲醛的降解率59.4%。当HRP浓度大于等于30 ug/mL时,苯甲醛的降解率可达到最大值64.7% (图2f)。
4.2. 不同纯度酶对苯甲醛去除率的影响
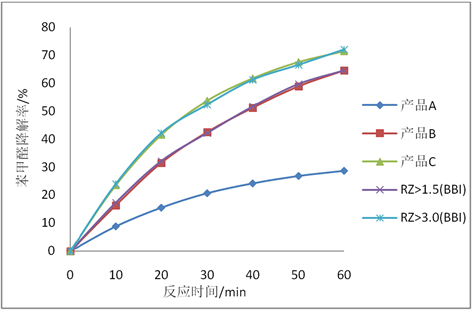
Figure 3. Relationships between HRPs with different purities and the removal rates of benzaldehyde within 60 min
图3. 不同纯度辣根过氧化物酶60 min内与苯甲醛去除率的关系
图3中五根曲线分别代表实验室制备得到的三种不同纯度的HRP产品A (RZ > 0.8,酶活 > 80 U/mg),B (RZ > 1.5,酶活 > 150 U/mg),C (RZ > 3.0,酶活 > 300 U/mg)以及BBI公司市售的HRP产品(RZ > 1.5和RZ > 3.0)五种产品,在表1所配的反应体系中,在最优反应条件下(反应温度为40℃,磷酸缓冲液pH为6,苯甲醛溶液浓度为5 mmol/L,过氧化氢溶液浓度为0.5 mol/L,HRP浓度为30 ug/mL,60 min),降解苯甲醛的曲线图。实验结果显示,产品A的最终降解率为28.7%,比同条件的产品B低36%比产品C低42.8%,产品A的降解效果与产品B和C有显著性差异,产品B与产品C相差6.8%,不存在显著性差别。产品B和C的曲线分别与BBI公司对应的产品基本一致,说明产品B和C与BBI公司相应的HRP产品对苯甲醛的降解效果相当。从经济适用性角度考虑,产品C (RZ > 3.0)对苯甲醛的降解效果仅为产品B (RZ > 1.5)的1.1倍,而价格是产品B的2.3倍(以BBI市售价格为参考),产品C的纯化流程也较产品B更为复杂,选用RZ > 1.5,酶活 > 150 U/mg的HRP产品进行苯甲醛的降解反应具有最佳性价比。
基金项目
江苏省自然科学基金(BK20190608)和江苏省博士后科研资助计划(2019K220)。
文章引用
严筱文,陈胜胜,Rajendran Satheeshkumar,刘向晖,王文龙. 辣根过氧化物酶的纯度与降解苯甲醛效果关系的研究
Study on the Relationship between the Purity of Horseradish Peroxidase and Efficacy on the Degradation of Benzaldehyde[J]. 药物化学, 2020, 08(02): 14-20. https://doi.org/10.12677/HJMCe.2020.82003
参考文献
- 1. Veitch, N.C. (2004) Horseradish Peroxidase: A Modern View of a Classic Enzyme. Phytochemistry, 65, 249-259. https://doi.org/10.1016/j.phytochem.2003.10.022
- 2. Barnard, A. (2012) The Optimization of the Extraction and Purification of Horseradish Peroxidase from Horseradish Roots. Master Thesis, Stellenbosch University, Biochemistry.
- 3. 于峰, 李瑞娟, 李鹏聪, 等. 人血清透明质酸夹心化学发光免疫检测方法的建立[J]. 中国医药生物技术, 2012(5): 346-351.
- 4. 班艳娜. 辣根过氧化物酶及免疫磁珠在肿瘤标志物检测中的应用[D]: [硕士学位论文]. 重庆: 重庆医科大学, 2012.
- 5. 宋桂兰, 任皞, 贾素贞, 等. 酶催化分光光度法测定蛋白质[J]. 分析化学, 2007, 35(5): 731-734.
- 6. 陈莉华, 黄飞, 刘六战, 等. 吡罗红为底物的辣根过氧化物酶催化荧光反应测定葡萄糖[J]. 光谱学与光谱分析, 2003, 23(5): 917-921.
- 7. 朱红岩, 周赫元, 刘颖颖, 等. 水溶性聚噻吩类衍生物聚(3-噻吩丙二酸)的酶催化合成与表征[J]. 化工新型材料, 2017, 45(5): 146-148.
- 8. 段丽苹. 辣根过氧化酶催化的聚噻吩衍生物的合成[D]: [硕士学位论文]. 北京: 中国矿业大学, 2014.
- 9. 张东华. 辣根过氧化物酶在有机合成中的应用[J]. 应用化工, 2006, 35(10): 805-808.
- 10. 张锋. 辣根过氧化物酶降解苯酚废水催化特性研究[J]. 应用化工, 2012, 41(7): 1204-1207.
- 11. 顾磊. 新型辣根过氧化物酶复合纳米催化剂的合成及其对酚类污染物的降解研究[D]: [硕士学位论文]. 镇江: 江苏大学, 2018.
- 12. Wu, Y., Zhang, S., Wang, X., Na, N. and Zhang, Z. (2008) Development of a Benzaldehyde Sensor Utilizing Chemiluminescence on Nanosized Y2O3. Luminescence, 23, 376-380. https://doi.org/10.1002/bio.1047
- 13. Yang, F. and Guo, Z. (2016) Engineering NiO Sensitive Materials and Its Ultra-Selective Detection of Benzaldehyde. Journal of Colloid and Interface Science, 467, 192-202. https://doi.org/10.1016/j.jcis.2016.01.033
- 14. 王亚丽, 魏娟娟. 辣根过氧化物酶催化降解间苯二酚的研究[J]. 宁夏师范学院学报, 2015, 36(6): 53-60.
- 15. 王亚丽, 魏娟娟. 辣根过氧化物酶催化降解苯酚过程的研究[J]. 广东化工, 2016, 43(18): 51-53.
- 16. 贾泽慧, 王春涛, 张改玲. 辣根过氧化物酶催化降解水中苯甲醛[J]. 太原师范学院学报(自然科学版), 2017, 16(3): 78-81.
- 17. Chang, Q. and Tang, H. (2014) Immobilization of Horseradish Peroxidase on NH2-Modified Magnetic Fe3O4/SiO2 Particles and Its Application in Removal of 2,4-dichlorophenol. Molecules, 19, 15768-15782. https://doi.org/10.3390/molecules191015768
- 18. Bayramoğlu, G. and Arıca, M.Y. (2008) Enzymatic Removal of Phenol and p-Chlorophenol in Enzyme Reactor: Horseradish Peroxidase Immobilized on Magnetic Beads. Journal of Hazardous Materials, 156, 148-155. https://doi.org/10.1016/j.jhazmat.2007.12.008
- 19. Barnard, A. (2012) The Optimization of the Extraction and Purification of Horseradish Peroxidase from Horseradish Roots. University of Stellenbosch, Stellenbosch.
- 20. Mohamed, S.A., Abulnaja, K.O., Ads, A.S., Khan, J.A. and Kumosani, T.A. (2011) Characterisation of an Anionic Peroxidase from Horseradish cv. Balady. Food Chemistry, 128, 725-730. https://doi.org/10.1016/j.foodchem.2011.03.096
- 21. Mejri, F., Karmali, A., Jaoued, N., Asabianca, H. and Hosni, K. (2019) Purification and Partial Characterization of Peroxidases from Three Food Waste By-Products: Broad Bean Pods, Pea Pods, and Artichoke Stems. Applied Biochemistry and Biotechnology, 189, 576-588.
- 22. 孙海霞. 超滤提取辣根过氧化物酶的方法[P]. CN201210112799.4. 2012-08-01.
- 23. Carpenter, J.F., Chang, B.S., Garzon-Rodriguez, W. and Randolph, T.W. (2002) Rational Design of Stable Lyophilized Protein Formulations: Theory and Practice. Pharmaceutical Biotechnology, 13, 109-133. https://doi.org/10.1007/978-1-4615-0557-0_5
- 24. 暴玮, 刘雄民, 马丽, 等. 紫外分光光度法测定肉桂醛、苯甲醛和苯甲酸[J]. 理化检验–化学分册, 2009, 45(6): 687-689, 694.
- 25. 李彦威, 杨秀花, 勾洪磊, 等. 紫外分光光度法同时测定电合成产物苯甲醛和苯甲酸[J]. 光谱实验室, 2006, 23(4): 684-689.
- 26. Yuan, Z.Y. and Jiang, T.J. (2003) Horseradish Peroxidase. In: Whitaker, J.R., Voragen, A. and Wong, D.W.S., Eds., Handbook of Food Enzymology, Marcel Dekker Inc., New York, 403-411.
