Hans Journal of Medicinal Chemistry
Vol.
10
No.
02
(
2022
), Article ID:
50002
,
14
pages
10.12677/HJMCe.2022.102011
基于网络药理学和分子对接研究黄芩汤抗细菌感染的作用机制
唐思,陈双扣*,谭小庆,徐明鑫,秦齐刚,徐曦,郭耘牧,管天冰
重庆科技学院化学化工学院,重庆
收稿日期:2022年3月11日;录用日期:2022年3月31日;发布日期:2022年4月7日

摘要
目的:探讨黄芩汤治疗细菌感染的潜在机制及药效物质。方法:通过中药系统药理学数据库与分析平台(TCMSP)和GeneCards数据库获得黄芩汤抗细菌感染的活性成分及基因集。运用STRING数据库进行GO及KEGG通路富集分析,并利用Cytoscape V3.8.3软件构建活性成分–靶点、靶点–靶点相互作用(PPI)以及成分–靶点–通路(C-T-P)网络图。采用AutoDock vina对核心成分和关键靶点进行分子对接,最后借助体外抑菌实验,验证核心成分的抑菌活性。结果:共筛选出黄芩汤抗细菌感染的43个潜在靶点和11个活性成分。网络分析表明,槲皮素、山柰酚、汉黄芩素和β-胡萝卜素可能作用于TNF、CASP3、IL6和JUN 4个核心靶点,并通过Toll-like receptor、NOD-like receptor、NF-kappa B和RIG-I-like receptor signaling pathway等通路发挥抗细菌感染的作用。分子对接结果显示关键靶点与4个核心成分具有较高的亲和力。体外抑菌实验验证槲皮素、山柰酚、汉黄芩素和β-胡萝卜素有较好的抑菌活性。结论:网络药理学方法整合分子对接技术和体外抑菌实验研究,表明黄芩汤治疗细菌感染具有多成分、多靶点和多通路的特点,本文揭示了其药效物质和作用机制,为开发治疗细菌感染的新型联合药物提供了途径。
关键词
黄芩汤,细菌感染,网络药理学,分子对接,作用机制,抑菌实验

Network Pharmacology and Molecular Docking Analyses on Huangqin-Tang Decoction in the Treatment of Bacterial Infection
Si Tang, Shuangkou Chen*, Xiaoqing Tan, Mingxin Xu, Qigang Qin, Xi Xu, Yunmu Guo, Tianbing Guan
Department of Chemistry and Chemical Engineering, Chongqing University of Science and Technology, Chongqing
Received: Mar. 11th, 2022; accepted: Mar. 31st, 2022; published: Apr. 7th, 2022

ABSTRACT
Objective: To explore the potential mechanism and pharmacodynamic substances of Huangqin-Tang decoction in the treatment of bacterial infection. Methods: A target gene set and active compounds of Huangqin-Tang decoction against bacterial infection were obtained using the Traditional Chinese Medicine Systems Pharmacology database (TCMSP) and GeneCards databases. STRING database was utilized for Gene Ontology (GO) and Kyoto Encyclopedia of Genes and Genomes (KEGG) enrichment analysis. The compounds-targets network, compounds-targets-pathways network (C-T-P) and proteins-proteins interaction (PPI) network were constructed using Cytoscape 3.8.3 software. Molecular docking was performed to visualize the patterns of interactions between the core compounds and key target. Bacteriostatic experiment in vitro was performed to verify the antibacterial activity of core compounds screened. Result: 43 potential targets and 11 active compounds of Huangqin-Tang decoction in treatment of bacterial infection were screened. Network analysis indicated that quercetin, kaempferol, wogonin, and beta-carotene may act on 4 core targets, which were TNF, JUN, IL6 and CASP3, and Toll-like Receptor, NOD-like receptor, NF-kappa B, and RIG-I-like receptor signaling pathway and other pathways played a role in anti-bacterial infection. The molecular docking result showed that the key targets had high binding affinity with four core compounds of Huangqin-Tang decoction. In vitro bacteriostatic experimental verified that quercetin, kaempferol had good anti-inflammatory effect. Conclusion: The network pharmacological strategy integrates molecular docking and bacteriostatic experiment in vitro to reveal the therapeutic effect and potential mechanism of Huangqin-Tang decoction on bacterial infection, which could provide the way to develop new combination medicines for bacterial infection.
Keywords:Huangqin-Tang Decoction, Bacterial Infection, Network Pharmacology, Molecular Docking, Mechanism of Action, Bacteriostatic Experiment

Copyright © 2022 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
随着抗生素的过度使用,细菌耐药性问题愈来愈严重。目前,由耐药菌引起的感染每年至少造成70万人死亡,若不加以控制,预计到2050年死亡人数将达到1000万 [1] [2]。因此,新型抗菌药物的研发迫在眉睫。中药抗菌药物由于具有不良反应少、不易产生耐药性以及多靶点等优势被广泛研究。其中,黄芩汤为《伤寒论》中的经典名方,由黄芩、白芍、甘草和大枣四味药材组成,具有抗炎解毒、清热止利等功效 [3]。据研究报道,黄芩具有抗菌抗病毒、抗炎以及清除氧自由基等作用 [4],白芍作为毛茛科植物芍药的干燥根,可通过抑制NF-κBp65活化,减少TNF-α和前列素E2 (PGE2)等炎症因子表达来有效缓解结肠炎大鼠炎症状态 [5]。甘草具有补脾益气、清热解毒、缓急止痛等作用,而大枣则因其含有丰富的维生素C、维生素E等成分,具有补中益气、养血安神、增强免疫力的功效 [6] [7]。方剂配伍的原则为“君臣佐使”,在黄芩汤方剂中,黄芩属于君药,白芍、大枣、甘草等属于臣药,各药物成分相辅相成,共同发挥药效作用。严梅桢 [8] 通过体内外抑菌实验研究发现,黄芩汤及其代谢产物对50株肠道致病菌均有较好的抑菌作用,如致病菌沙门氏菌、痢疾杆菌、大肠杆菌、金葡球菌、绿脓杆菌等。白迎春等 [9] 探讨了加减黄芩汤对多重耐药人源性大肠杆菌病的影响,发现黄芩汤能显著提高血清因子IL-2的含量,促进机体免疫器官的发育,提高机体的免疫力,对人源多重耐药性大肠杆菌能起到一定的耐药逆转作用,表现出较好的抑菌作用。王隐喻 [10] 利用网络药理学和生物信息学探讨了黄芩汤治疗溃疡性结肠炎的作用机制,证实黄芩汤在菌群调节方面具有一定的表达优势。上述研究表明,黄芩汤中的四味成分相辅相成,共同发挥作用表现出抗菌活性,具有发展为新型抗菌药物的潜力。
网络药理学结合系统生物学、多向药理学和网络分析的技术和内容,通过系统层面的“药物–靶点–疾病”网络探索药物与疾病的关系,进一步研究药物的作用机制,其系统性、整体性符合中药多化合物、多靶点协同作用的特点 [11]。本文基于黄芩汤的抑菌作用,运用网络药理学方法、分子对接技术和体外抑菌实验,探讨黄芩汤治疗细菌感染的分子作用机制,为新型抗菌药物的研发提供数据参考。
2. 材料和方法
2.1. 黄芩汤成分及靶点收集
通过中药系统药理学数据库与分析平台(TCMSP) (https://tcmspw.com/)分别检索黄芩汤中四味中药的化学成分,并依据口服生物利用度(OB ≥ 30%)和药物相似性(DL ≥ 0.18)的标准对化学成分进行初筛,建立黄芩汤活性成分数据库。口服生物利用度(OB)和药物相似性(DL)是筛选活性成分的重要药动学参数 [12] 同时,从TCMSP数据库中搜索各活性成分的相关靶点,去除重复靶点后借助Uniprot数据库(https://www.uniprot.org/)对靶点进行注释,得到基因符号。
2.2. 黄芩汤抗细菌感染的靶点获取
以“anti-bacterial infection”为关键词,在GeneCards 数据库(https://www.genecards.org/, ver. 4.9.0)中获取抗细菌感染的相关靶点,并提取“相关性分数”靠前的前400个靶点与黄芩汤活性成分的靶点相映射,得到黄芩汤抗细菌感染的潜在靶点。利用Cytoscape V3.8.2 (http://www.cytoscape.org)构建化合物–靶点网络图,分析活性成分与潜在靶点间的关系。
2.3. 黄芩汤抗细菌感染的蛋白互作(PPI)网络构建
利用蛋白互作网络探究靶点与靶点之间的相互作用关系,同时筛选出“黄芩汤”抗“细菌感染”的核心靶点。将黄芩汤抗细菌感染的潜在作用靶点导入STRING数据库(https://string-db.org/, ver. 11.0),种属设置为“Homo sapiens”。为保证阳性率,蛋白互作评分大于等于0.400,删除离散目标后下载TSV文件。此外,在Cytoscape V3.8.2中导入TSV文件,绘制蛋白–蛋白相互作用(PPI)网络图,并利用网络拓扑分析插件cytoHubba进行分析,根据Degree值筛选得到黄芩汤抗细菌感染的核心靶点。
2.4. GO和KEGG富集分析
为进一步揭示黄芩汤抗细菌感染的作用机制,将潜在靶点输入STRING数据库,进行GO生物过程和KEGG信号通路富集分析。根据P值 < 0.05提取前20条结果进行可视化。
2.5. 化合物–靶点–通路网络的构建
根据KEGG富集分析结果,将P值 < 0.05的前60条信号通路、抗菌靶点以及黄芩汤核心成分导入Cytoscape V3.8.2中,构建了化合物–靶点–通路网络图,进一步分析了靶点、活性成分和通路的相互作用过程。利用网络拓扑分析插件cytoHubba,凸显核心靶点 [13],并与PPI网络中筛选出的核心靶点取交集,得到黄芩汤治疗细菌感染的关键靶点。
2.6. 分子对接
采用分子对接技术探索筛选的关键靶点和核心成分间的相互作用关系。于PDB数据库(https://www.rcsb.org)和TCMSP数据库中分别下载蛋白受体的3D共晶结构和小分子配体结构。利用PyRx软件删除大分子受体中的水分子和原配体,并通过自对接的方式以RMSD < 2.0 Å为标准确定对接参数模型 [14]。然后,在linux系统下,利用AutoDock vina软件将活性分子配体与蛋白质受体进行对接 [15],并利用Pymol软件对对接结果进行可视化处理。
2.7. 体外抑菌实验
2.7.1. 化合物
利用网络药理学和分子对接技术筛选出3个市售化合物进行体外抑菌实验。化合物相关信息见表1。
Table 1. Compound information
表1. 化合物相关信息
2.7.2. 菌株
根据相关文献报道,选择金黄色葡萄球菌(ATCC29213)作为实验对象。该菌株由重庆科技学院生物制药系提供,储存于−80℃甘油中。
2.7.3. 仪器与试剂
实验仪器包括电子天平(Practum124-1CN,广州市深华生物技术有限公司)、手提式压力蒸汽灭菌锅(lx-b50l,合肥华泰医疗设备有限公司)、恒温培养箱(JYB-66,上海跃进医疗器械有限公司)、恒温摇床(SHZ-82A,常州金坛精达仪器制造有限公司)、超净工作台(LHG-3_G-F8,苏净集团苏州安泰空气技术有限公司)、酶标仪(168-1130 iMark,BIO-RAD公司)、移液枪(469465, DragonMed)、细菌培养皿(90 × 15 mm,北京兰杰柯科技有限公司)、96孔板(常德比克曼生物科技有限公司)等。实验试剂包括酵母粉(分析纯,成都科龙化学试剂厂)、色氨酸(分析纯,北京奥博斯生物科技有限公司)、琼脂粉(分析纯,成都科龙化学试剂厂)、氯化钠(分析纯,成都科龙化学试剂厂)、二甲基亚砜DMSO (分析纯,成都科龙化学有限公司)、环丙沙星(分析纯,上海麦克林生化有限公司)。
2.7.4. 菌液培养
根据商品说明书,将2.5 g酵母粉、5.0 g色氨酸、5.0 g NaCl和100 mL蒸馏水溶解于250 mL的锥形瓶中,制备LB (Luria-Bertani)液体培养基 [16]。将金黄色葡萄球菌接种于琼脂固体培养基上,37℃培养过夜,然后将单个菌落置于LB (Luria-Bertani)液体培养基中,于37℃、180 rpm摇床中振荡培养4~6 h至菌种浓度为1 × 105 CFU/mL,储存于4℃冰箱中备用。
2.7.5. 化合物溶液的制备
将0.01 g化合物(槲皮素、山奈酚、汉黄芩素)分别加入5 mL的DMSO中,搅拌溶解得到2000 μg/mL的原液,并于室温保存。
2.7.6. MIC的测定
根据临床和实验室标准协会(CLSI)指南,采用双肉汤稀释法测定最低抑菌浓度(MIC) [17]。简而言之,在96孔板上用LB液稀释原液得到不同浓度(1000.00、500.00、250.00、125.00、62.50、31.25、15.63、7.82 g/mL)的化合物溶液。然后将等体积(100 µL/孔)的金黄色葡萄球菌接种于上述96孔板中。由于环丙沙星对金黄色葡萄球菌有较强的抑制作用,故采用环丙沙星作为阳性对照。阳性对照组为100 μL环丙沙星 + 100 μL LB液体培养基,阴性对照组为100 μL溶剂 + 100 μL LB液体培养基,空白对照组为100 μL溶剂 + 100 μL LB液体培养基。最后,将96孔板在37℃下培养18小时,观察结果。
2.7.7. 抑菌圈直径的测定
利用琼脂平板打孔法考察药物对金黄色葡萄球菌的抑制作用。采用金属打孔器在涂满菌液的琼脂平板上均匀打三孔,孔间距大于20 mm,将50 μL药物溶液加入孔中,最后置于37℃恒温培养箱中培养18 h后观察结果。每一个药物设置三组重复实验。采用游标卡尺测量每一个抑菌圈的直径,其中抑菌直径大于20 mm为极敏,15~19 mm为高度敏感,10~14 mm为重度敏感,10 mm以下为低度敏感 [18]。
3. 结果
3.1. 黄芩汤有效成分及作用靶点
根据TCMSP数据库,共得到黄芩汤的170个成分,其中黄芩36个成分,甘草92个成分,红枣29个成分,白芍13个成分。共获得2834个相关靶点,去除重复靶点和基因注释后,最终获得“黄芩汤”有效成分的173个靶点。
3.2. 黄芩汤抗细菌感染的潜在靶点
通过将黄芩汤的173个靶点与抗菌感染的前400个靶点相映射,筛选出黄芩汤抗细菌感染的43个潜在靶点,结果如图1所示。利用Cytoscape V3.8.2软件可视化潜在靶点与化合物间的关系,展示于图2中。通过插件cytoHubba的MCC算法,发现槲皮素(M1)、山奈酚(M2)、汉黄芩素(M3)、β-胡萝卜素(M4)、金合花素(M5)和黄芩素(M6)拥有高的Degree值,为关键活性成分。相关参数列于表2。
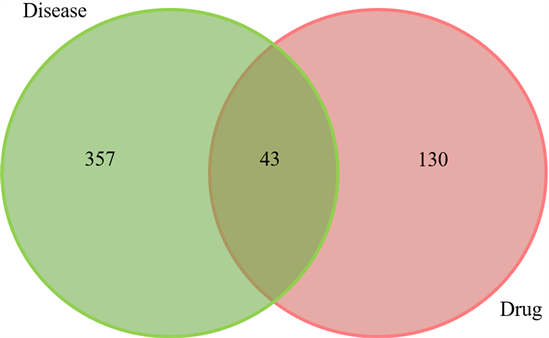
Figure 1. Venn diagram of coincidence target between drug and disease
图1. 药物与疾病交集靶点的维恩图
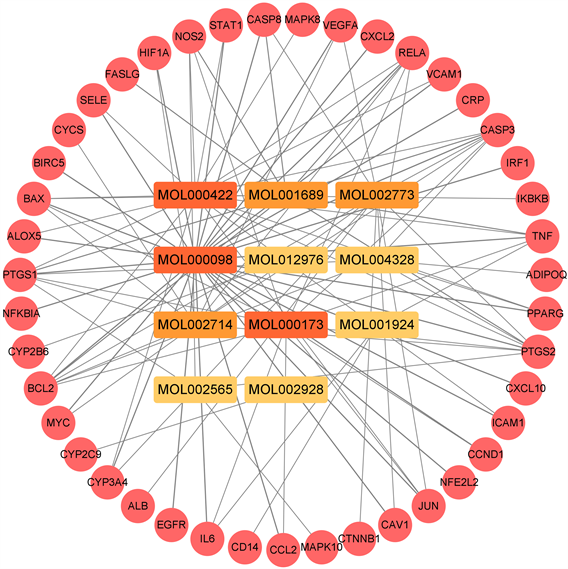
Figure 2. Compounds-targets network
图2. 化合物–靶点网络图
Table 2. Related parameters of key compounds in the compound-target network
表2. 化合物–靶点网络中关键化合物的相关参数
3.3. PPI网络分析
在STRING网站中输入43个潜在靶点,根据蛋白互作评分大于等于0.400提取结果。将TSV文件导入CytoscapeV3.8.2中,构建蛋白–蛋白互作网络,如图3所示。根据网络分析结果显示,共有43个节点,508条边,利用插件cytoHubba的MCC算法研究发现共11个核心靶点的Degree值大于30,分别为PTGS2、IL6、ALB、CCL2、VEGFA、TNF、CASP3、JUN、ICAM1、PPARG和HIF1A。

Figure 3. PPI interaction network of potential targets
图3. 潜在作用靶点的PPI网络图
3.4. GO和KEGG富集分析
通过GO富集分析得到410条条目,根据p < 0.05,筛选出排名靠前的182条条目,其中包括112条生物过程(BP)、49条分子功能(MF)和21条细胞成分(CC),分别选取富集最显著的前20条进行可视化,如图4(a)~(c)所示。生物过程主要包括inflammatory response、response to drug、positive regulation of transcription from RNA polymerase II promoter、positive regulation of transcription和DNA-templated,主要与炎症反应和酶调节有关的活性靶点为RELA、IKBKB和TNF。生物功能主要涉及identical protein binding、protein binding、protein heterodimerization activity、enzyme binding、protein homodimerization activity 和transcription factor binding,相关联的靶点有JUN, CAV1, HIF1A, TNF, and PTGS2等。细胞成分富集分析发现,潜在作用靶点主要分布在cytosol, nucleus, cytoplasm, nucleoplasm, extracellular space等部位。KEGG分析结果显示,43个潜在靶点主要参与75条通路(p < 0.05),包括TNF信号通路、Toll样受体信号通路、NOD样受体信号通路、NF-kappa B信号通路和RIG-I样受体信号通路等。前20条通路如图4(d)所示。其中,TNF信号通路主要涉及TNF, RELA, MAPK10, IL6和IKBKB等17个靶点。MAPK10, IKBKB, CXCL10, IL6和JUN等12个靶点主要作用于Toll样受体信号通路。NOD样受体信号通路主要涉及10个靶点,如MAPK10, NFKBIA, IKBKB, IL6和MAPK8等。NF-kappa B信号通路主要涉及NFKBIA, IKBKB, VCAM1, BCL2和CD14等10个靶点。MAPK10, NFKBIA, IKBKB, CXCL10和MAPK8等8个靶点主要作用于RIG-I样受体信号通路。上述研究结果表明黄芩汤抗细菌感染是一个多靶点、多通路的过程。
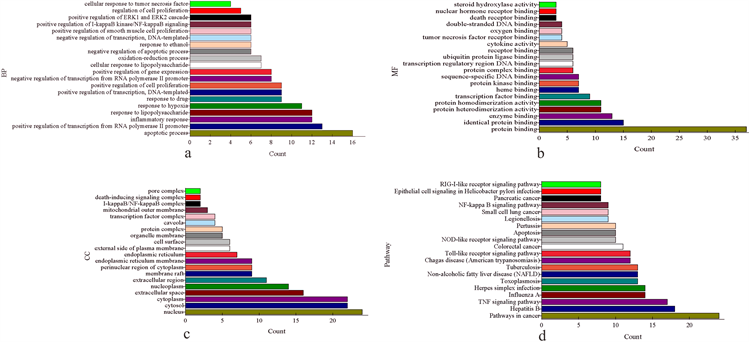
Figure 4. (a) Biological Processes (BP); (b) Molecular Function (MF); (c) Cellular Compounds (CC) analysis of potential targets; (d) KEGG analysis of potential targets
图4. 潜在靶点的(a)生物过程(BP),(b) 分子功能(MF),(c) 细胞成分(CC)分析以及(d) KEGG分析
3.5. C-T-P网络分析
采用4种中药,11个活性化合物,43个潜在靶点以及P值由小到大的前60条通路构建化合物–靶点–通路网络图(图5)。由图5可知,网络中共有129个节点和633条边。以靶点Degree值大于网络Degree
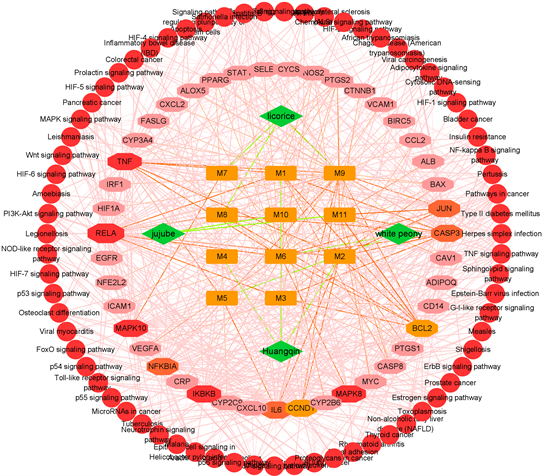
Figure 5. Compounds-Targets-Pathway network
图5. 化合物–靶点–通路网络图
平均值的两倍为标准,筛选出11个核心靶点,分别为RELA, TNF, IKBKB, MAPK10, MAPK8, NFKBIA, JUN, IL6, CASP3, BCL2和CCND1,并将其与PPI网络图中的核心靶点取交集,最终得到黄芩汤抗细菌感染的4个关键靶点,表明黄芩汤抗细菌感染的过程主要是通过活性化合物(槲皮素、山奈酚、黄芩素)作用于关键靶点(TNF、IL6、JUN、CASP3)和TNF信号通路、Toll样受体信号通路、NOD样受体信号通路等主要通路而实现的。
3.6. 分子对接
利用Autodock vina软件对黄芩汤抗细菌感染的4个关键靶点(TNF、JUN、IL6、CASP3)与5个活性化合物进行对接,探究其相互作用。从PDB数据库中检索并下载得到4个关键靶点的受体蛋白共晶结构,分别为3 kmc (TNF),2h96 (JUN),6ae3 (IL6)和2xyp (CASP3)。图6为分子对接的可视化结果和相关的详细信息列于表3中。通常认为分子对接得到的结合能若小于−5 kcal·mol−1,说明靶点与化合物具有一定的结合活性,且结合能越低,两者结合越稳定 [19]。根据分子对接后的能量可知,TNF与黄芩汤中的4个化合物(M1、M2、M3、M5)具有良好的亲和力。如图6所示,M1与3kmc受体蛋白上的两个氨基酸残基THR 347 (2.0 Å)和TYR 436 (2.1 Å)以H键的方式形成了稳定的对接模型(图6左上)。M2与THR 347形成了一个H键而稳定结合,键长为2.1 Å (图6右上)。M3以疏水作用的方式稳定存在于3 kmc中由THR 347、PRO437、ILE 438、VAL402、LEU 348、VAL434、HIS 405、TYR 436、GLU406和GLY 346等氨基酸残基形成的特异性活性口袋中(图6左下)。M5与3kmc中的GLY 349、LEU350、HIS 409、HIS 415、HIS405、THR 347、LEU 348、PRO 437、VAL 402和LEU 401通过疏水相互作用连接以形成稳定的M5-3kmc复合物(图6右下)。以上结果进一步揭示了黄芩汤中4个化合物共同作用于细菌感染的靶点,从而达到抗菌的目的。此外,槲皮素与TNF拥有最高的结合亲和力,其对接能量最低,为−8.9 kcal/mol。
 左上为M1-3kmc复合物;右上为M3-3kmc复合物;左下为M2-3kmc复合物;右下为M5-3kmc复合物。
左上为M1-3kmc复合物;右上为M3-3kmc复合物;左下为M2-3kmc复合物;右下为M5-3kmc复合物。
Figure 6. Molecular docking between the four active ingredients and protein 3kmc (encoded by TNF)
图6. 受体蛋白3kmc (TNF)与4个活性成分间的分子对接可视化图
Table 3. Docking score of active compounds with key targets of Huangqin-Tang decoction
表3. 黄芩汤活性成分与关键靶点的对接分数
3.7. 体外抑菌实验分析
3.7.1. MIC测定结果分析
单药抗菌与对照实验的结果如图7所示。利用体外抑菌法测定化合物对金黄色葡萄球菌的最小抑菌浓度(MIC),结果列于表4。环丙沙星(阳性对照)对金黄色葡萄球菌的MIC为0.98 µg/mL,槲皮素(M1)、山柰酚(M2)和汉黄芩素(M3)分别为62.50 µg/mL、31.25 µg/mL和1000.00 µg/mL。由表4可知,山柰酚对金黄色葡萄球菌的抑制作用最强,其次是槲皮素。实验结果进一步证明了网络药理学方法和分子对接技术的可靠性。

Figure 7. (a) Single drug bacteriostasis experiment; (b) Control experiment
图7. (a) 单药抑菌实验;(b) 对照实验
Table 4. The MIC of compound molecules
表4. 化合物分子的MIC值
“−”代表“清澈”;“+”代表“浑浊”。
3.7.2. 体外抑菌圈结果分析
抑菌圈实验相关数据如表5所示。单药抑菌实验结果发现阳性对照环丙沙星的抑菌直径为16.90 ± 0.64,槲皮素和山奈酚的抑菌直径分别为17.50 ± 0.82 mm, 17.33 ± 0.54 mm,表明金黄色葡萄球菌对上述药物高度敏感。通过与环丙沙星对比,进一步表明所筛选的药物(槲皮素和山奈酚)对金黄色葡萄球菌有显著的抑制作用。然而在与环丙沙星联用时,发现抑菌直径均有所减小,敏感度由高度敏感降为中度敏感,可能由于药物与环丙沙星表现为拮抗作用所致。
Table 5. Inhibitory diameter of single and combination drug
表5. 单药和联合用药的抑菌圈直径
4. 讨论
目前,细菌性感染疾病随着各类细菌对抗生素耐药性的增强,对人类健康造成的威胁也日益增加,预计到2050年,细菌感染将再次成为人类死亡的主要原因 [20] [21]。因此,开发一种新型的抗菌药物便具有重要意义。黄芩汤主要由黄芩、甘草、大枣以及白芍四种成分组成,具有清热止痢,和中止痛等功效。据记载,黄芪可清热除湿,净化火和解毒,甘草具有抗炎抗过敏作用,白芍具有温阳祛湿、补体虚、健脾胃等功效,可治疗风湿冷痛、风湿关节炎和腰肌劳损等疾病。大枣含有丰富的维生素C、维生素P,可提高人体免疫力,并且大枣还含有使癌细胞向正常细胞转化的物质,医药价值广泛。本文利用网络药理学方法,共获得黄芩汤活性成分170个,其中黄芩36个,甘草92个,大枣29个和白芍13个,经过删除重复值和基因注释处理,得到相关靶点共173个。根据化合物–靶点网络图的拓扑分析发现,M1 (槲皮素)、M2 (山柰酚)、M3 (汉黄芩素)和M4 (β-胡萝卜素)等成分为黄芩汤抗细菌感染的核心成分。其中,槲皮素是一种黄酮类化合物,具有抗炎、抗凋亡和免疫调节等作用,据文献报道,槲皮素可以抑制人体外周血单核细胞促炎细胞因子TNF-α的增殖及基因水平,降低IL-1β、IL-6等炎症因子以及MMP3、MMP9的表达,抑制炎症介质的产生,从而改善炎症症状 [22] [23]。山柰酚可通过调节FGFR3的活性,抑制碱性成纤维细胞因子(basic fibroblast growth factor, bFGF)对FGFR3-RSK2信号轴的激活水平,调控滑膜细胞的增殖迁移及T细胞介导的炎性细胞因子IL-7、IL-21和TNF-α的释放,从而达到缓解炎症反应的目的 [24]。汉黄芩素为一种黄酮类化合物,具有抗炎、抗氧化、抗菌、抗癌以及免疫调节等作用,可通过抑制LPS诱导的BV-2细胞促炎因子的释放而表现出抗炎作用 [25]。张海丽等 [26] 通过研究证明,黄芩素可以抑制脂多糖、三磷酸腺苷诱导的巨噬细胞炎症反应。β-胡萝卜素可以清除自由基而表现出抗氧化性。以上研究表明黄芩汤抗细菌感染的过程主要是槲皮素、山柰酚、汉黄芩素和β-胡萝卜素等成分发挥作用。
将成分靶点与“抗细菌感染”的疾病靶点相映射,得到黄芩汤抗细菌感染的43个核心靶点,结合PPI网络和C-T-P网络分析可知,IL6、TNF、CASP3和JUN四个靶点为黄芩汤抗细菌感染的关键靶点。IL6和TNF为促炎因子,在病原菌感染所引起的炎症中普遍上调。病毒感染时,将诱导机体合成大量TNF,TNF也可诱导体内产生IL6,两者关系密切,且IL6为TNF信号通路的重要因子,介导免疫调节、炎症诱导等 [27]。JUN为JNK的下游产物,且JUN的激活依赖于转录的凋亡信号通路,当JNK被激活后,将诱导JUN磷酸化,引起细胞凋亡,促进炎症的发展。因此,抑制JUN磷酸化可抑制细胞凋亡和自噬,从而抑制机体炎症的发展 [28]。CASP3属于Caspase蛋白家族中的一员,编码半胱氨酸–天冬氨酸蛋白酶,是细胞凋亡的关键执行者,当细胞接受凋亡刺激时,它被系列反应激活,进而诱导细胞发生凋亡 [29] [30]。根据上述靶点的功能及作用,可知黄芩汤可能是通过作用于上述核心靶点从而调控机体的炎症反应、免疫反应以及细胞凋亡等生物过程,从而达到抗细菌感染的目的。
GO分析表明,黄芩汤抗细菌感染主要是JUN, TNF, IL6等靶点在细胞质、细胞核、核质和细胞外空间等生物组分中,发挥相同蛋白结合、蛋白质结合、蛋白质异二聚化活性、酶结合、蛋白质同二聚化活性和转录因子结合等分子功能,涉及炎症反应、药物反应、RNA聚合酶II启动子的转录正调控、正调控转录和DNA模板等生物过程。KEGG通路分析显示黄芩汤抗细菌感染的过程主要涉及TNF信号通路、Toll样受体信号通路、NOD样受体信号通路、NF-kappa B信号通路和RIG-I样受体等信号通路。TNF信号通路中TNF-α为促炎细胞因子,可募集TRAF家族蛋白以激活NF-kappaB和JNK等转录因子,从而促进细胞的存活、分化、免疫和炎症反应 [31]。NOD样受体(Nucleotide Oligomerization Domain, NOD)主要存在于机体免疫细胞及上皮细胞中,可识别细胞壁胞壁酰二肽(MDP)成分,参与机体的固有免疫反应,同时也可介导炎症介质的释放 [32]。研究发现,NOD样信号通路激活后形成高分子复合体,通过受体相互作用蛋白2,进一步激活NF-κB信号通路和丝裂原活化蛋白激酶(Mitogen-Activated Protein Kinases, MAPK)信号通路,导致炎症反应的发生 [33] [34]。此外,NF-kappa B通路和Toll样受体通路均与炎性疾病有着非常紧密的关系,这些通路激活可促进白细胞介素1和肿瘤坏死因子α等炎症细胞因子的表达 [35] [36]。表明黄芩汤可能通过上述通路调节机体免疫反应和炎症反应达到抗细菌感染的目的。
分子对接结果表明,黄芩汤中的M1 (槲皮素)、M2 (山柰酚)和M3 (汉黄芩素)、M4 (β-胡萝卜素)和M5(金合欢素) 5种活性成分与TNF具有良好的结合活性,其中M1 (槲皮素)和M2 (山奈酚)与靶点IL6、CASP3和JUN通过疏水作用和氢键结合,在抗菌感染中发挥了重要作用。通过体外抑菌实验对活性成分最低抑菌浓度(MIC)和抑菌圈直径的测定,进一步证明M1 (槲皮素)和M2 (山柰酚)对金黄色葡萄球菌具有显著的抑菌作用,其中槲皮素和山柰酚的MIC分别为62.50 μg/mL和31.25 μg/mL,抑菌圈直径分别为17.50 ± 0.82 mm和17.33 ± 0.54 mm。结果与分子对接一致,表明槲皮素与山柰酚的协同作用在黄芩汤抗细菌感染过程中起着主要作用。
5. 总结
综上所述,本文采用网络药理学方法和分子对接技术分析了黄芩汤抗细菌感染的作用机制,并利用体外抑菌实验对结果的可靠性进行进一步的验证。结果表明黄芩汤复方抗细菌感染主要是黄芩中的槲皮素和白芍中的山柰酚成分通过TNF信号通路、Toll样受体信号通路、NOD样受体信号通路、NF-kappa B信号通路和RIG-I样受体等信号通路作用于TNF、IL6、CASP3和JUN等靶点从而调节机体的炎症反应和自身免疫反应而实现。进一步验证了中药复方中多成分之间的协同作用。
基金项目
重庆科技学院硕士研究生创新计划项目(YKJCX2020508)。
文章引用
唐 思,陈双扣,谭小庆,徐明鑫,秦齐刚,徐 曦,郭耘牧,管天冰. 基于网络药理学和分子对接研究黄芩汤抗细菌感染的作用机制
Network Pharmacology and Molecular Docking Analyses on Huangqin-Tang Decoction in the Treatment of Bacterial Infection[J]. 药物化学, 2022, 10(02): 108-121. https://doi.org/10.12677/HJMCe.2022.102011
参考文献
- 1. Peng, Z., Hayen, A., Kirk, M.D., Pearson, S., Cheng, A.C. and Liu, B. (2020) Microbiology Testing Associated with Antibiotic Dispensing in Older Community-Dwelling Adults. BMC Infectious Diseases, 20, Article No. 306. https://doi.org/10.1186/s12879-020-05029-z
- 2. Bezerra, W.G.A., Horn, R.H., Silva, I.N.G., Teixeira, R.S.C., Lopes, E.S., Albuquerque, Á.H., et al. (2017) Antibiotics in the Poultry Industry: A Review on Antimicrobial Resistance. Archivos de Zootecnia, 66, 301-307.
- 3. Zou, Y., Li, W.Y., Wan, Z., Zhao, B., He, Z.-W., Wu, Z.-G., et al. (2015) Huangqin-Tang Ameliorates TNBS-Induced Colitis by Regulating Effector and Regulatory CD4+ T Cells. BioMed Re-search International, 2015, Article ID: 102021. https://doi.org/10.1155/2015/102021
- 4. Bitto, A., Squadrito, F., Irrera, N., Pizzino, G., Pallio, G., Mecchio, A., et al. (2014) Flavocoxid, a Nutraceutical Approach to Blunt Inflammatory Conditions. Mediators of Inflammation, 2014, Article ID: 790851. https://doi.org/10.1155/2014/790851
- 5. Xiao, X., Li, X.J. and Diao, J.X. (2012) Effects of Total Glucosides of Paeony on Rats’ Ulcerative Colitis Caused by Dextran Sulfate Sodium. Journal of Foshan University: Natural Science Edition, 30, 4.
- 6. Yang, R., Wang, L.Q., Yuan, B.C. and Liu, Y. (2015) The Pharmacological Activities of Licorice. Planta Medica, 81, 1654-1669. https://doi.org/10.1055/s-0035-1557893
- 7. Lu, Y., Bao, T., Mo, J., Ni, J. and Chen, W. (2021) Research Advances in Bioactive Components and Health Benefits of Jujube (Ziziphus jujuba Mill.) Fruit. Journal of Zhejiang University: SCIENCE B, 22, 431-449. https://doi.org/10.1631/jzus.B2000594
- 8. 严梅桢, 左风, 宋红月, 叶文华, 周钟鸣. 黄芩汤及其肠道菌代谢产物抗菌作用的比较研究[J]. 中国中药杂志, 2003, 28(3): 243-246.
- 9. 白迎春. 加味黄芩汤对感染鼠耐药大肠杆菌acrAmRNA表达及鼠生化指标的影响[D]: [硕士学位论文]. 北京: 中国农业科学院, 2011.
- 10. 王隐瑜, 赵书涵, 郑晨曦, 苗永迪, 孙子钧, 郑雯升, 等. 黄芩汤对溃疡性结肠炎治疗作用的研究进展[J]. 临床医药文献电子杂志, 2019, 6(85): 69-70.
- 11. Yan, S.K., Zhao, J., Dou, S.S., Jiang, P., Liu, R.-H. and Zhang, W.-D. (2009) Meth-odology of Modernization Research in Traditional Chinese Medicine Based on Systems Biology and Network Biology. Chinese Journal of Natural Medicines, 7, 249-259. https://doi.org/10.3724/SP.J.1009.2009.00249
- 12. Wu, J., Liu, L., Hu, H., Gao, Z. and Lu, S. (2020) Bioinformatic Analysis and Experimental Identification of Blood Biomarkers for Chronic Nonunion. Journal of Orthopaedic Surgery and Research, 15, Article No. 208. https://doi.org/10.1186/s13018-020-01735-1
- 13. Higareda-Almaraz, J.C., Karbiener, M., Giroud, M., Pauler, F.M., Gerhalter, T., Herzig, S., et al. (2018) Norepinephrine Triggers an Immediate-Early Regulatory Network Response in Primary Human White Adipocytes. BMC Genomics, 19, Article No. 794. https://doi.org/10.1186/s12864-018-5173-0
- 14. Lohning, A.E., Levonis, S.M., Williams-Noonan, B. and Schweiker, S.S. (2017) A Practical Guide to Molecular Docking and Homology Modelling for Medicinal Chemists. Current Topics in Medicinal Chemistry, 17, 2023-2040. https://doi.org/10.2174/1568026617666170130110827
- 15. Trott, O. and Olson, A.J. (2009) AutoDock Vina: Improving the Speed and Accuracy of Docking with a New Scoring Function, Efficient Optimization, and Multithread-ing. Journal of Computational Chemistry, 31, 455-461. https://doi.org/10.1002/jcc.21334
- 16. Green, M.R. and Sambrook, J. (2018) Preparation of Plasmid DNA by Al-kaline Lysis with Sodium Dodecyl Sulfate: Maxipreps. Cold Spring Harbor Protocols, 2018, pdb-prot093351. https://doi.org/10.1101/pdb.prot093351
- 17. Liao, G., Peng, X., Li, T., Ye, Z., Xiang, X. and Fu, C. (2018) The Discovery of an Iridium (III) Dimer Complex as a Potent Antibacterial Agent against Non-Replicating Mycobacterium smegmatis. Polymers, 10, Article No. 297. https://doi.org/10.3390/polym10030297
- 18. Azab, M.E., Youssef, M.M. and El-Bordany, E.A. (2013) Synthesis and Antibacterial Evaluation of Novel Heterocyclic Compounds Containing a Sulfonamido Moiety. Molecules, 18, 832-844. https://doi.org/10.3390/molecules18010832
- 19. Gaillard, T. (2018) Evaluation of AutoDock and AutoDock Vina on the CASF-2013 Benchmark. Journal of Chemical Information and Modeling, 58, 1697-1706. https://doi.org/10.1021/acs.jcim.8b00312
- 20. Forlani, G., Petrollino, D., Fusetti, M., Romanini, L., Nocek, B. and Joachimiak, A. (2012) Δ1-Pyrroline-5-Carboxylate Reductase as a New Target for Therapeutics: Inhibition of the Enzyme from Streptococcus pyogenes and Effects in Vivo. Amino Acids, 42, 2283-2291. https://doi.org/10.1007/s00726-011-0970-7
- 21. Divala, T.H., Corbett, E.L., Stagg, H.R., Nliwasa, M., Sloan, D.J., French, N., et al. (2018) Effect of the Duration of Antimicrobial Exposure on the Development of Antimicrobial Resistance (AMR) for Macrolide Antibiotics: Protocol for a Systematic Review with a Network Meta-Analysis. System-atic Reviews, 7, Article No. 246. https://doi.org/10.1186/s13643-018-0917-0
- 22. Nair, M.P., Mahajan, S., Reynolds, J.L., Aalinkeel, R., Nair, H., Schwartz, S.A., et al. (2006) The Flavonoid Quercetin Inhibits Proinflammatory Cytokine (Tumor Necrosis Factor Al-pha) Gene Expression in Normal Peripheral Blood Mononuclear Cells via Modulation of the NF-κβ System. Clinical and Vaccine Immunology, 13, 319-328. https://doi.org/10.1128/CVI.13.3.319-328.2006
- 23. Haleagrahara, N., Hodgson, K., Miranda-Hernandez, S., Hughes, S., Kulur, A.B. and Ketheesan, N. (2019) Correction to: Flavonoid Quercetin-Methotrexate Combination Inhib-its Inflammatory Mediators and Matrix Metalloproteinase Expression, Providing Protection to Joints in Collagen-Induced Arthritis. Inflammopharmacology, 27, 201. https://doi.org/10.1007/s10787-018-0480-2
- 24. Lee, C.J., Moon, S.J., Jeong, J.H., Lee, S., Lee, M.-H., Yoo, S.-M., et al. (2018) Kaempferol Targeting on the Fibroblast Growth Factor Receptor 3-Ribosomal S6 Kinase 2 Signaling Axis Prevents the Development of Rheumatoid Arthritis. Cell Death & Disease, 9, Article No. 401. https://doi.org/10.1038/s41419-018-0433-0
- 25. Yan, J.J., Gao, L., Qin, X.M. and Gao, L. (2020) Baicalein At-tenuates the Neuroinflammation in LPS-Activated BV-2 Microglial Cells through Suppression of Pro-Inflammatory Cy-tokines, COX2/NF-κB Expressions and Regulation of Metabolic Abnormality. International Immunopharmacology, 79, Article ID: 1060902. https://doi.org/10.1016/j.intimp.2019.106092
- 26. 张海丽, 游雷鸣, 刘慧, 刘欢苇, 周思瑶, 吴珺, 等. 汉黄芩素对 LPS和ATP 联合诱导的巨噬细胞炎症反应的抑制作用[J]. 中国免疫学杂志, 2019, 16(9): 1059-1063.
- 27. Sennikov, S.V., Vasilyev, F.F., Lopatnikova, J.A., Shkaruba, N.S. and Silkov, A.N. (2014) Poly-morphisms in the Tumor Necrosis Factor Receptor Genes Affect the Expression Levels of Membrane-Bound Type I and Type II Receptors. Mediators of Inflammation, 2014, Article ID: 745909. https://doi.org/10.1155/2014/745909
- 28. 霍苏, 崔鹤蓉, 顾昱昊, 戴子琦, 李文, 刘小靖, 韩娜娜, 马涛, 王鹏龙, 雷海民. 基于网络药理学探究丹参治疗慢性肝炎的作用机制[J]. 世界中医药, 2021, 16(20): 2992-2998.
- 29. 毛德文, 陈月桥, 王丽, 武建华. Caspase-8及Caspase-3与细胞凋亡[J]. 辽宁中医药大学学报, 2008, 10(10): 148-150.
- 30. 卢晓晔, 钟雪云. Caspases与细胞凋亡(综述) [J]. 暨南大学学报(自然科学与医学版), 2000, 21(6): 120-124.
- 31. Noack, M. and Miossec, P. (2017) Selected Cytokine Pathways in Rheumatoid Arthritis. Seminars in Immunopathology, 39, 365-383. https://doi.org/10.1007/s00281-017-0619-z
- 32. Caruso, R., Warner, N., Inohara, N. and Núñez, G. (2014) NOD1 and NOD2: Signaling, Host Defense, and Inflammatory Disease. Immuni-ty, 41, 898-908. https://doi.org/10.1016/j.immuni.2014.12.010
- 33. Strobe, R.W., Murray, P.J., Kitani, A. and Watanabe, T. (2006) Signaling Pathways and Molecular Interactions of NOD1 and NOD2. Nature Reviews Immunology, 6, 9-20. https://doi.org/10.1038/nri1747
- 34. 钟豪轩, 罗心平. 模式识别受体NOD2在心血管疾病中的研究进展[J]. 国际心血管病杂志, 2019, 46(4): 226-229.
- 35. Pisani, L.P., Estadella, D. and Ribeiro, D.A. (2017) The Role of Toll Like Receptors (TLRs) in Oral Carcinogenesis. Anticancer Research, 37, 5389-5394. https://doi.org/10.21873/anticanres.11965
- 36. Chen, Y., Wu, D. and Sun, L. (2020) Clinical Significance of High-Mobility Group Box 1 Protein (HMGB1) and Nod-Like Receptor Protein 3(NLRP3) in Patients with Ulcerative Colitis. Medical Science Monitor, 26, Article ID: e919530. https://doi.org/10.12659/MSM.919530
NOTES
*通讯作者。
