Material Sciences
Vol.08 No.04(2018), Article ID:24706,10
pages
10.12677/MS.2018.84046
High Performance of MWCNT/GO/CA Composite Membranes for MB Adsorption
Bin Qiao1, Yanhui Li1,2*, Qi Li1, Qiuju Du1, Kunyan Sui1, Dechang Wang2, Cuiping Wang2, Hongliang Li1, Yanzhi Xia1
1Laboratory of Fiber Materials and Modern Textile, The Growing Base for State Key Laboratory, Qingdao University, Qingdao Shandong
2College of Mechanical and Electrical Engineering, Qingdao University, Qingdao Shandong

Received: Mar. 29th, 2018; accepted: Apr. 21st, 2018; published: Apr. 28th, 2018

ABSTRACT
The multi-walled carbon nanotube/graphene oxide/calcium alginate composite membranes (MWCNT/GO/CA) were prepared by freeze drying and used as an effective adsorbent for the removal of methylene blue (MB) from aqueous solution. A batch adsorption experiments were carried out to investigate the effect of different parameters, such as the MWCNT and GO contents, initial dye concentration, solution pH, temperature, adsorbent dosage and contact time on adsorption performance of MWCNT/GO/CA. The physicochemical properties of MWCNT/GO/CA were characterized by Fourier transform infrared spectroscopy (FTIR) and scanning electron (SEM). The kinetics of MB onto MWCNT/GO/CA was well described by the pseudo-second order model. The adsorption equilibrium data were analyzed by using the Langmuir and Freundlich isotherm models and the results showed that adsorption data could be described reasonably well by the Langmuir isotherm. The maximum adsorption capacity was up to 2748.76 mg/g, indicating that MWCNT/GO/CA is a promising adsorbent for the removal of MB from aqueous solution.
Keywords:Carbon Nanotubes, GO, Calcium Alginate, Methylene Blue, Adsorption
高性能多壁碳纳米管/氧化石墨烯/海藻酸钙复合膜吸附亚甲基蓝
乔斌1,李延辉1,2*,李奇1,杜秋菊1,隋坤艳1,王德昌2,王翠苹2,李洪亮1,夏延致1
1青岛大学纤维新材料国家重点实验室培育基地,山东 青岛
2青岛大学机电工程学院,山东 青岛

收稿日期:2018年3月29日;录用日期:2018年4月21日;发布日期:2018年4月28日

摘 要
采用冷冻干燥法制备了多壁碳纳米管/氧化石墨烯/海藻酸钙(MWCNT/GO/CA)复合膜,并研究了其对亚甲基蓝(MB)的吸附性能。复合膜的物理化学性质通过SEM和FTIR等方式来进行表征分析。并研究了GO和MWCNT的含量、MB的初始浓度、溶液pH、温度、吸附剂的加入量和接触时间对吸附过程的影响。动力学研究表明复合膜对MB动态吸附数据遵循准二级动力学方程。采用Langmuir和Freundlich模型对吸附平衡数据进行了分析,结果表明吸附数据很好地遵循Langmuir和Freundlich吸附模型,通过计算得到的最大吸附量高达2748.76 mg/g,表明MWCNT/GO/CA是一种非常有应用前景的MB吸附材料。
关键词 :碳纳米管,氧化石墨烯,海藻酸钙,亚甲基蓝,吸附

Copyright © 2018 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
在过去的几十年中,随着工业的大力发展和经济的高速的增长,大量含有染料的废水被排放到水环境中,造成水体缺氧,严重影响水生生物和微生物的生长,进而破坏水体的自净能力,也对人们的日常生活和身体健康造成严重的威胁 [1] [2] 。亚甲基蓝(MB)是一种广泛应用于印刷业,造纸业,纺织业的有机合成染料。由于这种染料含有稳定的苯环结构,并具有一定的毒性。从环保的角度出发,必须采取有效的方法去除水中的亚甲基蓝。目前处理染料废水的方法主要有:膜分离法、离子交换法、化学沉淀法、电解法和吸附法等 [3] [4] [5] [6] 。在这些方法中,吸附法具有效率高,操作简单,成本低廉等特点被广泛使用 [7] [8] ,因此,制备高效、环境友好型的新型吸附材料就成为了当今世界范围内的研究热点 [9] 。
随着新型纳米材料的迅猛发展,纳米材料在污水处理中的应用与研究已经取得了显著的成果。海藻酸钠(SA)因其具有优良的生物相容性、无毒性、亲水性、成膜性、稳定性、价格低廉以及可生物降解的特性,目前已经被广泛的应用于食品业、环保业、农业、医药工业以及日用品行业等其他领域 [10] [11] 。
多壁碳纳米管(MWCNT)和氧化石墨烯(GO)因为具有独特的纳米结构、稳定的化学性质和高的比表面积,可以高效、快速地吸附金属离子和有机污染物,因此在污水处理等方面显示出巨大的应用潜力 [12] [13] [14] [15] 。
本文采用共混和冷冻干燥法制备了MWCNT/GO/CA复合膜。这种复合膜充分结合了MWCNT和GO的优异吸附性能以及SA的环境友好等特点,不仅可以高效的去除MB,而且避免了尺寸微小的MWCNT和GO对水体造成的二次污染。本文采用SEM和FTIR等技术对复合膜的物理化学性质进行了表征分析,并研究了GO和MWCNT的含量、MB的初始浓度、温度、溶液初始pH、吸附剂加入量和接触时间等因素对吸附性能的影响。
2. 实验
2.1. 主要原料和仪器
MWCNT:深圳市纳米 港有限公司;SA (1.05~1.15 Pa∙s):上海埃彼化学试剂有限公司;氯化钙(CaCl2):天津市广成化学试剂有限公司;亚甲基蓝:天津市广成化学试剂有限公司。
水浴恒温振荡器(SHZ-82A):上海双捷实验设备有限公司;紫外可见分光光度计(TU-1810):北京普析通用仪器有限公司;磁力搅拌器(85-2):上海双捷实验设备有限公司;电子天平(BSM224.4):上海卓京实验设备有限公司;冷冻干燥机(FD-1B-50):北京博医康实验仪器有限公司;电热鼓风干燥箱(101-1):龙口市电炉制造厂。
2.2. MWCNT/GO/CA复合膜的制备
将GO和MWCNT(GO:MWCNT的重量比分别为3:1,2:1,1:1,1:2,1:3)与SA以2:3的重量比混合,搅拌8 h至混合均匀,将混合液静置于表面皿中2 h去除气泡,然后将混合液置于冰箱(海尔BCD-215KAW,青岛)中冷冻12 h。用真空冷冻干燥机(FD-1-50,Boyikang实验室设备有限公司,北京,中国)对样品进行冷冻干燥成膜。将冷冻干燥后的薄膜置于0.5 M的CaCl2溶液中浸泡12 h形成MWCNT/GO/CA薄膜,再用去离子水洗去多余的Ca2+后进行自然干燥。
2.3. 吸附剂的表征
通过Nicolet 5700傅里叶变换红外光谱仪(FTIR)对MWCNT/GO/CA复合膜的表面官能团进行分析。采用TM-3000扫描电子显微镜(SEM)对复合膜的表面形貌进行表征。
2.4. 吸附实验
研究了GO和MWCNT的含量、MB的初始浓度、温度、溶液初始pH、吸附剂加入量和接触时间对MWCNT/GO/CA复合膜吸附MB的影响。
称取一定量的MB,配制浓度为1000 mg/L的MB溶液。并对不同浓度的染料溶液进行吸附,吸附平衡后,剩余的MB浓度采用紫外分光光度计进行测量。吸附的平衡容量qe(mg/g),在时间t(min)时的吸附容量和去除率r%用如下公式计算:
(1)
(2)
(3)
其中,c0代表亚甲基蓝的初始浓度,ce代表平衡浓度,ct代表的浓度,其单位均为mg/L。V(L)表示溶液的体积,W(g)表示吸附剂的重量。
3. 结果与讨论
3.1. 吸附剂的表征
图1(a)~(e)为不同GO和WMCNT比例复合膜的光学照片。由图可以看出这种复合膜具有密集的孔洞结构。随着GO和WMCNT的比例降低,其表面越来越粗糙,并且会有粉末脱落。所以后面的实验我
们都用GO:MWCNT = 3:1的比例来进行。
图2(a)~(e)为不同GO和WMCNT含量的扫描电镜图,从图中可以看出复合膜具有多孔结构而且其孔壁表面较为光滑。随着GO含量的不断增加,膜的表面逐渐出现沟壑和褶皱,这表明GO和MWCNT与SA成功的结合在了一起。大量的褶皱和沟壑的出现使复合膜的比表面积和吸附位点大大增加,十分有利于吸附的进行。
红外谱图(图3)显示,复合膜在3345,2922,1599,1419,和1028 cm−1处有吸收峰,分别对应于−OH的伸缩振动,C-H伸缩振动,O-H弯曲振动,羧基中C-OH的伸缩振动和C-O-C的伸缩振动。对比MWCNT/GO/CA复合膜与CA、GO和MWCNT的红外谱图可知,复合膜包含CA和GO的所有吸收峰,也有MWCN的特有基团,如1026 cm−1对应于MWCN中C-O-C的伸缩振动。
 (a) GO:MWCNT = 3:1; (b) GO:MWCNT = 2:1; (c) GO:MWCNT = 1:1; (d) GO:MWCNT = 1:2; (e) GO:MWCNT = 1:3
(a) GO:MWCNT = 3:1; (b) GO:MWCNT = 2:1; (c) GO:MWCNT = 1:1; (d) GO:MWCNT = 1:2; (e) GO:MWCNT = 1:3
Figure 1. Optical photos of the composite membranes with different GO and MWCNT ratios
图1. 不同GO和MWCNT比例的复合膜的光学照片
 (a) GO:MWCNT = 3:1; (b) GO:MWCNT = 2:1; (c) GO:MWCNT = 1:1; (d) GO:MWCNT = 1:2; (e) GO:MWCNT = 1:3
(a) GO:MWCNT = 3:1; (b) GO:MWCNT = 2:1; (c) GO:MWCNT = 1:1; (d) GO:MWCNT = 1:2; (e) GO:MWCNT = 1:3
Figure 2. SEM images of the composite membranes with different GO and MWCNT ratios
图2. 不同GO和WMCNT比例的复合膜的SEM图片
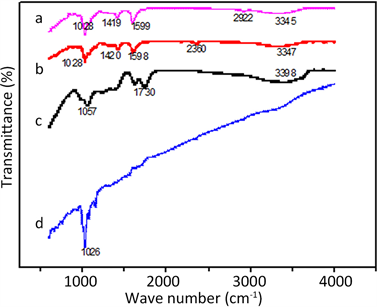
Figure 3. FTIR spectra of (a) MWCNT/GO/CA membrane; (b) CA; (c) GO; (d) MWCNT
图3. 红外谱图:(a) MWCNT/GO/CA复合膜;(b) CA;(c) GO;(d) MWCNT
3.2. 吸附性能研究
3.2.1不同GO和MWCNT比例对吸附性能的影响
图4为不同GO和MWCNT比例的复合膜对MB的吸附容量比较。从图中可以看出,在GO与MWCNT比例为3:1时,复合膜对MB的吸附容量为732.62 mg/g,随着GO与MWCNT比例的降低,吸附容量逐渐增加,在GO与MWCNT比例为0:1,吸附容量降至665.84 mg/g。在接下来的吸附实验中都选择GO:MWCNT = 3:1的复合膜作为吸附剂,并讨论其吸附性能。
3.2.2. 初始MB浓度和温度对吸附性能的影响
称取6份10 mg的MWCNT/GO/CA复合膜分别放入到20 mL不同浓度的MB溶液中,MB浓度分别为300、350、400、450、500、550 mg/L。将6组试样分别置于298、308、318 K的恒温水浴振荡器中振荡48 h至平衡。图5(a)显示随着MB初始浓度的增加,复合膜对MB的吸附容量也不断增加,在308 K时,当亚甲基蓝的浓度从300增加到550 mg/L时,吸附容量从545.36增加到976.70 mg/g,这是由于浓度梯度的驱动力增加造成的。由图5(a)可知,吸附容量随温度的增加而减小,当温度从298增加到318 K时,最大吸附容量从994.08降低到956.04 mg/g。这可能是由于过高的温度会削弱复合膜和染料分子之间的静电相互作用力。这就表明复合膜对亚甲基蓝的吸附是一个放热过程。
3.2.3. pH对吸附性能的影响
由图5(b)看出,当pH值从1.0增加到4.9时,去除率迅速增加。在低的pH值下,由于吸附过程中染料分子和氢离子之间对可用吸附位点存在竞争的关系,从而使染料的去除率较低 [16] 。随着pH进一步增加,吸附容量变化不大 [17] 。
3.2.4. 接触时间对吸附性能的影响
接触时间对于MWCNT/GO/CA吸附MB的影响如图5(c)所示。在初始阶段吸附容量迅速增加,随后逐渐减慢,直到平衡。这可能是由于在初始阶段有大量活跃的吸附位点。而随着时间的增加,吸附位点逐渐达到饱和,所以吸附容量逐渐减慢,直到平衡。
 (初始的亚甲基蓝浓度:300 mg/L,吸附剂量:10 mg,温度:303 K,pH:6.5)
(初始的亚甲基蓝浓度:300 mg/L,吸附剂量:10 mg,温度:303 K,pH:6.5)
Figure 4. The effect of different GO and MWCNT ratios on the adsorption properties of MWCNT/GO/CA
图4. 不同GO和MWCNT比例对MWCNT/GO/CA的吸附性能的影响
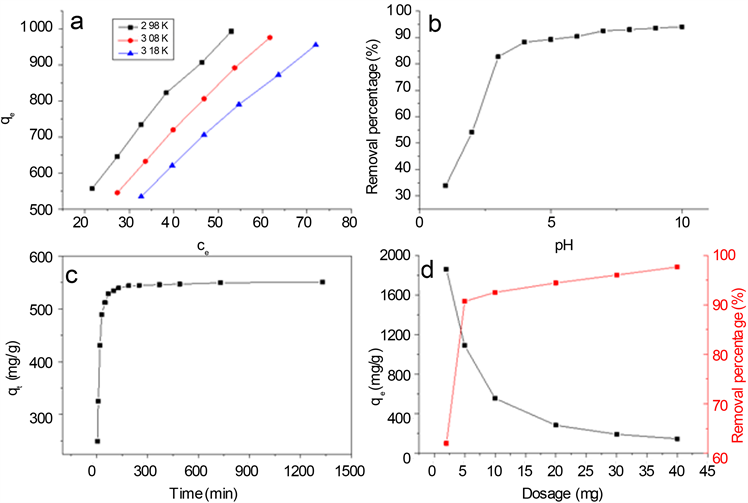
Figure 5. Effect of different experimental parameters on the adsorption: (a) The initial MB concentration and temperature effect; (b) The pH effect; (c) The contact time effect; (d) The dosage effect
图5. 不同实验参数对吸附性能的影响:(a) 初始MB浓度与温度的影响;(b) pH的影响;(c) 接触时间的影响;(d) 吸附剂量的影响
3.2.5. 吸附剂加入量对吸附性能的影响
MB的去除率随MWCNT/GO/CA复合膜的加入量增加而增加如图5(d)。这是因为吸附剂表面活跃的吸附位点和比表面积的增加。然而,在相同MB初始浓度条件下,随着吸附剂加入量的增加,单位质量吸附剂的吸附位点利用率降低,所以吸附容量随着吸附剂用量的增加而减少 [18] 。
3.3. 吸附等温线研究
吸附等温线模型常用来描述吸附质和吸附剂两者之间的相互作用和预测其吸附容量。Langmuir和Freundlich模型被用于拟合吸附数据。Langmuir模型是假定吸附发生在单分子层的均匀表面上来进行分析的。Langmuir模型的线性表达式为 [19] :
(4)
其中,qmax(mg/g)是最大吸附容量,kL(L/mg)是一个跟吸附过程中能量变化以及吸附质分子和吸附剂间相互作用的常数。通过Langmuir模型,可以得到一条线性曲线,如图6(a)所示,其中横轴是Ce,纵轴是Ce/qe。根据图中的曲线的斜率和截距可以得到qmax和kL的数值。通过Langmuir模型可以得出在293 K,303 K和313 K时的最大的理论吸附吸附容量分别为2748.76,2690.34和2184.37 mg/g。拟合相关系数R2 > 0.99,这表明实验数据与Langmuir模型拟合的很好,同时也意味着,单分子层吸附是吸附过程中的主要吸附机制。

Figure 6. (a) Langmuir model; (b) Freundlich model
图6. (a) Langmuir模型;(b) Freundlich模型
Freundlich模型的数学表达式如下 [20] :
(5)
其中kF是一个跟样品的吸附能力有关系的常数,1/n是一个跟吸附能力有关的常数,基于Freundlich模型我们可以得到一条线性曲线,如图6(b)所示,其中kF的数值可以通过截距和斜率计算得出。通过kF和n的值可以得知,温度的降低有利于吸附反应的进行。
从表1中的Langmuir和Freundlich模型参数中可以看出,所有的相关系数R2均大于0.98,说明两个吸附模型都能较好地拟合实验数据。
3.4. 吸附动力学
在吸附实验中,吸附动力学常用于描述吸附效率和解释吸附过程的控制机制。其中动力学模型Pseudo-first-order和Pseudo-second-order模型常被用来解释吸附行为。
Pseudo-first-order模型的数学表达式,如下所示 [21] :
(6)
其中,qe和qt是达到吸附平衡和在时间t(min)时的吸附容量(mg/g)。k1(1/min)是Pseudo-first-order模型吸附常数。k1和qe的数值可以通过log(qe-qt)对t拟合直线(图7(a))的斜率和截距进行计算(表2)。计算得到的相关系数R2仅为0.692。较低的相关系数说明动态吸附数据不符合Pseudo-first-order模型。
Pseudo-second-order模型的数学表达式,如下所示 [22] :
(7)
其中k2(1/min)是Pseudo-second-order 模型常数。k2和qe的数值可以通过t/qt对t的拟合直线(图7(b))的截距和斜率进行计算得到(表2)。Pseudo-second-order模型计算得到的相关系数(R2 = 0.9999)高于Pseudo-first-order模型的相关系数(R2 = 0.6924),说明动态吸附数据更符合准二级动力学方程。
3.5. 吸附热力学
为了研究温度对MB吸附性能的影响,焓(ΔH),熵(ΔS)等热力学参数可以通过Van’t Hoff公式计算 [23] :
(8)
吉布斯自由能(ΔG)可以通过如下公式计算:
(9)
其中T是绝对温度(K),R是通用气体常数(8.314 J/mol K)。将ln (qe/Ce)对1/T拟合成直线,斜率和截距就分别等于−ΔH/T和ΔS/R。
如表3所示,得到的焓变(ΔH = −23.67 kJ/mol)为负值,说明吸附反应是一个放热过程。吉布斯自由能(ΔG)为负值,表明复合膜对MB的吸附是一个自发的过程。当温度从298增加到318 K时,吉布斯自由能(ΔG)从−7.25升高到−6.62 kJ/mol,表明低温更有利于吸附。

Figure 7. Adsorption kinetic model: (a) Pseudo-first-order kinetic model; (b) Pseudo-second-order kinetic model
图7. 吸附动力学模型:(a) Pseudo-first-order模型;(b) Pseudo-second-order模型
Table 1. The parameters of the Langmuir and Freundlich models
表1. Langmuir和Freundlich模型参数
Table 2. The parameters of pseudo-first-order and pseudo-second-order kinetic models
表2. Pseudo-first-order model和Pseudo-second-order model参数
Table 3. Thermodynamic parameters at different temperatures
表3. 不同温度下热力学参数
4. 结论
采用冷冻干燥法制备了MWCNT/GO/CA复合膜,利用SEM和FTIR对其进行表征。通过讨论和分析吸附等温线,吸附动力学和热力学参数,探究了复合膜对MB吸附机制。实验结果表明,随着温度的升高,吸附剂和染料分子间的静电相互作用下降,导致MWCNT/GO/CA对MB的吸附容量会降低。随着pH值的减小,染料分子和氢离子对于吸附位点存在竞争关系,所以吸附容量会降低。动力学研究表明,Pseudo-second-order模型能更好的拟合动态吸附数据。吸附等温线研究表明,MWCNT/GO/CA对亚甲基蓝的吸附遵循Langmuir和Freundlich模型,在298 K时最大理论吸附量达到2748.76 mg/g。热力学研究表明,ΔG和ΔH的数值均为负值,所以吸附一个是自发的放热反应过程。
基金项目
国家自然科学基金(51672140),山东省自然科学基金(ZR2015EM038)和山东省泰山学者特聘专家(ts201511029)项目资。
文章引用
乔 斌,李延辉,李 奇,杜秋菊,隋坤艳,王德昌,王翠苹,李洪亮,夏延致. 高性能多壁碳纳米管/氧化石墨烯/海藻酸钙复合膜吸附亚甲基蓝
High Performance of MWCNT/GO/CA Composite Membranes for MB Adsorption[J]. 材料科学, 2018, 08(04): 412-421. https://doi.org/10.12677/MS.2018.84046
参考文献
- 1. Richardson, S.D., et al. (2007) Occurrence, Genotoxicity, and Carcinogenicity of Regulated and Emerging Disinfection By-Products in Drinking Water: A Review and Roadmap for Research. Mutation Research Reviews in Mutation Re-search, 636, 178-242.
https://doi.org/10.1016/j.mrrev.2007.09.001 - 2. Plewa, M.J., et al. (2004) Halonitrome-thane Drinking Water Disinfection Byproducts: Chemical Characterization and Mammalian Cell Cytotoxicity and Genotoxicity. Environmental Science & Technology, 38, 62-68.
https://doi.org/10.1021/es030477l - 3. Amin, N.K. (2009) Removal of Direct Blue-106 Dye from Aqueous So-lution Using New Activated Carbons Developed from Pomegranate Peel: Adsorption Equilibrium and Kinetics. Journal of Hazardous Materials, 165, 52-62.
https://doi.org/10.1016/j.jhazmat.2008.09.067 - 4. Bolto, B., et al. (2002) Removal of Natural Organic Matter by Ion Exchange. Water Research, 36, 50-57.
https://doi.org/10.1016/S0043-1354(02)00231-2 - 5. De-Bashan, L.E. and Bashan, Y. (2004) Recent Advances in Removing Phosphorus from Wastewater and Its Future Use as Fertilizer (1997-2003). Water Research, 38, 4222-4246.
https://doi.org/10.1016/j.watres.2004.07.014 - 6. Basha, C.A., et al. (2011) Heavy Metals Removal from Copper Smelting Effluent Using Electrochemical Filter Press Cells. Chemical Engineering Journal, 171, 563-571.
https://doi.org/10.1016/j.cej.2011.04.031 - 7. Apul, O.G. and Karanfil, T. (2015) Adsorption of Synthetic Organic Contaminants by Carbon Nanotubes: A Critical Review. Water Research, 68, 34.
https://doi.org/10.1016/j.watres.2014.09.032 - 8. Hokkanen, S., Bhatnagar, A. and Sillanpää, M. (2016) A Re-view on Modification Methods to Cellulose-Based Adsorbents to Improve Adsorption Capacity. Water Research, 91, 156.
https://doi.org/10.1016/j.watres.2016.01.008 - 9. Rocher, V., et al. (2008) Removal of Organic Dyes by Magnetic Alginate Beads. Water Research, 42, 1290-1298.
https://doi.org/10.1016/j.watres.2007.09.024 - 10. Zimmermann, H., Shirley, S.G. and Zimmermann, U. (2007) Alginate-Based Encapsulation of Cells: Past, Present, and Future. Current Diabetes Reports, 7, 314.
https://doi.org/10.1007/s11892-007-0051-1 - 11. Lee, P. and Rogers, M.A. (2012) Effect of Calcium Source and Exposure-Time on Basic Caviar Spherification Using Sodium Alginate. International Journal of Gastronomy & Food Science, 1, 96-100.
https://doi.org/10.1016/j.ijgfs.2013.06.003 - 12. Iijima, S. (1991) Helical Microtubules of Graphitic Carbon. Nature, 354, 56-58.
https://doi.org/10.1038/354056a0 - 13. Coleman, J.N., et al. (2006) Small but Strong: A Review of the Mechanical Properties of Carbon Nanotube-Polymer Composites. Carbon, 44, 1624-1652.
https://doi.org/10.1016/j.carbon.2006.02.038 - 14. Treacy, M.M.J., Ebbesen, T.W. and Gibson, J.M. (1996) Ex-ceptionally High Young’s Modulus Observed for Individual Carbon Nanotubes. Nature, 381, 678-680.
https://doi.org/10.1038/381678a0 - 15. Hummers Jr., W.S. and Offeman, R.E. (2003) Preparation of Graphitic Oxide. Journal of the American Chemical Society, 80, 1339.
- 16. Liu, L., et al. (2012) The Removal of Dye from Aqueous Solution Using Alginate-Halloysite Nanotube Beads. Chemical Engineering Journal, 187, 210-216.
https://doi.org/10.1016/j.cej.2012.01.136 - 17. Li, Y., et al. (2013) Methylene Blue Adsorption on Graphene Ox-ide/Calcium Alginate Composites. Carbohydrate Polymers, 95, 501-507.
https://doi.org/10.1016/j.carbpol.2013.01.094 - 18. Li, Y., et al. (2010) Removal of Lead from Aqueous Solution by Activated Carbon Prepared from Enteromorpha prolifera by Zinc Chloride Activation. Journal of Hazardous Mate-rials, 183, 583-589.
https://doi.org/10.1016/j.jhazmat.2010.07.063 - 19. Langmuir, I. (1918) The Adsorption of Gases on Plane Sur-faces of Glass, Mica and Platinum. Journal of Chemical Physics, 40, 1361-1403.
https://doi.org/10.1021/ja02242a004 - 20. Freundlich, H. (2017) Über die Adsorption in Lösungen. Zeitschrift für Physikalische Chemie, 57, 385-470.
- 21. Reddad, Z., et al. (2002) Adsorption of Several Metal Ions onto a Low-Cost Biosorbent: Kinetic and Equilibrium Studies. Environmental Science & Technology, 36, 2067-2073.
https://doi.org/10.1021/es0102989 - 22. Doğan, M., et al. (2006) Adsorption Kinetics of Maxilon Blue GRL onto Sepiolite from Aqueous Solutions. Chemical Engineering Journal, 124, 89-101.
https://doi.org/10.1016/j.cej.2006.08.016 - 23. Neghlani, P.K., Rafizadeh, M. and Taromi, F.A. (2011) Preparation of Aminated-Polyacrylonitrile Nanofiber Membranes for the Adsorption of Metal Ions: Comparison with Microfibers. Journal of Hazardous Materials, 186, 182-189.
https://doi.org/10.1016/j.jhazmat.2010.10.121
