Advances in Clinical Medicine
Vol.
10
No.
12
(
2020
), Article ID:
39219
,
8
pages
10.12677/ACM.2020.1012450
延安地区妊娠期妇女甲状腺激素 水平参考范围的建立及甲状腺 功能分析
夜雪敏1,王悦1,齐微1,王哲1,张宁梅2,李芳芹2*
1延安大学医学院,陕西 延安
2延安大学附属医院检验科,陕西 延安

收稿日期:2020年11月21日;录用日期:2020年12月11日;发布日期:2020年12月18日

摘要
目的:建立延安地区不同妊娠期妇女特异性甲状腺功能指标的参考范围,为本地区妊娠期妇女甲状腺疾病的诊治及管理提供依据。方法:选择2019年1月至12月在延安大学附属医院产科门诊健康体检的妊娠妇女1026例,作为本研究妊娠期甲状腺激素水平参考范围的“标准人群”,选择同期门诊孕前检查的育龄期非妊娠期妇女311例作为对照。化学发光法检测受检者血清TSH、FT4、FT3、TG-Ab、TPO-Ab水平,中位数(M)及双侧限值95% (P 2.5~P 97.5)建立甲状腺功能指标的参考范围。结果:1) 妊娠早期血清TSH、FT4、FT3分别为:(0.07~4.62) mIU/L,(11.76~21.59) pmol/L,(3.57~5.85) pmol/L;妊娠中期TSH、FT4、FT3分别为(0.13~4.89) mIU/L,(10.53~19.53) pmol/L,(3.25~5.49) pmol/L;妊娠晚期TSH、FT4、FT3分别为:(0.36~5.69) mIU/L,(8.39~16.88) pmol/L;(2.63~4.89) pmol/L。血清TSH在孕早期较低,随妊娠周数的增加而上升,至孕晚期达高峰,妊娠期与非妊娠期比较,不同妊娠期组内比较,均呈升高趋势,差异有统计学意义(P < 0.01),血清FT4在孕早期较非孕期高,此后随妊娠周数增加而下降,至孕晚期降至最低水平,各组内比较血清FT4降低趋势有统计学差异(P < 0.01);血清FT3在孕早期和孕前相当(P > 0.05),此后随着妊娠周数的增加而降低,至孕晚期达最低,各组降低趋势有统计学意义(P < 0.01);2) 按本研究建立的妊娠期参考值范围诊断标准:妊娠期甲减、亚甲减、甲亢、亚甲亢、低甲状腺素血症的总患病率(N%)约为0.58%、7.12%、0.58%、1.36%、2.05%。结论:延安地区妊娠期妇女血清甲状腺激素水平与非妊娠期存在差异,不同妊娠期妇女血清甲状腺激素水平呈现地区特异性变化。建立本地区甲状腺激素水平参考范围,以有效减少妊娠期甲状腺疾病的漏诊和误诊。
关键词
妊娠期,甲状腺激素,参考范围

Establishment of Reference Range of Thyroid Hormone Levels of Pregnant Women in Yan’an Area and Analysis of Thyroid Function
Xuemin Ye1, Yue Wang1, Wei Qi1, Zhe Wang1, Ningmei Zhang2, Fangqin Li2*
1School of Medicine, Yan’an University, Yan’an Shaanxi
2Department of Laboratory Medicine, Affiliated Hospital of Yan’an University, Yan’an Shaanxi

Received: Nov. 21st, 2020; accepted: Dec. 11th, 2020; published: Dec. 18th, 2020

ABSTRACT
Objective: To establish the reference peripheries of the specific thyroid function indexes of different pregnant women in Yan’an area, so as to provide the basis for the diagnosis, treatment and management of thyroid diseases in pregnant women in this area. Methods: A total of 1026 pregnant women who had a healthy physical examination in the obstetrical clinic of Yan’an University Affiliated Hospital from January to December 2019 were selected as the “standard population” for the reference range of thyroid hormone levels during pregnancy established in this study, and the childbearing age for pre-pregnancy examinations in the outpatient clinic during the same period was selected. 311 non-pregnant women served as controls. Chemiluminescence method was used to detect serum TSH, FT4, FT3, TG-Ab, TPO-Ab levels, median (M) and bilateral limit 95% (P 2.5 - P 97.5) to establish the reference range of thyroid function indexes Results: 1) Serum TSH, FT4 and FT3 in early pregnancy were: (0.07 - 4.62) mIU/L, (11.76 - 21.59) pmol/L, (3.57 - 5.85) pmol/L; TSH, FT4, FT3 in the second trimester They are (0.13 - 4.89) mIU/L, (10.53 - 19.53) pmol/L, (3.25 - 5.49) pmol/L; TSH, FT4 and FT3 in the third trimester are: (0.36 - 5.69) mIU/L, (8.39 - 16.88) pmol/L; (2.63 - 4.89) pmol/L. The median serum TSH is lower in the first trimester, and rises with the increase in the number of weeks of pregnancy, reaching a peak in the third trimester and exceeding the non-pregnancy level; comparisons between the pregnancy period and the non-pregnancy period, and the comparison within different pregnancy periods, all show an increase high trend, the difference was statistically significant (P < 0.01). The median serum FT4 was higher in the first trimester than in the non-pregnancy period, and then decreased with the increase in the number of weeks of pregnancy, and reached the lowest level in the third trimester. Compare serum FT4 in each group, the decreasing trend was statistically different (P < 0.01); the median serum FT3 was the same in the first trimester and before pregnancy, and then decreased with the increase in the number of weeks of pregnancy, and reached the lowest point in the third trimester. The difference between the groups was statistically significant (P < 0.01); 2) According to the diagnostic criteria of the pregnancy reference value range established in this study: the total prevalence (N%) of hypothyroidism, hypothyroidism, hyperthyroidism, hyperthyroidism, and hypothyroxinemia during pregnancy is about 0.58%, 7.12%, 0.58%, 1.36%, 2.05%. Conclusion: The serum thyroid hormone levels of pregnant women in Yan’an are different from those in non-pregnant women, and the serum thyroid hormone levels of women in different pregnancy periods show regional specific changes. Establish the reference range of the laboratory in this region to effectively reduce the missed diagnosis and misdiagnosis of thyroid diseases during pregnancy.
Keywords:Pregnancy, Thyroid Hormone, Reference Range

Copyright © 2020 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
甲状腺激素在人体的生长、发育过程中发挥着重要作用,正常的甲状腺功能对于胎儿及母体的健康至关重要。妊娠期甲状腺疾病发病率逐年上升,近年来已成为内分泌学及围产医学关注的热点领域。妊娠期甲状腺功能异常可对母体及胎儿造成不良影响,增加不良妊娠结局的风险,包括妊娠期糖尿病、妊娠期高血压、胎盘异常、流产、早产和低出生体重等 [1] [2]。妊娠期女性甲状腺激素分泌受下丘脑–垂体–甲状腺/胎盘轴的调节使得妊娠期甲状腺激素水平与非孕期存在差异 [3],采用非妊娠期妇女的甲状腺功能参考范围评估妊娠妇女的甲状腺功能可导致漏诊及误诊。2019年中华医学会内分泌及围产学会制定的《妊娠期及产后甲状腺疾病诊治指南》 [4] (第2版)以下简称(2019年中国指南)及2017美国甲状腺学会(American thyroid association, ATA)发布的《妊娠期及产后甲状腺疾病诊治指南》 [5] (以下简称2017ATA指南)均建议建立地区特异性甲状腺激素水平参考范围。目前延安地区尚无妊娠期孕周特异性的甲状腺功能参考值范围的研究。本研究通过对妊娠早、中、晚期孕妇血清甲状腺激素进行检测,初步建立本地区的妊娠期特异的甲状腺功能参考值范围,探讨妊娠期甲状腺激素的变化规律,并使用本研究建立参考值范围与2019年中国指南标准 [4] 及2011年ATA标准 [6] 筛查甲功异常患病率比较,现将结果报道如下。本研究获得研究对象的知情同意,并通过本院伦理委员会的审批。
2. 资料与方法
2.1. 研究对象
纳入2019年1月至12月在延安大学附属医院产科门诊建档的健康体检的妊娠妇女1026例作为研究组,选择同期门诊孕前检查的育龄期非妊娠期女性311例作为对照组。
依据美国国家临床生化研究院(National academy of clinical biochemistry, NACB)推荐的研究方法 [7] 制定研究组纳入标准:1) 育龄期单胎、头位妊娠妇女,年龄20~40岁;2) 既往无不良孕产史;3) 甲状腺抗体阴性(在本院实验室参考范围之内);4) 延安地区常住居民(居住时间大于5年);5) 无妊娠期剧吐、流产、胎位异常,无妊娠期糖尿病、高血压、先兆子痫及其他妊娠期合并症;6) 既往无其他疾病,如心脏病、高血压、糖尿病、系统性红斑狼疮及其他自身免疫病等。
研究组排除标准:1) 流产或不良妊娠者,双胎及多胎妊娠者;2) 既往有甲状腺疾病个人史及家族史者;3) 有可见、可触及或超声可见甲状腺结节者;4) 既往服用过影响甲状腺激素水平药物者(雌激素除外);5) 抗甲状腺过氧化物酶抗体(hyroid peroxidase thyroglobulin auto-antibody, TPOAb)、抗甲状腺球蛋白抗体(hyroid peroxidase thyroglobulin auto-antibody, TGAb)阳性(高于本院实验室参考范围的上限)者。
对照组入选标准:1) 无不孕病史;2) 月经周期规律;3) 无甲状腺疾病家族史及其他的免疫性疾病;4) 无服用影响甲状腺功能的药物;5) 甲状腺触诊及超声检查无肿大及异常结节;6) 甲状腺相关抗体 (TPOAb、TGAb及TRAb)阴性(低于本院实验室参考范围的上限)者。
2.1.1. 研究对象分组
早孕组(妊娠1~12 + 6) 298例,平均年龄(29.29 ± 4.03)岁;中孕组(妊娠13~27 + 6) 411例,平均年龄(29.37 ± 4.14)岁;晚孕组(妊娠28~40) 317例,平均年龄(29.67 ± 4.27)岁;对照组311例,平均年龄(29.32 ± 4.26)岁。
2.2. 实验方法
2.2.1. 标本采集
研究对象均清晨空腹肘静脉采血5 ml于促凝管中,室温静置30 min,3500 r/min离心10 min,分离血清后使用全自动化学发光仪检测血清促甲状腺激素(TSH)、游离甲状腺素(FT4)、游离三碘甲状原氨酸(FT3)、抗甲状腺球蛋白抗体(TGAb)、抗甲状腺过氧化酶抗体(TPOAb)水平,所有血清标本检测均在样本离心后当天完成,严格按照仪器及试剂说明书操作标准执行。本实验室按照厂家提供的质控标准品进行室内质控,批间变异率 < 5%。
2.2.2. 仪器及试剂
美国西门子全自动化学发光仪,型号ADVIA Centaur xp,所用试剂为厂家配套试剂,试剂编号06490106有效期至2020年12月6日。
2.3. 离群值处理
数据处理前再次对1034个数据进行审查,发现21例“可疑离群值”,参考美国临床实验室标准化文件《临床实验室如何确定、建立和验证参考区间;批准指南–第3版》(CLSI C28-A3) [8] 的要求,即1/3规则,将疑似离群点和其相邻点的差值D与数据全距R相比,若D/R ≥ 1/3则该点判定为离群点,予以剔除。最终发现8个点的D/R值为 > 1/3,即该点为离群点,予以剔除,其他13个疑似离群点D/R值均 < 1/3,予以保留,最终纳入观察组1026例。
2.4. 统计学处理
数据录入Excel表,采用SPSS25.0软件进行统计学分析;采用Kolmogorov⁃Smimov检验方法对年龄、血清FT3、FT4及TSH值做正态性检验,计量资料中呈正态分布的指标,其结果采用均数±标准差表示,组间及组内比较采用两独立t检验及单因素方差分析;呈非正态分布的指标,其结果使用中位数及双侧限值表示,即参考范围采用中位数及双侧限制95% (P 2.5~P 97.5)表示,组间或组内比较采用kruskal-Wallis H检验,率的比较采用χ2检验,p < 0.05为差异有统计学意义。
3. 结果
3.1. 观察组各组与对照组一般资料的比较
观察组各组与对照组的年龄比较差异无统计学意义(P > 0.05),不同妊娠期组内年龄比较无统计学差异(P > 0.05),孕早期、孕中期、孕晚期平均孕周分别为9.21 ± 2.53周、18.24 ± 2.61周、28.31 ± 3.12周。见表1。
3.2. 四组研究对象血清甲功参考范围及中位数变化趋势
以中位数及双侧限值95% (P 2.5~P 97.5)作为参考范围,得出孕妇不同孕期及非妊娠期妇女血甲状腺功能的参考范围(表2)。以对照组及不同孕期组为横坐标,所测得TSH、FT4、FT3水平中位数作为纵坐标绘制不同孕期甲状腺激素变化趋势图(图1)。血清TSH在孕早期较低,随妊娠周数的增加而上升,至孕晚期达最高,孕早、中、晚期较非孕期,孕中、晚期较孕早期,孕晚期较孕中期均呈逐渐升高趋势,差异有统计学意义(P < 0.01);血清FT4在孕早期较高,并略高于非孕期,差异有统计学意义(P < 0.05);此后随妊娠周数增加而下降,至孕晚期分别降至最低水平,不同妊娠期组内比较,血清FT4降低水平有统计学差异(P < 0.01);血清FT3在孕早期和孕前相当,两者比较无明显统计学差异(P > 0.05),孕早期后随着妊娠周数的增加而降低,至孕晚期达最低,三组妊娠期组内比较,FT3均呈减低趋势,差异有统计学意义(P < 0.05)。
Table 1. General information description in each group
表1. 各组一般资料描述表
注:同对照组年龄比较p > 0.05,T1、T2、T3组组内年龄比较p > 0.05。
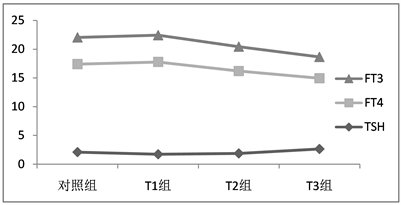
Figure 1. Trend of TSH, FT4, FT3 median change in each group
图1. 不同组TSH、FT4、FT3中位数变化趋势
Table 2. Reference range of thyroid function indexes in different pregnancy periods and control group M [p 2.5, p 97.5]
表2. 不同孕期及对照组甲功指标的参考范围M [p 2.5, p 97.5]
注:与对照组比较aP < 0.05;与早孕组比较bP < 0.05;与中孕组比较cP < 0.05。
3.4. 不同参考值范围下妊娠甲状腺疾病患病率情况
使用本研究建立的参考值范围标准、2011ATA标准及2019年中国指南标准(罗氏)分别对1026例妊娠期正常女性进行甲状腺疾病筛查,并对检出率进行比较。结果显示,按本研究建立的妊娠期参考值范围:妊娠期甲减、亚甲减、甲亢、亚甲亢、低甲状腺素血症的总患病率(N%)约为0.58%、7.12%、0.58%、1.36%、2.05%。按2019年中国指南参考范围标椎:妊娠期甲减、亚甲减、甲亢、亚甲亢、低甲状腺素血症的总患病率(N%)约为1.65%、4.19%、1.30%、6.82%、2.38%。按2011ATA参考值范围标准:妊娠期甲减、亚甲减、甲亢、亚甲亢、低甲状腺素血症的总患病率(N%)约为2.31%、23.87%、2.14%、0.87%、0.58%。三种不同标准下甲状腺疾病患病率的比较具有显著差异(χ2 = 313.62、358.2, P均 = 0.000 < 0.01),见表3。
Table 3. Comparison of abnormal detection rates of thyroid diseases under different diagnostic criteria [n%]
表3. 不同诊断标准下甲状腺疾病异常检出率的比较[n%]
注:*表示该标准下甲状腺疾病检查率与本研究标准比较p < 0.01。
4. 讨论
甲状腺激素是维持人体生长发育的重要激素,妊娠期母体和胎儿对甲状腺激素的需求增加以及妊娠期内分泌的变化,使得妊娠期甲状腺疾病的发病率高于非妊娠期女性。研究报道,全球范围内总体发病率为15% [3]。甲状腺激素分泌不足会增加不良妊娠结局的风险,如流产、死产及妊娠期并发症 [1] [2];同时对子代远期智力和运动发育产生负面影响 [9]。因此,妊娠期甲状腺功能检查及甲状腺功能异常的诊治和管理对于孕期保健及优生优育起到重要的作用。
妊娠早期胎盘分泌人绒毛膜促性腺激素(hCG)增加,通常在妊娠8~10周达到高峰,因其α亚单位与促甲状腺激素(TSH)相似,具有刺激甲状腺的作用。使血清TSH水平较非妊娠妇女水平低,血清hCG水平升高及TSH水平降低发生在妊娠8~14周,妊娠10~12周是TSH下降的最低点;妊娠中期血清TSH逐渐升高,妊娠晚期甚至会高于普通人群。FT4在妊娠早期因hCG的作用而升高,可高于普通人群参考范围上限。王欣 [10] 等学者认为,妊娠中晚期由于母体血容量增加、脱碘酶活性增加以及尿碘排泄增多使得母体碘缺乏,FT4逐渐下降,进而反馈性引起TSH升高。本实验建立的妊娠期参考范围为:妊娠早、中、晚期TSH分别为:1.72 (0.07~4.62) mIU/L,1.87 (0.13~4.89) mIU/L,2.65 (0.36~5.69) mIU/L;FT4分别为:16.05 (11.76~21.59) pmol/L,14.32 (10.53~19.53) pmol/L,12.29 (8.39~16.88) pmol/L;FT3分别为:4.66 (3.57~5.85) pmol/L,4.25 (3.25~5.49) pmol/L,3.72 (2.63~4.89) pmol/L。血清TSH中位数在孕早期较低,随妊娠周数的增加而逐渐上升,至孕晚期达最高,并高于非孕期水平;血清FT4中位数在孕早期较高,并略高于非孕期,此后均随妊娠周数增加而下降,至孕晚期分别降至最低水平。血清FT3中位数孕早期和孕前相当,孕早期后随着妊娠周数的增加而逐渐降低,至晚孕达最低。此结果及变化符合甲状腺激素生理变化特征,并与国内学者研究基本一致 [11] [12] [13]。
本研究根据NACB标准建立的本地区妊娠早期血清TSH的上限值为4.62 mIU/L,高于同研究的欧洲报道的数值3.44 mIU/L和美国报告的数值3.39 mIU/L [14] [15];与国内长江地区陈永梅等 [16] 实验结果基本一致,但明显高于衢州等沿海地区 [17] [18]。这提示妊娠期女性甲状腺激素存在明显种族、地域差异;其差异可能为生活习惯和碘营养状况的不同,同时检测方法、仪器及试剂不同结果也不尽相同。国内徐清芳等 [19] 对比三种不同全自动化学发光仪(德国西门Advia Centaur XP、美国贝克曼DXI800、意大利Liaison XL索灵)得出不同仪器诊断符合率不同。因此建立本地区特异性妊娠期甲状腺功能很有必要。
按本研究建立的妊娠期参考值范围妊娠期甲减、亚甲减、甲亢、亚甲亢、低甲状腺素血症的总患病率(N%)约为0.58%、7.12%、0.58%、1.36%、2.05%。采用2011年ATA标准及2019年中国指南标准在甲状腺功能异常检出率上具有明显统计学差异,可能造成妊娠期甲状腺疾病漏诊及过度诊断,从而可能增加产妇不必要的心理压力及过度诊断及治疗。相比而言,本研究建立的孕早期参考值范围更接近2019年中国罗氏指南的参考值上界4.52 mIU/L [4]。
本研究初步建立了延安地区妊娠期甲状腺参考值范围,同时对比2011年ATA、2019年最新版中国《妊娠和产后甲状腺疾病诊治指南》推荐值研究,结果表明指南推荐值可能并不适用于本地区的孕妇人群。同时,本研究有一定的局限性,主要为单个医院的研究,未能纳入其他医院就诊的妊娠妇女;今后的研究将进一步扩大样本量,纳入本地区其他多家医院研究,同时检测女性妊娠期碘营养状态,更科学的为本地区妊娠期甲状腺疾病的诊治提供依据。
综上所述,建立延安地区妊娠期特异性甲状腺激素参考范围,可准确反映本地区妊娠妇女的甲功状态,为妊娠妇女甲状腺疾病的诊断、治疗和监测提供了科学的依据,减少甲功异常的漏诊和误诊,减少不良妊娠结局的发生。
基金项目
延安市产业关键核心技术创新项目(SL2019ZCSY-103)。
文章引用
夜雪敏,王 悦,齐 微,王 哲,张宁梅,李芳芹. 延安地区妊娠期妇女甲状腺激素水平参考范围的建立及甲状腺功能分析
Establishment of Reference Range of Thyroid Hormone Levels of Pregnant Women in Yan’an Area and Analysis of Thyroid Function[J]. 临床医学进展, 2020, 10(12): 2991-2998. https://doi.org/10.12677/ACM.2020.1012450
参考文献
- 1. 修子冉, 吴君, 李欣宇. 妊娠合并亚临床甲状腺功能减退症的早期治疗对妊娠结局的影响分析[J]. 中国实用医药, 2020, 15(22): 139-141
- 2. Maraka, S., Ospina, N.M., O’Keeffe, D.T., et al. (2016) Subclinical Hypothyroidism in Pregnancy: A Systematic Review and Meta-Analysis. Thyroid, 26, 580-590. https://doi.org/10.1089/thy.2015.0418
- 3. 喻昆林, 宫芸, 于南南, 等. 昆明地区不同妊娠期甲状腺激素水平参考范围的建立及临床分析[J]. 现代妇产科进展, 2020, 29(1): 51-54
- 4. 《妊娠和产后甲状腺疾病诊治指南》(第2版)编撰委员会, 中华医学会内分泌学分会, 中华医学会围产医学分会.妊娠和产后甲状腺疾病诊治指南(第2版) [J]. 中华内分泌代谢杂志, 2019, 35(8): 636-665.
- 5. Alexander, E.K., Pearce, E.N., Brent, G.A., et al. (2017) Guidelines of the American Thyroid Association for the Diagonsis and Management of Thyroid Disease during Pregnancy and the Postpartum. Thyroid, 27, 31. https://doi.org/10.1089/thy.2016.0457
- 6. StagnaroGreen, A., Abalovich, M., Alexander, E., et al. (2011) Guidelines of the American Thyroid Association for the Diagnosis and Management of Thyroid Disease during Pregnancy and Postpartum. Thyroid, 21, 1081-1125. https://doi.org/10.1089/thy.2011.0087
- 7. Baloch, Z., Carayon, P., Conte-Devolex, B., et al. (2003) Laboratory Medicine Practice Guidelines. Laboratory Support for the Diagnosis and Monitoring of Thyoid Disease. Thyroid, 13, 3-126.
- 8. Horowitz, G.L., Altaie, S., Boyd, J.C., et al. (2010) Defining, Establishing, and Verifying Reference Intervals in the Clinical Laboratory, Approved Guideline. 3rd Edition, Clinical and Laboratory Standards Institute Document.
- 9. Su, P.Y., Huang, K., Hao, J.H., et al. (2011) Maternal Thyroid Function in the First Twenty Weeks of Pregnancy and Subsequent Fetal and Infant Development: A Prospective Population-Based Cohort Study in China. Journal of Clinical Endocrinology and Metabolism, 96, 3234-3241. https://doi.org/10.1210/jc.2011-0274
- 10. 王欣. 妊娠期甲状腺功能的生理改变[J]. 实用妇产科杂志, 2006(10): 577-578.
- 11. 蔡文倩, 胡晞江, 姚婷, 等. 武汉地区不同妊娠期女性血清甲状腺激素参考范围的建立[J]. 实用医学杂志, 2017, 33(24): 4082-4086.
- 12. 夏伟, 张春艳, 向腾霄, 等. 成都地区妊娠妇女特异性甲状腺激素参考范围的建立及甲状腺功能异常的筛查[J]. 重庆医学, 2019, 48(22): 3807-3810.
- 13. 金项果, 李磊. 永康地区正常妊娠妇女甲状腺功能指标参考值的研究[J]. 中国卫生检验杂志, 2020, 30(8): 953-956.
- 14. Mannisto, T., Surcel, H.M., Ruokonen, A., et al. (2011) Early Pregnancy Reference Intervals of Thyroid Hormone Concentrations in a Thyroid Antibody—Negative Pregnant Population. Thyroid, 21, 291-298. https://doi.org/10.1089/thy.2010.0337
- 15. Mannisto Joosen, A.M., van der Linden, I.J., de Jong-Aarts, N., et al. (2016) TSH and FT4 during Pregnancy: An Observational Study and a Review of the Literature. Clinical Chemistry and Laboratory Medicine, 54, 1239-1246. https://doi.org/10.1515/cclm-2015-0629
- 16. 陈永梅, 范荣梅, 龚兴瑞. 湖北省十堰市不同孕期血清甲状腺功能指标参考值建立[J]. 检验医学与临床, 2019, 16(20): 2939-2942.
- 17. 苏小苗. 惠州地区妊娠三期特异性甲状腺激素水平的参考值范围建立[J]. 中国地方病防治杂志, 2019, 34(6): 616-619.
- 18. 郑美霞, 王小红, 朱映, 等. 衢州地区孕妇甲状腺激素水平分析及参考区间的建立[J]. 中国妇幼保健, 2019, 34(22): 5110-5112.
- 19. 徐清芳, 张美华, 姚文杰, 等. 不同化学发光免疫分析系统检测亚临床甲状腺功能减退症血清促甲状腺素的对比研究[J]. 实用医技杂志, 2019, 26(9): 1140-1141.
NOTES
*通讯作者。
