Advances in Clinical Medicine
Vol.
12
No.
05
(
2022
), Article ID:
51239
,
6
pages
10.12677/ACM.2022.125557
误诊多年的原发性醛固酮增多症1例
石梦瑶,孙桂荣*
青岛大学附属医院检验科,山东 青岛
收稿日期:2022年4月11日;录用日期:2022年5月6日;发布日期:2022年5月13日

摘要
患者男,60岁,因情绪激动后出现胸闷、憋气半年余,伴有心慌、头晕、头痛收住我院心血管内科,既往高血压病史13年,规律服用“缬沙坦氨氯地平片”降压,血压控制不佳,最高为200/100 mmHg,“蛛网膜下腔出血颅内动脉瘤栓塞术后”10年,“右眼视网膜脱离”病史半年。否认吸烟饮酒史、心血管疾病及早发性高血压病家族史。入院检查心率65次/分,血压155/99 mmHg,一般情况及常规查体阴性,检验检查结果示血钾1.6 mmol/L,血钠147.8 mmol/L,尿液分析示PH 6.0,血浆醛固酮水平立位511 pg/mL、卧位655 pg/mL均升高,血浆肾素活性立位0 ng/mL/hr、卧位0 ng/mL/hr均降低,醛固酮/肾素活性比值(ARR)立位51.1、卧位65.5均升高,肾上腺CT动态增强扫描示双侧肾上腺见低密度结节影,考虑肾上腺皮质腺瘤所致的原发性醛固酮增多症,然后转泌尿外科行后腹腔镜下左肾上腺切除术,术后病理诊断为肾上腺皮质腺瘤,术后2周随访血浆醛固酮、血钾、血钠等生化指标水平均在正常范围,血压正常。
关键词
原发性醛固酮增多症,肾上腺腺瘤,高血压,低血钾

A Case of Primary Aldosteronism Misdiagnosed for Many Years
Mengyao Shi, Guirong Sun*
Department of Clinical Laboratory, The Affiliated Hospital of Qingdao University, Qingdao Shandong
Received: Apr. 11th, 2022; accepted: May 6th, 2022; published: May 13th, 2022

ABSTRACT
A 60-year-old male patient was admitted to the Department of Cardiovascular Medicine of our hospital because of chest tightness and suffocation for more than half a year after emotional agitation, accompanied by palpitation, dizziness and headache. He has a history of hypertension for 13 years and has been regularly taking “valsartan amlodipine tablets” for hypotensive for many years. His blood pressure has never been well controlled during the medication, with the highest value being 200/100 mmHg, with 10 years after intracranial aneurysm embolization for subarachnoid hemorrhage, and half a year after retinal detachment in the right eye. The patient denied smoking and drinking history, family history of cardiovascular disease and early onset hypertension. On admission, heart rate was 65 times/min, blood pressure was 155/99 mmHg, general condition and conventional physical examination were negative. The results of blood potassium and blood sodium were 1.6 mmol/L and 147.8 mmol/L, respectively. Urine analysis showed PH 6.0, and plasma aldosterone levels increased in vertical position 511 pg/mL and recubitus position 655 pg/mL respectively. The plasma renin activity was decreased by 0 ng/mL/hr in vertical position and 0 ng/mL/hr in recubitus position, and the aldosterone/renin activity ratio (ARR) was increased by 51.1 in vertical position and 65.5 in recubitus position. Dynamic enhanced adrenal CT scan showed low-density nodular opacity in both adrenal glands, which was considered as primary aldosteronism caused by adrenal cortical adenoma. Then, the patient was transferred to the urology department for retroperitoneal laparoscopic left adrenal gland resection, which was pathologically diagnosed as adrenal cortical adenoma. The plasma aldosterone, blood potassium, blood sodium and other biochemical indexes were all in the normal range and blood pressure was normal 2 weeks after surgery.
Keywords:Primary Aldosteronism, Adrenal Adenoma, High Blood Pressure, Hypokalemia

Copyright © 2022 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
原发性醛固酮增多症(primary aldosteronism, PA)简称原醛症,是指肾上腺皮质发生病变引起的醛固酮分泌增多,导致潴钠排钾、体液容量扩增、肾素–血管紧张素系统受抑制,表现为高血压、低血钾的临床综合征。研究表明,大量醛固酮可导致心脑血管系统、肾功能受损,相对于原发性高血压患者,PA患者心脑血管及肾脏损伤更为严重,过去认为PA患病率较低,仅占高血压病人的0.4%~0.2%,但随着筛查及诊断技术的提升,现有数据表明,我国因高血压就诊的患者中PA检出率高达10.7% [1],国外数据显示,在1、2、3级高血压患者中PA的检出率分别为1.99%、8.02%和13.2% [2],因此,早诊早治尤为重要,我们报道1例长期处于难以控制的高血压状态,并伴严重低钾血症和心脏及视网膜功能损害的继发性高血压病例,旨在提高临床医生对本病的认识,及时发现导致高血压病的继发因素,提高PA检出率,以减少继发性高血压的漏诊率和原发性高血压的误诊率。
2. 临床资料
2.1. 一般资料
患者老年男性,因“胸闷、憋气半年”就诊我院心内科门诊,并收住我院心血管内科病房进一步诊断和治疗。患者半年前于情绪激动后反复出现胸闷、憋气,伴心慌、头晕、头痛,情绪平稳及服用“速效救心丸”后约10分钟缓解,期间未就医系统诊治。入院查体:体温36.7℃,脉搏65次/分,呼吸18次/分,血压155/99 mmHg,心肺腹查体阴性。既往“高血压”病史13年,最高为200/100 mmHg,多年来规律服用“缬沙坦氨氯地平片”降压,在服用药物期间血压从未得到很好的控制,“蛛网膜下腔出血颅内动脉瘤栓塞术后”10年,“右眼视网膜脱离”病史半年,否认吸烟饮酒史、心血管疾病及早发性高血压病家族史。
2.2. 检验检查及结果
患者入院后完善血、尿、便常规、血糖、血脂、电解质、肝肾功能、甲状腺功能、心衰和心肌损伤指标NT-proBNP、高敏肌钙蛋白等相关检验,结果示血钾1.6 mmol/L,血氯96.7 mmol/L,血钠147.8 mmol/L,高敏肌钙蛋白T 0.061 ug/L,其余指标均未见明显异常。检查结果示心电图一度房室传导阻滞、Q-T延长、多导ST-T改变;心脏超声检查发现:左房扩大、左室心肌肥厚升主动脉扩张(轻度),左室舒张功能减低,EF 60%,考虑高血压性心脏病变,心脏CT冠状动脉血管造影三维成像(CTA)示左右冠状动脉均未见斑块、狭窄及扩张,左冠前降支心肌桥。检验结果示血钾过低,符合低钾血症诊断标准,低钾血症分为缺钾性、转移性及稀释性低钾血症,其中以缺钾性为主要原因,包括摄入不足、排出过多 [3],患者饮食规律、无泮利尿药、噻嗪类利尿药等排钾利尿药物应用史、无胃肠道相关病史,为进一步明确为肾性缺钾或转移性低钾血症,进一步完善相关检验检查,检验结果示24小时尿钾检测24小时尿钾:36.5 mmol (血钾1.6 mmol/L),检查结果示泌尿系超声见右侧肾上腺区0.8 × 0.5 cm低回声结节,左侧肾上腺区见2.2 × 1.9 cm低回声结节,均边界清。结合患者病史,为进一步明确高血压为原发性或继发性,待血钾纠正后行高血压相关动态试验,检验结果示:血浆醛固酮511 pg/mL (立位),655 pg/mL (卧位)。血浆肾素活性0 ng/mL/hr (立位),0 ng/mL/hr (卧位)。醛固酮/肾素活性比值(ARR) 51.1 (立位),65.5 (卧位)。皮质醇及ACTH节律正常,性激素未见异常,检查结果颅脑CT平扫示颅内动脉瘤栓塞术后所见,余未见明显异常。肾上腺CT动态增强扫描示双侧肾上腺见低密度结节影,较大者位于左侧,长径约22 mm,增强扫描轻度强化,双侧肾上腺腺瘤可能性大,见图A、B。结合检验检查结果,患者24尿钾排泄增多,为肾性失钾,血浆醛固酮升高、肾素活性降低、ARR比值异常且CT提示双侧肾上腺占位,可诊断为高醛固酮、低肾素的继发性高血压伴肾性失钾,目前考虑为原发性醛固酮增多症。
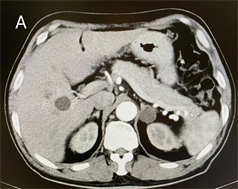
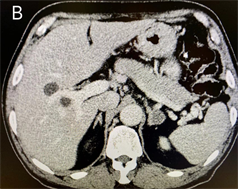
2.3. 诊断与鉴别诊断
根据2020版原发性醛固酮增多症诊断治疗的专家共识 [4],醛固酮 > 20 ng/dl、肾素水平低于检测下限、高血压伴低钾血症的患者可以不用进行确诊试验即可确诊为原醛症,患者血浆醛固酮水平增高、肾素活性降低、ARR增高、肾上腺CT动态增强扫描示双侧肾上腺见低密度结节影,较大者位于左侧,长径约22 mm,增强扫描轻度强化,双侧肾上腺腺瘤可能性大,符合原醛症诊断标准,对于高血压、低血钾的患者,鉴别诊断尤为重要,需要以下疾病相鉴别:(一) 非醛固酮所致盐皮质激素过多综合征,包括真性盐皮质激素过多综合征及表象性盐皮质激素过多综合征;(二) Liddle综合征,检测患者皮质醇、ACTH节律正常,性激素未见异常,可除外上述疾病;(三) 伴高血压、低血钾的继发性醛固酮增多症,包括分泌肾素的肿瘤、继发性肾素增高所致继发性醛固酮增多,患者肾素水平低,泌尿系统超声及肾功均未提示异常,不考虑本类疾病。
2.4. 治疗结果、随访及转归
未明确诊断前先给与患者对症药物治疗,静脉、口服补钾,口服枸橼酸钾溶液每日3次,每次20 ml;卡维地洛片每日2次,每次10 mg,患者血钾升高后完善高血压相关动态试验,明确诊断后给与患者口服螺内酯片每隔8小时一次,每次40 mg,并监测生命体征。根据2020最新版指南 [4],原醛症的治疗方法有手术和药物治疗两种,方案的选择取决于病因及患者对治疗药物的反应,其中醛固酮瘤及原发性肾上腺皮质增生(PAH)建议手术治疗作为首选 [4],请泌尿外科会诊进行评估,患者影像学提示双侧肾上腺占位,其中左侧肾上腺腺瘤直径2.2 cm (>1 cm),符合肾上腺占位的手术指征 [5],并与患者交代病情及相关治疗方案后,患者同意行手术治疗,同时建议患者行肾上腺静脉取血以明确病变部位,但患者因个人原因拒绝。在全身麻醉下行后腹腔镜下左肾上腺切除术,组织病理结果示肾上腺皮质腺瘤,Syn(部分+),CgA(−),MelanA(+),Inhibina灶(+),Ki-67(+, 1%),Calertinin(+),针对患者右侧肾上腺低回声结节,建议定期随访。患者手术顺利,好转出院,术后9天复查醛固酮值为52.02 pg/ml,分别于术后1天及术后9天复查血钾,血钾值恢复正常,分别为3.92 mmol/l、5.78 mmol/l,术后检测患者血压均在正常范围,根据患者原发性醛固酮增多症手术结果(PASO)研究的评价标准 [6],未服用降压药物,血压正常在120~130/80~90 mmhg左右,血钾及ARR正常,手术结果可评价为完全缓解。
3. 讨论
患者老年男性,根据上述相关检验检查结果,临床诊断为原发性醛固酮增多症,高血压病3级(极高危),电解质紊乱,低钾血症,高血压性心脏病,视网膜脱离(右眼),颅内动脉瘤破裂伴蛛网膜下腔出血栓塞术后,心电图及心脏超声提示心肌肥厚、高血压性心脏病变,冠脉CTA提示心肌桥(左冠前降支),既往视网膜脱离病史,以上考虑为高血压所致心脏、肾脏、眼部等靶器官损害,泌尿系统超声未见异常,可除外肾血管性高血压,患者行手术治疗,术后组织病理结果为肾上腺皮质腺瘤,病理诊断为原发性醛固酮增多症。
内分泌系统是由经典的分泌腺和能产生激素的器官与组织共同组成的,通过激素发挥调节效应,肾上腺是人体重要的内分泌腺,其分为肾上腺皮质和肾上腺髓质,其中盐皮质激素由肾上腺皮质球状带分泌,主要包括醛固酮、11-去氧皮质酮、11-去氧皮质醇,以醛固酮生物活性最强。醛固酮作用的靶器官包括唾液腺、胃肠道外分泌腺、汗腺、肾脏等,以肾脏最重要。肾素–血管紧张素–醛固酮系统(renin-angiotensin-aldosteron system, RAAS)是人体内分布最广的内分泌调节系统,其在血压的调节、心血管功能稳态、电解质以及维持体液的平衡中发挥着至关重要的作用。RAAS系统的主要调控因素是肾素,是由肾脏近球细胞分泌的一种酸性蛋白酶,肝脏或组织中合成和释放的血管紧张素原由肾素水解生产血管紧张素I ( angiotensin-I, Ang-I),血管紧张素转化酶(angiotensin converting enzyme, ACE)水解Ang-I变为血管紧张素II (angiotensin-II, Ang-II),血管紧张素中发挥主要生理作用的是Ang-II,肾上腺皮质球状带经其刺激可合成和分泌醛固酮 [7]。目前检测肾素常用的方法包括肾素活性(PRA)以及肾素浓度(PRC)两种,前者通过检测血管紧张素I (Ang-I)的产生速率去反映肾素活性,后者可直接检测出血浆肾素浓度。醛固酮主要作用于肾脏,可促进肾远曲小管、集合管上皮细胞对钠离子、水的重吸收、并增加钾离子的排泄,增加循环血量,参与机体的水盐调节,具有保钠排钾的作用,而机体过多产生的醛固酮就会导致体内钠潴留、排钾过多,细胞内外钠钾离子失衡,血容量过多,并且血管对去甲肾上腺素反应增强,交感神经兴奋性增强,引起高血钠、低血钾、顽固性高血压 [8]。肾小管和集合管通过Na+-H+交换和质子泵将H+主动分泌到小管液中,细胞内大量失钾后,钾离子通过肾脏排泄,导致尿钾增多、血钾降低,出现神经、肌肉、心脏及肾脏功能障碍,肾小管和集合管对H+的分泌减少,细胞外PH上升导致代谢性碱中毒,结合细胞外钙离子使游离钙减少,同时醛固酮促进尿镁排泄,可出现指端麻木及抽搐等症状。
目前,PA是与心脑血管疾病相关的继发性高血压的常见原因,占所有高血压发病患者的10%,原发性醛固酮增多症的及时诊断和治疗可减轻醛固酮特异性靶器官损害 [9]。对于PA患者治疗的目标是使血压和醛固酮恢复正常,主要目的是减少相关的并发症、提高生活质量和降低死亡率。醛固酮过量会导致心血管系统、脑血管系统、肾脏的严重损伤,包括冠状动脉疾病、心肌梗死、心律失常、心力衰竭以及主动脉夹层和中风、短暂性脑缺血发作、颅内动脉瘤破裂、慢性肾衰竭等。与原发性高血压相比,PA与这些疾病的关系更密切,患者目前已存在脑血管、心脏、眼部靶器官损害,高血压本身是PA的一种表现,可引起血管损伤和进一步重构,其次,除了高血压造成的直接损伤外,有充分证据表明,醛固酮在形态或功能方面均会导致动脉壁硬度增加,醛固酮过量会产生氧化应激,通过醛固酮刺激后发生炎症反应,引起的内皮损伤会损害血脑屏障和进一步的胶原蛋白重构,导致血管壁纤维化增加,增加血管破裂的风险 [10],并且内皮炎症有助于脑血管系统的负性重塑,从而减小血管直径,使血管壁的柔韧性降低,并进一步损害脑缺血期间脑血管的扩张。另外,醛固酮会降低一氧化氮的生物利用度,直接影响 6-磷酸葡萄糖脱氢酶和表皮生长因子受体,进一步增加血管硬度 [11]。PA的并发症可以通过药物和手术治疗来减少,这就强调了我们早发现、早诊断、早治疗PA的必要性。
原醛症的发展一般可分为三个阶段:仅有高血压阶段、高血压轻度钾缺乏阶段、高血压严重钾缺乏期。原醛症目前最常用ARR作为筛查指标,已广泛应用于临床,大大提升了原醛症检出率,ARR的测定目前包括醛固酮与血浆肾素浓度比值及其与肾素活性比值,其中,肾素活性检测为通过测定Ang-I的产生速率来间接反映肾素活性水平,Ang-I定量方法主要包括放射免疫法(RIA)和质谱法。目前采用放射免疫法以125I标记Ang-I作为竞争性抗原,通过竞争结合原理定量检测样品中的Ang-I,但此方法受影响因素过多,应用有一定局限性。质谱法主要包括电喷雾质谱(LC/ESI-MS/MS)、免疫基质辅助激光解离质谱(iMALDI-MS)两种,相对于免疫学分析方法,质谱法检测有高特异性、高灵敏度、低检测限、无放射性核苷酸等优势,使其有更广泛的应用,但质谱仪价格昂贵,且在方法标准化方面仍需进一步完善。近年来,全自动化学发光免疫分析法检测肾素浓度逐渐开展,该方法拥有检测速度快、稳定性和重复性好、易于标准化等优点。同时ARR也存在一定的局限性,由于目前诊断流程及检测方法未统一,ARR的切点变化范围过大,影响因素过多,ARR切点需实验室根据相应情况制定 [12] [13]。
通过该病例启示我们对于原醛症患者需明确手术及药物治疗两种方式所适用的疾病分型以及长期药物治疗的副作用、手术治疗的指征等,也使我们对最新版原醛症诊疗专家共识有了全面的了解,并对RAAS系统进行回顾学习,提醒各位医生在临床工作中对早发性和顽固性高血压患者应警惕和注重筛查继发性高血压的可能性和病因,鉴别诊断要更细致和完善,以免将继发性高血压误判为原发性高血压,使病情发展加重甚至出现严重的并发症,延误了有效的治疗。
声明
该病例报道已获得病人知情同意。
文章引用
石梦瑶,孙桂荣. 误诊多年的原发性醛固酮增多症1例
A Case of Primary Aldosteronism Misdiagnosed for Many Years[J]. 临床医学进展, 2022, 12(05): 3855-3860. https://doi.org/10.12677/ACM.2022.125557
参考文献
- 1. Wang, L., Li, N., Yao, X., et al. (2017) Detection of Secondary Causes and Coexisting Diseases in Hypertensive Patients: OSA and PA Are the Common Causes Associated with Hypertension. BioMed Research International, 2017, Article ID: 8295010. https://doi.org/10.1155/2017/8295010
- 2. Mosso, L., Carvajal, C., González, A., et al. (2003) Primary Aldosteronism and Hy-pertensive Disease. Hypertension, 42, 161-165. https://doi.org/10.1161/01.HYP.0000079505.25750.11
- 3. Kogika, M.M. and de Morais, H.A. (2017) A Quick Reference on Hypokalemia. Veterinary Clinics of North America: Small Animal Practice, 47, 229-234. https://doi.org/10.1016/j.cvsm.2016.10.010
- 4. 中华医学会内分泌学分会. 原发性醛固酮增多症诊断治疗的专家共识(2020版) [J]. 中华内分泌代谢杂志, 2020, 36(9): 727-736.
- 5. 张诗婷. 双侧肾上腺占位的诊治进展[J]. 中国微创外科杂志, 2018, 24(4): 349-353. https://doi.org/10.3969/j.issn.1009-6604.2018.04.016
- 6. Williams, T.A., Lenders, J.W.M., Mulatero, P., et al. (2017) Out-comes after Adrenalectomy for Unilateral Primary Aldosteronism: An International Consensus on Outcome Measures and Analysis of Remission Rates in an International Cohort. The Lancet Diabetes & Endocrinology, 5, 689-699. https://doi.org/10.1016/S2213-8587(17)30135-3
- 7. Patel, S., Rauf, A., Khan, H. and Abu-Izneid, T. (2017) Ren-in-Angiotensin-Aldosterone (RAAS): The Ubiquitous System for Homeostasis and Pathologies. Biomedicine & Pharmacotherapy, 94, 317-325. https://doi.org/10.1016/j.biopha.2017.07.091
- 8. Bothou, C., Beuschlein, F. and Spyroglou, A. (2020) Links between Aldoste-rone Excess and Metabolic Complications: A Comprehensive Review. Diabetes & Metabolism, 46, 1-7. https://doi.org/10.1016/j.diabet.2019.02.003
- 9. Gyamlani, G., Headley, C.M., Naseer, A., Valaulikar, G.S. and Geraci, S.A. (2016) Primary Aldosteronism: Diagnosis and Management. The American Journal of the Medical Sciences, 352, 391-398. https://doi.org/10.1016/j.amjms.2016.06.015
- 10. Feigin, V.L., Lawes, C.M., Bennett, D.A. and Anderson, C.S. (2003) Stroke Epidemiology: A Review of Population- Based Studies of Incidence, Prevalence, and Case-Fatality in the Late 20th Century. The Lancet Neurology, 2, 43-53. https://doi.org/10.1016/S1474-4422(03)00266-7
- 11. Briet, M. and Schiffrin, E.L. (2013) Vascular Actions of Aldosterone. Journal of Vascular Research, 50, 89-99. https://doi.org/10.1159/000345243
- 12. 钱婧雨, 刘向祎. 醛固酮检测方法及临床应用进展[J]. 中华检验医学杂志, 2019, 42(12): 1072-1077. https://doi.org/10.3760/cma.j.issn.1009-9158.2019.12.018
- 13. Stowasser, M., Ahmed, A.H., Pimenta, E., Taylor, P.J. and Gor-don, R.D. (2012) Factors Affecting the Aldosterone/ Renin Ratio. Hormone and Metabolic Research, 44, 170-176. https://doi.org/10.1055/s-0031-1295460
NOTES
*通讯作者Email: sunguirong@hotmail.com