Open Journal of Natural Science
Vol.
10
No.
06
(
2022
), Article ID:
58387
,
8
pages
10.12677/OJNS.2022.106127
有机小分子与血清白蛋白相互作用研究进展
吴旭1,2,李春雨1,王新1*
1辽宁大学药学院,辽宁 沈阳
2本钢板材股份有限公司质检计量中心,辽宁 本溪
收稿日期:2022年10月17日;录用日期:2022年11月19日;发布日期:2022年11月28日

摘要
在有机小分子与血清白蛋白相互作用领域,近年来受到重视并逐步开展深入的研究,通常采用荧光光谱法作为主要分析方法、并辅之以紫外吸收光谱法、拉曼光谱法、圆二色光谱法、分子对接技术、等温滴定热量法等方法,本文对近年来采用上述方法进行的研究进行了综合评述。在查阅近年文献后,介绍了有机小分子与血清白蛋白相互作用的进展,总结了本方向的相关研究方法,并对该领域未来的发展方向进行了分析、预测和展望。
关键词
有机小分子,血清白蛋白,光谱法,相互作用

Research Progress on the Interaction between Small Organic Molecules and Serum Albumin
Xu Wu1,2, Chunyu Li1, Xin Wang1*
1School of Pharmacy, Liaoning University, Shenyang Liaoning
2Quality Inspection and Measurement Center of Bensteel Sheet Co., Ltd., Benxi Liaoning
Received: Oct. 17th, 2022; accepted: Nov. 19th, 2022; published: Nov. 28th, 2022

ABSTRACT
In the field of interaction between small organic molecules and serum albumin, attention has been paid and in-depth research has been conducted in recent years. Fluorescence spectroscopy is usually used as the main analytical method, supplemented by ultraviolet absorption spectroscopy, Raman spectroscopy, circular dichroism spectroscopy, molecular docking technology, isothermal titration heat method and other methods. This paper gives a comprehensive review of recent studies using the above methods. After reviewing the recent literature, this paper introduces the progress of the interaction between small organic molecules and serum albumin, summarizes the relevant research methods in this direction, and analyzes, predicts and looks forward to the future development direction of this field.
Keywords:Organic Molecule, Serum Albumin, Spectrometry, Interaction

Copyright © 2022 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
有机小分子与血清白蛋白之间相互作用对人类体内血液循环系统、消化系统等的影响是近年来业内关注的热点。药物内的有机小分子与血液中各类成分的相互作用和影响不仅会对药物在体内的吸收、运输等产生作用,还会影响药物分子本身的功能,对药物活性也会产生影响。而蛋白质在人体中占据重要位置,是人类饮食结构中不可缺少的营养物质。
随着科技水平的不断发展,仪器设备技术的不断提高和更新,人类对于有机小分子与血清白蛋白的相互作用又有了更深的认识和研究,近年来通常采用荧光光谱法作为主要分析方法、并辅之以紫外吸收光谱法、拉曼光谱法、圆二色光谱法、分子对接技术、等温滴定热量法等方法研究有机小分子与血清白蛋白的相互作用越来越深入。
1.1. 人血清白蛋白
人血清白蛋白(Human Serum Albumin, HSA)的整体结构类似“心形”,结构见图1 [1]。是单一多肽链构型,包含585个氨基酸残基 [2],含量占血浆总蛋白的一半以上。在体液中HAS经常被用于运输脂肪酸、金属离子或其他治疗物质,而且能够保持血液正常的渗透压。当药物或小分子等物质进入血清白蛋白后,他们大部分会结合在Site I和Site II处的疏水空腔内,而结合在I位的远远高于结合在II位的。在血液蛋白质中,血清白蛋白具有相对分子量小、亲和力好、稳定性高的特点,因此在药物化学、临床医学、药代动力学、毒理学等领域里有非常广泛而且重要的应用和推广前景。
1.2. 牛血清白蛋白
牛血清白蛋白 [3] (Bovine Serum Albumin, BSA)是牛血清中的蛋白质,整体结构类似“球形”、含有折叠紧密的多肽链,是六百余个氨基酸残基的蛋白结构,牛血清白蛋白的整体性质与人血清白蛋白类似,但是价格却相对HAS便宜很多,因此经常作为研究相互作用的配体,代替人血清白蛋白使用。
Liang等 [4] 利用牛血清白蛋白研究与溴代苯酚之间的相互作用,有助于深入了解水环境中BSA对溴代苯酚环境的影响。
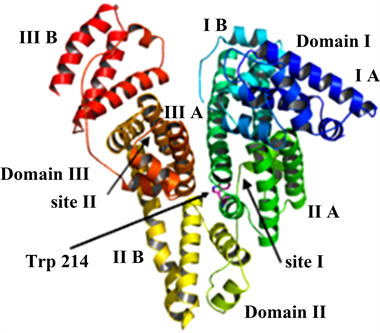
Figure 1. Structure of human serum album
图1. 人血清白蛋白结构
2. 主要研究方法
2.1. 荧光光谱法
目前,荧光光谱法作为研究物质之间相互作用的一种重要研究方法,在有机小分子与血清白蛋白相互作用领域被广泛应用,它可以利用分子吸收能量之后,发射出特征光谱在紫外或红外区,根据吸收到的特征光谱可以定性或定量的分析物质种类和含量 [5]。它通过测定蛋白质分子的自身荧光,或者向蛋白质分子特殊部位引入荧光探针然后测定其荧光来研究蛋白质分子的构象变化,或者是研究色氨酸和酪氨酸残基的微环境,或者是蛋白质变性等。利用Stern-Volmer方程 [6] 进行定量的计算(见式1),依据温度与Ksv值的变化规律推断猝灭机制,当正相关时说明是动态猝灭,负相关时为静态猝灭。
(1)
Li等 [7] 在研究链格孢霉毒素(Tenuazonic Acid, TeA)与血清白蛋白的互作机理时,利用荧光光谱技术。图2分别表示了TeA在0、5、10、15、20、25、30微摩尔每升浓度下分别与HSA和BSA反应的荧光光谱图。在波长为280 nm激发条件下,人血清白蛋白的最大发射峰在336 nm、牛血清白蛋白的最大发射峰在340 nm,单独存在TeA时没有荧光发射。随后TeA浓度再次增加时,加入到HAS和BAS溶液中时,荧光强度却呈现逐步下降的趋势,说明TeA与血清白蛋白之间由于存在相互作用而正在合成非荧光复合物。通过计算发现两种血清白蛋白的Ksv都是随温度升高而降低的,说明是静态猝灭。
Zhou等 [8] 采用同样的研究方法,探究HSA与正壬酸香草酰胺(Nonivamide,OC)反应情况,在天然构象中,人血清白蛋白的氨基酸残基中色氨酸残基(Trp)能够产生最大的荧光强度。研究发现,在OC浓度逐渐增加的实验条件下,HSA的荧光强度也在不断增加并伴随着明显的蓝移,而且不同温度下该实验结果均成立。而发生了明显微环境变化的Trp214也间接证明了HSA与药物结合后结构更加紧凑,并且OC分子结合在亚结构域IIA中。
荧光光谱法相对于电子探针法、二极管阵列检测法等具有准确度高、操作简单、灵敏度高、选择性强、时间较短等优势,被广泛应用于有机小分子与血清白蛋白相互作用的研究领域 [9],但是荧光光谱法也存在着无法避免和忽视的缺点,比如易受干扰、不能定量分析相关结构含量的变化等问题。
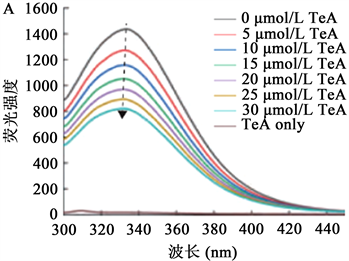
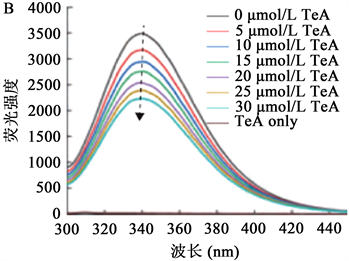 注:A:HSA-TeA;B:BSA-TeA。
注:A:HSA-TeA;B:BSA-TeA。
Figure 2. Fluorescence emission spectra of TeA and serum albumin
图2. TeA与血清白蛋白的荧光发射光谱
2.2. 紫外吸收光谱法
血清白蛋白中在紫外区有吸收峰的包括色氨酸、酪氨酸与苯丙氨酸等芳香性氨基酸,这些氨基酸的残基在190~310 nm范围内均存在吸收效应。紫外吸收可见光谱的研究对象大多在200~380 nm的近紫外光区和/或380~780 nm的可见光区有吸收。利用不同氨基酸残基的吸收波长,有机小分子与血清白蛋白作用前后吸收光谱的差异来研究相互作用的情况。
Wang等 [10] 利用紫外吸收光谱研究柠檬黄与牛血清白蛋白的相互作用研究中,如图3所示柠檬黄与BSA在278 nm出现明显的吸收峰,实验结果表明,物质之间的相互作用使得发色基团的微环境存在变化,导致BSA空间构象改变。
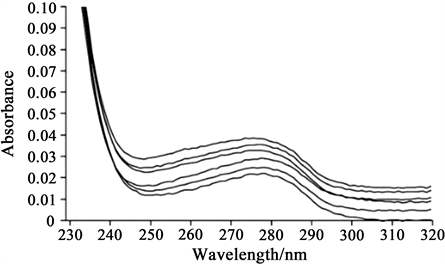
Figure 3. Fluorescence spectra of tartrazine-BSA (293 K)
图3. 柠檬黄与BSA的紫外光谱(293 K)
Zhao等 [11] 采用紫外吸收光谱法研究硫化纳米零价铁(CMC-S-nZVI)与牛血清白蛋白的互作机理,研究表明,随着硫化纳米零价铁浓度的增加,使得BSA的微环境发生了改变,逐步暴露出在疏水区的氨基酸残基。
紫外光谱法具有操作简单的特点,在日常实践中,经常被作为辅助手段进行分析,但是该方法存在提供信息有限的问题。
2.3. 拉曼光谱法
拉曼光谱法可以用于测定有机分子与血清白蛋白结合的构象变化,它的原理是化合物分子经过光照后产生的散射现象。利用光与物质之间的相互作用可以深入了解物质的构成或特性,还可以提供关于分子内和分子间振动的信息。大部分用于分辨化学物质的不同种类、化学物质的结构特征或化学基团特征,它与傅里叶变换红外光谱法互为互助效应。因为水的散射非常弱 [12],因此拉曼光谱法对于水溶液物质的研究效果较为突出,目前已经应用于氨基酸、金属离子等物质的测定。
Zhou等 [8] 结合荧光光谱仪、紫外光谱仪和拉曼等光谱技术研究正壬酸香草酰胺(Nonivamide, OC)与人血清白蛋白的相互作用。研究显示OC与HSA作用后,AuNPs [13] 表面存在OC氧离子倾斜吸附现象。
拉曼光谱法具有快速、准确的特点,而且样品测量后基本维持原样,在可见或近红外光的附近会出现谱带信号。目前,因为拉曼光谱法独特的优势,被研究人员广范应用,在分析有机小分子与血清白蛋白相互作用领域,与傅里叶光谱研究可以互为补充验证,为反应谱图结构特征提供更准确的依据。
2.4. 圆二色光谱法
圆二色光谱是应用广泛的测定蛋白质二级结构的方法,而且测定方法快速简便,对构象变化灵敏,所以它是研究蛋白质二级结构的主要手段之一,并已广泛应用于蛋白质的构象研究中。它以电子跃迁能级大小为理论基础, 利用圆二色光谱检测血清白蛋白的能级,目前被广泛用于研究分子立体结构与功能、相互作用领域。利用溶液中的光学活性分子的圆二色性解析其二级构象。由于蛋白质分子中存在不对称的二级构象,如α-螺旋、β-折叠、β-转角等立体结构,使得蛋白质分子对左、右圆偏振光的吸收也不同,经左、右圆偏振光透过后变成椭圆偏振光,利用这种蛋白质的圆二色性进行分析。该种方法具有测定时间短、简便、高效的特点;同时需要样本量非常少,且可在稀溶液中测定;无分子量或分子大小限制; 对二级、三级结构变化高度灵敏,能够探测到微小改变等检测优势。
Li等 [7] 在研究链格孢霉毒素(Tenuazonic Acid, TeA)与血清白蛋白的互作机理时,利用圆二色光谱法研究,如图4结果显示光谱的峰形在205 nm以下时基本一致,但当HAS与TeA浓度变换至1:5时,峰值在208 nm处明显增强,当BAS与TeA浓度变换至1:5时,峰值在222 nm处明显增强。而且通过圆二色光谱检测说明分子构象发生了变化,证明两物质之间存在相互作用,随着浓度增加,两物质反应后产物更加稳定。
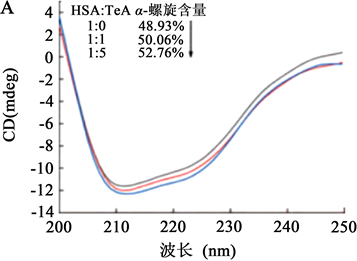
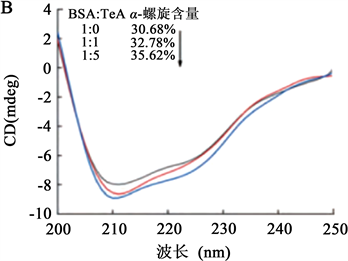 注:A:HSA-TeA;B:BSA-TeA。
注:A:HSA-TeA;B:BSA-TeA。
Figure 4. Circular dichroism spectrum of serum albumin in the presence of TeA
图4. TeA存在下血清白蛋白的圆二色光谱
圆二色光谱法,已经做为研究有机化学立体构型的一种重要手段,同时在提供手性分子构型等方面也发挥重要作用。在化学研究、药物研制领域被广泛应用,圆二色光谱在接近人体环境下进行测定,对构象变化反应灵敏,是研究蛋白构象变化的重要手段,而且二级结构的变化信息还可以与傅里叶光谱法的研究结果进行互相验证。
2.5. 分子对接技术
分子对接技术在小分子与血清白蛋白相互作用的研究领域被广泛应用,该技术的应用可以直观了解小分子与血清白蛋白的作用力类型,并能够通过结合位点判断分子相互作用的结合情况,进而达到快速研究分子与血清白蛋白反应的目的。常用的软件有AutoDock [14]、Surflex Dock [15]、Flex [16]、Gold [17] 等,分子对接技术的对接方法灵活,还可以适用于不同的配体和受体,对接方法概括起来可以分为刚性对接、半柔性对接、柔性对接 [18]。
Zhang等 [19] 利用分子对接技术,研究茯苓酸(pachymic acid, PA)与HSA的结合模式和结合位点。研究结果表明PA与HSA之间有较强的作用,相互作用方式主要为疏水相互作用和氢键相互作用 [20],具体结合情况见图5、图6。
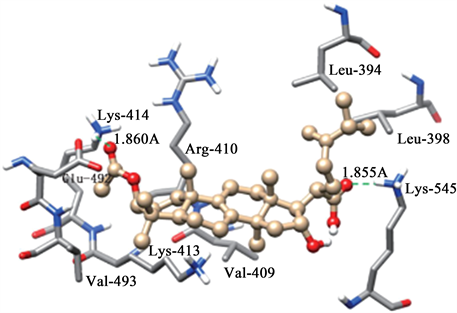
Figure 5. Molecular docking mode between PA and HSA
图5. PA与HSA的分子对接模式
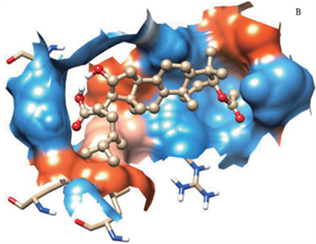
Figure 6. PA周围5Å范围以内氨基酸残基的疏水表面模型
图6. Hydrophobic surface model of amino acid residues within 5Å around PA
Fan等 [21] 利用分子对接技术研究不同PH条件下叶黄素和牛血清白蛋白的作用机理,研究结果表明叶黄素与BSA之间有较强的作用,相互作用方式主要为疏水相互作用和氢键相互作用,伴随少量静电相互作用,而且该研究结果能够很好的证明热力学实验的研究结果。
与一般的实验方法不同的是分子对接技术是应用分子动力学通过计算模拟得到的相互作用的结果,与实验方法相结合能够更好的应用于相互作用的研究,为实验提供更多的理论依据,但是也存在一定的风险,因为是从宏观角度进行模拟分析,计算偏差很有可能产生。
2.6. 等温滴定热量法
等温滴定热量法是一种研究生物热力学和动力学的方法,可以测量生物由于结合成份的增加所引发的热力学变化。当两种物质经过滴定发生反应时,伴随一种物质浓度的增加,反应体系的温度会发生变化,即热量产生变化,通过测量反应过程中ΔG、ΔH、ΔS等,判断作用力产生原因。它具有高灵敏度、高自动化的特点。而且通过测量所得的热力学常数还可与荧光光谱法进行比对分析。
Li等 [7] 在研究链格孢霉毒素(Tenuazonic Acid, TeA)与血清白蛋白的互作机理时,实验结果表明TeA和两种血清白蛋白相互作用为自发反应,且反应过程中疏水作用力起主要作用。
Fan等 [21] 借助热力学理论基础研究不同PH条件下叶黄素和牛血清白蛋白的反应情况,研究结果表明在不同PH条件下,热力学常数方向没有发生变化,说明PH的变化对二者反应过程没有影响。
等温滴定热量法因其特殊的优点而被广泛应用于有机分子与血清白蛋白相互结合的研究中,在确定结合常数、热力学常数、溶液中分子相互作用程度方面发挥重要作用。
3. 结论
目前,有机小分子与血清白蛋白相互作用的研究已经成为业内关注的热点问题,也在逐步成为科研工作者们深入探讨的课题。通过对相互作用的研究,可以直观反映生物体内化合物或物质本身的吸收、排泄、转运等过程。相较以往人们利用傅里叶变换红外光谱法、核磁共振光谱法等研究,现在的光谱研究技术具有针对性更强、检测效率更快的特点,对于小分子在人体内与血清白蛋白作用的时间和浓度的研究也更直接和更深远。综合利用荧光光谱法、紫外–吸收可见光谱法、分子对接方法等研究不同有机小分子与血清白蛋白之间的作用是研究生命体系过程中非常重要的医学问题之一,开展这方面的研究是生命科学未来的重要发展趋势和方向。
4. 展望
目前研究的方法也在不断更新和变化,如多种分析方法结合分析的研究思路已经成为研究相互作用的一大发展趋势,这些发展和研究将推动更多的学者不断向更深领域进行探究,研究有机小分子与血清白蛋白的相互作用对人类身体的健康和未来生命科学的发展方向有很大的借鉴意义,同时会促进药代动力学和生物毒性等相关领域的进步和研究推广。
基金项目
本文由辽宁省教育厅科学研究经费项目——面上项目(LJKZ0086)资助。
文章引用
吴 旭,李春雨,王 新. 有机小分子与血清白蛋白相互作用研究进展
Research Progress on the Interaction between Small Organic Molecules and Serum Albumin[J]. 自然科学, 2022, 10(06): 1140-1147. https://doi.org/10.12677/OJNS.2022.106127
参考文献
- 1. 张爱芹, 王嫚, 申刚义, 金军. 多溴联苯醚与人血清白蛋白相互作用的表面等离子体共振及分子对接[J]. 高等学校化学学报, 2020, 41(9): 2054-2060.
- 2. 韩忠保, 吴雨杭, 米媛媛, 等. 荧光光谱法结合分子对接研究人血清白蛋白对齐墩果酸与熊果酸的异构体识别作用[J]. 光谱学与光谱分析, 2019, 39(7): 2190-2195.
- 3. Chilom, C.G., David, M. and Florescu, M. (2020) Monitoring Biomolecular Interaction between Folic Acid and Bovine Serum Albumin. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 230, Article ID: 118074. https://doi.org/10.1016/j.saa.2020.118074
- 4. 梁雯洁, 蚁嘉颖, 张振轩, 杨梦婷. 溴代苯酚与牛血清白蛋白的相互作用研究[J/OL]. 化学试剂. https://doi.org/10.13822/j.cnki.hxsj.2022.0574, 2022-08-18.
- 5. Jahanban-Esfahlan, A. and Panahi-Azar, V. (2016) Interaction of Glutathione with Bovine Serum Albumin: Spectroscopy and Molecular Docking. Food Chemistry, 202, 426-431. https://doi.org/10.1016/j.foodchem.2016.02.026
- 6. Dezhampanah, H., Firouzi, R., Shoeili, Z.M. and Binazir, R. (2020) Intermolecular Investigation on Interaction of Two Ternary Copper(II) Schiff Base Complexes with Bovine Serum Albumin. Journal of Molecular Structure, 1205, Article ID: 127557. https://doi.org/10.1016/j.molstruc.2019.127557
- 7. 李佳欣, 李道亮, 周鸿媛, 等. 荧光光谱法研究链格孢霉毒素TeA与血清白蛋白的互作机理[J]. 食品工业科技, 2022, 43(8): 288-295.
- 8. 周家羽, 周光明, 陈蓉, 罗丹. SERS结合光谱法研究正壬酸香草酰胺与人血清白蛋白的相互作用[J]. 分析测试学报, 2022, 41(3): 361-367.
- 9. 王晓霞, 聂智华, 李松波, 等. 多光谱法与分子对接法研究盐酸四环素与牛血清白蛋白的相互作用[J]. 光谱学与光谱分析, 2018, 38(8): 2468-2476.
- 10. 王军, 王周利, 程晶晶. 多光谱法结合分子对接研究柠檬黄与牛血清白蛋白的相互作用[J]. 光谱学与光谱分析杂志, 2022, 42(3): 904-909.
- 11. 赵玲子, 菅琳晗, 杨炳君. 硫化纳米零价铁与牛血清白蛋白相互作用的光谱学研究[J]. 山东化工, 2021, 50(23): 106-107, 112.
- 12. Almutairi, F.M., Ajmal, M.R., Siddiqi, M.K., Amir, M. and Khan R.H. (2020) Multispectroscopic and Molecular Docking Technique Study of the Azelastine Interaction with Human Serum Albumin. Journal of Mo-lecular Structure, 1201, Article ID: 127147. https://doi.org/10.1016/j.molstruc.2019.127147
- 13. 申炳俊, 柳婷婷. 光谱法和分子对接技术研究胡桃醌与人血清白蛋白的相互作用[J]. 分析化学, 2020, 48(10): 1383-1391.
- 14. Zhang, Z.X., Yang, M.T., Yi, J.Y., et al. (2019) Comprehensive Insights into the Interactions of Two Emerging Bromophenolic DBPs with Human Serum Albumin by Multispectros Copy and Molecular Docking. ACS Omega, 4, 563-572. https://doi.org/10.1021/acsomega.8b03116
- 15. 顾佳丽, 王思宇, 杨丹, 等. 光谱法研究甲苯达唑与牛血清白蛋白的相互作用[J]. 分析科学学报, 2020, 36(6): 857-862.
- 16. 曹团武, 周坤, 黄文兵, 时建伟, 谭晓平, 黄春林, 冉嫒. 光谱法研究哈巴俄苷与人血清白蛋白的结合反应[J]. 分析化学, 2017, 45(5): 700-706.
- 17. 裘兰兰, 李金贵, 李芳. 分子对接技术与光谱法分析薯蓣皂苷和人血清白蛋白的相互作用[J]. 现代食品科技, 2020, 36(10): 93-99.
- 18. Dohare, N., Parray, M., Siddiquee, M.A., et al. (2020) Effect of Adiphenine Hydrochloride on the Structure of Bovine Serum Albumin: Spectroscopic and Docking Study. Journal of Molecular Structure, 1201, 127168-127179. https://doi.org/10.1016/j.molstruc.2019.127168
- 19. 张孟丽, 杨树德, 刘宇, 等. 茯苓酸与人血清白蛋白相互作用的荧光光谱及分子对接研究[J]. 药物分析杂志, 2020, 40(12): 2141-2148.
- 20. Guan, J., Yan, X., Zhao, Y.J., Sun, Y. and Peng, X. (2018) Binding Studies of Triclocarban with Bovine Serum Albumin: Insights from Multi-Spectroscopy and Molecular Modeling Methods. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 202, 1-12. https://doi.org/10.1016/j.saa.2018.04.070
- 21. 范金波, 康柱, 张炎, 等. 荧光光谱法探究pH值对叶黄素与牛血清白蛋白相互作用的影响[J]. 食品科学, 2022, 43(16): 153-159.
NOTES
*通讯作者。