Advances in Clinical Medicine
Vol.
14
No.
01
(
2024
), Article ID:
80004
,
7
pages
10.12677/ACM.2024.141212
吉非替尼与TRAIL协同诱导A549人肺腺癌细胞系凋亡的作用研究
程广东*,魏煜程#
青岛大学附属医院胸外科,山东 青岛
收稿日期:2023年12月25日;录用日期:2024年1月19日;发布日期:2024年1月29日

摘要
目的:本论文旨在探讨吉非替尼与肿瘤坏死因子相关凋亡诱导配体TRAIL (TNF-Related Apoptosis Inducing Ligand)的协同抗人肺癌作用并阐明两者协同的机制。方法:实验采用人A549肺癌细胞。实验分为对照组、吉非替尼处理组、TRAIL处理组及吉非替尼和TRAIL共同处理组。分别采用MTT实验,流式细胞术,Western-blot检测吉非替尼和TRAIL对A549细胞的存活、凋亡以及凋亡相关蛋白等方面的影响。结果:吉非替尼和TRAIL共同处理组的细胞存活率相较于空白对照组和各单独处理组均有显著变化。流式细胞术检测结果显示:对照组诱导的A549细胞凋亡比率分别为2.7%,15 μM吉非替尼单独处理组诱导的凋亡率为8.5%,100 ng/ml TRAIL单独处理组诱导的凋亡率为17.5%,而两者共同处理组诱导的凋亡比例为69.8%。相较与对照组或各单独处理组都有显著升高(P < 0.01)。Western-blot实验结果表明:吉非替尼和TRAIL显著诱导凋亡相关蛋白的水解。结论:吉非替尼和TRAIL可协同抑制肺癌细胞存活,促进细胞凋亡。
关键词
吉非替尼,肿瘤坏死因子相关凋亡诱导配体,肺癌,细胞凋亡,协同作用

Study on the Synergistic Effects on the Induction of Apoptosis in A549 Human Lung Adenocarcinoma Cell Line by Gefitinib and TRAIL
Guangdong Cheng*, Yucheng Wei#
Thoracic Surgery Department, Affiliated Hospital of Qingdao University, Qingdao Shandong
Received: Dec. 25th, 2023; accepted: Jan. 19th, 2024; published: Jan. 29th, 2024

ABSTRACT
Objective: This paper aims to explore the synergistic anti-lung cancer effect of gefitinib and TRAIL (TNF-Related Apoptosis Inducing Ligand), and elucidate the mechanism of their synergy. Method: The experiment applied human A549 lung cancer cells. The experiment was divided into control group, gefitinib treatment group, TRAIL treatment group, and gefitinib and TRAIL co-treatment group. MTT assay, flow cytometry, and Western-blot were used to detect the effects of gefitinib and TRAIL on the cell viability, apoptosis, and apoptosis related proteins of A549 cells. Result: The cell viability of the co-treated group with gefitinib and TRAIL showed significant changes compared to the control group and each individual treatment group. The results of flow cytometry showed that the apoptosis ratio of A549 cells induced by the control group were 2.7%. The apoptosis induced by 15 μM of gefitinib alone treatment group was 8.5%, the apoptosis induced by 100 ng/ml TRAIL alone treatment group was 17.5%, and the apoptosis induced by the combined treatment group was 69.8%. Compared with the control group or each individual treatment group, there was a significant increase (P < 0.01). The Western-blot experiment results showed that gefitinib and TRAIL significantly induced the hydrolysis of apoptosis related proteins. Conclusion: Gefitinib and TRAIL can synergistically inhibit the viability of lung cancer cells and promote cell apoptosis.
Keywords:Gefitinib, TRAIL, Human Pulmonary Carcinoma Cell, Apoptosis, Synergistic Effect

Copyright © 2024 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
人肿瘤坏死因子相关凋亡诱导配体TRAIL (TNF Related Apoptosis Inducing Ligand)能够在体内外诱导多种肿瘤细胞凋亡但对正常组织细胞无明显影响,具有良好的应用前景 [1] [2] [3] 。但肿瘤细胞对TRAIL的抗药性限制了TRAIL在肿瘤治疗中的应用。寻找能够增强TRAIL凋亡诱导作用的药物是目前国际肿瘤治疗研究的热点之一 [4] [5] [6] [7] 。吉非替尼是目前我国临床上广泛使用的治疗非小细胞肺癌的第一代靶向药物 [8] ,有关吉非替尼和一系列临床药物协同抑制多种肿瘤的生长的研究较少,尤其对肺癌细胞A549的增殖抑制尚未见报道。因此本研究将吉非替尼和TRAIL共同应用于A549肺癌细胞,观察其对细胞增殖和凋亡等的影响,并探讨两药联合是否具有协同作用,为两者在临床上的应用提供更坚实的理论基础。
2. 材料与方法
2.1. 细胞培养和试剂
A549细胞系购自ATCC,用含10%胎牛血清的A549培养液培养。吉非替尼购自阿斯利康制药有限公司。MTT购自sigma公司,Caspase-3,PARP抗体购自Cell signaling公司,Caspase-8抗体购自B.D.公司,Caspase-9抗体购自Santa Cruz公司。
2.2. 细胞存活实验
细胞按照1 × 104/孔的密度铺96孔板,37℃,5% CO2条件下贴壁过夜。各孔加入含有15 μM的吉非替尼的细胞培养液100 μl/孔,继续常规培养24 h。弃培养基,按照对照组,吉非替尼组,TRAIL组以及共同处理组分别加入含有DMSO的培养基、含有15 μM吉非替尼的培养基、含有100 ng/ml TRAIL的培养基以及含有吉非替尼和TRAIL的培养基。24 h后,每孔加入20 μl MTT溶液(5 mg/ml,即0.5% MTT),继续培养4~6 h。吸弃上清液,每孔加入150 μl DMSO,摇床中低速震荡10 min使结晶充分溶解,酶联免疫检测仪分别OD570 nm处测量各孔的吸光值。按照公示进行计算存活率 = (OD处理组/OD对照组) × 100%。
2.3. 结晶紫染色实验
细胞按照5 × 105/孔的密度铺6孔板,经药物处理后,吸弃培养基,1 ml PBS/孔冲洗细胞一次,1 ml/孔甲醇固定细胞5 min,500 μl/孔结晶紫染色5 min,倾倒染液,流水冲洗各孔,待六孔板晾干后,扫描。
2.4. 流式细胞术检测细胞凋亡
细胞按照5 × 105/孔的密度铺6孔板,经药物处理后,采用胰酶消化收集各组细胞,加入−80℃预冷的90%乙醇置于冰上固定细胞0.5 h或者−20℃固定过夜。1000 rpm离心5 min后弃上清,加入含1% FBS的PBS冲洗细胞一次。加入PI染液避光染色30 min,保存于4℃,流式细胞仪检测。
2.5. Western-Blot实验
细胞按照5 × 105/孔的密度铺6孔板,经药物处理后收集细胞并裂解,12,000 g、4℃离心15 min,上清移入另一管中,弃去沉淀考马斯亮蓝法检测样品蛋白浓度,SDS-PAGE分离蛋白样品。待蛋白分离完毕后转膜。以含10%奶粉的TBST室温平缓摇动封闭1 h或者4℃过夜。加入相应的一抗稀释液。一抗过夜或者室温2 h。以相应的HRP标记的二抗稀释液孵育,室温l h。采用化学发光仪进行曝光检测。
2.6. 统计学处理
采用SPSS 13.0统计软件对数据进行分析处理。各细胞A值,细胞抑制率、细胞凋亡率及个周期细胞所占的比例均以均数 ± 标准差表示,多组间样本均数比较采用单因素方差分析。
3. 结果
3.1. 细胞存活实验检测各组细胞存活率
采用MTT实验检测发现:15 μM的吉非替尼和100 ng/ml的TRAIL处理均能一定程度地抑制A549的存活,与空白对照组比较,吉非替尼和TRAIL单独处理组细胞增殖率均显著降低(P < 0.05) (图1)。相比于吉非替尼和TRAIL单独处理组,吉非替尼与TRAIL共同处理A549细胞能够极显著抑制A549细胞的存活(P < 0.01) (图1)。
3.2. 结晶紫染色实验检测各组细胞存活率
我们进一步采用结晶紫染色实验来验证这一结果。分别采用15 μM的吉非替尼预处理细胞24 h,再分别用15 μM吉非替尼和100 ng/ml的TRAIL分别或者共同处理A549细胞24 h。结果表明15 μM的吉非替尼处理细胞48 h,细胞出现一定的死亡现象,100 ng/ml的TRAIL处理细胞24 h,也对细胞产生了一定程度的杀伤作用(图2)。两者联合作用使得细胞的存活显著降低(图2)。本实验进一步验证吉非替尼和TRAIL具有协同抑制A549肺癌细胞存活的作用。
3.3. 流式细胞术检测各组细胞凋亡率
我们进一步采用流式细胞术检测了吉非替尼和TRAIL分别或者联合处理细胞后细胞的凋亡情况。分别采用15 μM的吉非替尼、100 ng/ml的TRAIL单独或共同作用A549细胞,并采用PI染色流式细胞仪检测细胞的凋亡情况。结果显示:对照组的凋亡比例为2.7%,吉非替尼诱导的凋亡为8.5%,TRAIL诱导的凋亡比例为17.5%,而吉非替尼和TRAIL联合作用可以诱导细胞发生凋亡的比例为69.8% (图3)。表明吉非替尼和TRAIL有显著的协同诱导A549凋亡的作用。
 *P < 0.05, ** P < 0.01.
*P < 0.05, ** P < 0.01.
Figure 1. Cell viability assay was applied to detect the viability of A549 cells in each treatment group
图1. 细胞存活实验检测各处理组A549细胞的存活情况
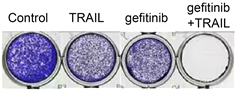
Figure 2. Cell viability was determined by crystal violet staining in A549 cells
图2. 结晶紫染色实验检测A549细胞的存活情况
 *P < 0.05, ** P < 0.01.
*P < 0.05, ** P < 0.01.
Figure 3. Apoptosis of A549 cells tested by flow cytometry
图3. 流式细胞术检测A549细胞的凋亡情况
3.4. Western-Blot实验检测各组细胞凋亡蛋白的变化
Caspase家族尤其是caspase-3、caspase-8、caspase-9以及PARP的水解是细胞凋亡的主要标志之一 [8] 。为了进一步探讨吉非替尼和TRAIL的协同诱导细胞凋亡的作用,我们采用Western-blot检测两者对上述凋亡相关蛋白的影响。我们采用15 μM的吉非替尼和100 ng/ml的TRAIL分别或共同处理A549细胞,收集细胞裂解液。实验结果表明:吉非替尼和TRAIL单独处理并不能显著促进上述蛋白的水解,如果两者联合则可以显著协同促进caspase-3、caspase-8、caspase-9以及PARP的水解(图4)。表明吉非替尼和TRAIL协同诱导A549细胞caspase依赖性的细胞凋亡。

Figure 4. Detecting the expression of apoptosis related proteins in cells upon different treatments by Western-blot
图4. Western-blot实验检测各处理细胞凋亡相关蛋白表达情况
4. 讨论
肿瘤坏死因子相关凋亡诱导配体(TRAIL)是肿瘤坏死因子家族中的一种配体,通过与促凋亡受体结合,能够在多种癌细胞中诱导凋亡,但在大多数正常人类细胞中没有作用。TRAIL因其可以特异性杀伤肿瘤细胞成为抗肿瘤的希望药物。大多数研究表明,TRAIL疗法在患者中是安全且耐受性良好的,但治疗结果不显著,只有少部分患者表现出有效反应 [9] 。例如,在一项治疗复发滤泡性非霍奇金淋巴瘤患者的II期试验中,当TRAIL联合利妥昔单抗给药时,患者的ORR没有提高,从而限制了其在临床上的应用 [10] 。因此,寻找能够与TRAIL协同并克服肿瘤细胞抗性的药物成为目前抗肿瘤研究领域的热点 [11] 。
在包括非小细胞肺癌在内的许多癌症中,EGFR过表达与细胞增殖、血管生成和肿瘤生长相关,于是靶向EGFR其成为治疗肿瘤的潜在的靶点。吉非替尼(商品名为易瑞沙)是一种苯胺喹唑啉衍生物,是表皮生长因子受体(EGFR)酪氨酸激酶(TK)的强抑制剂,在许多实体瘤的发病过程中发挥抑制肿瘤生长的作用。吉非替尼结合EGFR-TK结构域,阻止ATP与酪氨酸激酶结合,抑制进一步的自磷酸化和信号转导。它是目前研究最广泛、应用最广泛的EGFR-TK小分子抑制剂,已获得多个国家监管部门的批准,用于转移性或晚期非小细胞肺癌的治疗。与其他化疗药物相比,因其良好的活性及较弱的毒性,主要用于EGFR突变的NSCLC患者的一线或二线治疗 [12] 。本研究发现,吉非替尼处理可诱导A549细胞凋亡,凋亡相关蛋白表达略有增强。
为了增强抗肿瘤效果,联合疗法在临床上被普遍应用。肿瘤联合疗法指采用两种或两种以上的治疗药物或模式相结合发挥抗肿瘤作用,其在治疗癌症方面相较于单一疗法具有明显的优势。有研究发现,EGFR的激活诱导乳腺癌细胞对凋亡刺激产生耐药性,而EGFR小分子抑制剂吉非替尼可逆转乳腺癌细胞对TRAIL的耐药性,诱导乳腺癌细胞凋亡 [13] 。因此吉非替尼联合TRAIL方案应用于EGFR突变的 NSCLC患者可诱导肿瘤细胞的凋亡,降低肿瘤细胞耐药性。有研究报道EGFR的抑制剂能够和TRAIL协同抑制肿瘤的进展 [14] ,但未见吉非替尼和TRAIL协同抑制肺癌的报道。本文针对吉非替尼与TRAIL联用对人非小细胞肺癌A549细胞的增殖抑制和凋亡诱导作用及其机制进行了深入研究。结果显示,吉非替尼联合TRAIL处理A549细胞后,A549细胞凋亡显著增强,凋亡相关蛋白表达显著增加,表明二者联用具有协同抗肿瘤作用。
综上所述,吉非替尼联合TRAIL可协同抑制肺癌细胞的存活,促进细胞凋亡。因此,本研究可作为EGFR敏感癌症患者治疗方案的临床前研究,为吉非替尼联合TRAIL在临床上应用奠定了坚实的基础。
文章引用
程广东,魏煜程. 吉非替尼与TRAIL协同诱导A549人肺腺癌细胞系凋亡的作用研究
Study on the Synergistic Effects on the Induction of Apoptosis in A549 Human Lung Adenocarcinoma Cell Line by Gefitinib and TRAIL[J]. 临床医学进展, 2024, 14(01): 1476-1482. https://doi.org/10.12677/ACM.2024.141212
参考文献
- 1. Ivanov, V.N., Bhoumik, A. and Ronai, Z. (2003) Death Receptors and Melanoma Resistance to Apoptosis. Oncogene, 22, 3152-3161. https://doi.org/10.1038/sj.onc.1206456
- 2. Leblanc, H.N. and Ashkenazi, A. (2003) Apo2L/TRAIL and Its Death and Decoy Receptors. Cell Death & Differentiation, 10, 66-75. https://doi.org/10.1038/sj.cdd.4401187
- 3. Ozoren, N. and El-Deiry, W.S. (2003) Cell Surface Death Receptor Signaling in Normal and Cancer Cells. Seminars in Cancer Biology, 13, 135-147. https://doi.org/10.1016/S1044-579X(02)00131-1
- 4. Montinaro, A. and Walczak, H. (2023) Harnessing TRAIL-Induced Cell Death for Cancer Therapy: A Long Walk with Thrilling Discoveries. Cell Death & Differentiation, 30, 237-249. https://doi.org/10.1038/s41418-022-01059-z
- 5. Hellwig, C.T., Eugenia Delgado, M., Skoko, J., et al. (2022) Proteasome Inhibition Triggers the Formation of TRAIL Receptor 2 Platforms for Caspase-8 Activation That Accumulate in the Cytosol. Cell Death & Differentiation, 29, 147-155. https://doi.org/10.1038/s41418-021-00843-7
- 6. Phillips, D.C., Buchanan, F.G., Cheng, D., Solomon, L.R., Xiao, Y., Xue, J., et al. (2021) Hexavalent TRAIL Fusion Protein Eftozanermin Alfa Optimally Clusters Apoptosis-Inducing TRAIL Receptors to Induce on-Target Antitumor Activity in Solid Tumors. Cancer Research, 81, 3402-3414. https://doi.org/10.1158/0008-5472.CAN-20-2178
- 7. Overdijk, M.B., Strumane, K., Beurskens, F.J., Ortiz Buijsse, A., Vermot-Desroches, C., Vuillermoz, B.S., et al. (2020) Dual Epitope Targeting and Enhanced Hexamerization by DR5 Antibodies as a Novel Approach to Induce Potent Antitumor Activity through DR5 Agonism. Molecular Cancer Therapeutics, 19, 2126-2138. https://doi.org/10.1158/1535-7163.MCT-20-0044
- 8. Kumar, P., Mangla, B., Javed, S., et al. (2023) Gefitinib: An Updated Review of Its Role in the Cancer Management, Its Nanotechnological Interventions, Recent Patents and Clinical Trials. Recent Patents on Anti-Cancer Drug Discovery, 18, 448-469. https://doi.org/10.2174/1574892818666221026164940
- 9. Lemke, J., von Karstedt, S., Zinngrebe, J. and Walczak, H. (2014) Getting TRAIL Back on Track for Cancer Therapy. Cell Death & Differentiation, 21, 1350-1364. https://doi.org/10.1038/cdd.2014.81
- 10. Belada, D., Mayer, J., Czuczman, M.S., et al. (2010) Phase II Study of Dulanermin plus Rituximab in Patients with Relapsed Follicular Non-Hodgkin’s Lymphoma (NHL). Journal of Clinical Oncology, 28, Article 8104. https://doi.org/10.1200/jco.2010.28.15_suppl.8104
- 11. Cohen, S.J., Cohen, R.B. and Meropol, N.J. (2005) Tar-geting Signal Transduction Pathways in Colorectal Cancer—More than Skin Deep. Journal of Clinical Oncology, 23, 5374-5385. https://doi.org/10.1200/JCO.2005.02.194
- 12. Yuan, Y., Li, X.F., Chen, J.Q., et al. (2014) Critical Appraisal of the Role of Gefitinib in the Management of Locally Advanced or Metastatic Non-Small Cell Lung Cancer. OncoTargets and Therapy, 28, 841-852. https://doi.org/10.2147/OTT.S34124
- 13. Yerbes, R., López-Rivas, A., Reginato, M.J. and Palacios, C. (2012) Control of FLIPL Expression and TRAIL Resistance by the Extracellular Signal-Regulated Kinase1/2 Pathway in Breast Epithelial Cells. Cell Death & Differentiation, 19, 1908-1916. https://doi.org/10.1038/cdd.2012.78
- 14. Jun, H., Jang, E., Kim, H., et al. (2022) TRAIL & EGFR Affibody Dual-Display on a Protein Nanoparticle Synergistically Sup-presses Tumor Growth. Journal of Controlled Release, 349, 367-378. https://doi.org/10.1016/j.jconrel.2022.07.004
NOTES
*第一作者。
#通讯作者。