Advances in Clinical Medicine
Vol.
13
No.
03
(
2023
), Article ID:
62951
,
8
pages
10.12677/ACM.2023.133620
miR-485-3p调控肝癌细胞铁死亡的 分子机制研究
孙文胜1,刘之谦2,李新章1,姜继康3,李杰1*
1山东大学齐鲁医学院,山东 济南
2山东第一医科大学第一附属医院肝胆外科,山东 济南
3孝昌县第一人民医院检验科,湖北 孝感
收稿日期:2023年2月21日;录用日期:2023年3月16日;发布日期:2023年3月23日

摘要
目的:探讨miR-485-3p调控肝癌细胞系HepG2铁死亡的分子机制。方法:使用转染试剂transfect-mate分别转染miR-485-3p模拟物或抑制物至肝癌细胞HepG2中并通过qPCR验证转染效果。加入铁死亡诱导剂索拉非尼(SF),通过CCK-8法检测肝癌细胞增殖水平。通过RT-qPCR验证铁死亡诱导剂作用下肝癌细胞内miR-485-3p表达水平。通过脂质过氧化物试剂盒(MDA)、C11-BODIPY、铁离子检测试剂盒、分别检测肝癌细胞内过氧化物、铁离子积累水平。Western blot测定转染miR-485-3p模拟物或抑制物后核受体共激活因子4 (NCOA4)的表达水平。结果:与“NC + SF”组相比,“Mimics + SF”组肝癌细胞活力减弱,“Inhibitor + SF”组肝癌细胞活力显著增强。qPCR结果显示索拉非尼诱导后,肝癌细胞内miR-485-3p表达水平较对照组升高。“Mimics + SF”组细胞内丙二醛(MDA)、铁离子水平较“NC + SF”组显著升高。共聚焦显微镜下观察到 “Mimics + SF”组肝癌细胞内ROS累积显著,“Inhibitor + SF”组相对较低。Western blot结果显示转染miR-485-3p模拟物后肝癌细胞内NCOA4表达增强,而转染抑制物后NCOA4表达显著下降。结论:miR-485-3p可以通过调控NCOA4影响肝癌细胞铁死亡。
关键词
肝细胞癌,miR-485-3p,核受体共激活因子4,铁死亡

Research on Molecular Mechanism of miR-485-3p Regulation on Ferroptosis in Hepatocellular Carcinoma Cells
Wensheng Sun1, Zhiqian Liu2, Xinzhang Li1, Jikang Jiang3, Jie Li1*
1Cheeloo College of Medicine, Shandong University, Jinan Shandong
2Department of Hepatobiliary Surgery, The First Affiliated Hospital of Shandong First Medical University, Jinan Shandong
3Clinical Laboratory Department, Xiaochang First People’s Hospital, Xiaogan Hubei
Received: Feb. 21st, 2023; accepted: Mar. 16th, 2023; published: Mar. 23rd, 2023

ABSTRACT
Objective: To investigate the molecular mechanism of miR-485-3p on ferroptosis of hepatocellular carcinoma cell line HepG2. Methods: Transfect-Mate was used to transfect miR-485-3p mimics or inhibitors into HepG2 cells, and the transfection effect was verified by qPCR. Adding Sorafenib (SF) as ferroptosis inducer, the proliferation of hepatocellular carcinoma cells was detected by CCK-8 assay. RT-qPCR was used to verify the expression level of miR-485-3p in hepatocellular carcinoma cells under the effect of ferroptosis inducer. The accumulation levels of superoxide and iron in HCC cells were detected by Lipid Peroxidation MDA Assay Kit (MDA), C11-BODIPY and Iron assay Kit respectively. Western blot was used to determine the expression level of nuclear receptor coactivator 4 (NCOA4) after transfection with miR-485-3p mimic or inhibitor. Results: Compared with “NC + SF” group, the viability of hepatocellular carcinoma cells in “Mimics + SF” group was decreased, while that in “Inhibitor + SF” group was significantly increased. qPCR results showed that after sorafenib induction, the expression level of miR-485-3p in hepatocellular carcinoma cells was higher than that in the control group. The levels of malondialdehyde (MDA) and intracellular iron in the “Mimics + SF” group were significantly higher than those of “NC + SF” group. It was observed under confocal microscope that ROS accumulation in hepatocellular carcinoma cells of the “Mimics + SF” group was significant, while the “Inhibitor + SF” group was relatively low. Western blot results showed that the expression of NCOA4 in hepatocellular carcinoma cells was enhanced after transfection with miR-485-3p mimics, while the expression of NCOA4 was significantly decreased after transfection with inhibitor. Conclusion: miR-485-3p affects ferroptosis in hepatocellular carcinoma cells by regulating NCOA4.
Keywords:Hepatocellular Carcinoma, miR-485-3p, Nuclear Receptor Coactivator 4, Ferroptosis

Copyright © 2023 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
据国家癌症中心数据,我国肝癌的发病率排名第四,死亡率排名第二,仅次于肺癌 [1]。因此寻找新的潜在的治疗肝癌的靶点具有非常重要的意义。铁死亡是一种以脂质过氧化物、铁离子累积为主要特征的程序性死亡,现有研究表明,铁死亡与肝癌的发展有关 [2]。miR-485-3p位于染色体14q32.31,研究表明miR-485-3p在结直肠癌 [3] [4] 、宫颈癌 [5] 、和乳腺癌 [6] 等恶性肿瘤中可以作为肿瘤抑制因子。相反,研究显示miR-485-3p可作为促癌因子在胃癌 [7] 和肝癌中发挥作用。在肝癌中,miR-485-3p能与LinC00052形成互补碱基对,降低神经营养酪氨酸激酶受体(NTRK3)对肝癌细胞增殖和转移的抑制作用,从而促进肝癌细胞增殖和转移 [8]。另有研究显示,在HepG2细胞中,敲除miR-485-3p可以相对提高MAT1A的mRNA和蛋白质水平,MAT1A的表达水平与肝细胞癌的发生呈负相关,MAT1A表达升高,抑制了肝癌细胞生长和侵袭 [9]。有研究证实miR-485-3p可以通过介导铁转运蛋白影响细胞内铁的代谢,过表达miR-485-3p能降低铁转运蛋白的活性,造成细胞内铁累积 [10]。然而,miR-485-3p是否参与调控肝癌细胞铁死亡,仍待进一步研究。本研究以肝癌细胞系HepG2为研究对象,探讨miR-485-3p在肝癌细胞铁死亡过程中的影响及作用机制,为肝癌的综合治疗提供潜在的靶点。
2. 材料与方法
2.1. 主要材料和试剂
肝癌细胞系HepG2购自塞库生物。模拟物(hsa-miR-485-3p mimics)、抑制物(hsa-miR-485-3p inhibitor)、阴性对照(Negative control)、转染试剂(transfect-mate)均购自上海吉玛制药技术有限公司基因。MEM培养基、胰蛋白酶-EDTA消化液、青链霉素混合液、PBS均购自上海源培生物科技股份有限公司。胎牛血清购自Gibco美国赛默飞世尔科技有限公司。RT-qPCR试剂盒购自湖南艾科瑞生物工程有限公司公司。脂质氧化(MDA)检测试剂盒购自上海碧云天生物技术有限公司。铁离子比色法检测试剂盒采购于北京普利莱基因技术有限公司。引物采购于上海吉玛制药技术有限公司。C11-BODIPY581/591购自武汉爱博泰克生物科技有限公司。GAPDH抗体、NCOA4抗体、FTH1抗体、SLC7A11抗体、抗体均购自美国Cell Signaling Technology公司(CST)。TBST缓冲液、30%丙烯酰胺、过硫酸铵(APS)、四甲基乙二胺(TEMED)均购自武汉塞维尔生物科技有限公司。
2.2. 方法
2.2.1. 细胞培养与分组
肝癌细胞系HepG2在含10%胎牛血清及1%青链霉素混合液的MEM培养基中培养。细胞培养箱保持5% CO2、37℃的恒温条件。细胞复苏、细胞传代均在生物安全柜中进行。细胞每培养15代,更换1次细胞。HepG2细胞共分为6组,分别为“NC + DMSO”组(阴性对照组)、“NC + SF”组(索拉非尼诱导组)、“Mimics + DMSO”组(miR-485-3p过表达组)、“Mimics + SF”组(miR-485-3p过表达 + 索拉非尼诱导组)。“Inhibitor + DMSO”组(miR-485-3p抑制组)、“Inhibitor + SF”组(miR-485-3p抑制 + 索拉非尼诱导组)。
2.2.2. CCK-8 (Cell Counting Kit-8)实验
细胞活力检测:转染后的HepG2细胞,按照细胞传代步骤进行消化吹打混匀,显微镜下计数(5 × 103/well)接种于96孔板中,总培养基体积100 μL。24 h后加药,加药处理24 h后更换培养基,避光条件下加入提前配制好的CCK-8检测试剂,总体积100 μL,培养箱中孵育2 h。用酶标仪测定450 nm处的吸光度值,记录实验数据。
2.2.3. 克隆形成实验
将转染处理过的HepG2细胞(6 × 102/well)接种于12孔板中。细胞在添加10%胎牛血清的培养基中培养2周,每4天更换一次培养基。待形成肉眼可见细胞团时,加药处理24 h,室温下用4%的多聚甲醛细胞固定液固定细胞20 min,然后用0.1%的结晶紫染色。双蒸水冲洗3~5次,自然晾干后拍照保存。
2.2.4. PCR实验
预先处理好的细胞清洗3遍,提取细胞总RNA。测定RNA浓度后,参照产品说明书反转录生成cDNA,以上操作均在冰上进行。使用伯乐CFX-96荧光定量PCR仪行实时荧光定量PCR。2−ΔΔCt法计算miRNA实时水平。
2.2.5. 丙二醛(MDA)检测
裂解液充分裂解细胞后,4℃ 12,000 r/min离心10 min,取上清液。加入配制好的MDA检测工作液,溶液充分混匀,100℃孵育15 min,水浴冷却至室温,室温1000 r/min离心10 min,最后取200 μL样品加入96孔板中,每样本重复3次,酶标仪532 nm波长测定吸光度。依据标准浓度曲线及样品蛋白浓度计算细胞内MDA水平。
2.2.6. 铁离子检测
向培养好细胞的6孔板中加入400 μL/孔铁离子检测试剂裂解液,室温下置于摇床上裂解2 h充分裂解细胞。吸取样品至1.5 ml离心管,根据说明书加入各组样品及所需试剂,充分混匀,60℃孵育1 h,冷却至室温后瞬时离心,加入30 μL铁离子检测剂,室温孵育30 min,取200 μL于96孔板,550 nm测定吸光度值。依据标准浓度曲线及样品蛋白浓度计算细胞内铁离子水平。
2.2.7. C11-BODIPY实验
C11-BODIPY用于检测细胞内脂质过氧化。HepG2细胞(15 × 104/well)六孔板种板,细胞融合度40%左右进行转染,转染后24 h加药,加药处理24 h后用含50 µmol/L C11-BODIPY试剂培养基按说明书进行培养,所得各组样品用激光共聚焦显微镜进行测定。
2.2.8. Western Blot实验
RIPA裂解细胞20 min后,刮匙刮下细胞,转移至1.5 mL样品管中。4℃离心机12,000 r/min离心15 min,取上清液提取细胞总蛋白。使用BCA试剂盒测定细胞蛋白浓度,按照1:4体积比添加蛋白电泳上样缓冲液充分混匀后,95℃金属浴中加热5 min,−20℃保存备用。取10 μg蛋白上样,电泳80 V、30 min,120 V、60 min,转膜。脱脂牛奶封闭2 h。TBST缓冲液清洗条带3遍,孵育一抗过夜。所用抗体均按照说明书1:1000稀释。二抗1:3000稀释,常温下孵育1 h,TBST缓冲液清洗条带3遍。加入超敏显影液,显影仪下发光显影。
2.3. 统计学处理
所获数据应用GraphPad Prism 8软件进行统计分析。计量资料以x ± s表示,两独立样本间差异的比较采用独立样本t检验。所有实验均重复3次。P < 0.05为差异具有统计学意义。
3. 结果
3.1. miR-485-3p对HepG2细胞铁死亡的影响
通过CCK-8实验测定加入索拉非尼前后肝癌细胞的活力,结果显示“Mimics + DMSO”组细胞活力相比“NC + DMSO”组明显升高,而“Mimics + SF”组肝癌细胞活力相比于“NC + SF”组显著降低(图1(a))。细胞克隆形成实验结果显示:在索拉非尼的诱导下,miR-485-3p表达增强后,HepG2的细胞活力显著下降,而敲低miR-485-3p后,HepG2的细胞活力明显增强(图1(b))。PCR结果显示,索拉非尼诱导组的miR-485-3p表达水平较NC组显著升高(图1(c))。这些结果提示miR-485-3p在调控肝癌细胞铁死亡中发挥了作用。我们通过检测细胞内铁离子水平、丙二醛(MDA)水平发现“Mimics + SF”组的MDA和铁离子水平较“NC + SF”组明显升高(图1(d)、图1(e)),“Inhibitor + SF”组铁离子水平较“NC + SF”组明显降低(图1(f))。共聚焦显微镜下观察到,索拉非尼诱导后的各组细胞ROS水平均有明显升高;且“Mimics + SF”组荧光强度显著高于“NC + SF”组,而“Inhibitor + SF”组细胞内ROS水平较“NC + SF”组下降(图1(g))。
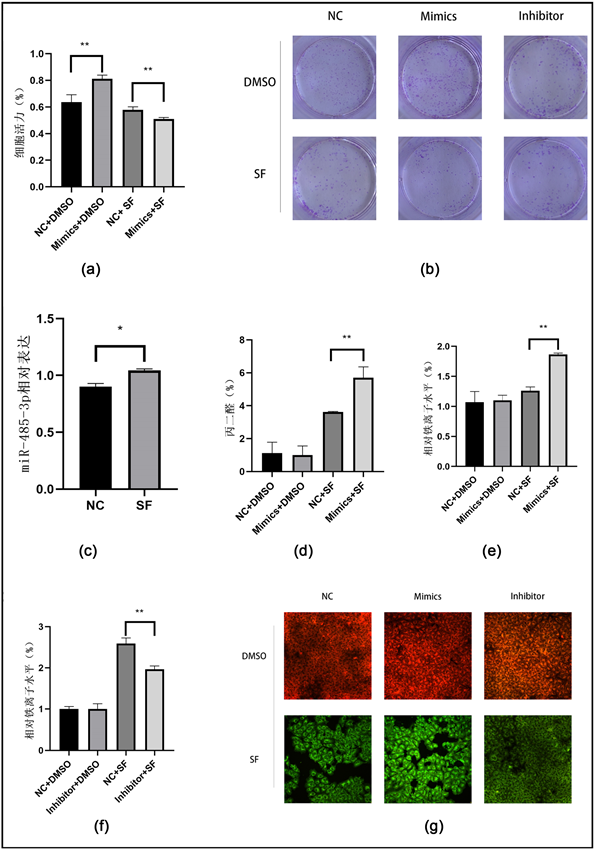
Figure 1. Effect of miR-485-3p on ferroptosis of HepG2 cells. (a) Changes in cell viability after overexpression of miR-485-3p; (b) Cell growth and proliferation in different groups; (c) The expression of miR-485-3p after sorafenib induction was detected by RT-qPCR; (d) Comparison of malondialdehyde levels in cells of different groups; (e) Comparison of intracellular iron levels in different groups after overexpression of miR-485-3p; (f) Comparison of intracellular iron levels in different groups after inhibition of miR-485-3p; (g) ROS fluorescence signals in cells of each group were observed under confocal microscope. The green fluorescence was oxidation state and the red fluorescence was non-oxidation state *P < 0.05, **P < 0.01
图1. miR-485-3p对HepG2细胞铁死亡的影响。(a) 过表达miR-485-3p后细胞活力变化;(b) 不同组别细胞生长增殖情况;(c) RT-qPCR检测索拉非尼诱导后miR-485-3p的表达变化;(d) 不同组别细胞内丙二醛水平比较;(e) 过表达miR-485-3p后不同组别细胞内铁离子水平比较;(f) 抑制miR-485-3p后不同组别细胞内铁离子水平比较;(g) 共聚焦显微镜下观察各组细胞内ROS荧光信号,绿色荧光为氧化态,红色荧光为非氧化态*P < 0.05, **P < 0.01
3.2. miR-485-3p调控HepG2细胞铁死亡的机制
为了进一步探索miR-485-3p调控肝癌细胞铁死亡的机制,我们预测了miR-485-3p在铁死亡通路中可能的靶基因,首先,我们使用铁死亡数据库FerrDb,分别筛选出“铁死亡驱动基因”和“铁死亡抑制基因”中评分前10位的基因,使用miRWalk数据库筛选得到上述基因中与miR-485-3p具有结合位点且评分前5位的基因:TP53、IREB2、NCOA4、FTH1、SLC7A11。本研究中选取NCOA4、FTH1、SLC7A11作为预选基因进行Western blot验证。结果显示:NCOA4、SLC7A11和FTH1在索拉非尼诱导铁死亡后表达都有所下降,但在非诱导铁死亡组过表达或抑制miR-485-3p后,只有NCOA4的表达量出现了显著变化。“Mimics + DMSO”组NCOA4表达量较“NC + DMSO”组明显升高,“Mimics + SF”组NCOA4表达量较“NC + SF”组也有轻度升高(图2(a)、图2(b))。“Inhibitor + DMSO”组较“NC + DMSO”组NCOA4表达量明显下降,“Inhibitor + SF”组较“NC + SF”组NCOA4表达量也有轻度下降(图2(c)、图2(d))。以上结果提示,miR-485-3p可以通过正向调控NCOA4的表达影响铁死亡。
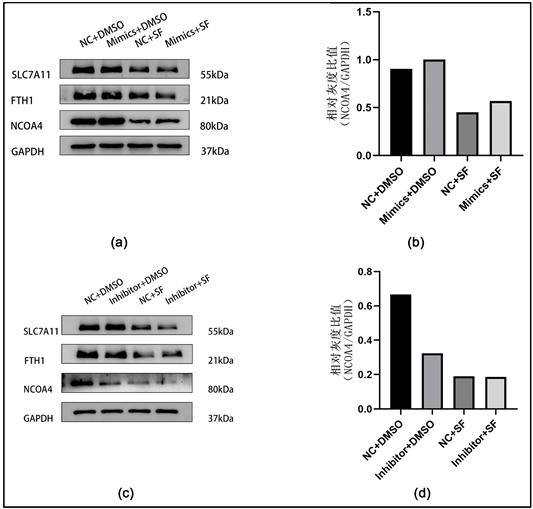
Figure 2. miR-485-3p positively regulates NCOA4 and affects ferroptosis of HepG2 cells. (a) Western blot detection of changes in the expression of ferroptosis related proteins after overexpression of miR-485-3p were detected by Western blot; (b) Changes of NCOA4 expression in different groups of cells after overexpression of miR-485-3p; (c) Western blot detection of changes in the expression of ferroptosis related proteins after the inhibition of miR-485-3p; (d) Changes in the expression of NCOA4 in different groups of cells after the inhibition of miR-485-3p
图2. miR-485-3p正向调控NCOA4影响HepG2细胞铁死亡。(a) Western blot检测过表达miR-485-3p后铁死亡相关蛋白的表达变化;(b) 过表达miR-485-3p后不同组别细胞NCOA4表达的变化;(c) Western blot检测抑制miR-485-3p后铁死亡相关蛋白的表达变化;(d) 抑制miR-485-3p后不同组别细胞NCOA4表达的变化
4. 讨论
铁死亡是一种以铁离子、脂质过氧化物累积为主要特征的程序性死亡,与肿瘤、神经系统疾病、缺血–再灌注损伤、肾损伤、血液疾病等多种疾病的病理生理过程密切相关 [11]。铁死亡通过调节细胞内谷胱甘肽(GSH)、细胞内脂质过氧化物及其他相关物质的水平影响肝癌的发展 [12]。索拉非尼是第一个被批准用于肝癌晚期全身治疗的药物,研究认为索拉非尼作为铁死亡诱导剂,可以作用于system XC−,消耗肝癌细胞内谷胱甘肽,导致脂质过氧化,最终引起肝癌细胞铁死亡,其作用与erastin相似 [13]。然而在肝癌的临床治疗中,使用索拉非尼后很快便可产生耐药性。因此寻找新的铁死亡靶点对治疗肝癌具有重要意义。MicroRNAs (miRNAs)是一类进化上保守的非编码RNA,作为基因表达的转录后调节因子,参与细胞增殖、凋亡等多种生物学过程 [14]。过去的研究认为,miRNA的作用机制是作为负调控因子在胞质中与靶mRNA结合导致靶mRNA的翻译抑制或引起靶mRNA的降解 [15]。最新的研究证实,miRNA同样存在于细胞核中。核内miRNA可通过结合增强子,改变增强子的染色质状态,从而激活基因的转录表达 [16]。诺贝尔奖得主菲利普·夏普(Phillip Allen Sharp)最新的研究也证实miRNA激活理论 [17],说明miRNA具有双重功能,在胞质中作为负向调控因子抑制基因表达,在细胞核内作为正向调控因子激活基因的转录。多项研究证实,miRNAs在肝癌的发生、发展中发挥着重要作用,并被认为可能成为新的肝癌治疗靶点 [18]。核受体共激活因子4 (Nuclear receptor coactivator 4, NCOA4)是一种选择性货物受体,与铁蛋白自噬关系紧密。NCOA4可以直接识别和结合FTH1介导铁蛋白自噬降解,释放大量游离铁,最终引起铁死亡 [19]。据报道,NCOA4表达水平同样受细胞内铁离子水平的影响,在铁充足的条件下,NCOA4可以与HERC2稳定结合。促进NCOA4蛋白酶体转换并降低细胞内NCOA4水平,促进铁蛋白积累和铁储存,在缺铁条件下,NCOA4-HERC2结合减弱,NCOA4的蛋白酶体转换减少导致NCOA4水平升高,加快铁蛋白自噬降解,从而增加游离铁 [20]。本研究中发现,过表达miR-485-3p后,促进了HepG2细胞的生长增殖,这与之前miR-485-3p促进肝癌进展的报道相符。有意思的是,我们研究发现在索拉非尼诱导下,过表达miR-485-3p后,HepG2细胞铁死亡指标出现了升高,抑制miR-485-3p的表达后细胞铁死亡指标出现了下降。说明miR-485-3p在HepG2细胞铁死亡的过程中起到了促进作用。过表达miR-485-3p后HepG2细胞中NCOA4的表达量升高,抑制miR-485-3p的表达后NCOA4的表达量出现降低。研究证实,NCOA4是铁死亡正向调控因子,敲低NCOA4抑制了erastin诱导的铁死亡,而NCOA4的过表达促进了铁死亡 [21]。说明miR-485-3p可以正向调控NCOA4的表达影响肝癌细胞HepG2的铁死亡,这引起了我们的兴趣。我们推测miR-485-3p正向调控NCOA4的机制可能有两种。一是miR-485-3p在细胞核内与增强子结合后,激活了转录表达,使得NCOA4表达升高。二是miR-485-3p在细胞质内起作用,通过沉默或降低某种分子的表达,间接地使NCOA4表达升高。然而,由于围绕正向miRNA调控机制的研究刚刚起步,其生物学意义和具体功能仍需要进一步的研究证实。
5. 结论
综上,我们证实了miR-485-3p可以正向调控NCOA4的表达并最终影响HepG2细胞的铁死亡。但是对于miR-485-3p调控NCOA4的具体机制以及该通路是否受其他分子的调控,仍需要进一步的研究证实。我们期待更深一步的研究能为肝癌的治疗提供新的可能的方案。
基金项目
国家自然科学基金资助项目,项目编号:81802414。
文章引用
孙文胜,刘之谦,李新章,姜继康,李 杰. miR-485-3p调控肝癌细胞铁死亡的分子机制研究
Research on Molecular Mechanism of miR-485-3p Regulation on Ferroptosis in Hepatocellular Carcinoma Cells[J]. 临床医学进展, 2023, 13(03): 4320-4327. https://doi.org/10.12677/ACM.2023.133620
参考文献
- 1. Chen, W.Q., Sun, K.X., Zheng, R.S., et al. (2018) Cancer Incidence and Mortality in China, 2014. Chinese Journal of Cancer Research, 30, 1-12. https://doi.org/10.21147/j.issn.1000-9604.2018.01.01
- 2. 付宇, 黄桂芹, 王英迪, 程润, 刘伟洁, 缪明星, 颜天华. 肿瘤细胞的铁死亡机制[J]. 生命的化学, 2022, 42(11): 1961-1967.
- 3. 殷军锋, 顾明. 沉默circ_0007385对结肠癌细胞增殖、迁移及凋亡的影响[J]. 临床外科杂志, 2022, 30(8): 762-766.
- 4. Taherdangkoo, K., Kazemi, N.S.R., Hajjari, M.R., et al. (2020) miR-485-3p Suppresses Colorectal Can-cer via Targeting TPX2. Bratislavske Lekarske Listy, 121, 302-307. https://doi.org/10.4149/BLL_2020_048
- 5. 祁海云, 王荣兰, 聂伟. miR-485-3p靶向NR1D2调控宫颈癌细胞增殖、迁移和侵袭的分子机制研究[J]. 中国优生与遗传杂志, 2021, 29(5): 618-623.
- 6. 艾尼•沙塔尔, 闫焕英, 丁伟, 阿迪力江, 苏鹏程. 长链非编码RNA MALAT1靶向miR-485-3p调控乳腺癌细胞对紫杉醇的耐药性[J]. 南方医科大学学报, 2020, 40(5): 698-702.
- 7. Wang, H., Wang, N., Zheng, X.L., et al. (2021) Circular RNA hsa_circ_0009172 Suppresses Gastric Cancer by Regulation of microRNA-485-3p-Mediated NTRK3. Cancer Gene Therapy, 28, 1312-1324. https://doi.org/10.1038/s41417-020-00280-7
- 8. Xiong, D.M., Sheng, Y.R., Ding, S.J., et al. (2016) LINC00052 Regulates the Expression of NTRK3 by miR-128 and miR-485-3p to Strengthen HCC Cells Invasion and Migration. Oncotarget, 7, 47593-47608. https://doi.org/10.18632/oncotarget.10250
- 9. Yang, H.P., Cho, M.E., Li, T.W.H., et al. (2013) MicroRNAs Regulate Methionine Adenosyltransferase 1A Expression in Hepatocellular Carcinoma. The Journal of Clinical Investi-gation, 123, 285-298. https://doi.org/10.1172/JCI63861
- 10. Sangokoya, C., Doss, J.F. and Chi, J.-T. (2013) Iron-Responsive miR-485-3p Regulates Cellular Iron Homeostasis by Targeting Ferroportin. PLOS Genetics, 9, e1003408. https://doi.org/10.1371/journal.pgen.1003408
- 11. Li, J., Cao, F., Yin, H.-L., et al. (2020) Ferroptosis: Past, Present and Future. Cell Death & Disease, 11, Article No. 88. https://doi.org/10.1038/s41419-020-2298-2
- 12. 潘亚芳, 郭玮. 肝癌中铁死亡的调控因素及潜在应用进展[J]. 中国临床医学, 2021, 28(6): 1050-1055.
- 13. 刘静, 刘文天. 铁死亡在消化系统肿瘤中的研究进展[J]. 临床与实验病理学杂志, 2022, 38(3): 331-333.
- 14. Yates, L.A., Norbury, C.J. and Gilbert, R.J.C. (2013) The Long and Short of MicroRNA. Cell, 153, 516-519. https://doi.org/10.1016/j.cell.2013.04.003
- 15. Towler, B.P., Jones, C.I. and Newbury, S.F. (2015) Mechanisms of Regulation of Mature miRNAs. Biochemical Society Transactions, 43, 1208-1214. https://doi.org/10.1042/BST20150157
- 16. Xiao, M., Li, J., Li, W., et al. (2017) MicroRNAs Activate Gene Tran-scription Epigenetically as an Enhancer Trigger. RNA Biology, 14, 1326-1334. https://doi.org/10.1080/15476286.2015.1112487
- 17. Suzuki, H.I., Young, R.A. and Sharp, P.A. (2017) Su-per-Enhancer-Mediated RNA Processing Revealed by Integrative MicroRNA Network Analysis. Cell, 168, 1000-1014.E15. https://doi.org/10.1016/j.cell.2017.02.015
- 18. Khare, S., Khare, T., Ramanathan, R. and Ibdah, J.A. (2022) Hepatocellular Carcinoma: The Role of MicroRNAs. Biomolecules, 12, 645. https://doi.org/10.3390/biom12050645
- 19. Fang, Y.Y., Chen, X.C., Tan, Q.Y., et al. (2021) Inhibiting Ferroptosis through Disrupting the NCOA4-FTH1 Interaction: A New Mechanism of Action. ACS Central Science, 7, 980-989. https://doi.org/10.1021/acscentsci.0c01592
- 20. Santana, C.N., Gikandi, A. and Mancias, J.D. (2021) The Role of NCOA4-Mediated Ferritinophagy in Ferroptosis. In: Florez, A.F. and Alborzinia, H., Eds., Ferroptosis: Mechanism and Diseases, Advances in Experimental Medicine and Biology, Vol. 1301, Springer, Berlin, 41-57. https://doi.org/10.1007/978-3-030-62026-4_4
- 21. Gryzik, M., Asperti, M., Denardo, A., et al. (2021) NCOA4-Mediated Ferritinophagy Promotes Ferroptosis Induced by Erastin, but Not by RSL3 in HeLa Cells. BBA—Molecular Cell Research, 1868, Article ID: 118913. https://doi.org/10.1016/j.bbamcr.2020.118913
NOTES
*通讯作者。