Advances in Clinical Medicine
Vol.
13
No.
04
(
2023
), Article ID:
64633
,
13
pages
10.12677/ACM.2023.134933
新生儿坏死性小肠结肠炎手术时机临床分析及其预测模型的构建
赵春阳,刘瑶,段于河,英庆龙,赵静,朱荣坤,邢茂青*
青岛大学附属医院小儿外科,山东 青岛
收稿日期:2023年3月26日;录用日期:2023年4月21日;发布日期:2023年4月27日

摘要
目的:根据Bell分期对新生儿坏死性小肠结肠炎(necrotizing enterocolitis, NEC)手术患儿进行分组及临床相关数据分析,比较得出治疗效果最佳时机,并探究构建Bell-II期至Bell-III期阶段的患儿手术时机预测模型,将手术时机的选择量化,为手术治疗NEC提供一定依据。方法:回顾性分析2006年6月至2021年6月于青岛大学附属医院小儿外科进行手术治疗的59例NEC患儿以及经过禁饮食胃肠减压等保守治疗72 h后病情好转的61名患儿临床资料,根据Bell分期将接受手术患儿分为Bell-II期手术组(n = 27)与Bell-III期手术组(n = 32),对照组为非手术组患儿。第一部分选取手术组与非手术组两组患儿入院诊断后治疗3天的临床数据如一般情况、生命体征和辅助检查等,以及对两手术组患儿围手术期临床数据的比较,选取敏感炎症指标降钙素原(PCT)、C反应蛋白(CRP)以及患儿住院时长和并发症情况,应用SPSS 25.0软件分析得出最佳手术时机;第二部分将两手术组数据采用R软件进行单因素和多因素Logistic回归筛选特异性指标,综合分析各项数据,建立手术时机预测模型,通过受试者工作特征(receiver operating characteristic, ROC)曲线下面积评估模型拟合效果并拟合优度验证。结果:第一部分数据显示相对照于非手术组患儿,手术组患儿病情指标进展有统计学意义,并且手术前和手术后Bell-III期手术组的 PCT、CRP水平均高于Bell-II期手术组(P < 0.05),且Bell-III期手术组的住院时间及并发症发生率水平均高于Bell-II期手术组(P < 0.05);Logistic单因素及多因素回归分析后显示术前血小板减少、中性粒细胞减少、酸中毒、腹胀和影像学Duke评分为对Bell-II期和Bell-III期手术时机差异产生影响的独立因素(P < 0.05);该手术时机预测模型ROC曲线下面积为0.9;拟合优度检验,评估预测模型准确度,得到c2 = 3.444,P = 0.9;绘制列线图的校准曲线为斜率接近1的直线。结论:Bell-II期手术患儿较Bell-III期手术患儿术后恢复好,并发症少,康复时间短;手术时机预测模型列线图有较好的准确性,对于已进入Bell-II期至Bell-III期阶段的NEC患儿在手术时机的量化选择上具有一定的临床参考价值。
关键词
新生儿坏死性小肠结肠炎,手术时机,预测模型

Clinical Analysis of Surgical Opportunity and Construction of Predictive Model for Neonatal Necrotizing Enterocolitis
Chunyang Zhao, Yao Liu, Yuhe Duan, Qinglong Ying, Jing Zhao, Rongkun Zhu, Maoqing Xing*
Department of Pediatric Surgery, Affiliated Hospital of Qingdao University, Qingdao Shandong
Received: Mar. 26th, 2023; accepted: Apr. 21st, 2023; published: Apr. 27th, 2023

ABSTRACT
Objective: According to Bell staging, the patients with necrotizing enterocolitis (NEC) were divided into groups and clinical data were analyzed, and the best treatment time was obtained. The prediction model of surgical opportunity from Bell-stage II to Bell-stage III was constructed, and the choice of surgical opportunity was quantified so as to provide a basis for surgical treatment of NEC. Methods: The clinical data of 59 children with NEC who underwent surgery in the Department of Pediatric surgery of the Affiliated Hospital of Qingdao University from June 2006 to June 2021 and 61 children who improved after 72 hours of conservative treatment such as fasting gastrointestinal decompression were retrospectively analyzed. According to Bell stage, the children were divided into Bell-stage II operation group (n = 27) and Bell-stage III operation group (n = 32), and the control group was non-operation group. In the first part, the clinical data such as general condition, vital signs and auxiliary examination 3 days after admission between the operation group and the non-operation group were selected, and the perioperative clinical data of the two groups were compared, and the sensitive inflammatory indexes such as procalcitonin (PCT), C-reactive protein (CRP), length of stay and complications were selected, and the best operation time was obtained by SPSS 25.0 software analysis. In the second part, the two groups of data were screened by single-factor and multi-factor Logistic regression with R software, and the surgical opportunity prediction model was established by comprehensively analyzing the data. The fitting effect of the model was evaluated by the area under the receiver working characteristic (ROC) curve and the goodness of fit was verified. Results: The first part of the data showed that the progress of disease index in the operation group was significantly higher than that in the non-operation group, and the levels of PCT and CRP in the Bell-stage III operation group before and after operation were higher than those in the Bell-stage II operation group (P < 0.05). The hospital stay and the incidence of complications in the Bell-stage III operation group were higher than those in the Bell-stage II operation group (P < 0.05). Logistic univariate and multivariate regression analysis showed that preoperative thrombocytopenia, neutropenia, acidosis and abdominal distension were independent factors affecting the surgical opportunity between Bell-stage II and Bell-stage III (P < 0.05). The area under the ROC curve of the operation timing prediction model is 0.9. The goodness-of-fit test was used to evaluate the accuracy of the prediction model, and c2 = 3.444, P = 0.9 was obtained. The calibration curve of the line chart is a straight line with a slope close to 1. Conclusions: The postoperative recovery of children with Bell-stage II operation is better than that of Bell-stage III operation, the complications are less and the recovery time is shorter. The surgical opportunity prediction model has a good accuracy, and it has a certain clinical reference value for the quantitative selection of surgical opportunity in children with NEC who have entered the stage from Bell-II to Bell-III
Keywords:Neonatal Necrotizing Enterocolitis, Surgical Opportunity, Prediction Model

Copyright © 2023 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
NEC是新生儿期常见的胃肠道外科急症 [1] ,NEC在极低出生体重儿中发病率约为5%~12%,是导致新生儿尤其是早产儿和低出生体重儿死亡的重要病因 [2] ,死亡率高达20%~30% [3] [4] 。虽然现在NEC临床诊断治疗较前及时,技术革新多,但NEC的诊疗效果进展仍不显著。
临床上广泛应用的Bell分期将NEC分为三期:I期可疑期、II期确诊期和III期进展期。当Bell-II期患儿出现生命体征的波动,腹膜炎体征或腹部包块形成时,可考虑进行手术探查 [5] 。当病程进展至Bell-III期,往往病情恶化进展加速,出现休克、DIC、腹胀加重以及肠穿孔等表现,此时成为手术治疗的绝对指征,但手术治疗作用局限,对预后转归影响大 [6] 。
当前关于NEC患儿的最佳手术时机尚有争论,如何针对患儿进行个体化评估,一直以来是个难题 [7] 。其发病机制尚不明确,临床通常通过患儿相关病史、高危因素及辅助检查指标包括早产 [8] [9] [10] 、呼吸窘迫 [11] 、喂养方式、实验室化验及影像学分析结合主观临床经验判断,缺乏综合直观的指标进行诊断。本研究拟回顾性分析进行手术治疗的NEC患儿相关参数,探讨NEC患儿的最佳手术时机,并且应用统计学方法制定一个评分模型并验证其在NEC手术时机预测准确性,完善NEC相关模型,为临床工作提供帮助。
2. 资料与方法
2.1. 分组标椎
① 将出现下列2项及2项以上特征:轻度代谢性酸中毒(pH 7.30~7.35)、轻度血小板减少、腹部触痛明确、影像学疑似腹水的患儿纳入Bell-II期手术组;② 将下列3项及3项以上特征:血压不稳、呼吸暂停、混合酸中毒、中性粒细胞减少、弥漫性腹膜炎体征明显、腹胀、腹壁红肿、腹水明确等表现的患儿纳入Bell-III期手术组。③ 非手术组:患儿出现腹胀,胃潴留呕吐、大便潜血阳性、影像学肠管扩张、禁饮食胃肠减压等保守治疗3天病情缓解。排除标准:消化道畸形,先天性代谢性疾病等。
2.2. 研究对象
回顾性选取2006年6月~2021年6月于青岛大学附属医院小儿外科进行手术治疗的NEC患儿61例,剔除2例放弃治疗患儿,参考第5版《实用新生儿学》NEC的诊断标准及Bell分期标准 [12] 并按照上述分组标准,将患儿分为Bell-II期手术组(27例)和Bell-III期手术组(32例)。本次研究得到患儿家属同意并已通过医院伦理委员会审核批准。
2.3. 数据整理
收集整理非手术组、Bell-II期手术组及Bell-III期手术组临床资料包括:1) 患儿一般情况,例如患儿性别、纠正纠正胎龄、体重等;2) 术前患儿症状体征如呼吸情况、心率变化、血压波动、体温变化及腹部查体情况等;3) 患儿术前相关辅助检查,如血常规、CRP、PCT、血气分析及影像学检查结果(DAAS评分),以及术后1月左右血常规、CRP、PCT结果,其中CRP、PCT是作为反映炎症程度指标;4) 患儿并发症和住院时间。5) 根据患儿复查结果,统计术后并发症如急性感染、弥漫性血管内凝血(DIC)等,并且收集远期预后不良结果如生长发育迟缓和神经发育不良。
2.4. 统计学方法
应用SPSS 25.0统计软件对数据进行统计学分析;使用4.2版本的R语言软件绘制相关列线图及ROC曲线。计量资料通过设计标准转化为二分类变量。计量资料首先应用Shapiro-Wilk正态性检验,连续正态分布且方差齐数据用平均数 ± 标准差(x ± s)表示并且使用t检验进行组间比较;偏态分布和/或方差不齐的连续数据采用中位数(四分位数间距) [M(P25, P75)]表示,并通过Mann-Whitney U检验比较组间比较。计数资料采用频数(%)表示,并用χ2检验或Fisher确切概率法。临床资料采用单因素及多因素Logistic回归模型筛选能够成为Bell-III期手术的独立影响因素。通过导入R软件绘制相关列线图、ROC曲线和决策曲线(DCA曲线)。P < 0.05为差异有统计学意义。
3. 结果
3.1. 一般情况比较
非手术组中,男29例,女32例;手术组中,男27例,女32例,性别差异无统计学意义(P = 0.845)。非手术组中,平均纠正胎龄(34.03 ± 2.815)周,出生时体重2340~4080 g,平均出生时体重(2798.21.7 ± 480.82) g;手术组中,平均纠正胎龄(33.04 ± 2.92)周,出生时体重1150~4080 g,平均出生时体重(2774.57 ± 673.11) g,其中纠正胎龄差异具有统计学意义(P = 0.003),出生体重比较无统计学意义(P = 0.59),见表1。
Table 1. Comparison of general conditions between non-operation group and operation group
表1. 非手术组与手术组一般情况对比
手术组临床表现分析中,患儿血小板减少、CRP升高、酸中毒、合并败血症、Duke评分(DAAS) ≥ 8、嗜睡和腹壁红肿的发生水平均高于非手术组患儿,其差异具有统计学意义(P < 0.05),见表2。
Table 2. Analysis of clinical manifestations between non-operation group and operation group
表2. 非手术组与手术组临床表现分析
注:a. 体温<35℃或>38.5℃;b. 收缩压低于60 mmHg;c. 安静状态下心率> 140次/分;d. 血小板计数 < 100 × 109/L;e. 白细胞计数 > 5 × 109/L或<20 × 109/L;f. 中性粒细胞计数 < 1.5 × 109/L;g. Duke评分包括0分:肠腔充气正常;1分:肠腔充气表现为轻度扩张;2分:肠腔充气表现为中度扩张或者肠腔充气表现正常但存在粪便样透影;3分:肠腔充气表现为肠襻有局部性中度扩张;4分:存在肠襻分离或者肠道间隙局部性增厚;5分:存在多处肠道间隙增厚;6分:可能存在肠壁积气;7分:肠襻固定或者存在持续扩张;8分:临床确诊为或者高度怀疑肠壁积气;9分:存在门静脉积气;10分:存在气腹。
Bell-II期组中,男15例,女12例;Bell-III期组中,男14例,女18例,性别差异无统计学意义(P = 0.366)。Bell-II期组中,平均纠正胎龄(33.07 ± 2.43)周,出生时体重1150~4080 g,平均出生时体重(2698.7 ± 691.30) g;Bell-III期组中,平均纠正胎龄(33.02 ± 3.30)周,出生时体重1300~4080 g,平均出生时体重(2540.65 ± 655.29) g,两组的一般资料比较无统计学意义(P > 0.05),见表3。
Table 3. Comparison of general conditions between the Bell-II surgery group and the Bell-III surgery group
表3. Bell-II期手术组与Bell-III期手术组一般情况对比
3.2. 两组不同时期的PCT、CRP水平、术中病变范围和住院时长及并发症的比较
手术前和手术后Bell-III期手术组的PCT、CRP水平均高于Bell-II期手术组(P < 0.05,图1)。
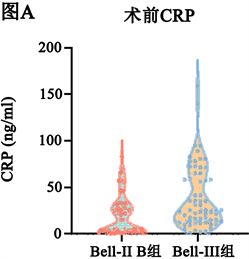
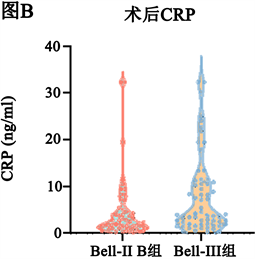
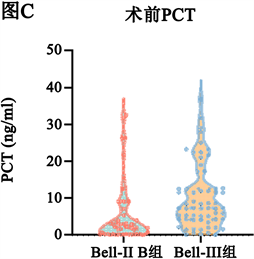
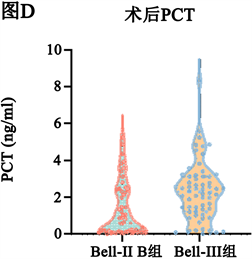
Figure 1. Statistical test of the preoperative and postoperative CRP and PCT data of the two groups showing in violin diagrams. (A) (B) There was significant difference in CRP between the two groups before and after operation, Mann-Whitney U test, P < 0.05; (C) (D) There was significant difference in PCT between the two groups before and after operation, Mann-Whitney U test, P < 0.05
图1. 两组患儿术前与术后CRP、PCT情况比较。(A) (B) 两组间手术前后CRP差异有统计学意义,Mann-Whitney U检验P < 0.05;(C) (D) 两组间手术前后PCT差异有统计学意义,Mann-Whitney U检验P < 0.05
术中发现Bell-III期手术组患儿病变范围较Bell-II期手术组大(P < 0.05,见表4)。
Table 4. Comparison of lesion size between the Bell-II surgery group and the Bell-III surgery group
表4. Bell-II期手术组与Bell-III期手术组病变范围对比
在NEC恢复期可能出现的并发症,急性期并发症:感染并发症(脓毒症、脑膜炎、腹膜炎、脓肿形成)、DIC、呼吸循环系统衰竭;晚期并发症:肠狭窄、肠衰竭、短肠综合征、复发NEC、粘连性肠梗阻。远期预后不良:生长发育延迟、神经发育不良(如脑性瘫痪、认知障碍及视力障碍等)。
Bell-III期手术组的住院时间、并发症及预后不良发生率水平均高于Bell-II期手术组,且差异具有统计学意义(P < 0.05),见表5。
Table 5. Comparison of postoperative prognosis between the two groups of children
表5. 两组术后预后情况对比
3.3. 影响NEC患儿手术时机预测的单因素分析
本研究共纳入59例手术患儿,其中根据患儿进行手术的时期分别纳入II期手术组(n = 27, 45.8%)和III期手术组(n = 32, 54.2%)。单因素分析结果提示III期手术组呼吸机使用时间 > 7天、术前血小板减少、中性粒细胞减少、CRP升高、Duke评分 > 8、酸中毒、腹胀、嗜睡、腹壁红肿构成比明显高于II期手术组,差异有统计学意义(P < 0.05)。见表6。
Table 6. Single factor analysis of influencing the prediction of NEC operation opportunity
表6. 影响NEC手术时机预测的单因素分析
3.4. 影响NEC患儿手术时机预测的多因素分析
将单因素分析有统计学意义的变量呼吸机使用时间 > 7天、术前血小板减少、中性粒细胞减少、CRP升高、Duke评分 > 8、酸中毒、腹胀、嗜睡、腹壁红肿作为自变量,是否为Bell-III期手术作为因变量,多因素Logistic回归分析提示术前血小板减少、中性粒细胞减少、酸中毒、腹胀和影像学Duke评分为对Bell-II期和Bell-III期手术时机差异产生影响的独立因素(P < 0.05)。见表7。
Table 7. Multivariate Logistic regression analysis of factors affecting the prediction of NEC operation opportunity
表7. 影响NEC手术时机预测的多因素Logistic回归分析
3.5. 手术预测模型的建立和验证
根据上述数据利用R软件建立NEC手术时机预测模型列线图,见图2。列线图中显示的各项预测指标对应分数之和为总分,总分所对应的概率即为NEC患儿此时需要手术的预测概率。其中包括血小板减少对应100分的权重,中性粒细胞减少对应75分的权重,合并酸中毒对应60分的权重,合并腹胀对应62.5分的权重,影像学危急值对应65分的权重。
3.6. 预测模型的验证
采用ROC曲线检验评价预测模型区分能力,见图3。最靠近左上角的最佳临界点为(0.905, 0.783),Youden指数为0.688,得到的曲线下面积为0.9。绘制列线图校准曲线,得到斜率接近于1的直线,并进行Hosmer-Lemeshow拟合优度检验,评估预测模型准确度,得到c2 = 3.444,P = 0.9,提示列线图预测风险准确度良好,见图4。
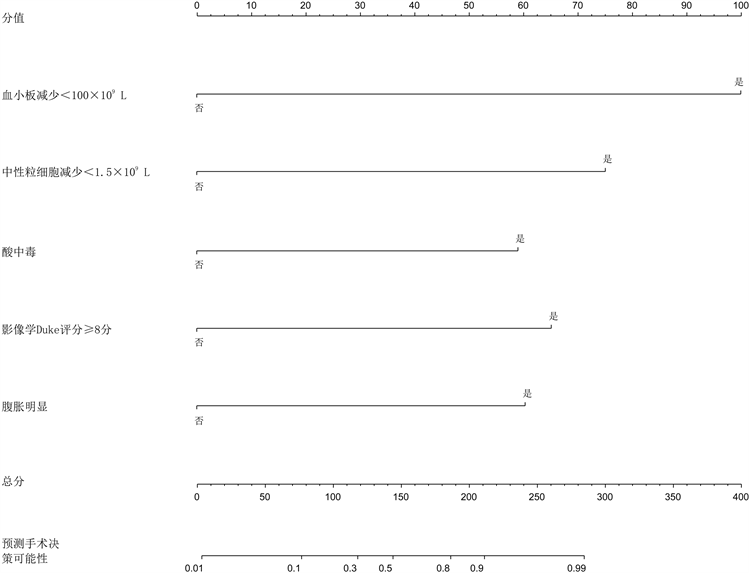
Figure 2. Nomogram prediction model
图2. 列线图预测模型
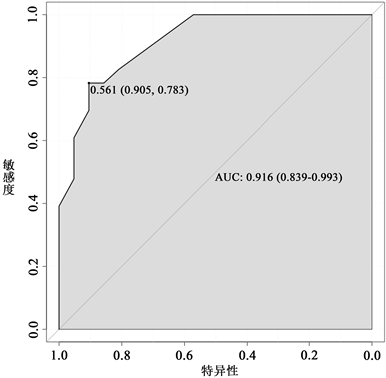
Figure 3. Prediction effect ROC curve
图3. 预测效果ROC曲线

Figure 4. Predictive model calibration curve
图4. 预测模型校准曲线
4. 讨论
在本研究中,非手术组患儿病情较手术组患儿情况稳定,各项临床指标均优于手术组患儿(P < 0.05),且保守治疗72 h病情缓解,而手术组患儿在保守治疗期间各项关键指标如症状体征、PLT水平和影像学检查提示情况恶化等,非手术不能缓解。术前和术后1月时,Bell-III期组的CRP和PCT水平均高于Bell-II期,差异存在统计学意义(P < 0.05)。CRP是反映机体炎性反应和组织受损的重要生化指标,并且可以反映NEC病情的转归 [13] 。当患儿发生NEC时可引起相应的肠道急性炎症及肠管受损,这种急性时相蛋白会在短时间内分泌增加,并会随着病情发展水平随之升高。在机体受到感染的冲击时,PCT水平也显著升高,对NEC的诊断具有十分重要的作用,可作为评估病情程度及预后的敏感指标,对于早期预测患儿预后有重要的临床价值 [14] 。
并且研究的结果表明,早期手术治疗术中发现病变范围明显较晚期手术局限,Bell-II期组患儿住院天数显著少于Bell-III期组,Bell-II期组术后患儿并发症和远期预后不良均少于Bell-III期组,说明及早进行手术对NEC患儿改善预后结局起到积极有利的作用,能够提高患儿的耐受能力和存活率,因此,相比而言,NEC患儿于Bell-II期手术为佳,与Munaco等人观点一致 [15] 。
关于手术时机的讨论还有学者表示按照Bell分期难以保证预估病情的实效性,并建议在出现病情恶化前行手术治疗 [16] 。同样地,张志波认为最佳手术时机为肠管坏死而肠内容物尚未进入腹腔时,可以考虑Bell-II期的局部腹膜炎体征为较好的手术时机 [5] 。刘斌认为限于病情变化及现有技术手段检查较难发现这一良机,只能将手术风险更大的肠穿孔作为NEC手术的绝对指征 [17] 。往往患儿发生肠道穿孔后再进行手术,无法保证患儿生存率及预后质量水平的提高 [18] 。及早判断预测新生儿NEC手术时机,有助于更好地控制病情发展,减少住院时间以及并发症发生率,具有重要临床意义,在此基础上我们构建预测模型量化提示NEC手术时机。
简捷、直观的列线图可以展现出现临床事件的风险大小,它可通过评分相加,方便实用,被广泛应用于临床 [19] [20] 。本研究显示,血小板减少、中性粒细胞减少、酸中毒、腹胀和影像学危急值可以作为预测手术时机的影响指标。相对应的,对于NEC患儿列线图模型预测总分超过285分,则表示患儿的病情有99%的可能性从Bell-II期进展至Bell-III期,并且存在行手术治疗的必要。目前现有的模型旨在预测NEC的发生。国外有专家结合影像学检查包括腹部X线和腹部超声分析,探索出手术预测模型,可指导腹部X线无明显气腹的可疑NEC患者的手术决策 [21] 。另有手术预测模型研究提出白细胞计数、血小板计数和CRP水平联合预测早期NEC患儿是否需要手术 [22] 。
本研究显示PLT是NEC进展的一个重要客观指标,Bell-III期PLT < 100 × 109/L的患儿要多于Bell-II期的患儿。MINER等 [23] 发现Bell-III期患儿的PLT明显低于Bell-II期患儿(P < 0.001)。一般来说,在NEC发病前期PLT升高,随着病情进展而逐渐降低,可能原因是细菌释放内毒素造成PLT破坏增多,生成减少 [24] ,炎症过程中发生弥散性血管内凝血(DIC),可进一步造成PLT的减少 [25] 。黄艳等人发现PLT持续下降提示预后不良,其临界值为95.5 × 109/L [26] 。其他研究认为PLT的大幅下降被认为可以预测肠坏疽的存在 [27] 。本研究结果表明中性粒细胞减少预示着NEC病情恶化。发病时,中性粒细胞从骨髓中大量释放,外周血呈现中性粒细胞增多表现,随着感染加重,中性粒细胞在杀死吞噬细菌等异物后,自身破坏增多,造成数量减少。有人认为,当肠穿孔后,大量肠道污染物腹腔内扩散,腹膜发挥包裹作用,外周血中性粒细胞趋向腹膜 [28] 引起其数值的降低。本研究中,两期的患儿均合并不同程度酸中毒,Bell-III期患儿常常合并代谢性酸中毒和呼吸性酸中毒及电解质紊乱,酸中毒程度较Bell-II期重,当血气分析pH < 7.2时,难以纠正的酸中毒影响内脏器官功能,加重病情,形成恶性循环,这提示我们在病情发展阶段密切关注患儿内环境稳态的重要性,从而降低NEC患儿的死亡率 [29] 。NEC的诊疗中影像学检查极其重要,主要包括腹部平片和腹部超声,而超声在检测肠壁和门静脉积气以及气腹方面更加敏感 [30] 。为了使影像学报告更量化直观,我们采用了Coursey的DAAS评分 [31] 。笔者认为DAAS评分对于两者都适用,可以两种检查同时进行,提高影像学诊断的敏感度,为临床医师提供更好的决策。医生对待阴性影像学报告体征需要谨慎,不能根据这些阴性条件否定NEC的存在放弃手术 [16] ,这需要存疑但积极的态度,反复多次定时检测,综合评估,不能因为迟疑而延误最佳手术时机。随着技术的发展,腹腔镜的出现给NEC手术指征指明了一条道路,可将腹腔镜作为有创检查手段,更直观的发现病变部位,从而明确诊断 [32] 。如果镜下操作困难,必要时行中转开腹探查,及时手术切除坏死肠断,避免病情进一步恶化。
本研究研究表明了在NEC患儿Bell-II期行手术在临床治疗效果上优于Bell-III期手术治疗,并且根据这一研究信息构建了NEC手术时机预测模型,为临床判断NEC更好的手术时机提供支持。但是本研究纳入患儿数量有限,还需要进一步开展多中心长期随访观察进一步完善数据并深入论证。
综上所述,对于进入Bell-II期的NEC患儿,及早手术可较好地控制病情,减少术后住院时间以及术后并发症,获得良好预后。NEC手术时机预测列线图模型具有良好的区分度和准确度,可有效预测病情发展,减少观察病情变化的时间浪费,有助于评估手术时机决策,对NEC的手术治疗提供一定的支持。
文章引用
赵春阳,刘 瑶,段于河,英庆龙,赵 静,朱荣坤,邢茂青. 新生儿坏死性小肠结肠炎手术时机临床分析及其预测模型的构建
Clinical Analysis of Surgical Opportunity and Construction of Predictive Model for Neonatal Necrotizing Enterocolitis[J]. 临床医学进展, 2023, 13(04): 6668-6680. https://doi.org/10.12677/ACM.2023.134933
参考文献
- 1. Sylvester, K.G., Liu, G.Y. and Albanese, C.T. (2012) Necrotizing Enterocolitis. In: Coran, A.G., Ed., Pediatric Surgery, 7th Edition, Elsevier Saunders, New York, 1187-1207. https://doi.org/10.1016/B978-0-323-07255-7.00094-5
- 2. Sheng, Q., Lv, Z., Xu, W., et al. (2016) Short-Term Surgical Outcomes of Preterm Infants with Necrotizing Enterocolitis: A Single-Center Experience. Medicine (Baltimore), 95, e4379. https://doi.org/10.1097/MD.0000000000004379
- 3. Patel, R.M., Kandefer, S., Walsh, M.C., et al. (2015) Causes and Timing of Death in Extremely Premature Infants from 2000 through 2011. The New England Journal of Medicine, 372, 331-340. https://doi.org/10.1056/NEJMoa1403489
- 4. Pisano, C., Galley, J., Elbahrawy, M., et al. (2020) Human Breast Milk-Derived Extracellular Vesicles in the Protection against Experimental Necrotizing Entero-colitis. Journal of Pediatric Surgery, 55, 54-58. https://doi.org/10.1016/j.jpedsurg.2019.09.052
- 5. 张志波. 新生儿坏死性小肠结肠炎: 从Bell分期解读到手术指征的把握[J]. 临床小儿外科杂志, 2022, 21(4): 306-309.
- 6. 冉云, 文剑波. 新生儿坏死性小肠结肠炎的发病机制及防治进展[J]. 赣南医学院学报, 2020, 40(6): 611-615.
- 7. 中华医学会小儿外科分会新生儿外科学组. 新生儿坏死性小肠结肠炎外科手术治疗专家共识[J]. 中华小儿外科杂志, 2016, 37(10): 724-728.
- 8. 陈超. 新生儿坏死性小肠结肠炎的临床问题及防治策略[J]. 中华儿科杂志, 2013, 51(5): 321-325. https://doi.org/10.3760/cma.j.issn.0578-1310.2013.05.001
- 9. 范文婷, 廖伟. 新生儿坏死性小肠结肠炎发生的主要危险因素及手术时机对预后影响的回顾性分析[J]. 川北医学院学报, 2019, 34(6): 679-682.
- 10. 蔡岳鞠, 瞿柳红, 李薇, 等. 新生儿坏死性小肠结肠炎临床特点及预后不良危险因素多中心研究[J]. 中华实用儿科临床杂志, 2019, 34(1): 24-29. https://doi.org/10.3760/cma.j.issn.2095-428X.2019.01.006
- 11. Eaton, S., Rees, C.M. and Hall, N.J. (2017) Current Research on the Epidemiology, Pathogenesis, and Management of Necrotizing Enterocol-itis. Neonatology, 111, 423-430. https://doi.org/10.1159/000458462
- 12. 邵肖梅, 叶鸿瑁, 丘小汕. 实用新生儿学[M]. 第5版. 北京: 人民卫生出版社, 2019: 633-634.
- 13. Benkoe, T.M., Mechtler, T.P., Weninger, M., et al. (2014) Serum Levels of Interleukin-8 and Gut-Associated Biomarkers in Diagnosing Necrotizing Enterocolitis in Preterm Infants. Journal of Pediatric Surgery, 49, 1446-1451. https://doi.org/10.1016/j.jpedsurg.2014.03.012
- 14. 汪莉, 倪申旺, 朱克然, 等. C-反应蛋白、降钙素原在新生儿坏死性小肠结肠炎患儿的水平变化及临床意义[J]. 中国当代儿科杂志, 2018, 20(10): 825-830.
- 15. Munaco, A.J., Veenstra, M.A., Brownie, E., et al. (2015) Timing of Optimal Surgical Intervention for Neonates with Necrotizing Enterocolitis. The American Surgeon, 81, 438-443. https://doi.org/10.1177/000313481508100521
- 16. Eltayeb, A.A., Mostafa, M.M., Ibrahim, N.H. and Eltayeb, A.A. (2010) The Role of Surgery in Management of Necrotizing En-terocolitis. International Journal of Surgery (London, England), 8, 458-461. https://doi.org/10.1016/j.ijsu.2010.06.005
- 17. 刘斌, 刘远梅. 新生儿坏死性小肠结肠炎外科诊疗进展[J]. 中国普通外科杂志, 2015, 24(10): 1463-1467.
- 18. 安瑶, 李禄全. 新生儿坏死性小肠结肠炎手术指征的研究进展[J]. 发育医学电子杂志, 2017, 5(2): 118-121.
- 19. Liu, Y.F., Liu, J.E., Zhu, Y., et al. (2021) Development and Vali-dation of a Nomogram to Predict the Risk of Breast Cancer-Related Lymphedema among Chinese Breast Cancer Survi-vors. Support Care Cancer, 29, 5435-5445. https://doi.org/10.1007/s00520-021-06122-y
- 20. Wang, W., Yang, Z. and Ouyang, Q. (2020) A Nomogram to Predict Skip Metastasis in Papillary Thyroid Cancer. World Journal of Surgical Oncology, 18, 167. https://doi.org/10.1186/s12957-020-01948-y
- 21. Lazow, S.P., Tracy, S.A., Staffa, S.J., et al. (2021) Abdominal Ultrasound Findings Contribute to a Multivariable Predictive Risk Score for Surgical Necrotizing Enterocolitis: A Pilot Study. The American Journal of Surgery, 222, 1034-1039. https://doi.org/10.1016/j.amjsurg.2021.04.025
- 22. Yu, M., Liu, G., Feng, Z. and Huang, L. (2018) Combination of Plasma White Blood Cell Count, Platelet Count and C-Reactive Protein Level for Identifying Surgical Necrotizing Enterocolitis in Preterm Infants without Pneumoperitone-um. Pediatric Surgery International, 34, 945-950. https://doi.org/10.1007/s00383-018-4305-6
- 23. Miner, C.A., Fullmer, S., Eggett, D.L., et al. (2013) Factors Affecting the Severity of Necrotizing Enterocolitis. The Journal of Ma-ternal-Fetal & Neonatal Medicine, 26, 1715-1719. https://doi.org/10.3109/14767058.2013.798283
- 24. 杨磊, 徐巍, 李永伟, 等. 腹部超声在新生儿坏死性小肠结肠炎诊断及病情评估中的价值[J]. 中国当代儿科杂志, 2016(2): 108-112.
- 25. 焦建成, 余加林. 血小板计数与新生儿败血症预后关系分析[J]. 重庆医学, 2010(15): 1970-1972.
- 26. 黄艳, 梁小琴, 张敏, 等. 新生儿坏死性小肠结肠炎检测指标与预后的相关性分析[J]. 国际儿科学杂志, 2018, 45(7): 567-571. https://doi.org/10.3760/cma.j.issn.1673-4408.2018.07.019
- 27. Kenton, A.B., O’Donovan, D., Cass, D.L, et al. (2005) Severe Thrombocytopenia Predicts Outcome in Neonates with Necrotizing En-terocolitis. Journal of Perinatology, 25, 14-20. https://doi.org/10.1038/sj.jp.7211180
- 28. Balcom, R.J., Clark, D.A., Rokahr, J., Guancial, R. and Rathbun, S. (1985) Peritoneal Neutrophilic Cell Response in Necrotizing Enterocol-itis. The American Journal of Diseases of Children, 139, 701-704. https://doi.org/10.1001/archpedi.1985.02140090063030
- 29. Badowicz, B. (2000) NEC-Neonatal Necrotizing En-terocolitis—Methods of Treatment and Outcome: A Comparative Analysis of Scottish (Glasgow) and Polish (Western Pomerania) Case. Annales Academiae Medicae Stetinensis, 46, 137-149.
- 30. Epelman, M., Daneman, A., Navarro, O.M., et al. (2007) Necrotizing Enterocolitis: Review of State-of-the-Art Imaging Findings with Pathologic Correlation 1. Radiographies, 27, 285-305. https://doi.org/10.1148/rg.272055098
- 31. Coursey, C.A., Hollingsworth, C.L., Wriston, C., et al. (2009) Radiographic Predictors of Disease Severity in Neonates and Infants with Necrotizing Entero-colitis. American Journal of Roentgenology, 193, 1408-1413. https://doi.org/10.2214/AJR.08.2306
- 32. 胡博, 戴春娟, 赵旭稳, 等. 新生儿坏死性小肠结肠炎手术探查指征评价体系的临床研究[J]. 中华小儿外科杂志, 2015, 36(2): 89-94. https://doi.org/10.3760/cma.j.issn.0253-3006.2015.02.004
NOTES
*通讯作者Email: maoqingxing1966@163.com
