World Journal of Cancer Research
Vol.1 No.1(2011), Article ID:299,6 pages DOI:
Effect Mechanism of Resveratrol Induces SGC-7901 Apoptosis via Ca2+Signal Pathway
Tianjin University of Commerce, Tianjin
Email: anpeng19831021@tjcu.edu.cn
Received: Sep. 6th, 2011; revised: Sep. 21st, 2011; accepted: Sep. 29th, 2011.
ABSTRACT:
Objective: To study effect of resveratrol (Res) induce SGC-7901 cell apoptosis via Ca2+ signal. Methods: Use the MTT method to test the inhibition rates of Res in SGC-7901 tumor cells; Use FCM to detect the influence of the Res on tumor cell apoptosis and cell cycle; Use fluorescence microscope to identify the tumor cell apoptosis in the morphology. Results: Res inhibit SGC-7901 cell proliferatrion in a dosedependent manner, Its IC50 is 164.69 μmol·L–1. When the concentration of Res is 44, 88, 176 μmol·L–1, the rates of proliferatrion are 29.693%, 33.986%, 85.634%. G1 term is gradually diminished, S term become gradually increasement. G2/M term become gradually reduction. According to the morphology, the apoptosis body become increase, tumor cell’s caryoplasm become reduction and tumor cell karyopyknosis, the extent of the colour become deeply with the concentration of the Res. content of Ca2+ are 18.046 ± 1.0798; 19.7550 ± 2.1129; 26.6300 ± 2.0813 respectively. Conclusion: Res can inhibit the tumor cell prolieratrion and induce the tumor cell apoptosis via Ca2+ sigal pathway.
Keywords: resveratrol; SGC-7901; cell proliferation; cell cycle; Ca2+
Ca2+信号通路介导白藜芦醇诱导SGC-7901肿瘤 细胞凋亡的研究
安 鹏,姜子涛
天津商业大学,天津
Email: anpeng19831021@tjcu.edu.cn
摘 要:
目的:研究白藜芦醇(Res)诱导SGC-7901肿瘤细胞凋亡的Ca2+信号通路的机制。方法:MTT法测定Res对SGC-7901细胞抑制率;流式细胞仪检测Res对肿瘤细胞凋亡和肿瘤细胞周期的影响;荧光显微镜从形态学鉴定肿瘤细胞凋亡。激光共聚焦法测定白藜芦醇对肿瘤细胞Ca2+活性的影响。结果:Res明显抑制肿瘤细胞的增值,且呈一定剂量依赖关系,其IC50为164.69 μmol·L–1,当Res剂量为44、88、176 μmol·L–1时,肿瘤细胞的抑制率为:29.693%,33.986%,85.634%;此外,肿瘤细胞周期G1期细胞的比例减少,S期细胞的比例增加,G2/M期减小;通过形态学观察发现,随着Res剂量的增加,镜下凋亡细胞比例逐渐增加,肿瘤细胞的核浆比减小,细胞核高度固缩,染色程度加深,凋亡小体的数量不断增加。其对Ca2+含量的影响分别为18.0463 ± 1.0798、19.7550 ± 2.1129和26.6300 ± 2.0813。结论:Res明显抑制SGC-7901细胞的增殖且诱导其凋亡并影响Ca2+信号通路。
收稿日期:2011年9月6日,修回日期:2011年9月21日;录用日期:2011年9月29日
关键词:Res;SGC-7901;细胞增殖;细胞周期;Ca2+
1. 引言
白藜芦醇(Resveratrol Res)属非黄酮类多酚物质,是植物在恶劣环境下或遭到病原体侵害时自身分泌的一种植物抗毒素,已在72种植物中被发现[1]。早期研究发现,Res具有保护心血管、抗病原微生物和护肝等多种生物学作用,自从Jang et al.[2]于1997年系统地报道了Res的抗肿瘤作用后,迄今发现他能抑制多种癌细胞的生长,包括胃癌、肠癌、乳腺癌、白血病等,但其作用机制仍未明确。本实验旨在研究Res对人胃腺癌SGC-7901细胞增殖的影响。
2. 材料与方法
2.1. 材料
人胃腺癌细胞(SGC-7901)由哈尔滨商业大学药物研究所博士后科研工作站传代保种;白藜芦醇(Res,纯度为98%,分子量为228.2)和Hoechst 33258购于Sigma公司;RPMI1640培养基和胰蛋白酶购于GIBCO;胎牛血清购于Hyclone;PI购于Invitrodrion;SANYO MC0175型CO2培养箱(日本三洋公司);CLOUTER EPICS-XL流式细胞仪(美国BeckmanCoulter公司);荧光显微镜(Leica公司);SUNRISE 酶标仪(瑞士TECAN公司)。
2.2. 方法
2.2.1. 细胞培养
实验所用细胞于含5% CO2的37˚C培养箱中培养传代,培养基为RMPI1640培养液(含10%胎牛血清、100 U/ml青霉素和100 μg/ml链霉素);用0.25%胰酶-EDTA消化传代,每周传代两次。
2.2.2. MTT法测定Res对肿瘤细胞抑制作用
将对数生长期的SGC-7901细胞用胰酶消化后配制成浓度为1 × 104细胞/ml的细胞液,按1000个/孔接种于96孔板,每孔加100 μl。次日加入低、中、高剂量(分别为44,88,176 μmol·L–1)的Res及相应溶剂对照的新鲜培养液,每孔加100 μl,每组设三个平行孔,重复三次,于37℃继续培养72 h后,弃上清,每孔加100 μl新鲜配制的含0.5 mg/ml MTT的无血清培养液,继续培养4 h,弃培养上清,每孔加200 μl DMSO溶解MTT甲簪沉淀,用微型振荡器振荡混匀,用SUNRISE型酶标仪在参考波长450 nm,检测波长570 nm条件下测定光密度值(OD),以溶剂对照处理的肿瘤细胞为对照组,用下面公式计算药物对肿瘤细胞的抑制率,并按中效方程计算IC50[3]:

2.2.3. 形态学检测Res对肿瘤细胞凋亡研究
取指数生长期的人胃腺癌细胞SGC-7901加入适量0.25%胰蛋白酶液消化细胞,使贴壁细胞脱落。用含10%胎牛血清的培养基制备成浓度为3 × 105/ml的细胞悬液,于6孔板中每孔接种1 ml。将培养板置于37℃、5%CO2培养箱。24 h贴壁后加入不同浓度的Res(终浓度为44, 88, 176 μmol·L–1);阳性对照组加终浓度为153.8 μmol·L–1的5-FU;阴性对照组加入等体积不含药物的培养液。48 h后细胞用胰酶消化,PBS洗一遍,将细胞收集利用Hoechst 33258染色利用荧光显微镜进行观察[4]。
2.2.4. Res对肿瘤细胞凋亡作用的研究
将对数生长期细胞接种于6孔培养板中,细胞浓度为1 × 106个/ml,置于37℃,5%CO2条件培养箱中,24 h后加入不同浓度的Res(终浓度为44,88,176 μmol·L–1);阳性对照组加终浓度为153.8 μmol·L–1的5-FU;阴性对照组加入等体积不含药物的培养液。48 h后细胞用胰蛋白酶消化,PBS洗2次,70%冷乙醇固定,置入4℃冰箱中保存12 h以上,离心,用PBS液除尽乙醇,离心后的细胞重悬于浓度为50 μg/ml PI染液,37℃避光温育30 min,300目尼龙网过滤后,在CLOUTER EPICS-XL型流式细胞仪上测定凋亡细胞所占比例。检测细胞数为104个。激发波长488 nm,发射波长630 nm[5]。
2.2.5. Res对肿瘤细胞周期作用的研究
取指数生长期的人胃腺癌细胞SGC-7901,PBS洗2遍后,加入适量0.25%胰蛋白酶液消化,使贴壁细胞脱落。用含10%胎牛血清的培养基制备成浓度为3 × 105/ml的细胞悬液,于6孔板中每孔接种1 ml。将培养板置于37℃、5% CO2培养箱。24 h贴壁后加入不同浓度的Res(终浓度为44, 88, 176 μmol·L–1);阳性对照组加终浓度为153.8 μmol·L–1的5-FU;阴性对照组加入等体积不含药物的培养液。48 h后细胞用胰酶消化,离心收集细胞,细胞沉淀用70%乙醇悬浮,在4℃冰箱固定12 h以上。固定后的细胞用PBS洗两遍并悬浮之,加入PI染液(终浓度为50 μg/ml),37℃避光温育30 min,300目尼龙网过滤后,在CLOUTER EPICS-XL型流式细胞仪上分析细胞周期(激发波长488 nm,发射波长630 nm)[6]。
2.2.6. Res对肿瘤细胞Ca2+含量的影响
指数生长期的人胃腺癌细胞SGC-7901、人肝癌细胞HepG-2,加入适量0.25%胰蛋白酶液消化细胞,使贴壁细胞脱落。用含10%胎牛血清的培养基制备成浓度为3 × 105/ml的细胞悬液,于6孔板中每孔接种1ml。将平板置于37℃、5% CO2培养箱。24 h后不同浓度的RES,使其终浓度分别44、88、176 μmol·L–1;阳性对照组加5-FU,其终浓度为153.8 μmol·L–1;阴性对照组加入不含药物相同体积的培养液。药物作用48 h后吸出培养皿中的培养液,加胰酶消化,用无钙台式液洗一遍;加入浓度为4 μg/ml的Fluo-3/AM荧光探针200 μl,37℃避光温育30 min;将孔中的盖玻片取出,盖在载玻片上,避光,激光共聚焦显微镜扫描观察。激发波长488 nm,发射波长540~570 nm。
3. 结果
3.1. MTT法测定Res对肿瘤细胞抑制作用
阴性对照抑制率为0,阳性对照抑制率为34.76%,明显高于阴性对照;Res各剂量组抑制率明显高于阴性对照,并呈剂量–效应关系,其中IC50为164.69 μmol·L–1(见图1)。
3.2. 形态学观察Res对肿瘤细胞凋亡影响
加入Res后,出现大量凋亡细胞,且呈剂量依赖效应;凋亡细胞染色体DNA断裂并聚集成细小的凝
聚块,细胞形态不整齐,部分细胞胞核染色质分布不均匀,胞核染色质浓缩,边集,其中Res(176 μmol·L–1)组多数细胞死亡(见图2)。
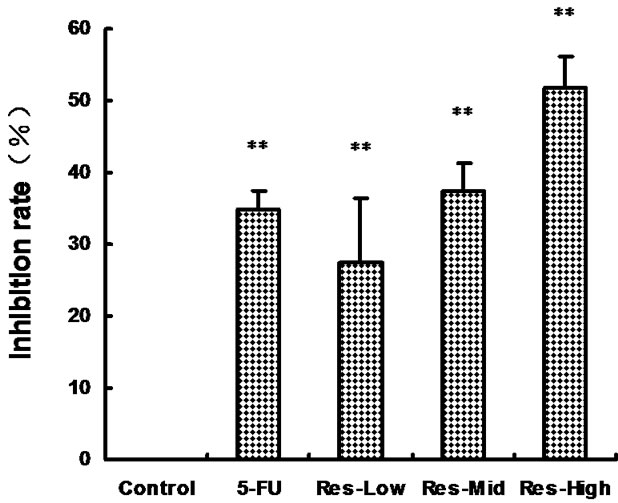
Figure 1. The relationship between the Res concentration and the Inhibition rates in SGC-7901. ** P < 0.01 vs Control
图1.
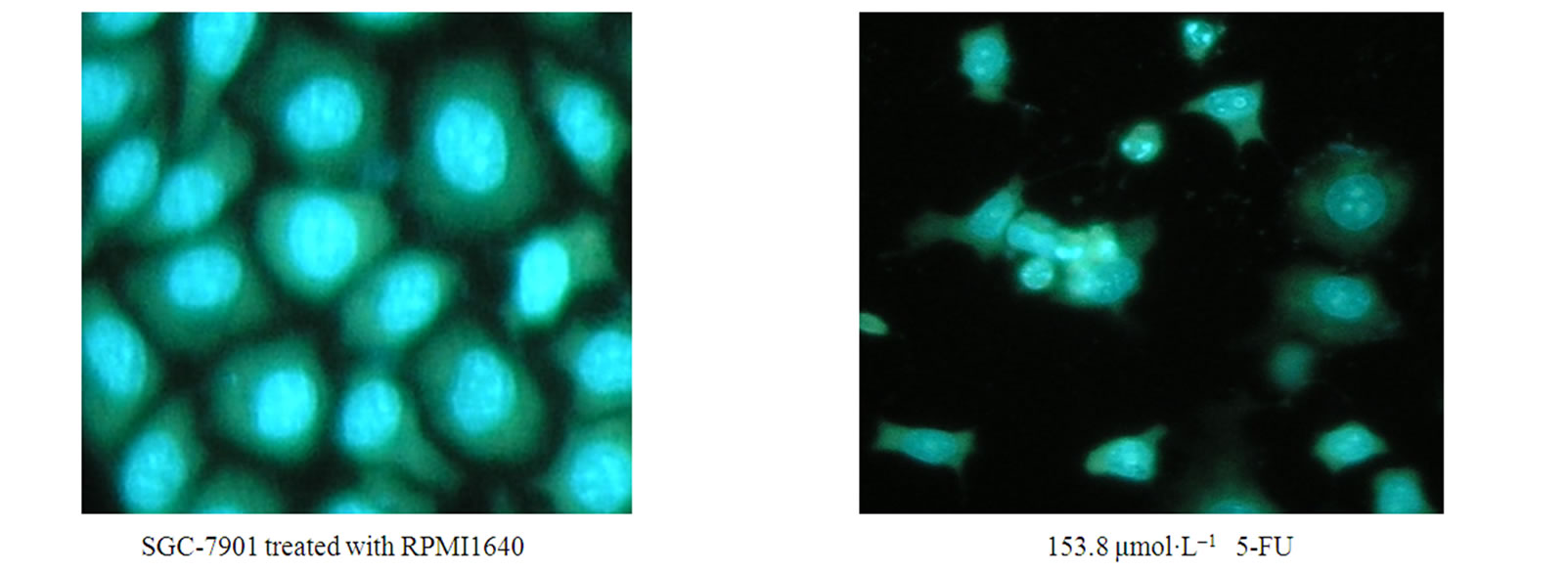
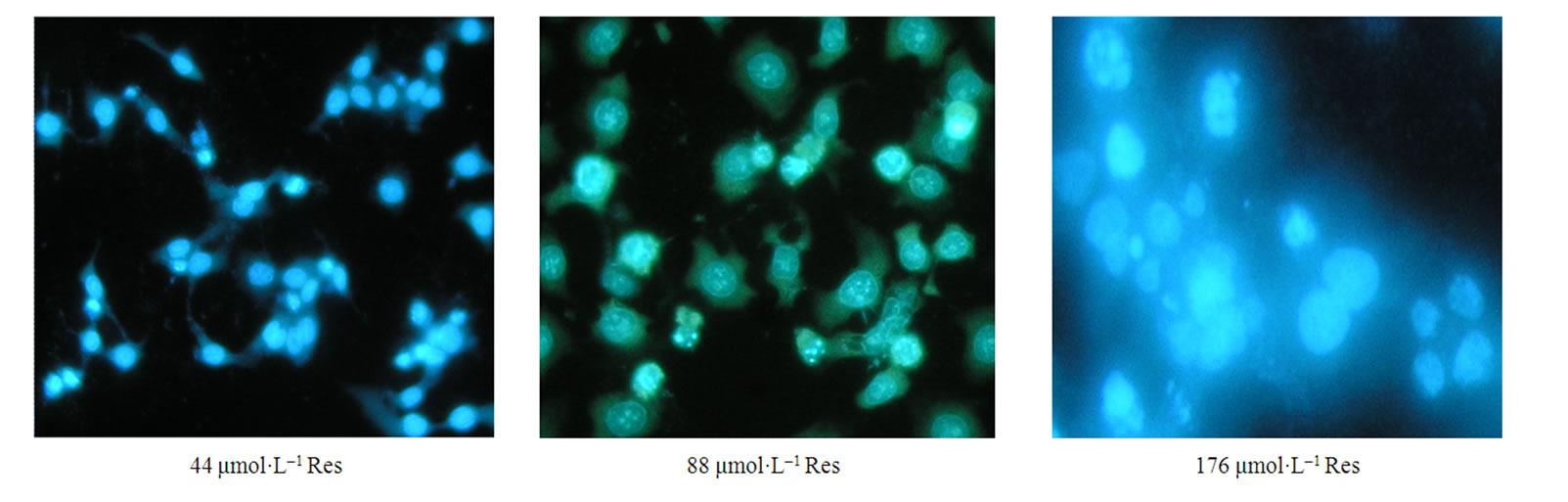
Figure 2. Morphological appearance of SGC-7901 cells by fluorescence detection (×400)
图2.
3.3. Res对肿瘤细胞凋亡作用研究
流式细胞仪测定“亚G1细胞群”的含量结果发现:各剂量Res诱导SGC-7901细胞的凋亡率为29.693%,33.986%,85.634%,且呈一定的剂量效应关系(见图3)。
3.4. Res对肿瘤细胞周期作用研究
流式细胞仪观察Res作用于SGC-7901细胞48 h对其细胞周期分布的影响表明:Res对各时相均明显抑制,同时使G1期细胞的比例减少,S期细胞的比例增加,G2期细胞的比例增加,且呈明显的剂量依赖性(见图4)。
3.5. Res对肿瘤细胞Ca2+作用的研究
利用激光共聚焦显微镜观察白藜芦醇对肿瘤细胞中钙离子信号的影响,研究结果表明:在48小时白藜芦醇药物作用下,肿瘤细胞中的钙离子浓度随着药物含量的逐渐增加而增加并且呈现一定的量效关系(如图5)。
4. 讨论
本研究用MTT法观察Res对SGC-7901细胞生长的影响,结果显示:Res对SGC-7901细胞具有较强的杀伤作用,其杀伤作用不亚于阳性对照药5-FU。
细胞凋亡是受基因控制的细胞死亡过程,大多数细胞凋亡受其刺激因子作用后出现基因表达的变化或表达新的基因,而这些基因直接控制细胞凋亡的发生和发展。细胞外部因素则通过信号传递而影响这些基因的表达,从而间接地调节细胞凋亡,这些作用的最终结局是激活细胞内DNA酶,引起染色质的异常凝聚和DNA的裂解,从而触发细胞凋亡。
本文通过荧光显微镜和流式细胞术等仪器检测了Res诱导肿瘤细胞凋亡的作用。流式细胞仪检测发现,随着Res浓度的不断增大,肿瘤细胞凋亡率不断升高;光学显微镜,荧光显微镜以及电子显微镜等观察发现:细胞胞质浓缩,细胞核染色质密度增高,染色加深,呈半月形凝集在核膜周边,核仁裂解,进而胞膜内陷,


Figure 3. The effects of Res induced SGC-7901 cell apoptosis
图3.
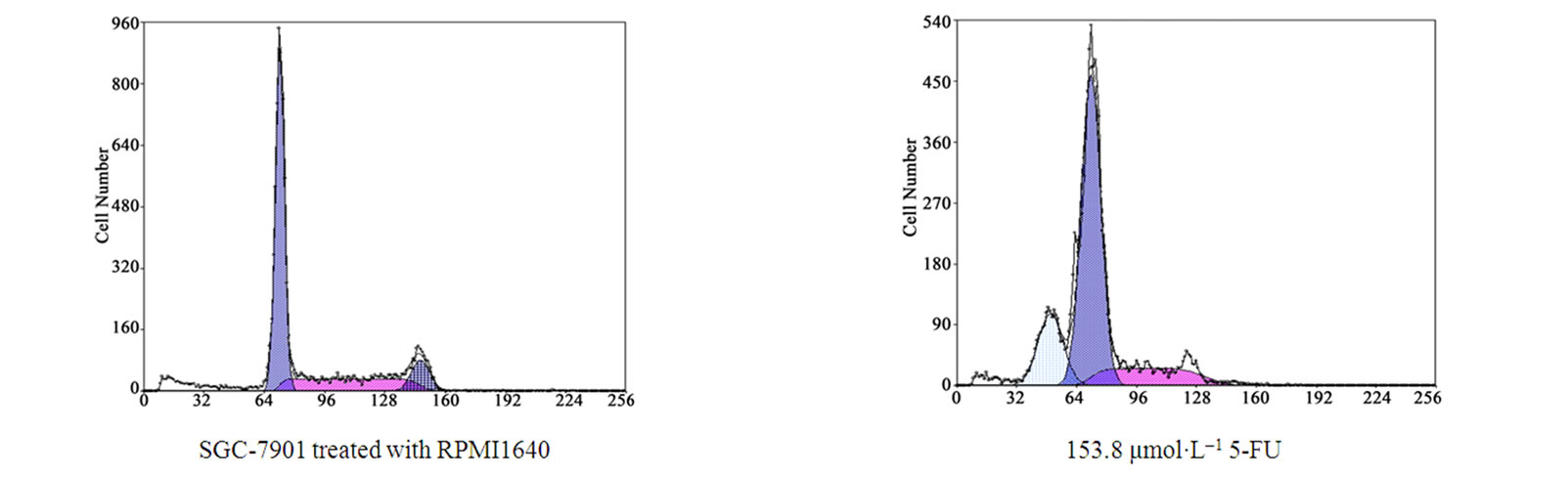
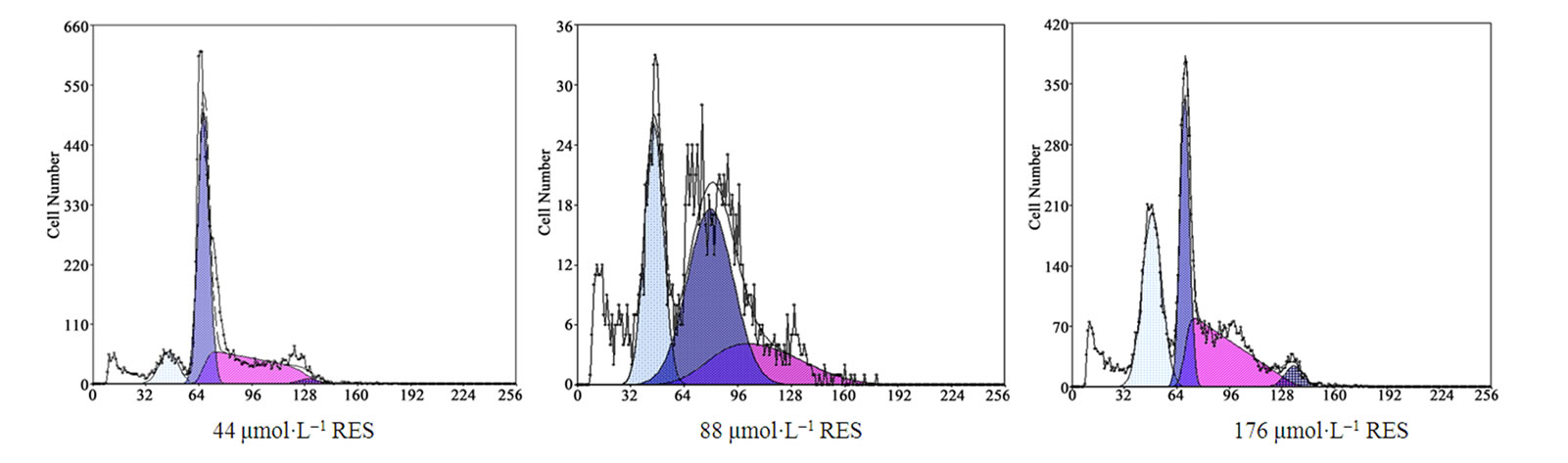
Figure 4. The effect of RES on the cell cycle of SGC-7901 cells
图4.
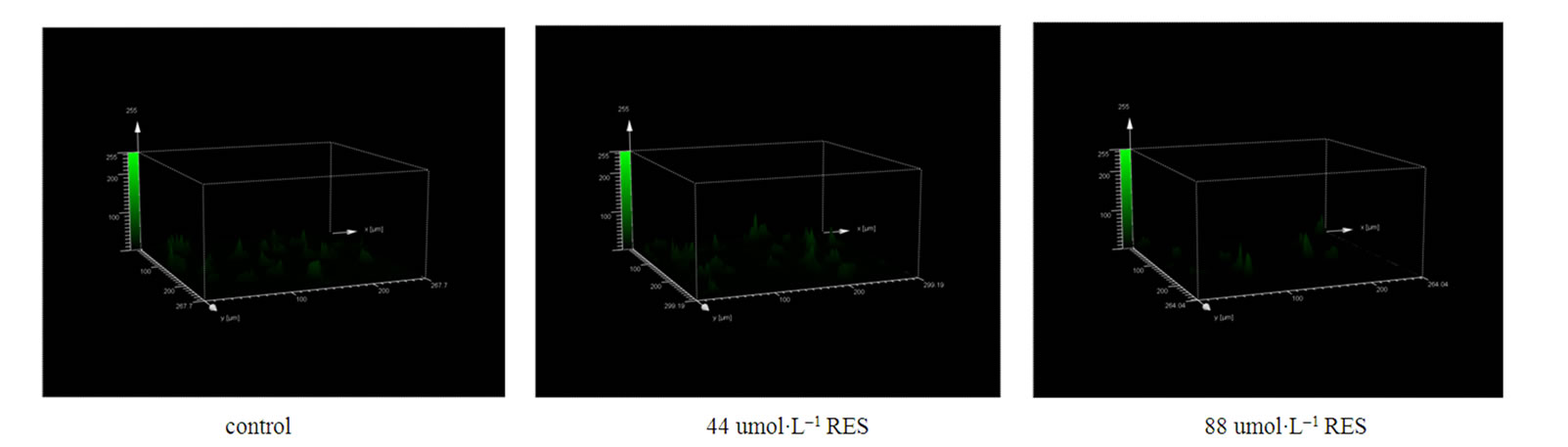
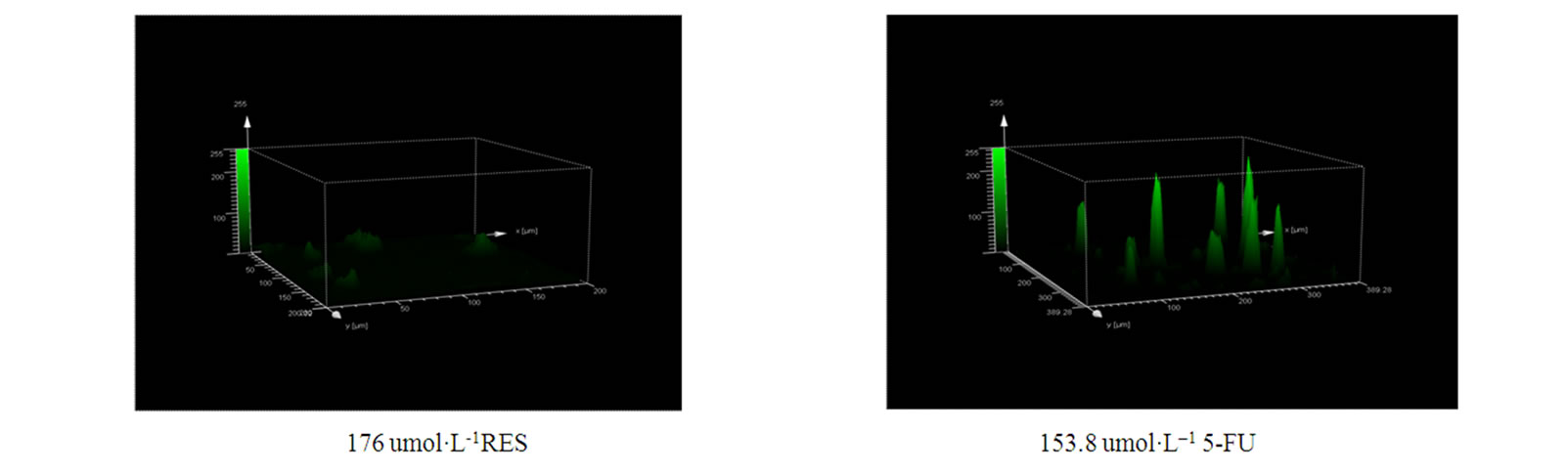
Figure 5. Laser scanning confocal microscope(LSCM) analysis Ca2+ in SGC-7901. Cells are petreated with differential dose RES or without RES for 48h. After 48h cells are washed by PBS and stained with Fluo-3 for 30min, then washed by PBS 2 times again and underwent LSCM analysis. Content of Ca2+ are shown above the arrows
图5.
随即与临周细胞脱离,自行分割成为多个外有膜包裹,内含物不外溢的凋亡小体。同时还可以看出,随着Res浓度的不断加大,凋亡小体的数量不断增大。这些研究进一步表明,Res能够诱导SGC-7901肿瘤细胞凋亡,且凋亡作用与Res的浓度呈现一定的剂量依赖关系。
细胞周期(cell cycle)是指细胞从上一次分裂结束开始生长到下一次分裂终止所经历的过程。细胞周期中的间期细分为G1期(DNA合成前期),S期(DNA合成期),G2期(DNA合成后期),M期(细胞有丝分裂期)。细胞周期调控(cell cycle regulation)是一个非常复杂和精细的调节过程,它与细胞的分化、生长和死亡有着紧密的关系。DNA或纺锤体损伤通常会触发细胞周期阻滞或凋亡,细胞周期阻滞经常发生在G1/S期或G2/M期交界处。肿瘤细胞周期的特点是细胞群主体分布于DNA合成活跃的S期。抗肿瘤药可使细胞周期动力学发生明显变化。细胞凋亡的特点就是细胞内DNA的含量发生了变化。正常增殖细胞在各个时期其DNA含量各不相同,并呈周期性变化:在细胞开始合成RNA和蛋白质的G1期,其DNA含量仍然保持二倍体;进入S期后,DNA合成开始,此时细胞的DNA含量介于二倍体与四倍体之间;当DNA合成结束后,细胞进入G2期,并继续合成RNA和蛋白质,直到进入M期,G2期和M期的DNA含量都是四倍体;随后细胞发生有丝分裂,形成两个子细胞,它们可能进入下一个细胞周期,也可能进入静止期(G0期),G0期与G1期的DNA含量均为二倍体。在核酸染料饱和的前提下,每个细胞内核酸染料的多少取决于细胞的DNA含量[7-10]。因此,通过分析细胞的荧光强度,可以了解细胞群体中各周期的分布状况,进而分析细胞的生长状态,以判断细胞的凋亡程度。本实验结果显示:Res对肿瘤细胞各期变化均有影响,使G1期细胞的比例减少,S期细胞的比例增加,G2期细胞的比例增加,且呈明显的剂量依赖性,表明Res对肿瘤细胞增殖具有抑制作用。
参考文献 (References)
[1] 张红雨, 徐长庆, 李宏霞等. 白藜芦醇抗心律失常和抗心肌缺血作用研究[J]. 中国药理学通报, 2006, 22(3): 383-384.
[2] M. Jang, L. Cai, G. O. Udeani, et al. Cancer chemopreventive activity of resveratrol, a natural product derived from grapes. Science, 1997, 275(5297): 20-218.
[3] N. G. Azios, L. Krishnamoorthy, M. Harris, et al. Estrogen and Resveratrol regulate Rac and Cdc42 signaling to the Actin Cytoskeleton of metastatic breast cancer cells. Neoplasia, 2007, 9(2): 147-158.
[4] S. Emilie, V. T. Celine and L. Kim. Resveratrol interferes with AKT activity and triggers apoptosis in human uterine cancer cells. Molecular Cancer, 2006, 5(1): 45.
[5] D. M. Huang, Y. C. Shen, C. Wu, et al. Investigation of extrinsic and intrinsic apoptosis pathways of new clerodane diterpenoids in hum an prostate cancer PC-3 cells. European Journal of Pharmacology, 2004, 503(1-3): 17-24.
[6] B. J. Thomas. Cell-cycle control during development: Taking it up a notch. Developmental Cell, 2005, 8(4): 451-452.
[7] D. Delmas, C. Rebe, S. Lacour, et al. Resveratrol-induced apopotosis is associated with Fas redistribution in the tafts and the formation of a deathrinducing signaling complex in colon cancer cells. Journal of Biological Chemistry, 2003, 278(42): 41482-41490.
[8] N. A. Thornberry, Y. Lazebnik. Caspases: Enemies within. Science, 1998, 281(5381): 1312-1316.
[9] B. Kadenbach, S. Arnold, I. Lee, et al. The possible role of cytochrome coxidase in stress-induced apoptosis and degenerative diseases. Biochimica et Biophysica Acta, 2004, 1655(1-3): 400-408.
[10] R. C. Koya, H. Fujita, S. Shimizu, et al. Gelsolin inhibits apoptosis by blocking mitochondrial membrane potential loss and cytochrome c release. Journal of Biological Chemistry, 2000, 275(20): 15343-15349.