Advances in Environmental Protection
Vol.
13
No.
02
(
2023
), Article ID:
64123
,
11
pages
10.12677/AEP.2023.132039
天然黏土矿物对土霉素吸附特性及机理研究
丁炜轩,郭嘉钰,孔维晨,王文静,蒋煜峰*
兰州交通大学环境与市政工程学院,甘肃 兰州
收稿日期:2023年3月6日;录用日期:2023年4月11日;发布日期:2023年4月18日

摘要
为了探究天然黏土矿物对四环素类兽药抗生素的吸附行为及机理,选取土霉素(OTC)为目标污染物,采用批平衡法,分析土霉素在蒙脱土和高岭土上的吸附动力学、热力学以及相关影响因素(初始浓度、温度、离子强度)对吸附过程的影响。结果显示,三种浓度土霉素在蒙脱土和高岭土上的吸附进程分为快吸附阶段(0~10 min)、慢吸附阶段(10 min~30 min)直至平衡,平衡时间分别是0.5 h和1 h,高岭土对土霉素的吸附量要高于蒙脱土,土霉素在两种土壤上的吸附动力学均符合准二级动力学模型。土霉素在高岭土上的解吸量小于蒙脱土,土霉素在土壤上的解吸迟滞系数HI均小于0.7,其解吸速率均小于吸附速度,为正的吸附滞后作用,且土霉素浓度越高,在土壤中的解吸速率越慢。温度升高有利于土霉素在高岭土上吸附,但不利于其在蒙脱土上的吸附。25℃为蒙脱土吸附土霉素最适温度。土霉素在两种黏土上的吸附均符合Freundlich模型。土霉素在高岭土上的n值大于1,表明土霉素在高岭土上吸附较易进行。土霉素在高岭土上吸附的KF值大于蒙脱土,说明高岭土对土霉素的吸附能力更强。加入Na+与Ca2+均会抑制土霉素在黏土上的吸附,浓度越高抑制程度越强,且Ca2+的抑制作用要强于Na+。研究结果表明天然黏土矿物在土壤对四环素类抗生素吸附中有重要的贡献。
关键词
土霉素,天然黏土,吸附,解吸,吸附滞后

Study on the Adsorption Characteristics and Mechanism of Oxytetracycline by Natural Clay Minerals
Weixuan Ding, Jiayu Guo, Weichen Kong, Wenjing Wang, Yufeng Jiang*
School of Environmental and Municipal Engineering, Lanzhou Jiaotong University, Lanzhou Gansu
Received: Mar. 6th, 2023; accepted: Apr. 11th, 2023; published: Apr. 18th, 2023

ABSTRACT
In order to explore the adsorption behavior and mechanism of tetracycline antibiotics on natural clay, oxytetracycline (OTC) was selected as the target pollutant, andbatch equilibrium method was used to analyze the adsorption kinetics and thermodynamics of oxytetracycline on montmorillonite and kaolin, as well as the influencing factors (initial concentration, temperature and ionic strength) on the adsorption process. The results showed that the adsorption process of three concentrations of oxytetracycline on montmorillonite and kaolin was divided into fast adsorption stage (0~10 min), slow adsorption stage (10~30 min), until equilibrium stage, and the equilibrium time was 0.5 h and 1 h, respectively. The adsorption capacity of kaolin for OTC was higher than that of montmorillonite. The adsorption kinetics of OTC on the two soils were consistent with the pseudo-second-order kinetics model. The desorption capacity of oxytetracycline on kaolin is less than that of montmorillonite, and the desorption hysteresis coefficient of OTC on soil HI is less than 0.7, and the desorption rate is less than the adsorption rate, which is a positive hysteresis effect, and the higher the concentration of OTC, the slower the desorption rate in soil. Increasing temperature is beneficial to the adsorption of OTC on kaolin, but not conducive to its adsorption on montmorillonite. 25˚C was the optimum temperature for adsorption of OTC by montmorillonite. The adsorption process of OTC on the two natural clays was consistent with Freundlich model, and the adsorption of OTC on kaolin could also be fitted by Langmuir model. The n value of OTC on kaolin is greater than 1, indicating that the adsorption of OTC on kaolin is easier. The KF value of OTC adsorbed on kaolin is higher than that of montmorillonite, indicating that kaolin has stronger adsorption capacity for OTC. Both Na+ and Ca2+ can inhibit the adsorption of OTC on natural clay. The higher the concentration is, the stronger the inhibition degree is, and the inhibition effect of Ca2+ is stronger than that of Na+. Our result suggested that adsorption of OTC on natural clay may have key contribution on soil adsorption for tetracycline antibiotics.
Keywords:Oxytetracycline, Natural Clay, Adsorption, Desorption, Adsorption Hysteresis

Copyright © 2023 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
近年来兽药抗生素(Veterinary antibiotics, VAs)被广泛用于养殖业中,以保护动物健康及促进动物生长,但抗生素在动物体内并不能完全被吸收,有高达90%以上抗生素及其代谢物会随着排泄物进入土壤环境中 [1] ,经食物链进入人体,进而危害人体健康。据统计,我国每年用的兽用抗生素消耗量至少6.3万吨,预计到2030年时将增至10.66万吨 [2] [3] 。土霉素(Oxytetracycline,OTC)是使用时间最早、用量最大的一种四环素类抗生素。由于其不易降解,可长时间稳定存在水体和土壤中,极易造成环境污染 [4] 。土壤中土霉素的主要来源为畜禽粪便、废水和污泥,在我国土壤中可以检测到的土霉素含量高达200 mg/kg [5] ,高浓度的土霉素,会造成严重的环境人体危害,因此亟待对土壤中土霉素环境行为展开研究。黏土是土壤的重要组成部分,根据黏土性质和结晶构造的差异,可将其分为三大类:高岭石、蒙脱石和水化云母类。黏粒矿物是土壤中矿物质颗粒最小,比表面积最大,同时又带有电荷的胶体物质 [6] 。黏土矿物的结构特性包括层间距、比表面积、电荷密度、吸附位点及可交换阳离子等,而具有不同特性的黏土矿物对污染物的吸附现象和机理也各不相同。有研究认为黏土矿物微孔的毛细管凝聚作用是其吸附有机物的可能机制。也有研究者认为改变黏土矿物表面阳离子的种类和组成能控制有机污染物的吸附行为 [7] 。课题组前期研究表明,黄土中的黏土矿物对黄土中兽药抗生素迁移转化行为有重要的影响 [8] 。当这些矿物质存在于土壤中时,其含量及结构对土壤的吸附能力有较大影响,可以在一定程度上改变或是污染物迁移能力 [9] 。黏土矿物晶体结构影响着有机物的界面行为,研究抗生素污染物在不同晶体结构黏土矿物上的吸附行为有助于认识黏土矿物吸附抗生素的机制,为控制和治理抗生素土壤污染提供科学依据。
本文以高岭土与蒙脱土作为研究对象,以土霉素为目标污染物,采用批平衡实验法研究:(1) 土霉素在蒙脱土和高岭土中的吸附解吸行为及机理;(2) 探究蒙脱土、高岭土在不同的环境条件下包括离子强度、离子类型及温度对土霉素吸附过程的影响。以期明确土霉素在两种天然黏土矿物上的吸附行为,进而揭示黏土对典型兽药抗生素吸附的差异性与贡献,以期为控制和治理兽药抗生素在土壤上的污染提供理论依据。
2. 材料与方法
2.1. 试剂及药品
实验所用土霉素购自山东西亚化学工业有限公司。CaCl2购自天津市大茂化学试剂厂,NaCl购自天津市北辰方正试剂厂,二者均为分析纯。
2.2. 吸附动力学实验方法
取7个50 mL的离心管为一组,每组加入0.5000 g的蒙脱土,再加250 mg/LOTC溶液,然后用0.01 mol/L的CaCl2背景溶液定容至25 mL,使OTC浓度分别为10、20和30 mg/L,同时做空白样。在25℃将样品放入水浴振荡器中,分别振荡5、10、15、30、60、120、240 min后,将样品取出后以4000 r/min转速离心15 min,之后使用0.45 μm滤头过滤后,在波长为276 nm的条件下测定上清液OTC浓度。高岭土吸附OTC实验方法同上。
2.3. 解吸动力学实验方法
取7个50 mL的离心管为一组,每组加入0.5000 g的蒙脱土,再加250 mg/L的OTC溶液,然后用0.01 mol/L的CaCl2背景溶液定容至25 mL,使浓度分别为10、20和30 mg/L,同时作为对照实验。将样品放入25℃水浴振荡器中,振荡至平衡。取出后以4000 r/min转速离心15 min,将上清液弃去。离心管再次加入25 mL的0.01 mol/L的CaCl2背景溶液,放入恒温振荡器中,在25℃振荡5、10、15、30、60、120、240 min,将样品取出后放以4000 r/min转速离心15 min,使用0.45 μm滤头过滤后,在波长为276 nm的条件下测定上清液OTC浓度。OTC在高岭土上解吸动力学实验方法同上。
2.4. 吸附热力学实验方法
取8个50 mL的离心管为一组,共3组。每组加入0.5000 g的蒙脱土,再加OTC溶液,然后用0.01 mol/L的CaCl2背景溶液定容至25 mL,使每组OTC浓度分别为0、3、5、8、10、15、20和25 mg/L。将样品放入恒温振荡器中,在25℃条件下振荡平衡后,将样品取出以4000 r/min转速离心15 min,后使用0.45 μm滤头过滤后,在波长为276 nm的条件下测定上清液中OTC浓度。15和35℃的实验及OTC在高岭土的吸附热力学实验方法同上。
2.5. 离子强度对OTC吸附的影响
取8个50 mL的离心管为一组。加入0.5000 g的蒙脱土,再加OTC溶液,然后用0.01 mol/L的CaCl2背景溶液定容至25 mL,使浓度分别为0、3、5、8、10、15、20、25 mg/L。将8组样品放入水浴振荡器中,在25℃条件下,振荡2 h,将样品取出以4000 r/min转速离心15 min,后使用0.45 μm滤头过滤后,在波长为276 nm的条件下测定上清液中OTC浓度。0.05 mol/L CaCl2、0.1 mol/L CaCl2、0.01 mol/L NaCl、0.05 mol/L NaCl、0.1 mol/L NaCl、空白对照实验及OTC在高岭土的离子强度实验方法同上。
2.6. 数据处理
对于土霉素在蒙脱土和高岭土上的吸附动力学,分别使用准一级动力学模型、准二级动力学模型和颗粒内扩散模型进行拟合 [9] [10] [11] [12] ,利用Langmuir模型、Freundlich模型和D-R模型 [13] [14] [15] 对不同温度时OTC在蒙脱土、高岭土上的吸附进程进行拟合,各模型方程见表1。
Table 1. Sorption kinetics and sorption thermodynamics models used in this study
表1. 本研究采用相关吸附动力学及热力学模型
其中:q1和q2平衡吸附容量(mg/g);qt随t时刻变化的即时吸附量(mg/g);k1和k2分别是拟一级动力学吸附常数(min−1)和拟二级动力学吸附常数[g/(mg·min)];Kp是颗粒内扩散常数[mg/(g∙min1/2)]。q1和q2分别表示最大吸附量;C是表示吸附剂吸附强度的常数;qs固相上的吸附量(mg/g);Ce液相浓度(mg/L);Qm污染物最大饱和吸附量(mg/g);KL兰格缪尔吸附常数(L/g);KF和n弗兰德利希模型常数;Qm,KF可根据方程求得;β为与吸附自由能有关的常数;ε为Polanyi势能,ε = RTln (1 + 1/ce),其中R为气体常数。
3. 结果与讨论
3.1. 吸附动力学
为探究OTC在黏土上的吸附平衡时间,分析OTC在黏土上吸附量与吸附时间的关系,绘制吸附动力学曲线如图1所示。由图可知,OTC在蒙脱土、高岭土上的吸附过程均可以分为快吸附与慢吸附和平衡阶段两个阶段 [17] 。蒙脱土与高岭土在0~10 min为快速吸附阶段,30 min之后为慢速吸附阶段直至平衡。在快速吸附阶段,土霉素被土壤迅速吸附,这是因为在土壤对OTC进行吸附的初期,黏土颗粒表面均存在大量可吸附位点,吸附质在短时间内迅速被吸附到黏土颗粒表面 [18] 。当土壤表面的吸附位点被逐渐占据,OTC在两种土壤上的吸附速率明显下降,进入慢吸附阶段,且逐渐趋于平衡,吸附量达到最大值。蒙脱土对土霉素的吸附平衡时长约为0.5 h;高岭土对土霉素的吸附平衡时长约为1 h。
由不同初始浓度OTC在蒙脱土和高岭土上的吸附试验可知,三个浓度下抗生素在蒙脱土上的平衡吸附量为0.468、0.947、1.430 mg/g;在高岭土上的平衡吸附量为0.485、0.974、1.461 mg/g。吸附量变化趋势表现为30 mg/L > 20 mg/L > 10 mg/L,表明随着初始浓度的增大,两种土壤对OTC的吸附量也随之增加。这是由于浓度较低时,OTC分子并未完全占据土壤颗粒表面。此外,浓度的升高使得水土两相OTC浓度差增大,传质推动力增加,有利于吸附反应的进行 [19] 。
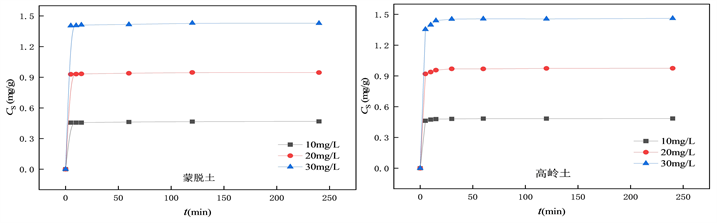
Figure 1. Fitting curves of adsorption kinetics of OTC at different concentrations
图1. 不同浓度OTC吸附动力学拟合曲线
Table 2. Fitting parameters of adsorption kinetics of OTC at different concentrations on two soils
表2. 不同浓度OTC在两种土壤上的吸附动力学拟合参数
由表2可知,OTC在蒙脱土和高岭土上的吸附过程中,准一级动力学模型R2分别为0.601~0.729和0.966~0.991,准二级动力学模型R2均趋近于1.000,颗粒内扩散模型的R2则在0.862~0.953与0.481~0.572之间,由此可见两种吸附进程均能被准二级动力学模型较好地拟合,这表示OTC在两种土壤上的吸附是由多种作用共同控制的吸附进程,且主要由化学吸附控制 [20] 。颗粒内扩散模型认为吸附进程中的液膜扩散阻力近似于零,且拟合曲线如果经过原点,则认为只受颗粒扩散的影响,否则还存在其他控制因素。利用颗粒内扩散模型对两种土壤吸附OTC进程进行拟合后发现,三种浓度吸附拟合方程均不过原点,说明OTC吸附过程可能包含多种不同的吸附过程,如表面点位吸附、液膜扩散和土壤颗粒内部的扩散等 [21] 。
3.2. 解吸动力学
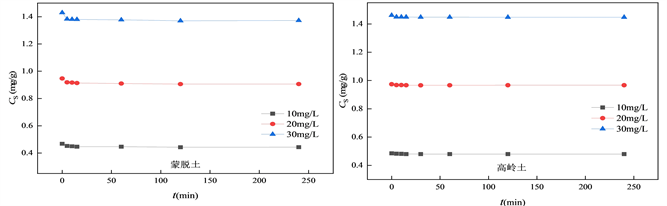
Figure 2. Desorption kinetics curves of OTC at different concentrations on soil
图2. 不同浓度OTC在土壤上的解吸动力学曲线
研究解吸时间与解吸量之间的关系对明确污染物迁移能力有重要意义。土霉素在蒙脱土和高岭土上的解吸动力学曲线如图2所示。可看到不同浓度的土霉素在黏土上的解吸过程也可分为两个阶段,即快速解吸阶段,慢速解吸阶段直至平衡。OTC在蒙脱土、高岭土的解吸量随着初始溶液浓度的变化趋势为30 mg/L > 20 mg/L > 10 mg/L。在OTC浓度从10 mg/L逐渐上升到30 mg/L的过程中,在在蒙脱土上的解吸量为0.442、0.906和1.371 mg/g;在高岭土上的解吸量为0.479、0.966和1.447 mg/g。土霉素在高岭土上的解吸量小于蒙脱土,说明在蒙脱土环境中,土霉素迁移能力更强,更易造成环境污染。
对于OTC在蒙脱土和高岭土中的解吸行为均存在的解吸滞后现象,其中用滞后系数表示:
(1)
式中,qd与qs分别指在一定温度和浓度时,吸附过程和解析过程中OTC在土壤中的吸附量,当HI > 1.0时,为负滞后作用;当0.7 < HI ≤ 1.0时,解吸速率和吸附速率相似,无滞后作用;当HI < 0.7时,解吸速率小于吸附速度,为正滞后作用。
表3为在温度为25℃时,不同浓度的土霉素在土壤中的HI。其结果表明,土霉素在蒙脱土和高岭土上的解吸迟滞系数HI均小于0.7,表明其解吸速率均小于吸附速度,为正滞后作用。随着解吸过程中OTC浓度的增加,解吸HI均有下降趋势,即OTC浓度越高,在土壤中的解吸速率越慢。
Table 3. Desorption kinetic hysteresis coefficients of OTC at different concentrations on two soils
表3. 不同浓度OTC在两种土壤上的解吸动力学迟滞系数
3.3. 吸附热力学

Figure 3. Adsorption isotherms of OTC on natural clay at different temperatures
图3. 不同温度下OTC在天然黏土上的吸附等温线
温度改变会影响土霉素在黏土上的吸附,15℃、25℃、35℃下OTC在蒙脱土、高岭土上的吸附热力学曲线如图3所示。在15℃、25℃、35℃温度下,OTC在高岭土上的吸附量为:1.177、1.183和1.193 mg/g,可见OTC在高岭土上吸附随着温度的升高,其吸附量也在逐渐增加,是一种吸热反应。原因可能是因为温度升高OTC溶解度增大,此外分子热运动的加剧,增加了土壤颗粒与OTC碰撞几率,进而提高了吸附量 [22] 。OTC在蒙脱土上的吸附量为:1.167、1.174和1.161 mg/g,由此可知,OTC在蒙脱土上的吸附最佳温度为25℃,当温度过高或者过低时,均会抑制OTC在蒙脱土上的吸附。原因可能是温度过高过低起主导的机制不同,温度高于25℃时,土壤有机质由玻璃态转变为橡胶态,不利于OTC的吸附 [23] ;而当温度降低时,污染物分子热运动速率降低,有效碰撞减少,抑制吸附反应进行。OTC的吸附反应过程由多种作用共同控制比较复杂,温度对不同的吸附机理的影响并不相同。所以,OTC在蒙脱土、高岭土上的吸附行为,在温度不同时作用效果也不相同。
Table 4. Adsorption thermodynamic fitting parameters of OTC at different temperatures
表4. 不同温度下OTC的吸附热力学拟合参数
不同温度下的Langmuir模型、Freundlich模型对OTC在蒙脱土上吸附进程的R2分别在0.976~0.991及0.996~0.999之间,但Langmuir模型Qm值小于0,明显与事实不符,Freundlich模型可以较好地解释OTC在蒙脱土上的吸附过程,说明蒙脱土对OTC的吸附形式是一种表面非均匀的多层吸附 [24] 。用Langmuir模型和Freundlich模型对OTC在高岭土上的吸附过程进行拟合,其拟合的相关系数R2分别在0.995~0.999及0.994~0.999之间,故Langmuir模型、Freundlich模型均可以较好的解释OTC在高岭土上的吸附过程。Freundlich模型拟合参数中的非线性指数n值越大表示吸附性能越好,通常认为当n > 1时,吸附较易进行;n < 0.5时,吸附不易进行 [25] 。由表4可知,OTC在蒙脱土和高岭土上的吸附过程中的n值介于0.693~1.239之间,表明OTC在黏土上的吸附较易进行。Freundlich模型拟合中的KF说明土壤对OTC的吸附能力,当KF值越大时,吸附能力越强 [26] 。由表4可以看出,蒙脱土的KF在0.557~0.644之间,高岭土的KF在0.822~0.937之间,说明高岭土对于OTC的吸附能力要大于蒙脱土。
3.4. 离子强度对吸附土霉素的影响
离子强度及种类的改变会通过挤占吸附位点、架桥等机制影响土壤对土霉素的吸附 [27] 。不同离子强度及类型对黏土吸附土霉素影响见图4~6。图4为不同浓度时的Na+对蒙脱土、高岭土吸附OTC的影响拟合曲线。由图可知除0.1 mol/L Na+对吸附有着明显的抑制作用外,0.01 mol/L Na+、0.05 mol/L Na+均对OTC在蒙脱土上的吸附产生了促进作用,且Na+浓度越小,对于OTC吸附的促进作用越明显。前人研究认为,Na+可以分散土壤胶体,降低土壤颗粒粒度,增大比表面积 [28] ,故可在一定程度上促进蒙脱土对OTC的吸附量。Na+会抑制高岭土吸附OTC,并且随着Na+浓度的逐渐增加,Na+对高岭土吸附的抑制作用会逐渐加剧。这可能是因为Na+更容易与土壤表面结合,挤占了更多的吸附点位 [29] 。Na+对两种土壤吸附OTC影响不同可能与土壤本身性质也有关系。

Figure 4. Effect of Na+ concentration on OTC adsorptionon to natural caly
图4. Na+浓度对OTC在天然粘土上吸附的影响
图5为不同浓度时的Ca2+对蒙脱土、高岭土吸附OTC的影响拟合曲线。由图5可得,Ca2+对蒙脱土对OTC的吸附为低浓度促进(0.01 mol/L)高浓度抑制(0.05 mol/L、0.1 mol/L),且浓度越高抑制程度越大。而Ca2+对高岭土吸附OTC的影响则仅有抑制。并随着Ca2+浓度升高抑制程度加大。低浓度的Ca2+对吸附进程体现出促进效果可能是因为其以共价键形式在固体表面与抗生素之间架桥,进而促进吸附 [30] 。但高浓度的Ca2+则会因为减弱团粒结构负电性,促进团粒结构之间团聚 [31] ,进而影响OTC与土壤反应,降低吸附量。
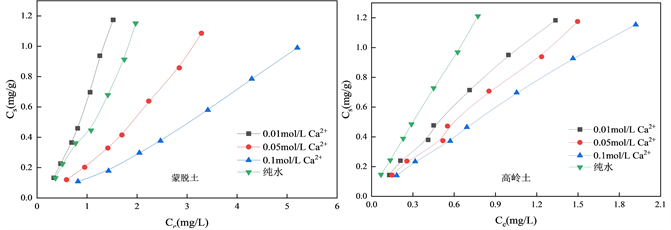
Figure 5. Effect of different Ca2+ concentration on OTC adsorption onto natural clay
图5. 不同Ca2+浓度对OTC在天然黏土上吸附的影响
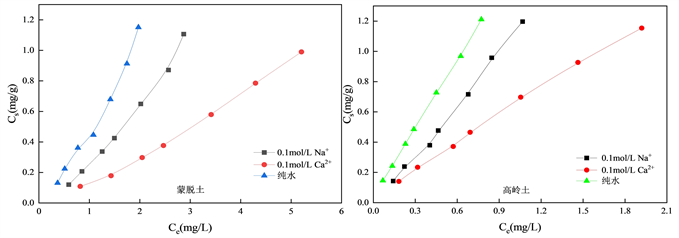
Figure 6. Effects of differentionic types on OTC adsorption onto natural clay
图6. 不同价态离子对OTC在天然黏土上吸附的影响
图6为Na+与Ca2+对蒙脱土、高岭土吸附OTC的影响拟合曲线。由图6可知,当加入相同浓度的Na+与Ca2+时,OTC在蒙脱土、高岭土两种土壤表面的吸附均受到抑制作用,且在两种土壤上,Ca2+对OTC在土壤上吸附过程的抑制程度均要强于Na+。这种现象的出现可能是由于Ca2+的离子半径大于Na+,能够占据土壤表面更多的吸附点位 [32] 。此外还有可能是由于二价离子的有效电荷数更多,更易于与土壤颗粒结合 [19] 。
4. 结论
(1) 土霉素在黏土中的吸附平衡时间约为1 h,0~10 min为快速吸附阶段,30 min之后为慢速吸附阶段。土霉素在黏土上的吸附动力学均符合准二级动力学模型,吸附进程以化学吸附为主。高岭土对OTC的吸附量大于蒙脱土,土霉素的解吸量蒙脱土要大于高岭土。土霉素在蒙脱土和高岭土上的解吸迟滞系数HI均小于0.7,表明土霉素在黄土与黏土中的解吸速率小于吸附速率,且土霉素浓度越高,在黏土中的解吸速率越慢。
(2) 25℃最有利于土霉素在蒙脱土上的吸附,温度过高过低都会抑制吸附;温度升高会促进高岭土吸附土霉素。利用Langmuir、Freundlich、D-R模型对两种黏土吸附土霉素过程进行拟合,发现两者均符合Freundlich模型拟合。3种温度下高岭土的n值均大于1,表明土霉素在高岭土上的吸附更易进行,与动力学实验结果一致。KF值表示土壤对土霉素的吸附能力,KF值越大,吸附能力越强,3种温度下高岭土的KF值均高于蒙脱土,说明高岭土的吸附能力要强于蒙脱土。
(3) 除0.01 mol/L、0.05 mol/L的Na+对蒙脱土吸附土霉素有些许促进作用外,其余浓度的Na+对两种土壤吸附进程都起到抑制作用,浓度升高抑制作用增强。低浓度情况下金属离子可以在黏土表面与土霉素之间架桥,促进吸附;而当浓度升高后,过多的金属离子会挤占吸附点位,阻止土壤吸附土霉素。相较于Na+,Ca2+对吸附进程抑制程度更大,前人研究认为这种现象可能是因Ca2+的离子半径大于Na+,能够占据土壤表面更多的吸附点位。此外也可能是因二价离子的有效电荷数更多,更易于与土壤颗粒结合导致。低浓度Na+促进吸附有利于降低土霉素迁移能力,可在一定程度上降低环境风险。
基金项目
甘肃省自然科学基金项目(No. 20JR5RA392)。
文章引用
丁炜轩,郭嘉钰,孔维晨,王文静,蒋煜峰. 天然黏土矿物对土霉素吸附特性及机理研究
Study on the Adsorption Characteristics and Mechanism of Oxytetracycline by Natural Clay Minerals[J]. 环境保护前沿, 2023, 13(02): 291-301. https://doi.org/10.12677/AEP.2023.132039
参考文献
- 1. 赵英姿, 徐振, 颜冬云, 等. 大环内酯类抗生素在土壤中的迁移转化与毒性效应分析[J]. 土壤, 2014, 46(1): 23-28.
- 2. 李兆军, 成登苗, 冯瑶, 等. 典型兽用抗生素自然环境行为及生态毒理效应[M]. 北京: 科学出版社, 2020.
- 3. 李兆军, 冯瑶, 刘元望, 等. 养殖废弃物中兽用抗生素削减原理[M]. 北京: 科学出版社, 2020.
- 4. 王迪. 植物残体对土霉素的吸附行为及机制研究[D]: [硕士学位论文]. 西安: 长安大学, 2016.
- 5. 郭欣妍, 王娜, 许静, 等. 兽药抗生素的环境暴露水平及其环境归趋研究进展[J]. 环境科学与技术, 2014, 37(9): 76-86.
- 6. 富添, 陆彩妹, 张连峰, 等. 黏土矿物吸附废水中磷的研究进展[J]. 大众科技, 2022, 24(5): 33-37.
- 7. Jiang, Y.F., Liang, X.R., Yuan, L.M., Nan, Z.J., Deng, X.R., Wu, Y.Q., Ma, F.F. and Diao, J.R. (2021) Effect of Livestock Manure on Chlortetracycline Sorption Behaviour and Mechanism in Agricultural Soil in Northwest China. Chemical Engineering Journal, 415, Article ID: 129020. https://doi.org/10.1016/j.cej.2021.129020
- 8. 张立超, 王绍伟, 包先明, 等. 两种不同极性有机物在离子饱和黏土矿物上的吸附行为[J]. 安全与环境学报, 2015, 15(2): 200-204.
- 9. Sarmah, A.K., Meyer, M.T. and Boxall, A.B. (2006) A Global Perspective on the Use, Sales, Exposure Pathways, Occurrence, Fate and Effects of Veterinary Antibiotics (VAs) in the Environment. Chemosphere, 65, 725-759. https://doi.org/10.1016/j.chemosphere.2006.03.026
- 10. Ho, Y.S. and McKay, G. (1998) Sorption of Dye from Aqueous Solution by Peat. Chemical Engineering Journal, 70, 115-124. https://doi.org/10.1016/S0923-0467(98)00076-1
- 11. Ho, Y.S. and McKay, G. (1998) The Kinetics of Sorption of Basic Dyes from Aqueous Solution by Sphagnum Moss Peat. Canadian Journal of Chemical Engineering, 76, 822-827. https://doi.org/10.1002/cjce.5450760419
- 12. Ho, Y.S. and McKay, G. (1998) Kinetic Models for the Sorption of Dye from Aqueous Solution by Wood. Journal of Environmental Science and Health Part B: Process Safety and En-vironmental Protection, 76, 183-191. https://doi.org/10.1205/095758298529326
- 13. Weber, W.J. and Morriss, J.C. (1963) Kinetics of Adsorption on Carbon from Solution. Journal of Sanitary Engineering Division: American Society of Civil Engineering, 89, 31-60. https://doi.org/10.1061/JSEDAI.0000430
- 14. Langmuir, I. (1918) The Adsorption of Gases on Plane Surfaces of Glass, Mica and Platinum. Journal of American Chemical Society, 40, 1361-1403. https://doi.org/10.1021/ja02242a004
- 15. Freundlich, H. (1906) Uber Die Adsorption in Losungen (Adsorption in Solution). Physical Chemistry Periodical, 57, 384-470. https://doi.org/10.1515/zpch-1907-5723
- 16. Dubinin, M.M., Zaverina, E.D. and Radushkevich, L.V. (1947) Sorption and Structure of Active Carbons. I. Adsorption of Or-ganic Vapors. Russian Journal of Bioorganic Chemistry, 21, 1351-1362.
- 17. 刘兰兰. 四环素类兽药抗生素在西北黄土上的吸附特征及淋溶降解行为研究[D]: [硕士学位论文]. 兰州: 兰州交通大学, 2020.
- 18. Srinivasan, P. and Sarmah, A.K. (2013) Co-Contaminants and Factors Affecting the Sorption Behaviour of Two Sulfonamides in Pasture Soils. Environmental Pollution, 180, 165-172. https://doi.org/10.1016/j.envpol.2013.05.022
- 19. 石磊平, 蒋煜峰, 广阿龙, 等. 天然有机质对土霉素在西北灰钙土上吸附行为的影响[J]. 环境科学研究, 2019, 32(9): 1584-1593.
- 20. Deng, X.R., Jiang, Y.F., Zhang, M.A., Nan, Z.J., Liang, X.R. and Wang, G. (2022) Sorption Proper-ties and Mechanisms of Erythromycin and Ampicillin in Loess Soil: Roles of pH, Ionic Strength, and Temperature. Chemical Engineering Journal, 434, Article ID: 134694. https://doi.org/10.1016/j.cej.2022.134694
- 21. Steinberg, S.M., Pignatello, J.J. and Sawhney B.L. (1987) Persistence of 1,2-Dibromoethane in Soils: Entrapment in Intraparticle Micropores. Environmental Science and Technology, 21, 1201-1208. https://doi.org/10.1021/es00165a007
- 22. Maszkowska, J., Bialk-Bielinska, A., Mioduszewska, K., Wagil, M., Kumirska, J. and Stepnowski, P. (2015) Sorption of Sulfisoxazole onto Soil: An Insight into Different Influencing Factors. Environmental Science and Pollution Research. International, 22, 12182-12189. https://doi.org/10.1007/s11356-015-4445-3
- 23. Sun, K., Gao, B., Zhang, Z.Y., Zhang, G.X., Zhao, Y. and Xing, B.S. (2010) Sorption of Atrazine and Phenanthrene by Organic Matter Fractions in Soil and Sediment. Environmental Pollution, 158, 3520-3526. https://doi.org/10.1016/j.envpol.2010.08.022
- 24. Kümmerer, K. (2013) Pharmaceuticals in the Environment: Sources, Fate, Effects and Risks. 3rd Edition, Springer-Verlag, Berlin.
- 25. Jiang, Y.F., Zhang, Q., Wen, H., Yuan, L.M., Liu, L.L. and Wu, Y.Q. (2020) Single and Competitive Sorption Behavior and Mechanism of Sulfadiazine and Chlortetracycline on the Loess Soil in Northwest China. Environmental Pollution, 263, Article ID: 114650. https://doi.org/10.1016/j.envpol.2020.114650
- 26. Miao, J.H., Wang, F., Chen, Y., Zhu, Y., Zhou, Y. and Zhang, S. (2019) The Adsorption Performance of Tetracyclines on Magnetic Graphene Oxide: A Novel Antibiotics Absorbent. Applied Surface Science, 475, 549-558. https://doi.org/10.1016/j.apsusc.2019.01.036
- 27. Sudarshan, T., Kurwadkar, C., Adams, D., Michael, T., Meyer, A. and Kolpin, D.W. (2007) Effects of Sorbate Speciation on Sorption of Selected Sulfonamides in Three Loamy Soils. Journal of Agricultural Food and Chemistry, 55, 1370. https://doi.org/10.1021/jf060612o
- 28. Tongaree, S., Flanagan, D.R. and Poust, R.I. (1999) The Interaction be-tween Oxytetracycline and Divalent Metal Ions in Aqueous and Mixed Solvent Systems. Pharmaceutical Development and Technology, 4, 581-591. https://doi.org/10.1081/PDT-100101397
- 29. Hu, S.Q., Zhang, Y., Shen, G.X., Zhang, H.C., Yuan, Z.J. and Zhang, W. (2019) Adsorption/Desorption Behavior and Mechanisms of Sulfadiazine and Sulfamethoxazole in Agricultural Soil Systems. Soil and Tillage Research, 186, 233-241. https://doi.org/10.1016/j.still.2018.10.026
- 30. Pils, J.V. and Laird, D.A. (2007) Sorption of Tetracycline and Chlortetracycline on K- and Ca-Saturated Soil Clays, Humic Substances, and Clay-Humic Complexes. Environmental Science and Technology, 41, 1928-1933. https://doi.org/10.1021/es062316y
- 31. 刘兰兰, 蒋煜峰, 石磊平, 等. 施加牛粪熟肥对黄土吸附双酚A的影响[J]. 环境科学研究, 2019, 32(6): 1063-1073.
- 32. 原陇苗, 蒋煜峰, 刘兰兰, 等. 天然腐殖酸对黄土吸附敌草隆的影响[J]. 环境科学研究, 2019, 32(11): 1904-1912.
NOTES
*通讯作者。
